文章信息
- 彭江, 孙一铭, 宋锋, 李鹏, 饶灿, 孙敏
- Peng Jiang, Sun Yiming, Song Feng, Li Peng, Rao Can, Sun Min
- 尾巨桉3-羟基-3-甲基戊二酰CoA还原酶基因的克隆及表达分析
- Molecular Cloning and Prokaryotic Expression of the Gene Encoding HMG-CoA Reductase from Eucalyptus urophylla×E.grandis
- 林业科学, 2011, 47(2): 164-168.
- Scientia Silvae Sinicae, 2011, 47(2): 164-168.
-
文章历史
- 收稿日期:2010-06-30
- 修回日期:2010-11-22
-
作者相关文章
尾巨桉(Eucalyptus urophylla×E.grandis)属于桃金娘科(Myrtaceae)桉属(Eucalyptus)速生树种之一,其油腺细胞能够产生1, 8-桉叶素、β-桉叶醇和α-蒎烯等主要成分的挥发性精油。桉树精油具有疏风解热、祛湿解毒、抑菌消炎、防腐止痒的医药功效(Ogunwande et al., 2005);同时作为牙膏、口香糖、化妆品及食品的香精来源。因此,开发尾巨桉精油具有重要的经济价值,但工业上桉树精油产率一般为0.8%~5%,相对较低(宋永芳, 1990);而遗传代谢工程已成为提高植物次生代谢产物含量的有效手段之一。
桉树精油主要由单萜、倍半萜及其含氧衍生物组成(Degenhardt et al., 2009);萜类化合物是植物的主要次生代谢产物之一。植物萜类合成代谢存在甲羟戊酸途径(MVA)和2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)2种途径,二者都能产生萜类物质的共同前体异戊烯基焦磷酸,再由它生成单萜、倍半萜、双萜和多萜(McGarvey et al., 1995)。3-羟基-3-甲基戊二酰CoA还原酶(HMGR)被普遍认为是MVA途径中的第1个关键酶,催化3-羟基-3-甲基戊二酰CoA生成甲羟戊酸。目前,已从拟南芥(Arabidopsis thaliana)、烟草(Nicotiana tabacum)、橡胶树(Hevea brasiliensis)、喜树(Camptotheca acuminata)及青蒿(Artemisia carvifolia)等植物中分离到HMGR。Schaller等(1995)将橡胶树的HMGR转化到烟草中,结果HMGR酶活性增强3~8倍,同时甾醇总含量提高近6倍。Manzano等(2004)在拟南芥中超量表达其自身HMGR,结果也能够提高甾醇总含量。本研究通过RACE技术从尾巨桉叶片中克隆到HMGR基因,并进行组织特异性表达分析和原核表达试验,为该基因的功能验证以及通过遗传转化提高尾巨桉精油产率奠定基础。
1 材料与方法 1.1 植物材料试验材料选用6年生尾巨桉,栽种于西南大学生态种植园。
1.2 质粒和菌株pMD19-T载体,购自TaKaRa大连宝生物公司;pQE-30载体、大肠杆菌(Escherichia coli)DH5α菌株和M15菌株由西南大学三峡库区生态环境教育部重点实验室保存。
1.3 总RNA提取用RNA plant(mini)Kit(上海华舜生物技术有限公司)提取尾巨桉根、茎、枝和叶总RNA,经1.2%琼脂糖凝胶电泳检测,用NanoDrop 2000型分光光度计测定浓度。
1.4 HMGR保守片段、3′端及5′端的PCR扩增基于同源克隆,通过NCBI查找到橡胶树、青钱柳(Cyclocarya paliurus)、拟南芥、烟草、番茄(Lycopersicon esculentum)和水稻(Oryza sativa)的HMGR(登录号依次为AB294692.1,EU296534.1,AY488113.1,AB021862.1,L40938.1,L28995.1),设计简并引物fHMGR:5′-GATGC(C/A)ATGGG(A/G)ATGAACATGG-3′,rHMGR:5′-TACC(C/A)ACCTCAAT(G/A)GA(G/A)GGCAT-3′,于上海英骏生物技术有限公司合成。按TAKARA RNA PCR Kit(AMV)Ver.3.0(TaKaRa)说明将尾巨桉总RNA逆转录合成cDNA第1链,依照TàKàRà普通PCR反应说明于53.5 ℃进行HMGR保守片段扩增。回收目的片段与pMD19-T连接,转化大肠杆菌DH5α后涂于固体培养基LB,经PCR鉴定的阳性克隆送上海英骏公司测序。根据HMGR保守片段,设计3′ RACE引物HMGR3-1:5′-AACATCGTGGCAGCCATCTTTA-3′和HMGR3-2:5′-GGACCTTCACGTTTCTGTGACC-3′;以及5′RACE引物HMGR5-1:5′-GCTGGCTTCTTGTCGGCGCAGA-3′和HMGR5-2:5′-GTCGCTCTGGAGGAAGTCCAGG-3′。
按3′-Full RACE Core Set Ver.2.0(TaKaRa)说明将尾巨桉总RNA逆转录合成cDNA第1链,分别于56 ℃和59.5 ℃进行HMGR 3′RACE巢式PCR反应,回收PCR产物、转化、测序。按BD SMARTTM RACE cDNA Amplification Kit(Clontech)说明将尾巨桉总RNA逆转录合成cDNA第1链。按Advantage® 2 PCR Kit(Clontech)说明分别于63.5 ℃和64 ℃进行HMGR 5′ RACE巢式PCR反应,回收目的片段、转化、测序。
将HMGR保守片段、3′端和5′端序列在Vector NTI Suite 8中进行拼接,得到该基因的cDNA全长,并查找ORF及推导氨基酸序列。
1.5 HMGR组织特异性表达分析根据内参基因18S(登录号:AY615679.1)和HMGR序列,设计荧光定量PCR引物f18S:5′-ACTCATAACGACTCTCGGCAAC -3′,r18S:5′-GCGTTCAAAGACTCGATGGT-3′;以及fHMGR:5′-GAAAGGCGCTAACAAGGAGCTA-3′,rHMGR:5′-GTACTTCATGTGGCTCTTCACG-3′。取尾巨桉根、茎、枝和叶总RNA各100 ng,按PrimeScriptTM RT reagent Kit(TaKaRa)说明逆转录合成cDNA第1链,按照SYBR®Premix Ex TaqTM Ⅱ(TaKaRa)说明于58 ℃在Chromo 4实时定量PCR仪(Bio-Rad)进行反应,每组样品重复3次,采用2-ΔΔCT法于软件Opticon Monitor 3中进行结果分析。
1.6 HMGR的原核表达根据HMGR ORF序列,设计在上、下游引物5′端分别引入Sph Ⅰ和Sal Ⅰ酶切位点的扩增引物fQE30-HMGR:5′-ACATGCATGCATGTATGGCCGCCATC-3′,rQE30-HMGR:5′-ACGCGTCGACGTCGTTAAGAGGAGACCTT-3′。以叶cDNA为模板,按PrimeSTAR® HS DNA Poly-merase(TaKaRa)说明于65 ℃进行扩增,通过加“A”、纯化后连接、转化、测序。按DNA Ligation Kit Ver.2.0(TaKaRa)说明将阳性克隆质粒pMD19-T-QE30-HMGR进行Sph Ⅰ和Sal Ⅰ双酶切所得目的片段与pQE-30载体骨架相连接,形成重组质粒pQE-30-HMGR并转化后涂于固体培养基LB,通过PCR及双酶切鉴定得到阳性克隆质粒pQE-30-HMGR并转化大肠杆菌M15,PCR检测出阳性克隆。以空pQE-30质粒为对照,将含重组质粒pQE-30-HMGR的大肠杆菌M15培养至OD600约为0.6,加入IPTG至终浓度1 mmol·L-1,分别诱导表达1,2,3,4,5,6 h后,收集菌液,进行SDS-PAGE电泳检测。
2 结果与分析 2.1 HMGR保守片段、3′端及5′端克隆HMGR保守片段扩增产物经测序表明大小为451 bp。通过NCBI在线Blast N比对表明此片段与橡胶树的4个HMGR(登录号:AB294692.1,AY706757.1,AF429388.1,X54659.1)相似性均高达78%,说明扩增片段确为尾巨桉HMGR保守片段。HMGR3′ RACE和5′ RACE扩增结果如图 1,测序表明3′端特异性片段为626 bp;5′端存在大小为750 bp和1 029 bp的2个片段,其中750 bp的片段包含于1 029 bp的片段。将HMGR保守片段、3′端和5′端序列拼接得到cDNA全长为1 955 bp,该基因命名为EuHMGR1,GenBank登录号为GQ915611。

|
图 1 尾巨桉EuHMGR1保守片段(A)、3′RACE(B)及5′RACE(C)扩增 Figure 1 PCR products of conservative fragment(A), 3′RACE(B) and 5′RACE(C) of EuHMGR1 from E. urophylla×E. grandis M: DL2000 Marker. |
尾巨桉EuHMGR1全长包括66 bp的5′-UTR和329 bp 3′-UTR以及1 560 bp的ORF,编码519个氨基酸。在起始密码子ATG附近存在Kozak序列,如图 2方框所示,该序列满足Kozak规则, 即若将第1个ATG中的碱基A,T,G分别标为1,2,3位,则第4位的偏好碱基为G;同时ATG 5′端约15 bp范围的侧翼序列内不含碱基T(Kozak, 1984)。Kozak序列相当于原核生物的SD序列,当该类序列存在时转录和翻译效率最高,推测可能是核糖体启动翻译的识别起始位点。同时,在cDNA 3′末端具有典型的poly A结构,图 2横线所示。
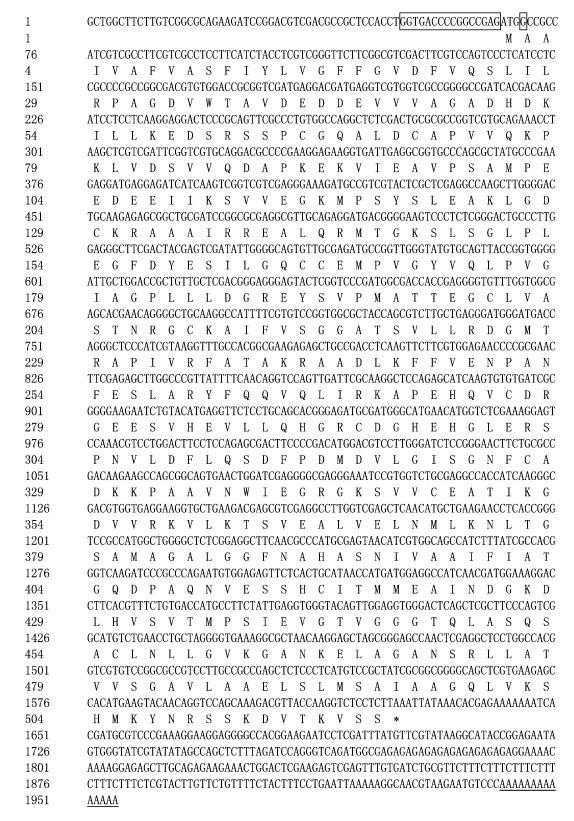
|
图 2 尾巨桉EuHMGR1核苷酸序列及氨基酸推导 Figure 2 The full-length cDNA sequence and deduced amino acid of EuHMGR1 from E. urophylla×E. grandis |
通过NCBI在线Blast P比对,尾巨桉EuHMGR1氨基酸序列与青钱柳、陆地棉(Gossypium hirsutum)、橡胶树、南京椴(Tilia miqueliana)、烟草(登录号依次为ABX82838.1,AAC05088.1,BAF98281.1,AAY68034.1,AAL54878.1)的HMGR相似度高达74%,72%,72%,70%,70%,表明克隆所得EuHMGR1确为尾巨桉HMGR基因,其推导的氨基酸序列准确可信。
2.3 EuHMGR1组织特异性表达分析通过实时定量PCR得到EuHMGR1相对定量表达结果(图 3),EuHMGR1在枝组织表达量最高,叶仅次于枝,根部位基本上没有表达。叶是尾巨桉次生代谢产物含量最多的组织,存在大量的萜类挥发性精油成分,根基本上不存在精油;因此EuHMGR1在叶和枝组织的表达量远高于茎和根。尾巨桉EuHMGR1作为甲羟戊酸途径中生成萜类前体物质的第1个关键酶基因,其表达量与桉树精油合成代谢旺盛程度是相一致的。

|
图 3 尾巨桉不同组织中EuHMGR1的定量表达分析 Figure 3 Relative quantitative expression analysis of EuHMGR1 from E.urophylla×E. grandis in different tissues |
尾巨桉EuHMGR1 ORF扩增片段经测序表明,其与预期ORF相一致,大小为1 560 bp,没有发生碱基突变,可读性较好。将EuHMGR1 ORF连接到pQE-30形成重组质粒pQE-30-EuHMGR1并转化大肠杆菌M15。以空载体pQE-30为对照,将含重组质粒pQE-30-EuHMGR1的大肠杆菌M15阳性克隆经IPTG诱导表达,含重组质粒pQE-30-EuHMGR1的大肠杆菌M15被诱导高效表达,如图 4所示,SDS-PAGE电泳检测出分子质量约55 ku的重组蛋白,与理论预测蛋白分子质量一致,而空白对照中没有出现与预测大小相同的蛋白;在诱导表达1~6 h范围内,以诱导3 h时表达量最高,之后逐渐减弱。EuHMGR1能成功进行原核表达,表明该基因能被正确翻译为3-羟基-3-甲基戊二酰CoA还原酶蛋白。
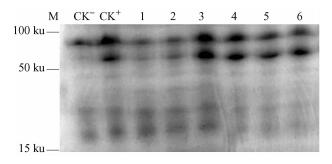
|
图 4 尾巨桉EuHMGR1重组蛋白SDS-PAGE电泳 Figure 4 SDS-PAGE analysis of recombinant EuHMGR1 protein M:蛋白分子量标准;CK-:pQE-30空载体;CK+:pQE-30-HMGR1重组质粒;1-6:pQE-30-EuHMGR1重组质粒分别诱导表达1,2,3,4,5,6 h。 M: Protein marker; CK-: Protein of pQE-30 in E. coli M15; CK+:No induced by IPTG protein of pQE-30-EuHMGR1 in E. coli M15; 1-6: Proteins of pQE-30-EuHMGR1 in E. coli M15 induced by IPTG from 1 to 6 hours respectively. |
在拟南芥(Enjuto et al., 1994)、麻疯树(Jatropha curcas)(Lin et al., 2009)等植物中已成功克隆出HMGR并进行了相关的功能验证分析。目前,植物HMGR相关的研究工作主要集中于生物碱以及草本植物胡椒薄荷(Mentha × piperita)和薰衣草(Lavandula latifolia)精油方面,而在木本植物挥发油代谢方面相关研究报道甚少。
植物HMGR通常存在3个以上的基因家族成员(Sando et al., 2008;MaldonadoMendoza et al., 1997),不同的基因家族成员在植物的代谢调控中发挥不同的生物学功能。如橡胶树HMGR1主要参与调控橡胶合成,HMGR3作为持家基因维持萜类正常代谢。本研究从尾巨桉中仅克隆得到EuHMGR1一个基因,其是否存在其他基因家族成员还需进一步验证(Cao et al., 2010),为今后尾巨桉HMGR基因家族成员的克隆以及研究各基因家族成员在桉树精油合成代谢中的调控作用提供可靠信息。
本研究采用RACE方法成功克隆到尾巨桉EuHMGR1基因,全长cDNA为1 955 bp,包含1 560 bp的ORF,编码519个氨基酸。实时荧光定量PCR分析表明,该基因在枝组织的表达量最高,叶次之,根中没有表达;此结果与Jiang等(2006)对杜仲(Eucommia ulmoides)HMGR组织特异性表达分析结果相一致。本试验中选用的pQE-30是由T5启动子启动的高效融合蛋白表达载体,构建到此载体上的尾巨桉EuHMGR1基因能够在大肠杆菌中高效表达,SDS-PAGE电泳检测出大小约55 ku的重组蛋白,与理论预测蛋白分子量相一致;由于表达的融合蛋白带有组氨酸标签,可进一步纯化并进行蛋白理化性质、催化活性等相关分析。
桉树精油的合成代谢网络相当复杂,不仅受代谢上游MVA和MEP途径上多个关键酶调控,同时还牵涉代谢下游催化生成各种单萜、双萜及简单含氧衍生物的酶,如香叶醇合成酶、芳樟醇合成酶和柠檬烯合成酶等。Lane等(2010)研究薰衣草花朵开放过程中HMGR,LinS和DXS基因的表达情况,HMGR前后表达水平没有明显变化,油腺细胞中单萜类化合物大量增加的原因推测主要为LinS,DXS 2个基因的作用,HMGR的作用不显著。由此可见,单个基因对代谢调控能力是有限的,本研究所克隆的尾巨桉EuHMGR1对桉树精油合成代谢调控是否起关键作用还有待进一步开展遗传转化方面的研究。
宋永芳. 1990. 桉树叶的利用[M]. 哈尔滨: 北京:中国林业出版社: 22-24.
|
Cao X Y, Zong Z M, Ju X Y, et al. 2010. Molecular cloning, characterization and function analysis of the gene encoding HMG-CoA reductase from Euphorbia pekinensis Rupr[J]. Molecular Biology Reports, 37(3): 1559-1567. DOI:10.1007/s11033-009-9558-7 |
Degenhard J, Kollner T G, Gershenzon J. 2009. Monoterpene and sesquiterpene synthases and the origin of terpene skeletal diversity in plants[J]. Phytochemistry, 70(15/16): 1621-1637. |
Enjuto M, Balcells L, Campos N, et al. 1994. Arabidopsis thaliana contains two differentially expressed 3-hydroxy-3-methylglutaryl-CoA reductase genes, which encode microsomal forms of the enzyme[J]. Proc Natl Acad Sci USA, 91(3): 927-931. DOI:10.1073/pnas.91.3.927 |
Jiang Jihong, Kai Guoyin, Cao Xiaoying, et al. 2006. Molecular cloning of a HMG-CoA reductase gene from Eucommia ulmoides Oliver[J]. Biosci Rep, 26(2): 171-181. DOI:10.1007/s10540-006-9010-3 |
Kozak M. 1984. Compilation and analysis of sequences upstream from the translational start site in eukaryotic messenger-RNAs[J]. Nucleic Acids Research, 12(2): 857-872. DOI:10.1093/nar/12.2.857 |
Lane A, Boecklemann A, Woronuk G N, et al. 2010. A genomics resource for investigating regulation of essential oil production in Lavandula angustifolia[J]. Planta, 231(4): 835-845. DOI:10.1007/s00425-009-1090-4 |
Lin J, Jin Y J, Zhou M Q, et al. 2009. Molecular cloning, characterization and functional analysis of a 3-hydroxy-3-methylglutaryl coenzyme A reductase gene from Jatropha curcas[J]. African Journal of Biotechnology, 8(15): 3455-3462. |
Maldonado-Mendoza I E, Vincent R M, Nessler C L. 1997. Molecular characterization of three differentially expressed members of the Camptotheca acuminata 3-hydroxy-3-methylglutaryl CoA reductase (HMGR) gene family[J]. Plant Molecular Biology, 34(5): 781-790. DOI:10.1023/A:1005866813347 |
Manzano D, Fernandez-Busquets X, Schaller H, et al. 2004. The metabolic imbalance underlying lesion formation in Arabidopsis thaliana overexpressing farnesyl diphosphate synthase (isoform 1S) leads to oxidative stress and is triggered by the developmental decline of endogenous HMGR activity[J]. Planta, 219(6): 982-992. DOI:10.1007/s00425-004-1301-y |
McGarvey D J, Croteau R. 1995. Terpenoid metabolism[J]. Plant Cell, 7(7): 1015-1026. DOI:10.1105/tpc.7.7.1015 |
Ogunwande I A, Olawore N O, Adeleke K A, et al. 2005. Volatile constituents from the leaves of Eucalyptus cloeziana F.Muell and E.propinqua Deane & Maiden from Nigeria[J]. Flavour and Fragrance Journal, 20(6): 637-639. |
Sando T, Takaoka C, Mukai Y, et al. 2008. Cloning and characterization of mevalonate pathway genes in a natural rubber producing plant, Hevea brasiliensis[J]. Bioscience Biotechnology and Biochemistry, 72(8): 2049-2060. DOI:10.1271/bbb.80165 |
Schaller H, Grausem B, Benveniste P, et al. 1995. Expression of the Hevea brasiliensis (H.B.K.) Mull.Arg.3-hydroxy-3-methylglutaryl-coenzyme A reductase 1 in tobacco results in sterol overproduction[J]. Plant Physiology, 109(3): 761-770. |
 2011, Vol. 47
2011, Vol. 47

