文章信息
- 王娟娟, 张文辉
- Wang Juanjuan, Zhang Wenhui
- NaCl和Na2CO3胁迫对四翅滨藜种子萌发及保护酶活性的影响
- Effects of Activities of Protective Enzymes and Seed Germination in Atriplex canescens under NaCl and Na2CO3 Stress
- 林业科学, 2011, 47(2): 154-160.
- Scientia Silvae Sinicae, 2011, 47(2): 154-160.
-
文章历史
- 收稿日期:2009-05-15
- 修回日期:2009-12-10
-
作者相关文章
土壤盐渍化是困扰人类的五大土壤问题之一(王春裕等,1997)。我国华北和滨海地区存在大量盐渍化土地,有些区域土壤含盐量达到1%以上(毛建华等,2005),严重影响着当地种植业生产的持续发展,也给园林绿化带来很大困难。大量培育、引种、选择具有耐盐、耐旱特性植物,在干旱和盐渍化地区栽培,不仅能够改善干旱和盐渍化环境,而且能够带来经济效益,是未来园林绿化和林业发展的方向。
四翅滨藜(Atriplex canescens), 藜科滨藜属植物, 原产美国中西部地区, 常绿或半常绿饲料灌木。该种属深根性树种,叶灰绿色,枝叶繁密,生物量高,蛋白质丰富,富硒,具有耐干旱、耐盐碱、速生等优良特性(Jos′e et al., 2004; Aslam et al., 1986), 广泛用于牧场改良和水土保持。我国于1990年开始引种, 先后在青海、宁夏、新疆、吉林、内蒙古、陕西等地进行区域性栽培试验,初步判定四翅滨藜引进到我国后基本保持原产地的优良特性,适合在干旱地区栽培,并且易繁殖,可作为造林绿化树种(赵晓明等,2005)。笔者于2005年春季从青海省林业局引进一批四翅滨藜种子,在天津塘沽区、津南区和天津师范大学试验田进行引种试验,经过几年的试验观测,四翅滨藜生长发育正常,表现出一定的耐盐、耐碱特性,同时枝叶浓密,密被灰白色绒毛,具有良好的观赏性。但是,四翅滨藜到底能在何种程度的碱化土壤生长,能否适应滨海盐渍化和碱化生境,并作为园林绿化植物在滨海地区栽培尚需要进一步深入研究。
天津滨海地区盐渍化土壤主要由3类物质构成:NaCl,Na2CO3和NaHCO3(杨永利等, 2004),前者属于中性盐,后2种属于碱性盐。中性盐胁迫与碱性盐胁迫实际是2种性质不同的胁迫, 应该将前者称为盐胁迫而将后者称为碱胁迫, 碱胁迫比盐胁迫具有更大的生态破坏力(石德成等,1998;Elshma,1996)。种子萌芽成苗是植物生活史中最脆弱的环节,通常以植物种子在天然条件下能否通过“环境筛”作为评价种群适应力和生存力的指标。四翅滨藜种子能否在盐碱土条件下萌发成苗, 是能否在天津滨海盐渍化地区栽培、园林利用的前提。因此,通过设置土壤盐碱梯度,探索四翅滨藜在盐碱胁迫下的种子萌发过程和生理生化反应具有重要意义。此前,Edward等(1996;1998)和胡生荣等(2008)在四翅滨藜对NaCl和PEG胁迫的响应及周玉泉(2007)在嫩枝扦插和造林技术方面进行研究,而四翅滨藜对碱性盐胁迫的研究尚未见报道。
本文在控制试验条件下,设置NaCl和Na2CO3胁迫梯度,对四翅滨藜种子萌发、生长及保护酶系统进行测定,目的是阐明四翅滨藜萌发过程中对盐碱胁迫耐受性潜力,为其在盐碱地栽培提供依据。
1 材料与方法 1.1 试验材料2008年10月从青海省林业厅种苗总站购买当年产四翅滨藜种子。2009年1月将种子去翅后,选取饱满、大小均一的种子作为盐碱胁迫的备用材料。
1.2 试验方法1) 溶液配制 NaCl溶液:用NaCl配成Na+浓度依次为0.05,0.10,0.15,0.20,0.25 mol·L-1的不同NaCl溶液, 相应pH值均为6.5(用NaOH溶液调配);Na2CO3溶液:用Na2CO3配成Na+ 浓度为0.05,0.10,0.15,0.20,0.25 mol·L-1的不同Na2CO3溶液, 相应的pH值为8.8,9.5,10.2,11.3和12.4。
2) 发芽试验 种子去翅、低温有利于发芽(徐秀梅等,2003)。去翅的种子5 ℃冷藏4天后,用蒸馏水浸泡24 h,经30% H2O2消毒4 min,蒸馏水冲洗后放人发芽床中。发芽床采用置入2层纱布和1层滤纸的培养皿(ϕ12 cm)。每发芽床30粒种子,依次加入配制好的NaCl和Na2CO3溶液,蒸馏水作对照,每处理3次重复。2天更换1次纱布和滤纸。于SPX-150B-Z型生化培养箱内,恒温25 ℃,相对湿度60%,连续黑暗培养10天,每日观察、计录发芽数、测量胚根和胚轴长度。
3) 指标测定 ①生长指标测定 以胚根伸长0.2 cm作为发芽标志,每天定时记录种子萌发数和胚根的长度,种子一般可在10天之内结束发芽试验的周期(郑光华,2004),而四翅滨藜幼苗正常出土时间为6~20天(徐秀梅等,2003),故本试验将发芽周期定为10天,发芽结束后测定幼苗鲜质量。具体计算公式如下:
萌发率G = n/N×100%,n为萌发种子数,N为供试种子数(孙时轩,1992)。发芽指数Gi = Σ(Gt/Dt),Gt为时间t日的萌发数,Dt为相应的萌发天数。发芽值Vg = Vp×MDG。峰值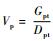
日平均发芽率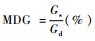
活力指数Iv =S×Gi,S为幼苗鲜质量(郑光华,2004)。
生长速率=L / Σ[Ni×(Dt-Di + 0.5) ],L指每一皿中全部萌发种子胚根或胚轴长度的总和; Ni指第i天的萌发种子
数; Dt指试验持续的天数(10天)(Ahmed et al., 2004)。
②保护酶测定 保护酶酶液的提取:待发芽结束(10天后)后,取每培养皿中全部发芽的种子(去掉种皮),置于预冷的研钵中,加适量预冷的50 mmol·L-1磷酸缓冲液(含1% PVP,pH值7)及少量石英砂,在冰浴中研磨成匀浆,在2~4 ℃下,12 000 g离心20 min。上清液为酶液。
SOD的测定参照李合生(2000)的方法,以抑制NBT光化还原50%为一个酶活性单位表示。CAT的测定用紫外吸收法,以1 min内A240减少0.1的酶量为一个酶活性单位(薛应龙,1985)。POD的测定用愈创木酚染色法,以每1 min内A470变化0.01为一个过氧化物酶活性单位(张志良等,2003;朱广廉等,1990)。
4) 数据分析方法 所得数据用SPSS 13.0进行统计分析,在置信水平95%上用Duncan方法进行多重比较,Excel绘图。
2 结果与分析 2.1 NaCl和Na2CO3胁迫对四翅滨藜种子萌发的影响1) NaCl和Na2CO3胁迫对种子总萌发率的影响 如图 1:四翅滨藜种子在NaCl胁迫下,总萌发率在0.05 mol·L-1时,比对照略有增加,为对照的1.1倍;在0.10 mol·L-1时比对照下降,但无明显差异;在0.15,0.20和0.25 mol·L-1时萌发率与对照相比差异显著,分别下降50%,70%和90%。种子在Na2CO3胁迫下总萌发率比对照均下降,在Na+ 浓度为0.05和0.10 mol·L-1时与对照无明显差异;0.15和0.20 mol·L-1时分别下降73%和90%,与对照相比差异显著;0.25 mol·L-1时种子不萌发。可能由于随着盐浓度的增加,种子吸水困难,萌发率降低。
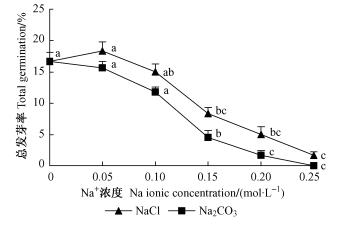
|
图 1 盐碱胁迫对种子总萌发率的影响 Figure 1 Effect of salt and alkali on total germination |
相同Na+ 浓度NaCl胁迫的种子萌发率均略高于Na2CO3胁迫,但差异不明显。说明四翅滨藜种子萌发主要受渗透作用影响。
2) NaCl和Na2CO3胁迫对种子发芽指数的影响 发芽指数综合种子萌发的数目、速度以及整齐程度3个因素, 比单纯的发芽率更能全面地反映种子的萌发情况。图 2反应:0.05 mol·L-1 NaCl处理下种子的发芽指数比对照高27.6%,随着处理浓度的升高发芽指数降低,在0.15,0.20和0.25 mol·L-1时与对照差异显著,分别下降65.2%,81.3%和93.6%。种子在Na2CO3胁迫下发芽指数均降低,在Na+ 浓度为0.10,0.15和0.20 mol·L-1时与对照差异显著,分别下降42%,83.1%和93.6%,0.25 mol·L-1时发芽指数为0。相同Na+ 浓度NaCl处理下发芽指数是Na2CO3处理的1.42,1.48,2.06和2.94倍,0.25 mol·L-1时Na2CO3处理种子发芽指数为0。说明相同Na+ 浓度时,Na2CO3处理对种子发芽指数的抑制作用大于NaCl处理。
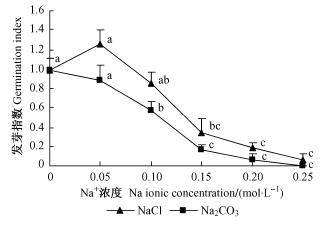
|
图 2 不同浓度NaCl和Na2CO3胁迫对种子发芽指数的影响 Figure 2 Effects of different concentration of NaCl and Na2CO3 on the seed germination index |
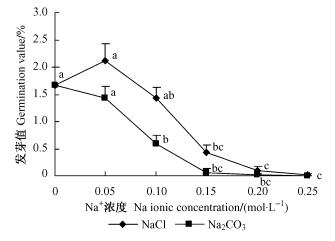
3) NaCl和Na2CO3胁迫对种子发芽值的影响 发芽值是反映种子活力的一个指标,它是衡量种子发芽多少和快慢以及抵御不良环境能力的一个综合指标(朱海涛等,2002)。在0.05 mol·L-1 NaCl处理下种子的发芽值为对照的1.28倍(图 3),之后随盐浓度的升高而降低,0.15,0.20和0.25 mol·L-1时分别为对照的26.4%,6.1%和1.0%,与对照差异显著。种子在Na2CO3胁迫下发芽值均降低,且降幅较大,在Na+ 浓度为0.15 mol·L-1时发芽值已不足对照的1%。等Na+ 浓度NaCl处理下的发芽值是Na2CO3处理的1.48,2.40,7.19和4.28倍,0.25 mol·L-1时Na2CO3处理种子发芽值为0。说明四翅滨藜种子更能耐受盐胁迫。
|
图 3 不同浓度NaCl和Na2CO3胁迫对种子发芽值的影响 Figure 3 Effects of different concentration of NaCl and Na2CO3 on the seed germination value |
种子萌发后, 胚根和胚轴的延伸反映出植物定居成苗的特性。如表 1:四翅滨藜种子在0.05 mol·L-1 NaCl处理下胚根和胚轴的长度分别为对照的1.13和1.04倍,盐浓度大于0.10 mol·L-1时胚根和胚轴的长度与对照相比减小,在0.15,0.20和0.25 mol·L-1时与对照差异显著。种子在Na2CO3胁迫下胚根和胚轴的长度均减小,且降幅明显,在较低pH值(0.05和0.10 mol·L-1)时就与对照有显著差异,胚根分别下降29.2%和61.2%;胚轴分别下降55%和78.2%。随着pH值的增大胚根和胚轴长度急剧缩短至小于1 cm。说明Na2CO3胁迫严重影响了种子胚根和胚轴的生长。
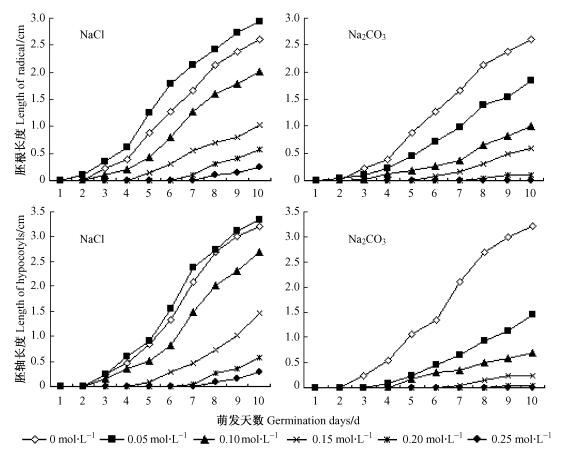
由于处理下种子萌发时间存在差异, 胚根、胚轴的生长时间不同, 因此速度指标较长度指标能更为准确地反映盐胁迫的抑制程度(刘宝玉等,2007)。种子在盐碱胁迫下胚根和胚轴生长速率均比对照减慢(表 1),但在0.05 mol·L-1 NaCl处理下胚根和胚轴的生长早于对照(图 4)。在0.10,0.15,0.20和0.25 mol·L-1NaCl胁迫下胚根生长速率与对照相比差异显著,分别下降32.8%,63.0%,82.8%和96.0%;在0.15,0.20和0.25 mol·L-1Na2CO3胁迫下,胚轴生长速率与对照相比差异显著,分别下降65.6%,85.5%和94.6%。在Na2CO3胁迫下,Na+ 浓度≥0.05 mol·L-1时胚根和胚轴的生长速率均与对照有明显差异。胚根生长速率分别下降40.1%,60.3%,85.0%和97.1%,0.25 mol·L-1时为0。胚轴生长速率分别下降52.5%,73.7%和91.8%,0.20和0.25 mol·L-1时为0。等Na+ 浓度NaCl处理下的胚根生长速率是Na2CO3处理的1.49,1.69,2.46和5.88倍,0.25 mol·L-1时Na2CO3处理种子胚根不生长;NaCl处理下的胚轴生长速率是Na2CO3处理的1.84,2.12和4.21倍,0.20和0.25 mol·L-1时Na2CO3处理种子胚轴生长。高浓度NaCl和Na2CO3胁迫推迟了种子的萌发,进而延缓胚根和胚轴的延伸。从图 4可得:Na2CO3处理下种子胚根和胚轴的生长均迟于NaCl处理。说明pH值对抑制种子胚根的生长起主要作用,而四翅滨藜把推迟种子胚根胚轴的延伸作为适应盐碱环境的一种生存策略。
|
|
|
图 4 不同浓度NaCl和Na2CO3胁迫对种子胚根和胚轴逐日变化的影响 Figure 4 Effects of different concentration of NaCl and Na2CO3 on the daily radicle and hypocotyls lengths of the seeds |
种子活力比常规发芽率的测定更可以反映种子在实际条件下萌发速度和整齐度以及幼苗健壮生长的潜势(徐秀梅等,2002)。由图 5得知:四翅滨藜种子在0.05 mol·L-1 NaCl处理下活力指数为对照的1.35倍,之后随着盐浓度的增加种子活力下降,在0.15,0.20和0.25 mol·L-1时均与对照有明显差异,分别下降69.2%,89.8%和97.1%。在Na2CO3处理下种子活力均下降,在Na+ 浓度为0.05,0.10,0.15和0.20 mol·L-1时均与对照差异显著,分别下降13.5%,60.5%,91.0%和96.9%,0.25 mol·L-1时降为0。相同Na+ 浓度NaCl处理的种子活力是Na2CO3处理的1.55倍,2.26,3.42和4.49倍,0.25 mol·L-1时Na2CO3处理种子活力指数为0。说明等Na+ 浓度时,Na2CO3处理对种子活力的抑制作用大于NaCl处理。

|
图 5 不同浓度NaCl和Na2CO3胁迫对种子活力指数的影响 Figure 5 Effects of different concentration of NaCl and Na2CO3 on the seed vigor index |
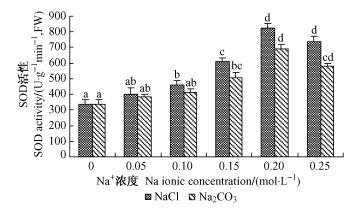
1) NaCl和Na2CO3胁迫对种子SOD活性的影响 在NaCl和Na2CO3胁迫下种子SOD的活性表现为随胁迫浓度增加先升后降(图 6)。NaCl为0.20 mol·L-1时SOD的活性达到最大,为对照的2.44倍,0.25 mol·L-1时开始下降,为对照的2.18倍,浓度≥0.10 mol·L-1时均与对照差异显著。Na2CO3处理下,在Na+ 浓度为0.20 mol·L-1时SOD的活性达到最大,为对照的2.05倍,0.25 mol·L-1时开始降低,为对照的1.72倍。浓度≥0.15 mol·L-1时均与对照差异显著。等Na+ 浓度NaCl处理的SOD活性是Na2CO3处理的1.06~1.27倍。说明盐碱胁迫对SOD活性的影响表现为低浓度促进,高浓度抑制;且Na2CO3处理的抑制程度大于NaCl处理。
|
图 6 不同浓度NaCl和Na2CO3胁迫对种子SOD活性的影响 Figure 6 Effects of different concentration of NaCl and Na2CO3 on the seed SOD activity |
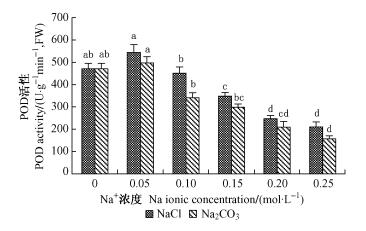
2) NaCl和Na2CO3胁迫对种子POD活性的影响 在NaCl和Na2CO3胁迫下种子POD的活性表现为随胁迫浓度增加先升后降(图 7)。NaCl为0.05 mol·L-1时POD的活性比对照高,为对照的1.16倍,0.10 mol·L-1时开始逐渐下降,0.15,0.20和0.25 mol·L-1时与对照差异显著,分别为对照的74.0%,52.4%和44.7%。Na2CO3处理下,在Na+ 浓度为0.05 mol·L-1时POD的活性比对照高,为对照的1.06倍,0.10 mol·L-1时开始逐渐下降,0.20和0.25 mol·L-1时与对照差异显著,分别为对照的44.4%和33.3%。相同Na+ 浓度NaCl处理的POD活性是Na2CO3处理的1.09~1.34倍。说明POD对盐碱胁迫较敏感。
|
图 7 不同浓度NaCl和Na2CO3胁迫对种子POD活性的影响 Figure 7 Effects of different concentration of NaCl and Na2CO3 on the seed POD activity |
3) NaCl和Na2CO3胁迫对种子CAT活性的影响 随胁迫浓度增加NaCl处理下种子CAT的活性表现先降后升,Na2CO3处理下先升后降(图 8)。NaCl为0.10 mol·L-1时CAT的活性最低并与对照差异显著,为对照的61.6%,之后最胁迫浓度增加而上升。Na2CO3处理下,在Na+ 浓度为0.05 mol·L-1时CAT的活性达最大,为对照的1.15倍,0.10 mol·L-1时开始逐渐下降,0.15,0.20和0.25 mol·L-1时与对照差异显著,分别为对照的63.1%,59.5%和45.8%。相同Na+ 浓度处理下,0.05和0.10 mol·L-1时Na2CO3处理的CAT活性比NaCl处理高,为1.34和1.33倍,0.15~0.25 mol·L-1时NaCl处理的CAT活性比Na2CO3处理高,为1.33~2.80倍。说明四翅滨藜种子的CAT活性对盐碱胁迫的响应机制不同。

|
图 8 不同浓度NaCl和Na2CO3胁迫对种子CAT活性的影响 Figure 8 Effects of different concentration of NaCl and Na2CO3 on the seed CAT activity |
盐分是盐生环境中限制种子萌发的最重要的环境因子, 高盐条件可以引发或强迫种子进入休眠状态。在蒸馏水环境下四翅滨藜种子的发芽率仅为16.7%,可能是由种子休眠造成的,因为四翅滨藜种子需要储藏约10个月才能完成后熟作用(徐秀梅等,2002)。在0.05 mol·L-1 NaCl处理下种子的发芽率、发芽指数、发芽值和活力指数均比对照高,说明低浓度盐胁迫可以促进四翅滨藜种子萌发,这与廉彭彭(2008)对疣苞滨藜(Atriplex verrucifera)种子的研究一致。当NaCl浓度﹥0.05 mol·L-1时,以上各指标均随盐浓度的增加而下降,且当NaCl浓度≥0.15 mol·L-1时,以上各指标均与对照有显著差异,说明随着盐胁迫的增强, 四翅滨藜种子周围水势下降, 细胞内外水势差也随之变小, 种子吸水困难(Munns, 2002; 陈月艳等,1997), 由于吸水不足, 胚乳内储藏物质不能动员, 呼吸作用受到抑制, 种子难以萌发(杨春武等,2006)。四翅滨藜种子能耐受的最大盐浓度大于0.25 mol·L-1,这比胡生荣等(2008)的结果稍高。这可能与种子发芽环境不同有关。
在Na2CO3胁迫下, 种子的发芽率、发芽指数、发芽值、活力指数、胚根和胚轴的生长速率均随Na2CO3浓度的增大而降低,当Na+浓度为0.25 mol·L-1(pH值12.4)时,种子不能发芽,且Na+ 浓度相同时,Na2CO3胁迫下各指标均小于NaCl胁迫。在Na+浓度≥0.15 mol·L-1(pH值10.2)或0.10 mol·L-1(pH值9.5)时,发芽率、发芽指数和发芽值与对照有显著差异,而Na+浓度≥0.05 mol·L-1(pH值8.8)时,胚根和胚轴的长度及生长速率和活力指数就与对照有显著性差异,说明Na2CO3胁迫对种子萌发的抑制作用主要体现在对胚根、胚轴生长的抑制上。主要是因为萌发后期胚根、胚轴生长需要从环境摄取大量矿质元素, 植物不仅需要进行渗透调节, 同时也需要进行pH值调节。此时pH值作用可能就会逐渐增强甚至转向主导地位。由表 1、图 5可得:NaCl处理比Na2CO3处理下胚根和胚轴的生长速率以及活力指数最大高出4~6倍,且Na2CO3处理下的胚根、胚轴的逐日生长量明显小于NaCl处理。已有研究证明:缓冲量和盐浓度是影响向日葵(Helianthus annuus)(孙国荣等,1999;石德成等,1998)和羊草(Aneurolepidium chinense)(Shi et al., 2005a)苗生长的主导因素, pH值甚至比盐度影响还大(Shi et al., 2005a; 2005b),这与本研究结果相似。综合以上种子萌发指标得出,四翅滨藜种子萌发初期主要受盐胁迫影响,而萌发后期的生长主要受pH值影响。
盐碱胁迫对质膜的伤害被认为是盐碱对植物的原初伤害(曾韶西等,1997), 由活性氧(ROS)引起的膜脂过氧化是引起膜伤害的重要原因(杨淑慎等,2001)。SOD,POD和CAT是植物体内酶促防御系统的3个重要保护酶, 它们协同作用相互配合消除活性氧,保护植物膜系统(Tiffin et al., 1959)。NaCl胁迫下,SOD在0~0.20 mol·L-1时随处理浓度的升高而升高,浓度大于0.20 mol·L-1之后下降;POD在0.05 mol·L-1时升高,大于0.10 mol·L-1时随处理浓度的升高而下降;而CAT在0~0.10 mol·L-1时随处理浓度的升高而下降,在0.10~0.25 mol·L-1时随处理浓度的升高反而升高,说明四翅滨藜种子在低浓度NaCl(≤0.10 mol·L-1)胁迫下,主要是SOD和POD起作用,这与寇贺等(2007)对大豆(Glycine max)种子萌发的研究结果相似;而高浓度NaCl(>0.10 mol·L-1)胁迫下,主要是SOD和CAT起作用。说明四翅滨藜种子在低盐和高盐胁迫下的调控机制不同,这有待于进一步研究。与之相比,在Na2CO3胁迫下SOD和POD的变化与NaCl胁迫下相同,而CAT却表现为先升后降(只在Na+ = 0.05 mol·L-1时略微升高),致使在高浓度Na2CO3处理下只有POD保持较高活性,而在Na+浓度﹥0.20 mol·L-1时也开始下降。造成这种现象的原因可能是由于Na2CO3胁迫时打破保护酶系统的平衡, 不利于清除活性氧, 使膜脂过氧化程度大于NaCl作用时(寇贺等,2007),因为碱性盐胁迫下除了Na+ 作用外还增加高pH值的作用(王平等,1994)。
陈月艳, 孙国荣, 李景信. 1997. Na2CO3胁迫对星星草种子萌发过程中水分吸收及膜透性的影响[J]. 草业科学, 14(2): 27-30. |
胡生荣, 张勇. 2008. 不同预处理对滨藜种子在逆境中萌发的影响[J]. 种子, 27(4): 1-6. |
寇贺, 曹敏建, 那桂秋. 2007. Na2CO3和NaCl对大豆种子萌发胁迫效应的比较研究[J]. 种子, 26(12): 27-30. DOI:10.3969/j.issn.1000-8071.2007.12.016 |
刘宝玉, 张文辉, 刘新成, 等. 2007. 沙枣和柠条种子萌发期耐盐性研究[J]. 植物研究, 27(6): 721-728. |
李合生. 2000. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社.
|
廉彭彭, 周桂玲. 2008. NaCl胁迫对疣苞滨藜种子萌发和早期幼苗生长的影响[J]. 西北植物学报, 28(12): 2461-2466. DOI:10.3321/j.issn:1000-4025.2008.12.016 |
毛建华, 沈伟然. 2005. 天津滨海新区土壤盐碱与污染状况及土地利用的思考[J]. 天津农业科学, 11(4): 15-17. |
石德成, 盛艳敏. 1998. 复杂盐碱生态条件的人工模拟及其对羊草生长的影响[J]. 草业学报, 7(1): 36-41. |
孙国荣, 阎秀峰. 1999. 盐碱胁迫下星星草种子萌发过程中有机物、呼吸作用及其几种酶活性的变化[J]. 植物研究, 19(4): 445-451. |
孙时轩. 1992. 造林学[M]. 北京: 中国林业出版社.
|
王春裕. 1997. 诌议土壤盐渍化的生态防治[J]. 生态学杂志, 16(6): 67-71. |
王平, 殷立娟, 李建东. 1994. 中性盐和碱性盐对羊草幼苗胁迫的研究[J]. 草业学报, 3(2): 37-43. |
徐秀梅, 张新华. 2002. 四翅滨藜种子发芽生态学研究[J]. 宁夏农林科技, (6): 14-20. |
徐秀梅, 陈广宏. 2003. 四翅滨藜生物学、生态学及繁殖特性探讨[J]. 宁夏农林科技, (4): 1-7. |
薛应龙. 1985. 植物生理学实验手册[M]. 上海: 上海科学技术出版社.
|
杨春武, 贾娜尔·阿汗, 石德成, 等. 2006. 复杂盐碱条件对星星草种子萌发的影响[J]. 草业学报, 15(5): 45-51. |
杨淑慎, 高俊凤. 2001. 活性氧、自由基与植物的衰老[J]. 西北植物学报, 21(2): 215-220. |
杨永利, 徐君. 2004. 滨海重盐渍荒漠化地区生态重建生物技术模式的研究:以天津滨海新区为例[J]. 农业环境科学学报, 23(2): 359-363. |
郑光华. 2004. 种子生理研究[M]. 北京: 科学出版社.
|
朱广廉, 钟海文, 张爱琴. 1990. 植物生理学实验[M]. 北京: 北京大学出版社.
|
朱海涛, 张发亮, 刘叠宏, 等. 2002. 20%克福玉米种衣剂对种子活力的影响[J]. 洛阳农业高等专科学校学报, 22(1): 25-26. |
曾韶西, 王以柔, 李美如. 1997. 冷和盐预处理提高水稻幼苗抗寒性期间细胞Ca2+-ATP酶活性的变化[J]. 植物学报, 39(4): 308-314. |
赵晓明, 权文富. 2005. 吉林西部四翅滨藜引种初报[J]. 吉林林业科技, 34(5): 10-12. |
周玉泉. 2007. 美国四翅滨藜嫩枝扦插技术[J]. 山西林业科技, (3): 44-45. |
张志良, 瞿伟菁. 2003. 植物生理学实验指导[M]. 北京: 高等教育出版社.
|
Ahmed D, Karim B H, Claude G S, et a1. 2004. Alinity effects on germination, growth, and seed production of the halophyte Cakile maritime[J]. Plant and Soil, 262(1): 179-189. |
Aslam Z, Jeschke W D, Barrett-Lennard E G, et al. 1986. Effects of external NaCl on the growth of Atriplex amnicola and the ion relations and carbohydrate status of the leaves[J]. Plant, Cell and Environment, 9(7): 571-580. |
Edward G, Jed B J. 1998. Effects of soil salt levels on the growth and water use efficiency of Atriplex canescens (chenopodiaceae) varieties in drying[J]. American Journal of Botany, 85(1): 10-16. DOI:10.2307/2446548 |
Edward G, Rachael P. 1996. Na and K accumulation and salt tolerance of Atriplex canescens (chenopodiaceae) genotypes[J]. American Journal of Botany, 83(8): 997-1005. DOI:10.2307/2445988 |
Elshma S. 1996. Comparative effect of sodium carbonate, sodium sulphate, and sodium chloride on the growth and related metabolic activities of pea plants[J]. Journal of Plant Nutrition, 19(5): 717-728. DOI:10.1080/01904169609365155 |
Jos′e R, Mar′la J L, Manuel B. 2004. Effect of NaCl and KCl salts on the growth and solute accumulation of the halophyte Atriplex nummularia[J]. Plant and Soil, 259(1/2): 163-168. DOI:10.1023/B:PLSO.0000020953.50331.a5 |
Munns R. 2002. Comparative physiology of salt and water stress[J]. Plant, Cell and Environment, 25(2): 239-250. DOI:10.1046/j.0016-8025.2001.00808.x |
Shi D, Sheng Y. 2005a. Effect of various salt-alkaline mixed stress conditions on sunflower seedlings and analysis of their stress factors[J]. Environmental and Experimental Botany, 54(1): 8-21. DOI:10.1016/j.envexpbot.2004.05.003 |
Shi D, Wang D. 2005b. Effect s of various salt-alkali mixed stresses on Aneurolepidium chinense (Trin.) Kitag[J]. Plant and Soil, 271(1/2): 15-26. |
Tiffin L O, Brown J C. 1959. Absorption of iron from iron chelate by sunflower roots[J]. Science, 130: 274-275. |
 2011, Vol. 47
2011, Vol. 47


