文章信息
- 高建锋, 刘晓光, 高克祥, 刘璇, 李超, 王庆华
- Gao Jianfeng, Liu Xiaoguang, Gao Kexiang, Liu Xuan, Li Chao, Wang Qinghua
- 杨树内生菌球毛壳抗生物质的培养基优化、检测和动力学
- Optimazation of Media for Culturing Endophytic Fungus Chaetomium globosum Isolated from a Poplar Detection and Dynamics of Antifungal Substances
- 林业科学, 2011, 47(2): 82-88.
- Scientia Silvae Sinicae, 2011, 47(2): 82-88.
-
文章历史
- 收稿日期:2009-09-10
- 修回日期:2010-01-16
-
作者相关文章
2. 江苏大学生命科学研究院 镇江 212013;
3. 山东省泰安市徂徕山林场 泰安 271000
2. Institute of Life Sciences, Jiangsu University Zhenjiang 212013;
3. Forest Farm of Culai Mountain of Tai'an Tai'an 271000
毛壳菌通常存在于土壤和有机肥中,是子囊菌中最大的属之一,它可以有效降解纤维素和有机物,并对土壤中的其他微生物产生拮抗作用,因此,毛壳菌成为植物病原菌的生物防治菌并被广泛应用(池玉杰等,2002)。球毛壳菌(Chaetomium globosum)和螺卷毛壳菌(C. cochliodes)对多种植物病原菌有明显的抑制作用,作用机制主要表现为重寄生和产生毛壳素(chaetomin)等抗生素(Aggarwal et al., 2004)。
球毛壳ND35菌株是一个分离自健康毛白杨(Populus tomentosa)的内生菌优势菌株,球毛壳ND35属于子囊菌亚门、核菌纲、球壳目、黑孢壳科。研究表明:ND35具有明显促进植株生长的作用和对多种病原菌有重寄生作用(刘晓光等,1999;印敬明等,2006),从ND35的发酵液中提取产生的脂溶性抗生素类物质,能对玉米弯孢叶斑病(Curvularia lunata)等20多种病原菌的菌丝生长和孢子的萌发产生明显的抑制作用(万慧等,2007),但是抗生素的产量不高。
本试验目的在于研究球毛壳ND35在各种培养基中发酵培养,分离纯化球毛壳ND35抑菌活性物质,进行产量和生物活性测定,进一步找到培养球毛壳ND35抗生物质的最佳培养基;并对其活性组分进行定位和理化性质鉴定;同时对球毛壳ND35抗生物质液体培养的动力学进行分析,为将来监控大规模的工业发酵提供依据,为下一步的工业化生产打下基础。
1 材料与方法 1.1 供试菌种杨树内生真菌:球毛壳ND35,从河北省保定市的健康毛白杨树体内分离。
病原菌:杨树腐烂病病菌(Valsa sordida),从黑龙江省大庆市三北防护林的小黑杨(Populus×xiaohei)树皮腐烂病疤上分离。
1.2 发酵培养和抑菌粗提物提取参考万慧等(2007)的方法,将球毛壳ND35在PDB中培养,得黄褐色固体粗提物,用少量丙酮回溶收集,待丙酮挥发后,-20 ℃密闭保存备用。
1.3 正交试验设计优化培养基以碳源、氮源、矿质元素、生长因子和pH值为基本因子,每个因子均选取4个水平,用L16(45)正交表设计各种培养基组合(表 1)获16种培养基。将优选出的培养基组合进行综合评比,从中选择影响抗生物质产量的主要因素以及确定最佳组合(Xiao et al., 2004)。
|
|
参考梁建根等(2007)的方法并稍加改动,制备以下8种处理液:
1) 球毛壳ND35发酵液的制备 将球毛壳ND35经PDA培养基平板活化后,挑取菌丝饼接种于PDB培养基中,28 ℃下振荡(160 r·min-1)培养15天,得到发酵液。
2) 球毛壳ND35发酵液的过滤处理 将发酵液经微孔滤膜(0.22 μm)过滤除菌,得到无菌发酵液,即活性代谢产物。
3) 球毛壳ND35发酵液的浓缩处理 将发酵液在旋转蒸发仪上浓缩处理,即可得到浓缩10倍的处理液。
4) 球毛壳ND35发酵浓缩液的过滤处理 取步骤3)中的10倍浓缩发酵液,经微孔滤膜(0.22 μm)过滤除菌,得到无菌的10倍浓缩发酵液。
5) 球毛壳ND35发酵液的灭菌处理 将发酵液经0.1 MPa灭菌30 min,得到灭菌的发酵液。
6) 球毛壳ND35发酵液中菌体的制备 将发酵液在高速冷冻离心机上,4 ℃,12 000 r·min-1离心20 min,去除上清液,沉淀用磷酸缓冲液(pH 7.0)悬浮洗涤3次,最后悬浮在该缓冲液中,得到发酵液中菌体液。
7) 球毛壳ND35发酵液中死菌体的制备 将步骤5)处理中的菌体液经0.1 MPa灭菌30 min,得到死菌体。
8) 球毛壳ND35发酵液中菌体的超声波及无菌处理 将处于对数期的发酵液离心,将菌体用0.85% NaCl洗涤2~3次后,用其5倍体积的0.85% NaCl悬浮,然后在-20 ℃的冰箱中处理24 h,解冻后,在振荡器上振荡混合均匀,然后将盛有菌悬液的器皿放在冰水浴中,在超声波破碎仪上进行处理,然后将经超声波破碎后的处理液经0.1 MPa灭菌30 min,得到无菌的超声波处理液。
在PDA平板中央接种杨树腐烂病菌菌饼,生长14 h后在与其边缘相距1.5 cm十字交叉打直径为5 mm的4个孔,然后在每个孔内加入20 μL的处理液,以无菌水为对照。28 ℃恒温培养箱中进行培养,24 h后测定病原菌菌落面积(mm2),并计算菌落生长抑制率,试验重复3次。生长抑制率(%)=(对照菌落面积-处理菌落面积)/对照菌落面积×100。
1.5 抗生物质鉴别和测定 1.5.1 捷克八溶剂系统由于各类抗生素的酸碱性、极性及溶解度不同,它们在捷克八溶剂系统中呈现出来的Rf值所绘成的曲线图谱也有一定的特征,因此,捷克八溶剂系统能将抗生素进行初步分类。溶剂系统(V/V)包括:1)水饱和的正丁醇;2)水饱和的正丁醇,内含2 %对甲苯磺酸;3)正丁醇:乙酸:水(2:1:1);4)水饱和的正丁醇,内含2%六氢吡啶;5)以正丁醇饱和的0.5 mol·L-1、pH 7磷酸缓冲液;6)正丁醇饱和的水,内含2%对甲苯磺酸;7)苯:甲醇(4:1),本系统所用滤纸先用0.5 mol·L-1、pH 7磷酸缓冲液处理后晾干;8)甲醇:水(3:1),水内含3% NaCl。本系统所用滤纸事先用0.5% Na2SO4处理后晾干。按照捷克学者Doskochiloba等人的方法,对球毛壳ND35的萃取浓缩液进行纸层析试验,测定活性斑点的Rf值,做出纸层析色谱图(周德庆,1986)。
1.5.2 pH纸层析取16 cm×0.5 cm的新华1号层析滤纸(分别用pH 2.2,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0的缓冲溶液处理干燥),将球毛壳ND35抑菌活性物质点于距离滤纸底端0.5 cm处,点样量为5 μL,在二氯甲烷和甲醇的展层溶剂中进行上行展层。展层距离为15 cm,重复3次。室温展层结束后,取出滤纸条在无菌操作台上晾干。然后采用平板生物显影法测其抑菌活性物质的展层距离。根据抑菌圈的位置确定活性物质在不同溶剂中的展层距离,做出纸层析色谱图。
1.5.3 紫外-可见光吸收光谱球毛壳ND35抑菌活性物质用等体积乙酸乙酯抽提,所得抽提液经蒸发浓缩后,溶于甲醇中,然后置于紫外分光光度计(U2810,日本日立公司)中扫描。由于抑菌活性物质样品于400~1 100 nm之间无吸收峰,故选择190~400 nm范围内进行全波段扫描。
1.5.4 薄层层析和高效液相色谱球毛壳ND35抗生物质的薄层层析(TLC)和各组分抑菌活性检测参考万慧等(2007)的方法。将球毛壳ND35抑菌物质用少量甲醇溶解,经微孔有机滤膜(孔径0.22 μm)过滤后,用高效液相色谱仪(Agilent 1200)分析。高效液相色谱(HPLC)条件:色谱柱Zorbax eclipse XDB-C18,150 mm×4.6 mm,流动相为甲醇:水(65:35,V/V)等度洗脱,流速1 mL·min-1; 进样量20 μL; 柱温为25 ℃; 紫外检测波长为254 nm。
1.6 抗生物质液体培养的动力学分析将球毛壳ND35接种于PDB培养基内,28 ℃、160 r·min-1下振荡培养。每隔2天定时取样,以发酵液对杨树腐烂病菌菌丝生长的抑制率、pH值、菌丝的产量和吸光度作为球毛壳ND35抗生物质液体培养的主要动力学指标。
2 结果与分析 2.1 培养基组成和发酵条件的正交试验结果球毛壳ND35在不同配方培养基中培养后提取抗生物质,产量见表 2。极差比较R如下:氮源因素列极差最大,生长因子次之,pH值因素居中,矿质元素因素再次之,碳源因素最次。说明对抗生物质产量影响的顺序为氮源>生长因子>pH值>矿质元素>碳源。根据表 2,试验较优组合为第13组试验:其组合为A4B1C4D2E3。碳源应取第4水平,氮源应取第1水平,矿质元素应取第4水平,生长因子应取第2水平,pH值应取第3水平,即碳源应选葡萄糖和蔗糖的组合,氮源应选牛肉膏,矿质元素应选硫酸亚铁,生长因子应选维生素B1,pH值应选pH 7。
|
|
方差分析结果表明(表 3),由F值可知,各因子对球毛壳ND35抑菌活性物质产量影响强度为:氮源、生长因子、矿质元素对产量的影响达到极显著水平;pH值对产量的影响达到显著水平。
|
|
试验结果见表 4。球毛壳ND35浓缩10倍的发酵液抑菌活性最强,对病原菌的生长抑制率达到90.95%,其次是原发酵液,生长抑制率达到82.91%,发酵液中菌丝体对病原菌的生长抑制率为80.47%,说明发酵液中菌丝体本身具有很强的抑菌作用。这与之前报道相吻合(万慧,2007)。0.22 μm微孔滤膜处理的发酵液有较好的抑菌活性,而灭菌处理的发酵液菌体和超声波+0.22 μm微孔滤膜处理的发酵液菌体也有抑菌活性,这说明球毛壳ND35菌丝胞外和胞内都有抗菌活性物质,并具有较好的热稳定性,为将来的工业化生产提供了可能。
|
|
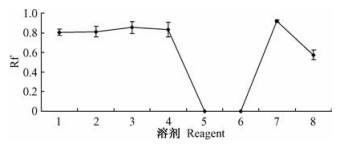
球毛壳ND35抗生物质在捷克八溶剂系统中展层的Rf值如图 1所示。活性物质在第1, 2, 3, 4, 7, 8溶剂系统中的Rf值较大,说明球毛壳ND35抗生物质是一种极性较弱的活性物质。在第5, 6种溶剂系统中的Rf约为0。成为倒船帆形。参照经典的各类抗生素纸层析图谱,这个图谱特征与第5类(非水溶性I型抗生素)抗生素的纸层析色谱图特征相近,故把该抗生物质初步归为金色抗霉素类抗生素。
|
图 1 捷克八溶剂系统纸层析 Figure 1 Jack's eight solvents system paper chromatography |
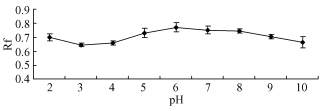
经一系列不同pH缓冲液处理的层析,球毛壳ND35抗生物质的Rf值显示一定规律性的变化(图 2),不论pH值有何变化,其Rf值始终变化不大,故与原点呈大致平行线,根据上述图形特征可把球毛壳ND35抗生物质归为中性抗生素类。但相对来看,球毛壳ND35抗生物质在pH 6.0时Rf最大,考虑pH对抗菌物质的影响,可选择pH 6.0作为萃取的最适pH。
|
图 2 pH纸层析 Figure 2 pH paper chromatography |
球毛壳ND35抗生物质具有特征吸收光谱(图 3),其最高吸收峰的位置分别为:221,279.5 nm。表明该活性物质为多组分混合物。其吸收峰在221 nm处出现,其多组分混合物中可能含有多糖类物质。全波段光谱检测有助于弄清其物质种类,同时为今后的提取纯化提供检测手段。
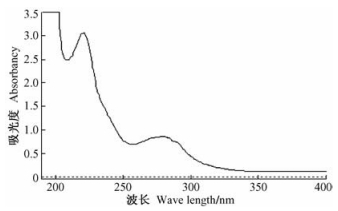
|
图 3 紫外吸收光谱 Figure 3 UV absorption spectrum |
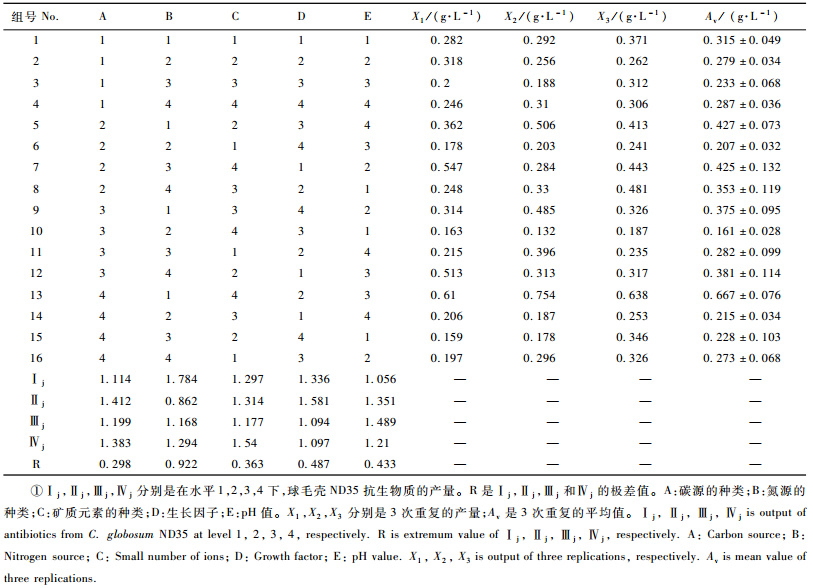
以254 nm作为检测波长,球毛壳ND35抑菌物质粗提液的高效液相色谱分析结果(图 4B)显示,分别在1.585,2.512,7.566,11.600 min处出现4个显著的吸收峰,这与TLC板分离结果(图 4A)相吻合。分别将TLC板的4个亮点取下测定其活性,结果显示4个亮点都有较强的活性。以抑菌物质对杨树腐烂病菌菌丝生长作为指示,4种组分抑制率分别是65.15%,69.67%,70.05%,68.84%(表 5),为下一步的分离提供依据。

|
图 4 球毛壳ND35抗菌物质的硅胶板薄层层析分离和高效液相色谱 Figure 4 TLC and HPLC profile of antibiotic of strain C. globosum ND35 A:TLC profile of antibiotic of C. globosum ND35; B:HPLC profile of antibiotic of C.globosum ND35. |
|
|
球毛壳ND35抗生物质液体培养的动力学如图 5A所示,从接种当天开始每隔2天取样,发酵液中抗生物质对杨树腐烂病菌丝生长的抑制率升高,在第10天和第12天之间抑制率变化最快,在第14天之后抑制率开始下降。因此,球毛壳ND35发酵液抗生物质的提取控制在14~16天之间。如图 5B所示,从接种当天开始每隔2天取样测定,发酵液中的pH值一直下降,抗生物质在pH 6.4左右开始产生,并且达到最大值,随着抗生物质的降解,pH值还将下降。因此,在培养过程中检测pH值的变化来预测发酵是否正常有很大的意义。如图 5C所示,从接种当天开始每隔2天取样测定菌丝的产量,菌丝在前8天处于急速生长阶段,菌丝大量积累,第8天之后,菌丝量开始下降,主要是发酵液中的营养成分不足,为维持细胞的生长,菌丝产生自溶现象,出现菌丝降解。如图 5D所示,从接种当天开始每隔2天取样,将发酵液稀释10倍,在221 nm下测定其吸光度来测定发酵液抗生物质的含量。从图 5D中可以看出,在第14天处吸光度最大这与图 5A相吻合,也与以前的结论相吻合(万慧,2007)。所以,在生产中可以通过在221 nm下测定发酵液的吸光度来测定球毛壳ND35抗生物质的产量。
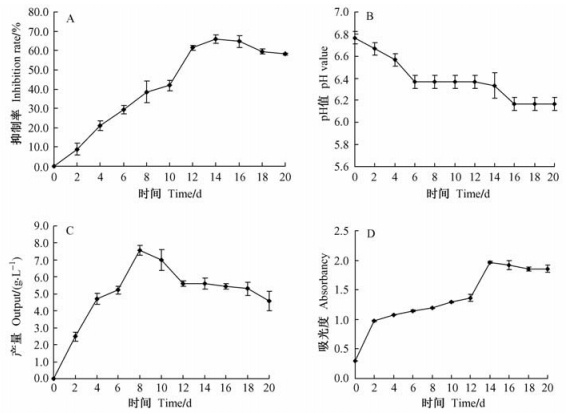
|
图 5 球毛壳ND35抗生物质液体培养的动力学分析 Figure 5 Dynamics analysis of antibiotics from C. globosum ND35 in liquid cultural medium A:ND35发酵液对杨树腐烂病菌的抑制率Inhibition rate of V. sordida by fermentation fluid from ND35;B:ND35发酵液pH值的变化Alteration of pH value of fermentation fluid from ND35;C:ND35菌丝量的变化Alteration of mycelium output from ND35;D:ND35发酵液稀释10倍后221 nm下的吸光度Absorbance of dilution 10-fold fermentation fluid from ND35 under the 221 nm. |
毛壳属真菌有些种如球毛壳菌(Chaetomium globosum)对多种土传和种传的植物病原菌,如立枯丝核菌(Rhizoctonia solani)、终极腐霉(Pythium ultimum)、大豆茎溃疡病菌(Diaporthe phaseolorum f.sp. meriolionalis)、稻瘟病菌(Pyricularia oryzae)以及苹果黑星病菌(Venturia inaequalis)等具有广谱拮抗性和较强抗逆性,显示了其生防潜能(Cullen et al., 1984;Pereira et al., 1997;Park et al., 2005)。毛壳菌产生抗生素类物质抑制病原菌的生长是其主要生防机制之一。Ding等(2006)从植物内生球毛壳菌IFB-E019分离出一种新的具细胞分裂抑制作用的生物碱类细胞毒素一球毛壳菌素[chaetoglobosin U (1)],同时分离了4种已知的毛壳菌素C (2),F (3),E (5)和penochalasin A (4),对多种病原菌具有抑制作用(Ding et al., 2006;刘志华,2006)。另外,从Chaetomium globosumF0142的发酵液分离提纯出chaetoviridins A和B,都对稻瘟病和小麦叶锈病(Puccinia recondita f.sp. tritici)显示了良好的防治效果(Park et al., 2005)。现已开发研制出一种新型广谱的生物杀菌剂Chaetomin,已有颗粒剂和粉剂问世(共包括22个菌株,C.cupreum CC01-CC10和C.globosum CG01-CG12),在泰国、菲律宾、中国、俄罗斯和越南作为一项实用的综合生物防治技术被引进,在10余种果蔬和大田作物上推广。
温室试验表明:球毛壳ND35的抗生物质粗提液稀释50倍液对玉米弯孢叶斑病的防治效果可达85.5%, 稀释250倍液防治效果达63.3%(万慧等,2007)。本研究通过薄层层析和高效液相色谱对球毛壳ND35产生的抗生物质进行分离发现4个活性组分,以抗生物质对杨树腐烂病菌菌丝生长抑制作为指示,抑制率分别是65.15%,69.67%,70.05%,68.84%。这为利用球毛壳ND35产生的抗生物质进行杨树病害田间生物防治奠定了基础。但是,这4个活性组分的结构成分还有待于深入研究。
由于该菌在PDB的培养基中产生抗生素的量较少,这对于抗生素的广泛应用有一定的限制。本研究通过正交试验设计最终优化出一种最适培养基,使抗生素的产量有原来的0.235 g·L-1增加到0.667 g·L-1。这为如何提高抗生素产量提供了参考。笔者利用捷克八溶剂系统、pH纸层析和紫外-可见光谱等方法对球毛壳ND35抗生物质的理化性质进行了初步研究,认为该抗生物质属于非水溶性I型抗生素类,pH 6.0可以作为萃取的最适pH。通过定位试验,发现在胞内和胞外都有抗生物质的产生。另外,本实验室过去的试验也显示,抗生物质粗提液的抑菌活性具热稳定性(万慧,2007)。这些理化性质都显示了球毛壳ND35菌抗生物质具有很好的开发和利用价值。但是,把这种抗菌物质开发成为理想的商品生物农药,还需要做很多的研究,下一步应对分离提纯的活性组分进行结构鉴定,确定其作用机理,为人工合成该物质以及活性物质合成相关基因的克隆奠定基础;确定把摇瓶培养扩大到大型发酵罐培养的工艺参数,为大规模的工业化生产提供理论依据。
池玉杰, 杨谦. 2002. 毛壳菌对植物病害的生物防治及存在的问题[J]. 农业系统科学与综合研究, 18(3): 215-218. |
梁建根, 吴吉安, 竺利红, 等. 2007. 生防菌BH_2发酵液中抑菌成分的定位及提取研究[J]. 中国农学通报, 23(11): 324-327. DOI:10.3969/j.issn.1000-6850.2007.11.070 |
刘晓光, 高克祥, 谷建才, 等. 1999. 毛白杨内生菌优势种毛壳ND35室内拮抗作用的研究[J]. 林业科学, 35(5): 57-61. |
刘志华. 2006. 球毛壳菌(Chaetomium globosum)功能基因克隆及表达研究. 哈尔滨工业大学理学院博士学位论文. http://d.wanfangdata.com.cn/Thesis/D250554
|
万慧, 刘晓光, 曹荣花, 等. 2007. 螺旋毛壳ND35抗生素的产生及其在病害生物防治中的作用[J]. 植物保护学报, 34(1): 51-56. |
万慧. 2007. 螺旋毛壳ND35抗生素的分离提取、部分理化特性及其生物活性测定. 山东农业大学植物保护学院硕士学位论文. http://d.wanfangdata.com.cn/Thesis/Y1094073
|
印敬明, 刘晓光, 万慧, 等. 2006. 螺旋毛壳Chaetomium spirale ND35防病促生作用初探[J]. 莱阳农学院学报:自然科学版, 23(4): 272-275. |
周德庆. 1986. 微生物实验手册[M]. 上海: 上海科技出版社: 339-345.
|
Aggarwal R, Tewari A K, Srivastava K D, et al. 2004. Role of antibiosis in the biological control of spot blotch (Cochliobolus sativus) of wheat by Chaetomium globosum[J]. Mycopathologia, 157(4): 369-377. DOI:10.1023/B:MYCO.0000030446.86370.14 |
Cullen D, Andrews J H. 1984. Evidence for the role of antibiosis in the antagonism of Chaetomium globosum to the apple scab pathogen, Venturia inaequalis[J]. Canadian Journal of Botany, 62(9): 1819-1823. DOI:10.1139/b84-246 |
Ding G, Song Y C, Chen J R, et al. 2006. Chaetoglobosin U, a cytochalasan alkaloid from endophytic Chaetomium globosum IFB-E019[J]. Journal of Natural Products, 69(2): 302-304. DOI:10.1021/np050515+ |
Park J H, Choi G J, Jang K S, et al. 2005. Antifungal activity against plant pathogenic fungi of chaetoviridins isolated from Chaetomium globosum[J]. FEMS Microbiology Letters, 252(2): 309-313. DOI:10.1016/j.femsle.2005.09.013 |
Pereira J, Dhingra O D. 1997. Suppression of Diaporthe phaseolorum f. sp. meridionalis in soybean steams by Chaetomium globosum[J]. Plant Pathology, 46(2): 216-223. |
Xiao J H, Chen D X, Xiao Y, et al. 2004. Optimization of submerged culture conditions for mycelial polysaccharide production in Cordyceps pruinosa[J]. Process Biochemistry, 39(12): 2241-2247. DOI:10.1016/j.procbio.2003.11.026 |
 2011, Vol. 47
2011, Vol. 47