文章信息
- 徐洁, 白坤栋, 万贤崇, 程国华, 张存义, 张兆欣
- Xu Jie, Bai Kundong, Wan Xianchong, Cheng Guohua, Zhang Cunyi, Zhang Zhaoxin
- 欧美杨107杨抗硫无性系的变异及其抗氧化保护系统对SO2响应
- Responses of Poplar (Populus×euramericana cv."74/76") SO2-Resistant Clone to SO2 Fumigation and the Variation in Antioxidant Systems
- 林业科学, 2011, 47(2): 66-71.
- Scientia Silvae Sinicae, 2011, 47(2): 66-71.
-
文章历史
- 收稿日期:2009-12-31
- 修回日期:2010-06-01
-
作者相关文章
2. 河南省濮阳林业科学研究所 濮阳 457000
2. Foresry Research Institute of Puyang County, Henan Province Puyang 457000
植物对大气SO2的反应取决于该污染物的浓度和植物个体的遗传性状。SO2主要通过气孔进入到植物体内,进入植物体后可导致体内产生活性氧(O2·)等自由基离子(Asada et al., 1975;Alscher, 1984; Garsed, 1984),它们在植物体内启动一系列反应,导致代谢变化。其中有些变化对植物会产生严重的危害。高浓度的SO2甚至还会导致植物出现急性的叶片坏死甚至植物死亡(Kondo,2002)。为使植物代谢保持平衡,植物体内有一套清除活性氧等自由基的保护机制,包括非酶系统和酶系统。非酶系统主要有还原型谷胱甘肽(GSH)、抗坏血酸(AsA)、半胱氨酸、类胡萝卜素等;酶系统主要有超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等,这些细胞保护酶活性的高低是衡量植物抗逆性的重要指标。SOD是植物体内氧代谢的关键酶,催化体内超氧化物的歧化反应产生氧和过氧化氢(H2O2)。而过氧化氢酶(CAT)和过氧化物酶(POD)均可清除植物体内的H2O2,从而使需氧生物体免受H2O2的毒害,它们在植物抗性中发挥重要作用(Takahama et al., 1997)。GSH的功能引起广泛的关注,它是控制植物体内氧化还原平衡的决定因素之一,它的功能包括在植物体内提供一个流动性的还原硫库;作为酶促反应的还原剂,参与抵抗或降低各种不良环境因子造成的氧化胁迫(Meyer et al., 2005; Mullineau et al., 2005)。谷胱甘肽也可以将过氧化氢还原为水。另外,抗坏血酸也对提高植物的抗性起积极作用(Conklin et al., 1996; Youssefian et al., 2001)。
为使植物代谢保持平衡,植物体内有一套清除活性氧等自由基的保护机制,包括非酶系统和酶系统。非酶系统主要有还原型谷胱甘肽(GSH)、抗坏血酸(AsA)、半胱氨酸、类胡萝卜素等;酶系统主要有超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等,这些细胞保护酶活性的高低是衡量植物抗逆性的重要指标。SOD是植物体内氧代谢的关键酶,催化体内超氧化物的歧化反应产生氧和过氧化氢(H2O2)。而过氧化氢酶(CAT)和过氧化物酶(POD)均可清除植物体内的H2O2,从而使需氧生物体免受H2O2的毒害,它们在植物抗性中发挥重要作用(Takahama et al., 1997)。GSH的功能引起广泛的关注,它是控制植物体内氧化还原平衡的决定因素之一,它的功能包括在植物体内提供一个流动性的还原硫库;作为酶促反应的还原剂,参与抵抗或降低各种不良环境因子造成的氧化胁迫(Meyer et al., 2005; Mullineau et al., 2005)。谷胱甘肽也可以将过氧化氢还原为水。另外,抗坏血酸也对提高植物的抗性起积极作用(Conklin et al., 1996; Youssefian et al., 2001)。
二氧化硫能使植物的光合作用强度减弱,导致干物质减少,产量降低。SO2是通过引起气孔关闭、减少叶面面积等途径来影响光合作用的(高吉喜等,1997)。当SO2浓度增大到一定值时会导致膜出现渗漏,细胞膜透性随SO2浓度的增加而显著增加(刘燕云等,1989)。植物对SO2的差异响应通常与植物的抗性有关,因此光合作用和细胞膜透性变化也被用作衡量植物抗性强弱的指标(卞泳梅等,1982;李世承等,1986)。
欧美杨107杨(Populus×euramericana cv. “74/76”)具有许多优良特性,在华北广为栽植(张绮纹等,2003)。笔者于2004年发现在高浓度SO2气体毒害后存活下来的1株欧美杨107杨突变株,并对植株突变株对SO2的抗性进行研究。
笔者比较了107杨抗SO2无性系和普通无性系之间对SO2抗性;同时测定它们的活性氧清除系统中的酶类和非酶类物质的活性或含量,以期检测是否是内部活性氧清除系统对抗性作主要贡献。在SO2胁迫下,测定气体交换、细胞膜透性的响应;另外还比较测定抗SO2无性系和普通无性系气孔结构,以及气孔的运动随SO2浓度的变化差别,以探索抗SO2无性系是否是通过增加对SO2拒收来提高的抵抗能力。本研究旨在为该抗性无性系的推广、利用提供理论依据,为抗性品种的选育提供理论指导,为在污染条件下提高生物存活率和生产力提供理论参考,同时也为今后基因改造奠定生理生化基础。
1 材料与方法 1.1 试验材料抗SO2无性系选自河南濮阳市南乐县古计固林场欧美杨107杨速生丰产林。母树于2003年春天用扦插苗造林,这批107杨苗木来自张绮纹研究员(中国林业科学研究院)在濮阳的科研示范基地。2004年因上风口建有几处排放高浓度二氧化硫气体的二硫化碳厂,致使出现了大面积的幼树死亡现象;而唯独其中的1株不仅没有死亡而且生长旺盛。笔者进行较为详细的试验观察,事发期间大气中SO2的浓度为10 mg·m-3左右(用Testo®350 plus烟气分析仪测定)。2006年3月笔者从母树上采条进行了1年生条硬枝扦插繁殖,扦插苗生长良好,此后每年都进行扩大繁殖,所得苗木的性状稳定,得到抗SO2无性系。该无性系的形态和普通欧美杨107杨基本相同,但叶片正面角质层比普通欧美杨107杨厚,叶子较大,芽细长。
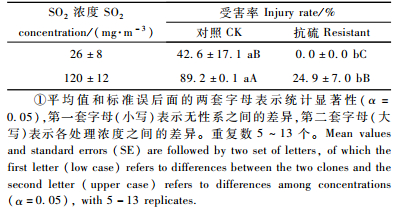
1.2 试验方法 1.2.1 抗硫无性系对二氧化硫熏气的抗性反应检测2007年7月,笔者用当年生抗SO2无性系和普通107杨的扦插苗木进行急性的毒性试验,比较它们对二氧化硫的抗性。试验在河南濮阳市华龙区孟轲乡进行。在事先竹竿搭成的架框上将聚乙烯塑料布围成4 m×宽2 m×高3 m的方型大棚,然后在边缘外围封土形成密闭的试验棚。普通和抗硫无性系随机安置在同1个塑料棚中。按照上述程序共建3个密闭大棚。于7月28日下午进行SO2熏气处理。其中1个为清洁对照棚;另外2个一次性充入高、低不同浓度的二氧化硫气体。充气后约20 min,用烟气分析仪(Testo® 350 plus,德国)测定棚内SO2浓度,分别为0.035,26,120 mg·m-3 (表 1)。2天后揭开大棚进行观察、测定、记录。被毒害的叶片变黑、坏死,症状先从叶尖和边缘开始。当叶片的一半以上出现受害状,叶片就很容易脱落。我们将受害1/2及以上的叶片定义为受害叶。
|
|
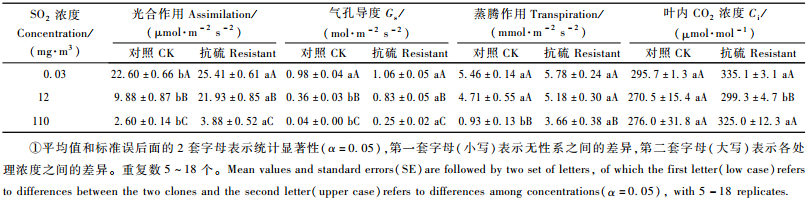
2009年5月在濮阳市华龙区孟轲乡进行SO2熏气后,抗硫和普通107杨无性系光合作用等生理反应的试验。大棚的建造,充气处理如前所述,共3个处理,对照、中浓度、高浓度,其SO2浓度分别为0.03,12,110 mg·m-3。每个处理2个重复棚。充气之后2 h揭开大棚进行光合作用等指标测定。之后,采取叶片放入低温保温箱内,带回实验室进行细胞膜透性的测定。
用便携式光合作用仪(LI-6400®,Li-Cor,美国)测定苗木的光合作用速率,气孔导度,蒸腾作用,叶内细胞间隙二氧化碳浓度。采用人工光源(1 500 μmol·m-2s-1 PPFD, photosynthetic photon flux density),利用大气CO2(380~390 μmol·mol-1),叶室温度25 ℃。每株选定完全展开的新叶测定。
相对电导率的测定,用蒸馏水将叶片洗净,用直径10 mm的打孔器取叶圆片20片放入试管中,加20 mL蒸馏水,抽真空1 h,室温下保持3~4 h,测其电导率S1,将试管封口,沸水浴10 min,冷却后平衡1 h,测其电导率S2,同时测定蒸馏水电导率S0。

|
于2009年4月,剪取抗硫无性系和普通107杨无性系枝条,扦插在1 L大小的花盆中,花盆中填有人工土,进行扦插苗繁殖,各无性系分别有100盆左右。这些苗木在中国林科院温室中培养。温室采用自然光照,昼夜温度在20~30/10~15 ℃。相对湿度在60%~70%。待其生长1个月后,取样进行下面各项测定。
1) 气孔的大小测定:印迹法。用无色透明指甲油均匀涂在叶片下表皮,待干后揭下做成气孔涂片,在显微镜下观察其气孔大小。每棵苗上取1片充分展开的新叶,每片叶上测定10个气孔,量取其长度、宽度,并测量气孔密度。
2) 可溶性蛋白含量的测定:采取新鲜叶片若干,用蒸馏水洗净,进行测定。称取叶片0.2 g,用10 mL的磷酸缓冲液(PBS,50 mmol·L-1,pH 7.0)冰浴研磨成匀浆,4 ℃下15 000 r·min-1离心15 min,上清液即为可溶性蛋白提取液。采用Bradford (1976)法,用牛血清白蛋白(BSA)作为标准样。
3) 超氧化物歧化酶(SOD)活性的测定:用磷酸缓冲液(PBS,50 mmol·L-1,pH 7.8,含0.1 mmol·L-1 EDTA),提取叶片中SOD。采用氮蓝四唑(NBT)法测定粗提取液中SOD活性。
4) 过氧化氢酶(CAT)、过氧化物酶(POD)活性的测定:用磷酸缓冲液(PBS,50 mmol·L-1,pH 7.0),提取叶片中酶粗提取液。CAT活性的测定:采用过氧化氢(H2O2)法,POD活性的测定:采用愈创木酚法。
5) 抗坏血酸(AsA)、还原型谷胱甘肽(GSH)含量的测定:用三氯乙酸(TCA, 5%)提取叶片中AsA和GSH。抗坏血酸测定:吸取标准液或提取液200 μL于对应试管中,分别往各管中加入NaH2PO4(150 mmol·L-1, pH 7.4)200 μL,H2O 200 μL,混合均匀。超过30 s后再分别往各管中加入三氯乙酸(TCA, 10%)溶液400 μL、H3PO4(44%)400 μL、2, 2-二联吡啶(4%)400 μL、FeCl3(3%)200 μL,混匀后在37 ℃水浴中保温60 min,然后测525 nm处的OD值。还原型谷胱甘肽测定:吸取标准液或提取液各0.25 mL,分别加入NaH2PO4(150 mmol·L-1, pH 7.7)2.60 mL,混合均匀后,往各管中加入0.15 mL DTNB试剂(75.3 mg DTNB溶于30 mL 100 mmol·L-1 pH 6.8 PBS中),摇匀后,30 ℃保温反应5 min,测412 nm处的OD值(以加磷酸缓冲液代替DTNB试剂作空白对照)。
1.3 数据处理及分析采用Excel进行t检验,SAS软件进行单因素方差分析,Duncan多重比较。以α=0.05为显著性鉴定标准。所有的测定都有5次以上的重复。
2 试验结果 2.1 SO2熏气处理后植物外部反应在对照棚中,抗硫和普通107杨无性系均无被毒害现象发生,未列出具体数据。然而在经SO2处理的后抗硫和作为对照的普通107杨出现明显的差异反应(表 1)。中等浓度(26±8)mg·m-3时,抗硫无性系没有出现叶片受害症状,而普通107杨受害的叶片达到42.6%。在高浓度(120±12) mg·m-3下,抗硫无性系也出现叶片受害症状,但受害率极显著地低于普通107杨。受害的植物叶片呈现出叶片焦枯、发黑、卷曲,叶柄下垂。
2.2 SO2熏气处理对杨树气体交换的影响没有人工施加SO2为对照,其浓度大约0.03 mg·m-3。无任中等浓度还是高浓度都明显地引起杨树光合作用和气孔导度的下降(表 2)。不过2种无性系受影响程度有显著的不同,抗硫无性系在中等浓度下其光合作用速率下降14%,而作为对照的普通107杨却下降56%。在高SO2浓度下,两者无性系都下降85%或以上。气孔导度的情况和光合速率类似,中等浓度下,抗硫无性系和普通107杨分别下降21%和63%。在高浓度下,抗硫无性系和普通107杨气孔导度分别下降77%和95%。虽然有显著的气孔导度反应,但蒸腾速率在中等SO2浓度下并没有发生变化。只是在高浓度下,蒸腾速率出现了急剧的下降,同样,普通107杨比抗硫无性系有更大弧度的反应,分别下降83%和37%。和前面3个指标相反,除了在中等SO2浓度时,抗硫无性系叶内细胞间隙的CO2浓度略有下降(11%),叶内细胞间隙的CO2浓度几乎没有明显的变化。而在没有外加SO2情况下,抗硫无性系比普通107杨的光合速率高,而其他3个指标没有变化。
|
|
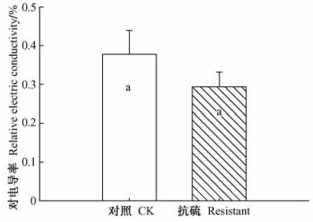
在中等SO2浓度处理下普通107杨叶片细胞膜透性略微高于抗硫无性系,但它们两者之间没有统计上的显著性(P>0.05)(图 1)。
|
图 1 叶片细胞膜的透性 Figure 1 Permeability of cell membrane in leaves |
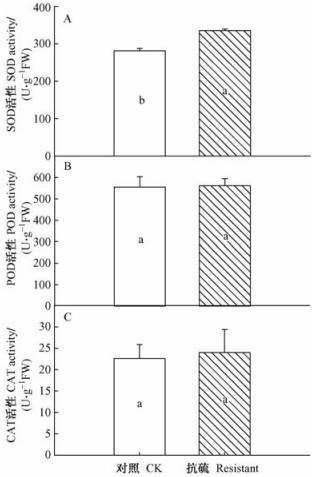
抗硫无性系叶片中SOD酶活性显著地高于普通107杨(P<0.05)(图 2)。而这2个无性系叶片中POD和CAT的活性差异不显著。
|
图 2 叶片中抗氧化酶活性 Figure 2 Activities of antioxidant enzymes in leaves |
抗硫无性系叶片中GSH含量显著地高于普通107杨(图 3)。而这2个无性系叶片中AsA含量差异不显著。

|
图 3 叶片中抗氧化剂含量 Figure 3 Antioxidant contents in leaves |
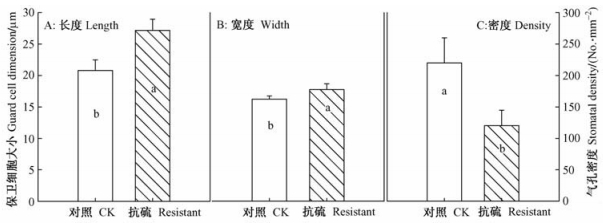
抗硫无性系叶片中气孔显著的大于普通107杨,而气孔密度显著的小于普通107杨(图 4)。
|
图 4 气孔的大小和密度 Figure 4 Dimension and density of stomata |
在中、高浓度SO2胁迫下普通107杨无性系出现严重的急性危害,呈现出大范围的叶片焦枯、脱离,而抗SO2无性系能够忍受较高的SO2浓度,在中等浓度不呈现受害症状,高浓度下受害症状也较轻微。这一结果说明该抗SO2无性系可以作为SO2渗漏的厂矿地区的绿化树种。和普通107杨无性系相比,在SO2胁迫下,抗硫无性系能够维持相当高的光合作用速率。由此可见:中等浓度的SO2不会明显地影响抗SO2无性系的光合积累和生长。另外,抗SO2无性系在无SO2处理时也具有较高的光合作用速率,植物旺盛的新陈代谢也增强植物抗逆境的能力。二氧化硫引起光合作用下降又几种途径,例如,气孔关闭(高吉喜等,1997);直接影响光合电子传递合磷酸化(Shimazaki et al., 1980)。本研究的结果显示无任是抗SO2无性系还是普通107杨无性系的叶内CO2浓度(Ci)相对稳定,不随SO2浓度而变化。Ci的相对恒定表明细胞间隙CO2浓度受到气孔开度和叶肉细胞对CO2的需求同步减少影响。当叶肉细胞对CO2的需求减少时,Ci就会升高,而气孔关闭会导致Ci降低。这一结果说明二氧化硫对气孔导度和羧化反应产生同步抑制作用。
试验的结果证明:笔者选育出来的抗SO2无性系具有很强的忍受高SO2浓度急性毒害的能力。这种毒害半个小时之内就会表现出来,所以这种抗毒害的能力必须要求植物体内预先要具有避免或抵抗SO2毒害的机制。从气孔导度的反应来看,该抗SO2无性系并没有表现出拒收二氧化硫的能力。所以抗SO2无性系必须具有更强的抵抗SO2毒害的机制。本研究的结果表明:抗SO2无性系中具有明显更高的SOD活性以及GSH含量。SO2进入植物体后可导致植物体内产生活性氧(O2- )等自由基离子(Asada et al., 1975;Garsed, 1984),这些自由基在植物体内启动一系列反应,导致代谢变化。其中有些变化对植物会产生严重的危害(Kargiolaki et al., 1991)。这些危害包括前面所述的光合作用和气孔导度的下降、可能还涉及细胞膜透性增加、以致叶片的焦枯和脱落。先前曾有报道SOD和GSH具有清除活性氧,保护植物免除SO2的危害作用(Tanaka et al., 1980),他们发现杨树的新叶中SOD活性是老叶的5倍,同时也发现新叶具有更强的抗SO2毒害的能力。近年通过基因工程进一步证明提高SOD活性和GSH含量的植物显著地表现出更强的抗SO2能力,大大地降低了SO2对转基因的烟草的急性毒害(Youssefian et al., 2001)。此外,在笔者选育的抗SO2无性系中另外2种抗氧化酶(POD和CAT)也较高活性,但差异不显著。
本研究还发现抗SO2无性系具有更大的保卫细胞和气孔,而它的气孔密度较低。虽然大的气孔以及小的气孔密度可以导致最大气孔导度的下降(Franks et al., 2009),而笔者测定的结果并没有遵循这个规律,即这2个无性系没有表现出气孔导度的差异。在SO2胁迫下,该抗硫无性系能够维持相当高的光合作用速率,同时也有较高的气孔导度。有些植物是通过敏感的气孔运动来避免吸入过多的有毒气体来避开毒气的毒害(Grulke et al., 2007)。而本研究的结果表明:该抗硫无性系没有表现出这种避毒的功能。也就是说抗SO2无性系不是通过减少经气孔吸入的二氧化硫量来体现它的抗硫性,其抗性和气孔吸入SO2量没有直接关系(Bressan et al., 1978)。田间试验是在5月下旬测定的,当时正值该地区比较干旱、炎热的时期。对照试验是在下午3点左右进行的,此时气孔可能仍处于部分关闭,即没有测到气孔导度的最大值。与气孔导度相反,叶片角质层的透性可能起到重要的作用。比较表 2中气孔导度和蒸腾速率对SO2处理的反应可以看出:在SO2中等浓度下,无任是抗硫无性系还是普通107杨气孔导度都明显下降,普通107杨气孔导度显著地低于无性系,2种无性系之间的蒸腾强度没有差别。可见普通107杨具有比抗硫无性系更大的角质层透性。很可能普通107杨在气孔关闭之后仍然可以通过角质层吸收二氧化硫。
抗SO2无性系具有很强的抗SO2的能力,在SO2熏气下,其可以维持很高的光合作用速率,叶片受害程度明显更轻。该无性系对SO2抗性主要得益于它们具有更高SOD活性和GSH含量,在正常环境条件下,生长健壮,表现在比普通107杨更高光合能力。
卞泳梅, 陈树元. 1982. 二氧化硫对植物细胞膜透性的影响[J]. 植物生理学通讯, 18(1): 41-45. |
李世承, 孙长祥, 李建利, 等. 1986. 大气污染与植物脱镁叶绿素a的关系Ⅱ[J]. So2对脱镁叶绿素a等生理生化指标影响的研究.辽宁大学学报, 13(4): 58-63. |
刘燕云, 曹洪法, 舒俭民, 等. 1989. 五种农作物对SO2的剂量反应及其急性伤害阈值[J]. 中国环境科学, 9(3): 183-190. |
高吉喜, 潘凤云, 周兴宝. 1997. 二氧化硫对植物新陈代谢的影响(Ⅱ)——对光合, 呼吸与物质代谢的影响[J]. 环境科学研究, 10(6): 5-9. |
张绮纹, 李金花. 2003. 杨树工业用材林新品种[M]. 北京: 中国林业出版社: 65.
|
Alscher R. 1984. Effects of SO2 on light-modulated enzyme reactions//Koziol M J, Whatley F R. Gaseous air pollutants and plant metabolism. London: Butterworths, 181-200.
|
Asada K, Kiso K. 1975. Initiation of aerobic oxidation of sulfite by illuminated spinach chloroplasts[J]. Eur J Biochem, 33(2): 253-257. |
Bradford M M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 72(1/2): 248-254. |
Bressan R A, Wilson L G, Filner P. 1978. Mechanisms of resistance to sulfur dioxide in the Cucurbitaceae[J]. Plant Physiol, 61(5): 761-767. DOI:10.1104/pp.61.5.761 |
Conklin B L, Williams E H, Last R L. 1996. Environmental stress sensitivity of an ascorbic acid-deficient arabidopsis mutant[J]. Plant Biol, 93(18): 9970-9974. |
Franks P J, Drake P L, Beerling D J. 2009. Plasticity in maximum stomatal conductance constrained by negative correlation between stomatal size and density: an analysis using Eucalyptus globulus[J]. Plant Cell Environ, 32(12): 1737-1748. DOI:10.1111/pce.2009.32.issue-12 |
Garsed S G. 1984. Uptake and distribution of pollutants in the plant and residence time of active species//Koziol M J, Whatley F R. Gaseous air pollutants and plant metabolism. London: Butterworths, 83-103.
|
Grulke N E, Neufeld H S, Davison A W, et al. 2007. Stomatal behavior of ozone-sensitive and-insensitive coneflowers (Rudbeckia laciniata var. digitata) in Great Smoky Mountains National Park[J]. New Phytol, 173(1): 100-109. |
Kargiolaki H, Osborne D J, Thompson F B. 1991. Leaf abscission and stem lesions (Intumescences)on poplar clones after SO2 and O3 fumigation:a link with ethylene release?[J]. J Exp Bot, 42(9): 1189-1198. DOI:10.1093/jxb/42.9.1189 |
Kondo N. 2002. Uptake, metabolism and detoxification of sulfur dioxide// Omasa K, Saji H, Youssefian S, et al. Air pollution and plant biotechnology-prospects for phytomonitoring and phytoremediation. Tokyo: Springer, 179-199.
|
Meyer A J, Hell R. 2005. Glutathione homeostasis and redox-regulation by sulfhydryl groups[J]. Photosynth Res, 86(3): 435-457. DOI:10.1007/s11120-005-8425-1 |
Mullineaux P M, Rausch T. 2005. Glutathione, photosynthesis and the redox regulation of stress-responsive gene expression[J]. Photosynth Res, 86(3): 459-474. DOI:10.1007/s11120-005-8811-8 |
Takahama U, Oniki T. 1997. A peroxidase, phenolics, ascorbate system can scavenge hydrogen peroxide in plant cells[J]. Physiologia Plantarum, 101(4): 845-852. DOI:10.1111/ppl.1997.101.issue-4 |
Shimazaki K, Sugahara K. 1980. Inhibition site of the electron transport system in lettuce chloroplasts by fumigation of leaves with SO2[J]. Plant Cell Physiol, 21(1): 125-135. |
Tanaka K, Sugahara K. 1980. Role of superoxide disxnutase in defense against SO2 toxicity and an increase in superoxide dismutase activity with SO2 fumigation[J]. Plant Cell Physiol, 21(4): 601-611. DOI:10.1093/oxfordjournals.pcp.a076035 |
Youssefian S, Nakamura M, Orudgev E, et al. 2001. Increased cysteine biosynthesis capacity of transgenic tobacco overexpressing an O-acetylserine(thiol) lyase modifies plant responses to oxidative stress[J]. Plant Physiol, 126(3): 1001-1011. DOI:10.1104/pp.126.3.1001 |
 2011, Vol. 47
2011, Vol. 47