文章信息
- 鲍绍文, 陶万强, 田呈明
- Bao Shaowen, Tao Wanqiang, Tian Chengming
- 黄栌与大丽轮枝菌互作的组织病理学变化
- Histopathological Response in the Interaction between Cotinus coggygria and Verticillium dahliae
- 林业科学, 2011, 47(2): 58-65.
- Scientia Silvae Sinicae, 2011, 47(2): 58-65.
-
文章历史
- 收稿日期:2009-12-18
- 修回日期:2010-06-30
-
作者相关文章
2. 北京市林业保护站 北京 100029
2. Beijing Forestry Protection Station Beijing 100029
黄栌(Cotinus coggyria)为漆树科(Anacardiaceae)黄栌属(Cotinus)落叶灌木,叶色秋季艳红,其提取物具有抗凝血、溶栓、降压等作用,具有较高的观赏及药用价值。但自20世纪80年代初,黄栌枯萎病发现于北京的香山(雷增普,1993),近年来在香山、西山林场以及北部山区严重发生,发病率达到7.5%~58.3%(葛瑾等,2007;韩婧,2009)。该病的发生,不仅破坏了香山的红叶景观,而且造成风景区黄栌的大量死亡,已成为严重影响北京市景观建设和生态安全的重大生物灾害。
大丽轮枝菌(Verticillim dahliae)具有寄主多、分布广的特点(雷增普,1993;Pegg et al., 2001;王建美,2008)。目前已知寄主达到660多种,引起许多重要经济作物发病,严重影响其产量与品质,并造成巨大的经济损失(殷锡圣等,1996;刘学堂等,1998)。尽管国内外许多学者以控制技术为核心开展大量的工作,但仍未能取得突破性进展。许多学者也试图通过对大丽轮枝菌与不同寄主互作的组织病理学研究来揭示其致病机制(Garber et al., 1966;Bowers et al., 1996;Perry et al.,1983a; 1983b;Isaac,1946;Gerik et al., 1988;Daayf et al., 1995;Heinza et al., 1998;马艳玲等,2008;王建美,2008;姚技强,1996;马远莉等,1990;Mace et al., 1978;Garber,1973;Gold et al., 1995;Robb et al., 1987;Storey et al., 1987;徐建华等,1997;陈珉等,2003;苗琛等,2004),但对病原菌致病过程的阐述仍不明确,而且大丽轮枝菌在不同寄主上的入侵部位、扩展过程及寄主的抗病机制等方面都有一定差异。本试验通过对黄栌枯萎病的组织病理学进行系统性的研究,旨在揭示枯萎病的致病机制和植物的抗病机制,并为枯萎病的综合管理及防治措施提供基础的理论依据。
1 材料与方法 1.1 试验材料2年生黄栌幼苗购于河北省定州市绿路园林苗圃场。栽植苗木的土壤为草炭土、黏土、沙土,按3:3:1的比例混合。土壤消毒用0.1%福尔马林液按500 mL·m-3拌入土壤中,混匀后用塑料膜捂盖7~8天。打开塑料膜,待福尔马林完全挥发后,将黄栌根部用自来水冲洗干净,种植在上述灭菌土壤中,在培育2~3个月以后对镜检和组织分离法确定的健康苗木进行接种(王建美,2008)。
大丽轮枝菌采自北京香山公园的发病黄栌,按常规组织分离法分离,取其野生型菌落的单孢后代作为接种菌株,保存于4 ℃的冰箱中备用。每个菌株经过连续2~3次以上的单孢分离,确保试验中每个菌株内的分生孢子具有相似或一致的遗传特性。
1.2 试验方法孢子悬浮液的制备:将供试菌株转入PDA试管中,置25 ℃下培养4~5天后,加无菌水10~15 mL于试管中,充分振荡制备分生孢子悬浮液。用灭菌吸管取1 mL菌液于PDA平板上均匀展布,置25 ℃下培养5~7天。待培养基上长满菌丝时,每皿加无菌水20 mL浸泡10 min,然后用移菌环在培养基表面轻轻推动,使分生孢子脱落,经4层纱布过滤于三角瓶中,用无菌水将孢子悬浮液浓度调节为1.8×106 cfu·mL-1。
接种采用创伤蘸根接种法(王建美,2008)。将植株连同土块从花盆中取出,用自来水将泥土冲去,再用无菌水冲洗,剪去植株根尖1~2 cm后,浸入分生孢子悬浮液中10 min,然后将接种植株定殖到花盆中,以无菌水浸根做对照,并置于25 ℃下培育。
1.3 采样及观察自接种之日起,每隔1天采样1次,共采集15次。每次采集4棵接种苗及1棵对照。采样时将黄栌根部在流水下冲洗干净,自根尖起每隔3~4 cm取样,直至植株顶端,取样长度约5~10 mm。
将采集的组织材料置于FAA固定液中,1周后用石蜡切片法制成永久切片,切片厚度为8~9 μm。切片在光学显微镜下观察显微结构,并拍照。同时,调查不同采样时间病原菌的存在状态、分布情况,统计寄主不同部位的导管总数、染病导管总数,并分别记录内部存在菌丝、侵填体和胶状物的导管数量,若导管内含有多种内含物则分开计数,最终以算术平均值计算各部分所占导管总数的比例。
2 结果与分析 2.1 病菌存在状态及动态分布通过对黄栌组织横断面的切片观察发现,大丽轮枝菌主要以菌丝的形态存在于木质部的导管中(图版Ⅰ-1),根尖附近的皮层细胞间隙也有少量菌丝存在(图版Ⅰ-4),而芽等顶端分生组织部位未发现病原菌存在(图版Ⅰ-5)。在被侵染的导管中,新生的菌丝多靠近导管壁(图版Ⅰ-2),成熟的菌丝则在导管内散乱分布(图版Ⅰ-3)。此外,菌丝仅在黄栌组织横断面的部分导管内出现,而相邻横断面上发病导管出现的部位及数量均有所差异,即菌丝在导管内的纵向延伸是非连续的。
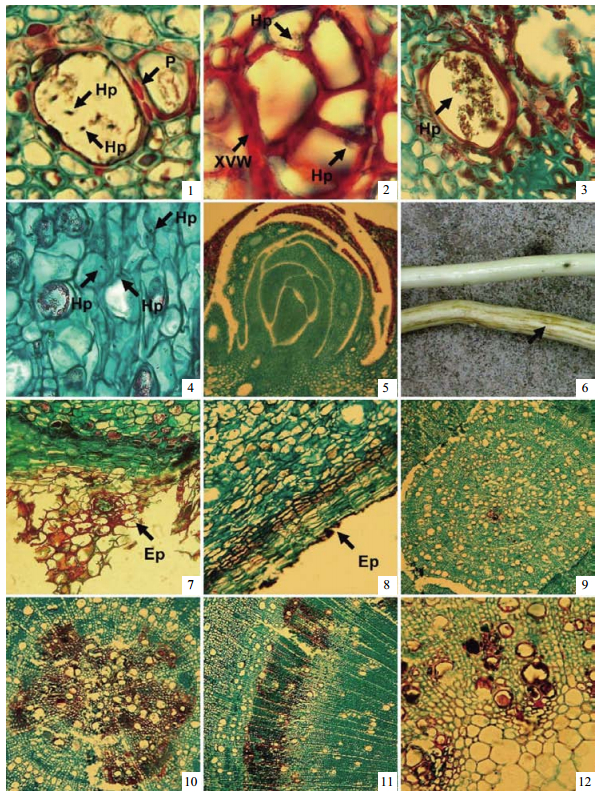
|
图版Ⅰ Plate Ⅰ 1.导管内出现的菌丝(Hyphae, HP)与纹孔(Pit, P)的病变;2.导管内新生的菌丝多集中在导管壁的夹角或边缘,导管因病菌入侵而变形,导管壁(Xylem Vessel Wall, XVW)增厚;3.成熟的菌丝(HP)在导管内散乱分布;4.皮层薄壁细胞的间隙中出现的菌丝(HP);5.芽未发现被侵染;6.上为健康的枝条,下为病害的枝条,箭头所指为棕色的病线;7.受害而脱落的外皮层(Epidermis, Ep);8.健康的外皮层(Ep);9.病害初期根部受害状;10.病害后期根部受害状;11.茎部受害的导管,主要集中在次生木质部;12.枝条上初生木质部受害的导管。 1.Hyphae appears in the vessel, and cause the pathological changes of pit; 2. Newborn hyphae Concentrated in the corner or the edge of the vessel, infection cause the deformation of vessel and vessel wall has thickened; 3. Mature hyphae scattered distribute in the vessel; 4. Hyphae appears in the cortex parenchyma cell; 5. No pathogen in the bud; 6. Healthy branch is the upper one, infected branch is the lower one, arrow shows the brown line; 7. Shedding epidermis because of infected; 8. Healthy epidermis; 9. Symptom of root in the initial stage of disease; 10. Symptom of root in the later stage of disease; 11.Infected vessels in stem mainly concentrated in secondary xylem; 12. Infected vessels in branch mainly concentrated in primary xylem. |
接种后至第8天,病菌主要集中在根部。接种48 h后,黄栌根部自根尖1~3 cm处即可见到病变出现(图版Ⅰ-9)。该部位的表皮及皮层组织出现破碎或瓦解现象(图版Ⅰ-7,8)。根部的5~10 cm附近的初生木质部导管发病严重(图版Ⅰ-10),横向发病面积逐渐扩大,病菌在此部位大量增殖,向上扩展的速率较慢(图 1)。接种8~10天,病菌到达茎部开始定殖,并通过导管继续向上部扩展。受侵染导管集中的部位由初生木质部转向次生木质部(图版Ⅰ-11)。接种14~16天,病原菌出现在枝干基部的一些枝条上,随后向末端及其他枝条蔓延。病菌到达枝条后,受侵染导管的主要位置由次生木质部转向初生木质部(图版Ⅰ-12)。接种20~22天,病原菌由枝条通过叶柄到达叶片导管内(图版Ⅱ-1,2)。随后叶部由边缘开始逐渐退绿,随时间延长症状逐渐加重。
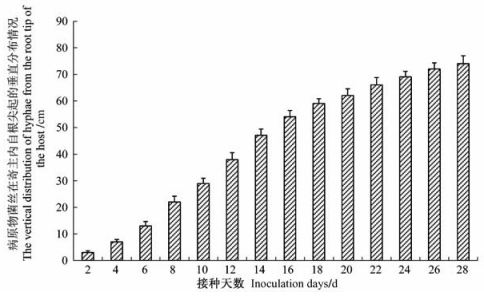
|
图 1 病原物菌丝随时间变化在寄主内的垂直分布情况 Figure 1 The vertical distribution of hyphae in the host with time variation |

|
图版Ⅱ Plate Ⅱ 1.叶部受害的导管被菌丝(HP)完全阻塞;2.箭头所示,叶部健康的导管;3.导管内刚出现的侵填体(Tylosis, T)及胶状物(Jelly, Je);4.导管内成熟的侵填体(T);5.箭头所指,健康的导管(V)和薄壁细胞(PC);6.胶状物(Je)将导管的内壁几乎完全包裹住;7.红色的胶状物(Je)将导管完全堵塞;8.充满胶状物(Je)的导管,下部箭头所示为导管狭小的末端;9.管壁增(XVW)厚的导管内,具有颗粒状的胶状物(Je);10.受菌丝(Hp)侵害的导管纹孔(P),导管壁(XVW)增厚;11.薄壁细胞(Parenchyma Cells, PC)尧木射线(Wood Ray, WR)内的胶状物,增厚的薄壁细胞的细胞壁;12.排列紊乱的薄壁细胞(PC)及附近的木射线(WR)出现红色的胶状物。 1.Infected vessels in the leaves were blocked by hyphae; 2. Arrow shows healthy vessels in leaves; 3. The newly emerging tylosis and jelly in vessels; 4. Mature tylosis in vessels; 5. Arrow shows healthy vessels and parenchyma cells; 6. Jelly fully surround the vessel; 7.Vessel were blocked by jelly; 8. Vessels were full of jelly, lower arrow shows the end of vessel; 9. Granulated jelly in the vessel, and the thickened vessel wall; 10. Pits were infected by hyphae; 11. Jelly in the parenchyma cells and wood rays, and the thickened wall of parenchyma cells; 12. Jelly in parenchyma cells and wood rays, irregular arrangement of parenchyma cells. |
导管内含物主要包括:菌丝、侵填体及胶状物3类。除菌丝外,侵填体与胶状物均为黄栌自身所产生的。侵填体是由邻近导管的薄壁细胞胀大,通过导管壁上未增厚的部分或纹孔进入导管腔内,形成大小不一的囊泡状突出物(图版Ⅱ-3,4)。胶状物是由病菌入侵导管后刺激临近薄壁细胞所产生(图版Ⅱ-6,7,9)。
黄栌不同部位的导管内含物,都会随接种时间的延长而增加,但增长的速度和数量各有不同(图 2~5)。各部位菌丝侵染速度按照根部→茎部→枝条→叶部的顺序逐渐加快。侵染后期叶部内含菌丝的导管比例最高(16.23%),根部(10.28%)与茎部(10.62%)含量相近,枝条最低(4.60%)。胶状物与菌丝呈现出一定的相关性,但随病情发展,差距逐渐明显。根部(3.84%)与茎部(4.72%)的胶状物含量较多,枝条(2.00%)及叶部(1.95%)的含量较少。不同部位导管中的侵填体的数量通常较少,且不规律。
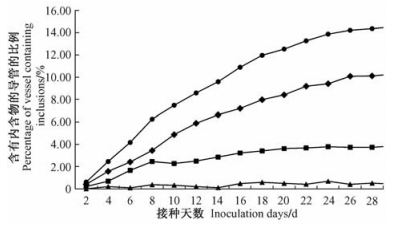
|
图 2 随时间变化根部含有不同内含物的导管所占比例 Figure 2 The percentage of vessel containing different inclusions in root with time variation |
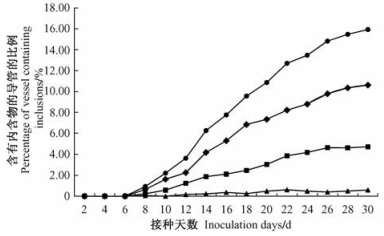
|
图 3 随时间变化茎部含有不同内含物的导管所占比例 Figure 3 The percentage of vessel containing different inclusions in stem with time variation |

|
图 4 随时间变化枝部含有不同内含物的导管所占比例 Figure 4 The percentage of vessel containing different inclusions in branch with time variation |
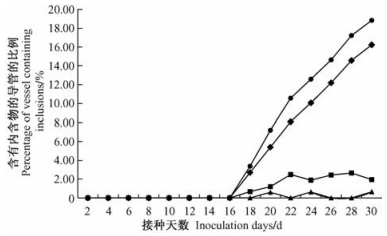
|
图 5 随时间变化叶部含有不同内含物的导管所占比例 Figure 5 The percentage of vessel containing different inclusions in leaf with time variation |
健康的导管壁染色后为淡红色,管壁较薄,形状多为近圆形或卵圆形(图版Ⅱ-5)。受侵染导管的管壁,染色后颜色与健康导管相比略深,管壁有增厚或木质化的现象,少数导管形状不规则(图版Ⅱ-9)。受菌丝侵染严重的导管与其他导管及薄壁细胞相接的纹孔,染色后会颜色较周围的部分深(图版Ⅱ-10)。
2.4 薄壁细胞健康的黄栌组织中,导管附近的薄壁细胞染色后细胞壁呈淡绿色,内部透明,排列有序,细胞形状较规则(图版Ⅱ-5)。而受侵染导管附近的薄壁细胞,细胞壁增厚,染色后为红色,内有大量红色的胶状物出现,排列紊乱,细胞形状也变得不规则(图版Ⅱ-11,12)。侵染后期或受侵严重的部位,在截面上发生病变的薄壁细胞围绕导管,呈现扇形或环形(图版Ⅲ-1,2)。

|
图版Ⅲ Plate Ⅲ 1.受害的导管及薄壁细胞形成环形;2.受害的导管及薄壁细胞形成扇形;3.木射线(WR)尧薄壁细胞(PC)及导管(Vessel, V)内都含有大量的红色胶状物;4.受害的木射线(WR)及薄壁细胞(PC)的纵切面;5.木射线(WR)内的颗粒状胶状物;6.健康的木射线(WR);7.木射线(WR)相连的导管(V)通常会出现病变;8.箭头所示,皮层薄壁细胞的增厚及变形;9.树脂道(Resin Canal, RC)内出现红色的物质,附近分泌细胞(Secretory Cell, SC)内含物增加;10.健康的树脂道及其附近的分泌细胞;11.髓部的薄壁细胞(Pith Parenchyma Cell, PiPC)内含物增加;12.健康的髓部的薄壁细胞。 1.Infected vessels and parenchyma cells forming circular; 2. Infected vessels and parenchyma cells forming fan-shaped; 3. Large amounts of jelly in Wood rays, parenchyma cells and vessels; 4. Longitudinal section of infected wood rays and parenchyma cells; 5. Granulated jelly in the wood rays; 6. Healthy wood rays; 7.Infected vessels always connect with infected wood ray; 8. Arrow shows thickening and transformation of parenchyma cells; 9. Red material appears in the resin canals, inclusion of secretory cells have increased; 10. Healthy resin canals and secretory cells; 11. Inclusion of parenchyma cells in pith have increased; 12. Healthy parenchyma cells in pith. |
健康植株的木射线无内含物(图版Ⅲ-6)。相反,发病植株导管附近的木射线内部,通常含有红色的胶状物(图版Ⅲ-3,4),同时与这些木射线相连的导管同样会受到侵染(图版Ⅲ-7)。胶状物的出现过程与导管中内含物相类似(图版Ⅲ-5),可能是由附近的薄壁细胞或导管进入到其中的。
2.6 髓和皮层健康植株的贮藏细胞内含物一般较少,染色后的颜色也较浅(图版Ⅲ-10,12)。而受侵染黄栌的髓部薄壁组织中的贮藏细胞,皮层中的树脂道及其附近的分泌细胞,在发病过程中其内部会不断积累一些物质,细胞在染色后的颜色逐渐加深(图版Ⅲ-9,11)。此外,皮层的薄壁细胞也有增厚和变形现象出现(图版Ⅲ-8)。
3 结论与讨论 3.1 入侵过程对于大丽轮枝菌所致枯萎病,许多学者认为是起始于分散在土壤或病残体中的微菌核(Ashworth et al., 1974;DeVay et al., 1974;Krikun et al., 1990),即使在无寄主的情况下仍可存活14年(Wilhelm,1955)。寄主根际当中的微菌核萌发后,可扩展到寄主的根部表面(Schreiber et al., 1963;Lacy et al., 1966;Evans et al., 1973;Fitzell et al., 1980;Nagtzaam et al., 1997)。本研究使用创伤蘸根接种发现大丽轮枝菌的孢子悬浮液可成功侵染黄栌。因而自然条件下,黄栌病株所产生的病菌孢子也可以通过类似的方式,再次对寄主进行重复侵染或者借助外力的作用(风、雨等)侵染附近的黄栌。
孢子萌发后产生的菌丝,通常附着在根尖或通过根尖延伸到主、侧根表面,菌丝会在表皮细胞间隙生长(Garber et al., 1966;Fitzell et al., 1980;Zhou et al., 2006;Eynck et al., 2007;Vallad et al., 2008)。通常情况下,大丽轮枝菌入侵的部位主要在根部,但在不同植物上入侵位置不同。如:棉花(Gossypium herbaceum)(Garber et al., 1966)、茄子(Solanum melongena)(Bowers et al., 1996;Perry et al., 1983b)、红豆草(Onobrychis viciaefolia)(Isaac,1946)的入侵部位主要位于根冠及伸长区以内,而位于马铃薯(Solanum tuberosum)(根冠及伸长区部分的病菌却并不能进行成功侵染(Perry,1983b;Bowers et al.,1996)。但Gerik等(1988)研究发现:病菌在棉花上的入侵部位是在距根尖1 mm以上的位置。在根部表面的菌丝,首先会使表皮和皮层组织瓦解,有利于病菌侵入导管(Klosterman et al.,2009)。大丽轮枝菌首先出现的位置在黄栌根尖的1~3 cm处,同时该区域的表皮有瓦解的现象(图版Ⅰ-7,8),表皮细胞的间隙同样有菌丝存在(图版Ⅰ-4)。因此,大丽轮枝菌很可能是由黄栌根部的伸长区及成熟区内进行侵入。
3.2 病菌存在状态及扩展过程对于大丽轮枝菌的存在状态,存在不同的看法。在棉花上,病原菌的整个侵染过程是通过根部、茎部向上扩展最后到达叶脉,而不停留在茎部,只有在叶脉中才有大量孢子聚集(姚技强,1996)。而马远莉等(1990)发现不同组织的导管内均有菌丝存在,个别导管中也有分生孢子。但董国菊(2002)在茄子的病株体内并未观察到孢子,并认为病原菌扩展是由菌丝体本身不断生长发育来完成的。本研究发现大丽轮枝菌在导管内主要以菌丝形态存在,并未发现病原菌的孢子形态。
受病原菌侵害的黄栌导管,从横向分布上来看,最初病原菌集中在根尖的初生木质部,而茎部则逐渐转为次生木质部,到达枝条后又转向初生木质部。而徐建华等(1997)的研究结果显示:在黄瓜(Sativus)的根部病菌主要集中在次生木质部,初生木质部受害较轻,这可能与寄主的不同有关。
大丽轮枝菌的孢子常陷入导管中的纹孔缘,同时在这里萌发并穿过导管壁上的纹孔膜侵染邻近的导管,而后形成菌丝体并产生更多的孢子重复侵染(Garber et al.,1966;Schnathorst,1981;Perry et al., 1983a;姚技强等,1996)。本试验发现:导管上的纹孔会因病害影响而产生变化,很可能是寄主防止病菌通过纹孔进行侧向侵染,而产生的防卫反应(图版Ⅱ-10)。此外,发病的导管很少单独存在,其附近的导管也会受到侵害,横截面上呈现明显的区域性(图版Ⅰ-10,11,12),而新生的菌丝又往往贴近导管壁(图版Ⅰ-2)。因此,病原菌在黄栌内的横向扩展,可能是利用孢子穿过纹孔,孢子在导管的边缘萌发产生新的菌丝,而后菌丝成熟后产生孢子,继续向附近的导管进行循环侵染。
病原菌在黄栌上的纵向扩展过程中,导管内的胶状物及侵填体对于菌丝扩展可能起到阻碍的作用,导致菌丝及受侵染导管在垂直方向上是不连续的。同时,黄栌的导管末端处(图版Ⅱ-8),菌丝很难由此通过。尽管如此,病原菌却依然可以向上传播,最终出现在叶片的导管内。这说明大丽轮枝菌在黄栌导管中的扩展过程很可能不单依靠菌丝,而是以孢子和菌丝2种形态的交替,向周围及上部的导管进行侵染。
从黄栌上病原菌的扩展速度来看,大丽轮枝菌的扩展速度要大于2~3天推进一个导管层次。这可能与寄主本身的组织构造、防卫机制及病菌的致病力等方面有关(Daayf et al., 1995;Heinza et al., 1998)。
3.3 黄栌导管内含物及组织病变与病害发生的关系对于枯萎病,不同寄主的抗病机制不尽相同,如棉花对侵染的反应是木质部导管很快形成侵填体并迅速合成植保素(Mace,1978),导管内出现胶状物(Garber,1973)。在染病的棉花根部导管中会出现乳状的凸起(沈其益,1992;顾本康等,1996);番茄(Lycopersicon esculentum)表现为导管在垂直方向上形成侵填体和凝胶,在水平方向上产生胼胝质(Robb et al., 1987)和外膜反应(coating response)(Gold et al., 1995)防止病原菌的侧向侵染;马铃薯中则出现木质化的细胞壁,导管内产生栓状赘生物,防止病菌的横向侵染(Storey et al., 1987;Perry et al., 1983a; 1983b);黄瓜木质部导管中出现胼胝体(马艳玲,2008)、侵填体、壁的覆盖物、褐色物质,皮层薄壁细胞木栓化(徐建华等,1997;陈珉等,2003);西瓜(Citrullus lanatus)的薄壁组织多坏死,木质部导管中相继出现侵填体及些灰褐色物质,并发生管壁加厚现象,在筛管中筛板加厚形成胼胝体(苗琛等,2004)。黄栌在受侵染之后皮层薄壁细胞的增厚(图版Ⅲ-8),可能与抵御病原菌由外部侵入有关,而细胞壁增厚的程度则可能与黄栌的抗病性强弱有关。通常在发病导管及其附近的导管中会产生胶状物、侵填体与导管壁的增厚的现象。胶状物在导管内可以围住导管壁(图版Ⅱ-6),结合导管壁的增厚,可以防止病原菌通过导管壁进行侧向侵染。同时,胶状物及侵填体的出现,还能够以阻塞导管的方式来防止病菌的纵向的扩展,但通常情况下阻塞并非是完全的,还存在有少量的缝隙。这与棉花、番茄、黄瓜等寄主上得到的结果相一致。不同的是黄栌在防御过程中胶状物起主要作用,而侵填体的防卫作用并不明显。在受侵染的根部、茎部及枝条靠近茎部的区域,剥开表皮后会分布凌乱的褐色病线(图版Ⅰ-6),这些褐色的病线可能与导管内的胶状物有一定的联系(图版Ⅱ-8)。
导管中的胶状物是由病菌的入侵刺激附近的薄壁细胞所产生的,因此附近的薄壁细胞中也会存在有胶状物。而细胞的形态及相互间结构变化,可能是由于病菌的侵入而导致的损伤。这种情况在其他植物的枯萎病病害(苗琛等,2004;陈珉等,2003;马艳玲等,2008)或是其他病害中也有发生(赵仕光等,1999)。
髓部组织中常含有淀粉粒,有时也有含晶体和单宁的异细胞。在植物受到病、虫的侵害过程中,髓部组织中的酶类、木质素、蔗糖等物质含量的变化与抗病性有一定的关系(刘晓燕等,2007;Long et al., 2003)。髓部组织细胞中内含物的变化,笔者认为这可能与黄栌的抗病性有一定的联系。
黄栌树脂道及附近的分泌细胞中的内含物随病害发展而增加,但其是否有助于提高黄栌的抗病性,尚不清楚。在一些病害的发生会导致树脂道及其周围的泌脂细胞会发生病变,且内含物会因病菌的入侵而减少,寄主的木射线同样也会因受到损害,而出现空洞(Mamiya,1983;1985;Kusunoki,1987;Sugawa,1982;李良,2006;Nobuchi et al., 1984)。与上述研究的结果不同的是,大丽轮枝菌所致的黄栌枯萎病,除木射线中会出现胶状物外,并无受到其他可见的侵害。同时发生病变的木射线常与受侵染导管之间相连接,又因其在植物的生理活动过程中起到横向存储及运输的功能,在它内部出现的胶状物是否会被暂时存储或是输送到其他导管内;尽管研究过程中并未在木射线内发现菌丝或是孢子,但病原菌的孢子是否也可以像胶状物一样被运输到其他导管中,以及木射线在病害发生的过程中的真正发挥的作用,这一系列问题还有待进一步的研究。
黄栌导管、薄壁细胞及木射线等部分增加的各种物质,应属于植物因大丽轮枝菌侵入而产生正常的生理反应。其产生速度和强弱与被害程度及植物种类的抗病性等有一定的联系(Beckman et al., 1982;姚技强,1996)。
3.4 枯萎病致病机制讨论自从Bewley(1922)最先表述黄萎病原菌的培养滤液中存在外源致萎物质的概念后,对大丽轮枝菌毒素的研究随之不断深入。大丽轮枝菌在代谢过程中产生的糖蛋白毒素(Green,1954;Stroddart et al., 1966;仇元等,1978;Nachimas,1985;章元寿等,1989;甘莉等,1991),对植物具有强烈的致萎力(Pegg,1965;甘莉等,1991;Meyer et al., 1994;Chu et al., 1999;刘正坪等,2001),并显示与病原菌侵染同样的特征性症状,同时能够诱导植物体内各种酶类的活性改变及病程相关的物质含量的变化(Bruce,1993;Polle et al., 1994;Smit et al., 1997;Hiraga et al., 2001,刘正坪等,2003;贾芝琪等,2007),最终导致植物凋萎,以及叶片失绿、坏死、干枯。
轮枝菌的整个侵染过程是通过黄栌根部、茎部及枝条的导管向上扩展最终到达叶部,进一步证实黄栌枯萎病是一种维管束类型的系统性病害。病原菌的分布与侵染程度有关,在完全侵染(根、茎、枝、叶)的黄栌上,受侵染导管所占比例由高到低依次为:叶、茎、根、枝条,这与马远莉等(1990)、姚技强等(1996)的研究结果一致。黄栌的导管堵塞率最高为18.83%,由此看来大部分导管都能够进行正常的水分运输,导管阻塞并非引起黄栌枯萎的主要原因,其致萎作用可能远不如毒素的影响大。因此,要揭示黄栌枯萎病的致病机制,还需要从毒素方向进行深入研究。
陈珉, 汪国平, 吴定华, 等. 2003. 黄瓜枯萎病抗、感品种在病菌入侵后的病理组织学差异研究[J]. 华南农业大学学报, 24(4): 110-112. DOI:10.7671/j.issn.1001-411X.2003.04.030 |
董国菊. 2002. 茄子黄萎病菌生物学特性及在病株体内存在状态的研究. 山西农业大学学位论文. http://d.wanfangdata.com.cn/Thesis/Y455240
|
甘莉, 吕金殿. 1991. 棉花黄萎病菌毒紊的分离提纯及致萎活性测[J]. 西北农业大学学报, (3): 49-53. |
葛瑾, 颜蓉, 宋立洲, 等. 2007. 黄栌枯萎病的综合防治策略[J]. 中国城市林业, 5(3): 43-44. |
顾本康, 马存. 1996. 中国棉花抗病育种[M]. 南京: 江苏科学技术出版社.
|
韩婧. 2009, 香山黄栌枯萎病防治初步研究. 北京林业大学博士学位论文. 香山黄栌枯萎病防治初步研
|
贾芝琪, 袁海永, 李颖章. 2007. 大丽轮枝菌毒素对棉花悬浮细胞NO和H2O2的产生和GST基因表达的影响[J]. 科学通报, 52(8): 911-917. |
雷增普. 1993. 北京地区黄栌黄萎病病原菌的研究[J]. 北京林业大学学报, 15(3): 88-93. |
李良. 2006. 致病细菌毒素导致松萎蔫的病状和组织病理学变化. 南京农业大学博士学位论文. http://d.wanfangdata.com.cn/Thesis/Y906254
|
刘晓燕, 金继运, 何萍, 等. 2007. 氯化钾对玉米木质素代谢的影响及其与茎腐病抗性的关系[J]. 中国农业科学, 40(12): 2780-2787. DOI:10.3321/j.issn:0578-1752.2007.12.017 |
刘学堂, 宋晓轩. 1998. 棉花黄萎病菌的研究及最新进展[J]. 棉花学报, 10(3): 6-13. |
刘正坪, 王若菁, 张富荣, 等. 2001. 茄子黄萎病菌毒素液对茄种子发芽及幼苗生长的毒害作用[J]. 华北农学报, 16(1): 63-66. |
刘正坪, 赵明敏, 周洪友. 2003. 茄子黄萎病菌毒素对茄子愈伤组织几种酶活性的影响[J]. 植物病理学报, 33(4): 381-382. |
马艳玲, 吴凤芝, 刘守伟. 2008. 抗感枯萎病黄瓜品种的病理组织结构学研究[J]. 植物保护, 34(1): 81-84. |
马远莉, 甘莉. 1990. 棉花各部位黄萎病菌在导管中的分布[J]. 山西农业科学, (5): 1-2. |
苗琛, 尚富德, 江静, 等. 2004. 西瓜枯萎病抗性的细胞学研究[J]. 四川大学学报, 41(4): 877-880. |
仇元, 吕金殿. 1978. 棉花黄萎病菌培养滤液及其应用的初步研究[J]. 西北农学院学报, (1): 1-10. |
沈其益. 1992. 棉花病害一基础理论与防治[M]. 北京: 科学出版社.
|
王建美. 2008. 黄栌枯萎病病原菌及致病机理研究. 北京林业大学博士学位论文. http://d.wanfangdata.com.cn/Thesis/Y1283552
|
徐建华, 王建波, 利荣千, 等. 1997. 黄瓜感染枯萎病后组织病理学的研究[J]. 植物病理学报, 27(4): 349-352. |
姚技强, 林柏青, 肖蕴华. 1996. 茄子黄萎病抗病材料的组织病理学研究[J]. 植物病理学报, 26(2): 159-163. |
殷锡圣, 刘润进. 1996. 棉花黄萎病研究进展[J]. 中国棉花, 23(5): 2-6. |
章元寿, 王建新, 刘经芬, 等. 1989. 大丽轮枝菌毒素的分离、提纯及生物测定[J]. 真菌学报, 8(2): 140-147. |
赵仕光, 朱玮, 岳红艳. 1999. 溃疡病菌在杨树树皮组织中的扩展和对寄主细胞超微结构的影响[J]. 林业科学研究, 12(2): 118-126. |
Ashworth L J, Huisman O C, Harper D M, et al. 1974. Free and bound microsclerotia of Verticillium albo-atrum in soils[J]. Phytopathology, 64: 563-564. DOI:10.1094/Phyto-64-563 |
Beckman C B, Tallboys P W. 1982. Anatomy of resistance//Mace M E, Bell A A. Fungal Wilt Diseases of Plants. New York: Acad Press, 487-521.
|
Bewley W F. 1922. "Sleep disease" of the tomato[J]. Annals of Appiled Biology, 9(2): 116-134. DOI:10.1111/aab.1922.9.issue-2 |
Bowers J H, Nameth S T, Riedel R M, et al. 1996. Infection and colonization of potato roots by Verticillium dahliae as affected by Pratylenchus penetrans and P. crenatus.[J]. Phytopathology, 86(6): 614-621. DOI:10.1094/Phyto-86-614 |
Bruce A. 1993. Abolition of an inducible highly anionic peroxidase activity in transgenic tomato[J]. Plant Physiol, 101(1): 201-208. DOI:10.1104/pp.101.1.201 |
Chu Z Q, Jia J W, Zhou X J, et al. 1999. Isolation of glycopmteins from Verticillium dahliae and their phytotoxicity[J]. The Plant Journal, 41(9): 972-976. |
Daayf F, Nicole M, Geiger J P. 1995. Differentiation of Verticillium dahliae population on the basis of vegetative compatibility and pathogenicity on cotton[J]. European Journal of Plant Pathology, 101(1): 69-79. DOI:10.1007/BF01876095 |
DeVay J E, Forrester L L, Garber R H, et al. 1974. Characteristics and concentration of propagules of Verticillium dahliae in air-dried field soils in relation to prevalence of Verticillium wilt in cotton[J]. Phytopathology, 64: 22-29. DOI:10.1094/Phyto-64-22 |
Evans G, Gleeson A C. 1973. Observations on origin and nature of Verticillium dahliae colonizing plant roots[J]. Aus J Biol Sci, 26: 151-161. |
Eynck C, Koopmann B, Grunewaldt Stoecker G, et al. 2007. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques[J]. Eur J Plant Pathol, 118(3): 259-274. DOI:10.1007/s10658-007-9144-6 |
Fitzell R, Evans G, Fahy P C. 1980. Studies on the colonization of plant roots by Verticillium dahliae Klebahn with use of immunofluorescent staining[J]. Aust J Bot, 28(3): 357-368. DOI:10.1071/BT9800357 |
Garber R H, Houston B R. 1966. Penetration and development of Verticillium albo-atrum in cotton plant[J]. Phytopathology, 56: 1121-1126. |
Garber R H. 1973. Fungus penetration and development in Verticillium Wilt of Cotton[M]. College Station, Texas: United States Department of Agriculture Publication: 69-77.
|
Gerik J S, Huisman O C. 1988. Study of field-grown cotton roots infected with Verticillium dahliae using an immunoenzymatic staining technique[J]. Phytopathology, 78(9): 1174-1178. DOI:10.1094/Phyto-78-1174 |
Gold J, Robb J. 1995. The role of the coating response in Craigella tomatoes infected with Verticillium dahliae, race-1 and race-2[J]. Physiol Mol Plant Pathol, 47(3): 141-157. DOI:10.1006/pmpp.1995.1048 |
Green R J. 1954. A preliminary investigation of toxins produced in vitro by Verticillium albo-atrum[J]. Phytopathology, 44: 433-437. |
Heinza R, Leebs W, Saparnoa A, et al. 1998. Cyclical systemic colonization in Verticillium infected tomato[J]. Physiological and Molecular Plant Pathology, 52(6): 385-396. DOI:10.1006/pmpp.1998.0163 |
Hiraga S, Sasaki K, Ito H, et al. 2001. A large family of class Ⅲ plant peroxidases[J]. Plant Cell Physiol, 42(5): 462-468. DOI:10.1093/pcp/pce061 |
Isaac I. 1946. Verticillium wilt of sainfoin[J]. Ann Appl Biol, 33(1): 28-34. DOI:10.1111/aab.1946.33.issue-1 |
Klosterman S J, Atallah Z K, Vallad G E, et al. 2009. Diversity, pathogenicity, and management of Verticillium species[J]. Annu Rev Phytopathol, 47: 39-62. DOI:10.1146/annurev-phyto-080508-081748 |
Krikun J, Bernier C C. 1990. Morphology of microsclerotia of Verticillium dahliae in roots of gramineous plants[J]. Can J Plant Pathol, 12: 439-441. DOI:10.1080/07060669009500988 |
Kusunoki M. 1987. Symptom development of pine wilt disease histopatholonical observations with electron microscope[J]. Ann Phytopath Soc Jpn, 53(3): 622-629. |
Lacy M L, Horner C E. 1966. Behavior of Verticillium dahliae in rhizosphere and on roots of plants susceptible, resistant and immune to wilt[J]. Phytopathology, 56: 427-430. |
Long S S, Li Y L, Shi C X, et al. 2003. Relationships between sucrose content and resistance of core to stalk rot[J]. Jour. of Northwest Sci-Tech Univ of Agri and For (Nat Sci Ed), 31(4): 113-118. |
Mace M E, Bell A A, Stipanovic R D. 1978. Histochemistry and identification of flavanols in Vericillium wilt resistant and susceptible cottons[J]. Physiological Plant Pathology, 13(2): 143-149. DOI:10.1016/0048-4059(78)90027-9 |
Mamiya Y. 1985. Initial pathological change and disease development in pine trees induced by the pine wood nematode, Bursaphelenchus xylophilus[J]. Ann Phytopath Soc Japan, 51: 546-552. DOI:10.3186/jjphytopath.51.546 |
Mamiya Y. 1983. Pathology of the pine wilt disease caused by Bursaphelenchus xylophilus[J]. Ann Rev Phytopathol, 21: 201-220. DOI:10.1146/annurev.py.21.090183.001221 |
Meyer R, Slater V, Duber I A. 1994. A phytotoxic protein-lipopolysaccharide complex produced by Verticillium dahliae[J]. Physiology, 35(6): 1449-1453. |
Nachimas A. 1985. Biological and immunological characterization of alow molecular weight phytotoxin isolated from a protein lipopolysaccharide complex produced by a potato isolate of Verticillium dahliae Kleb[J]. Physiol Plant Path, 26(1): 43-55. DOI:10.1016/0048-4059(85)90029-3 |
Nagtzaam M P M, Termorshuizen A J, Bollen G J. 1997. The relationship between soil inoculum density and plant infection as a basis for a quantitative bioassay of Verticillium dahliae[J]. Eur J Plant Pathol, 103(1): 597-605. |
Nobuchi T, Tominaga T, Fudai K, et al. 1984. Cytological study of pathological changes in Japanese black pine (Pinus thumbergii) seedings after inoculation with pine-wood nematode (Bursaphelenchus xylophilus)[J]. Bull Kyotlo Univ For, 56: 224-233. |
Pegg G F. 1965. Phytotoxln production by Verticillium albo-atrum Reinke et Berthold[J]. Nature, 208: 1228-1229. |
Pegg G F, Brady B L. 2001. Verticillium Wilts. CABI Publishing, Wallingford, UK, 1-30.
|
Perry J W, Evert R F. 1983a. Histopathology of Verticillium dahliae within mature roots of Russet Burbank potatoes[J]. Can J Bot, 61(12): 3405-3421. DOI:10.1139/b83-384 |
Perry J W, Evert R F. 1983b. The effect of colonization by Verticillium dahliae on the root tips of Russet Burbank potatoes[J]. Can J Bot, 61(12): 3422-3429. DOI:10.1139/b83-385 |
Polle A, Otter T, Selferr F. 1994. Apoplastic peroxidases and lignification in needles of Norway Spruce[J]. Plant Physiol, 106(1): 53-60. DOI:10.1104/pp.106.1.53 |
Robb J, Powell D A, Street P F S. 1987. Time course of wall-coating secretion in Verticillium-infected tomatoes[J]. Physiological Molecular Plant Pathology, 31(2): 217-226. DOI:10.1016/0885-5765(87)90066-X |
Schnathorst W C. 1981. Life cycle and epidemiology of Verticillium//Mace M E, Bell A A, Beckman C H. Fungal Wilt Diseases of Plants. Academic Press, New York, USA, 81-111.
|
Schreiber L R, Green R J. 1963. Effect of root exudates on germination of conidia and microsclerotia of Verticillium albo-atrum inhibited by soil fungi static principle[J]. Phytopathology, 53: 260-264. |
Smit F, Dubery I A. 1997. Cell wall reinforcement in cotton hypocotyls in response to a Verttcillium dahliae elicitor[J]. Phytochemistry, 44(5): 811-815. DOI:10.1016/S0031-9422(96)00595-X |
Storey G W, Evans K. 1987. Interactions between Globodera pallida juve-niles, Verticillium dahliae and three potato cultivars, with descriptions of associated histopathologies[J]. Plant pathology, 36(2): 192-200. DOI:10.1111/ppa.1987.36.issue-2 |
Stroddart J L, Carr A J H. 1966. Properties of wilt toxins produced by Verticillium albo-atrum Reinke & Berth[J]. Ann Appl Biol, 58(1): 81-92. DOI:10.1111/aab.1966.58.issue-1 |
Sugawa T. 1982. Occurrence of traumatic resin and cytological changes of parenchyma cells in the stem of Japanese black pine suffering from pine wood nematodes[J]. J Jpn For Soc, 64(3): 112-116. |
Vallad G E, Subbarao K V. 2008. Colonization of resistant and susceptible lettuce cultivars by a green fluorescent protein-tagged isolate of Verticillium dahliae[J]. Phytopathology, 98(8): 871-885. DOI:10.1094/PHYTO-98-8-0871 |
Wilhelm S. 1955. Longevity of Verticillium wilt fungus in the laboratory and field[J]. Phytopathology, 45: 180-181. |
Zhou L, Hu Q, Johansson A, et al. 2006. Verticillium longisporum and V. dahliae infection and disease in Brassica napus[J]. Plant Pathol, 55(1): 137-144. DOI:10.1111/ppa.2006.55.issue-1 |
 2011, Vol. 47
2011, Vol. 47

