文章信息
- 张飞, 陈发棣, 房伟民, 陈素梅, 李风童
- Zhang Fei, Chen Fadi, Fang Weimin, Chen Sumei, Li Fengtong
- 菊花营养性状杂种优势表现与主基因+多基因混合遗传分析
- Heterosis and Major Gene Plus Polygene Mixed Genetic Analysis for Vegetative Traits in Chrysanthemum
- 林业科学, 2011, 47(2): 46-52.
- Scientia Silvae Sinicae, 2011, 47(2): 46-52.
-
文章历史
- 收稿日期:2009-11-30
- 修回日期:2010-04-20
-
作者相关文章
2. 浙江省农业科学院花卉研究开发中心 杭州 311202
2. Flower Research and Development Centre, Zhejiang Academy of Agricultural Sciences Hangzhou 311202
菊花(Dendranthema morifolium)是我国的传统名优花卉,在园林绿化和城市美化中具有重要作用。在菊花生命周期中,营养生长阶段占据很大部分,因此菊花的营养性状也是影响其园林绿化效果的重要因素之一。近年来,分子育种技术迅猛发展,转基因(孙磊等,2008; Yang et al., 2009; Jiang et al., 2009)、基因克隆(Miao et al., 2010)和表达文库构建(Chen et al., 2009)等研究在菊花中均有相关报道,但是传统的杂交育种方法依然是目前创造菊花新种质、培育菊花新品种的最直接、最有效的手段。然而,菊花本身复杂的遗传背景——高度杂合性、自交不亲和性、高倍性等,限制了相关遗传学理论在菊花育种研究中的应用,无法按照大田农作物的纯系亲本类型进行科学、合理的遗传设计,致使关于菊花观赏性状遗传控制基础的研究比较滞后。早期的一些研究主要是基于群体平均数的分布(陈云志等,1991; 徐文辉等,2000; 陈发棣等,2003; 蒋甲福等,2003),严格地说,这些研究结果只能是经验上的总结;而且这些报道基于的研究群体都比较小,缺乏统计学意义,因此,得出的结果有待进一步研究。
一般认为,数量性状受大量多基因控制,但是现在很多研究结果打破了这一传统观点,特别是QTL定位分析结果也表明控制数量性状遗传的基因在效应大小上有较大差异(黄秦军等,2004; Dugo et al., 2005; 张德强等,2005; 齐靖等,2009),有的甚至出现主基因遗传特性,表现为主基因和多基因混合遗传的模式。盖钧镒等(2003)将这种混合遗传的模式视为主基因-多基因遗传体系,传统认为的单纯主基因控制和单纯多基因控制的情况作为该遗传体系的特例,并提出主基因+多基因混合遗传模型分离分析方法,用于鉴别数量性状的主-多基因混合遗传模型并估计相关遗传参数。该方法涉及单个分离世代(F2)与多个分离世代联合2种情形(王建康等,1997; 章元明等,2000),已经在多种作物的遗传研究中得到应用(Guo et al., 2006; 陈四龙等,2009; 刘莉等,2009; 路昭亮等,2009; 阎立英等,2009),但在菊花等遗传背景比较复杂的园林植物中尚未见报道。菊花营养性状的遗传机制究竟如何,是否由主基因控制,能否找到一种与菊花营养性状紧密连锁的遗传标记,至今仍不明确。本研究利用植物数量性状的主基因+多基因混合遗传模型分析方法对菊花F1杂交群体8个营养性状2年表型观测数据进行遗传分析,探讨菊花部分营养性状的遗传模型和基因作用方式,估计主基因的遗传效应和遗传方差,为菊花杂交亲本选配、扩大菊花遗传基础提供理论依据,同时为今后菊花优良营养性状QTL定位和分子标记辅助育种的深入研究奠定理论基础。
1 材料与方法 1.1 试验材料供试材料为保存于南京农业大学中国菊花种质资源保存中心的盆栽小菊品种‘奥运含笑’和地被菊品种‘雨花落英’,经多年无性繁殖栽培鉴定,性状表现稳定。2006年秋,以‘雨花落英’为母本,‘奥运含笑’为父本杂交,获得240余粒F1杂交种子,次年3月初经穴盘点播,连同亲本扦插苗于4月中下旬单株标号随机定植在菊花苗圃地,栽培环境与管理方式同大田常规栽培。
1.2 试验方法 1.2.1 田间性状调查从F1杂交群体中任意选择142株F1实生苗以扦插的方式每年进行无性繁殖保存,并于2008和2009年秋季营养生长末期调查亲本和F1群体植株的营养性状,包括株高(cm)、冠幅(cm)、株高/冠幅比值、中部(顶始第10节)节间长度(cm)、花颈长度(cm)、中部叶长(cm)、叶宽(cm)和叶长/宽比值8个性状,各性状(除株高、冠幅外)单株重复测量3次,并计算2年性状调查的平均值。具体统计方法参照李鸿渐(1993)的《中国菊花》专著。
1.2.2 杂种优势分析及显著性检验杂种优势分别以中亲优势和中亲优势率表示。杂交F1群体的平均数(Fm)与中亲值(mid-parents value, Mp)之差定义菊花各营养性状的中亲优势Hm,即Hm=Fm-Mp。将(Fm-Mp)/ Mp×100%定义为中亲优势率(Rh)。其中,中亲值(Mp)为双亲某性状的平均值。采用SPSS 11.5进行基本描述性数据的统计分析及样本均值t检验。
1.2.3 菊花营养性状的混合遗传分析以2年性状调查的平均值为基础进行混合遗传分析。采用盖钧镒等(2003)建立的植物数量性状混合遗传模型的主基因+多基因分析方法中的单个F2世代的分离分析方法,对菊花F1单株(株系)测量数据用A,B 2类11种遗传模型配合表型次数分布求出各种遗传模型的极大似然函数值(maximum likelihood value,MLV),由极大似然函数值计算出AIC(Akaike’s information criterion)值。然后通过AIC值选择供选的相对最佳模型,同时进行一组适合性检验,包括均匀性检验U12, U22, U32,Smirnov检验(nW2),Kolmogorov检验(Dn),根据AIC值最小原则和适合性检验的结果选择出最优模型。根据最优模型采用最小二乘法估计出主基因的效应值、方差、主基因遗传率等遗传参数。主基因遗传率: hmg2=σmg2/σp2。分析软件由南京农业大学国家大豆改良中心提供。
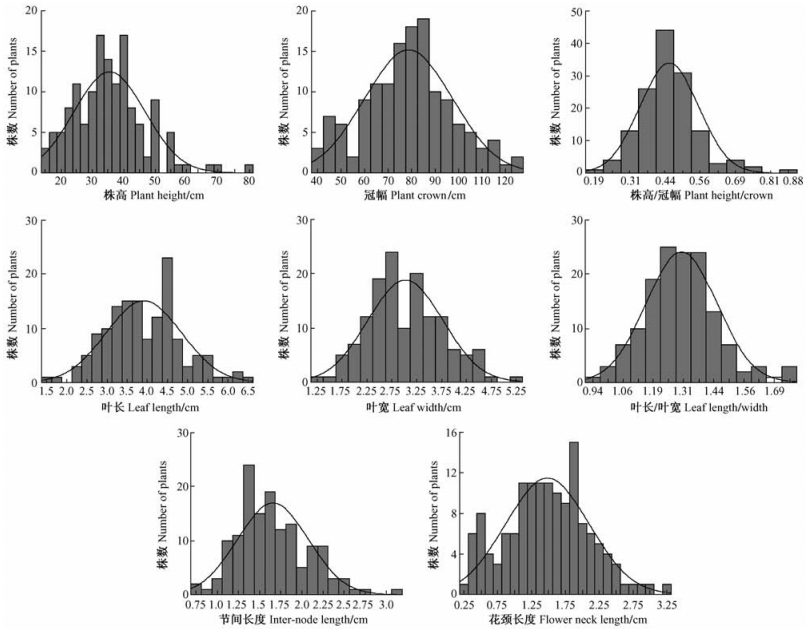
2 结果与分析 2.1 菊花营养性状在F1代的表型分布与杂种优势表现菊花8个营养性状在亲本及F1代分离的描述性数据分析见表 1。菊花亲本间8个营养性状差异均较大,而且在F1群体中分离比较广泛,变异系数大于10%,为遗传分析提供了较好的遗传差异基础。从表 1中的峰度和偏度与F1群体各性状的次数分布(图 1)可知:大部分营养性状分布于双亲之间,表现出连续性较好的正态分布,表明它们可能属于多基因控制的数量性状。
|
|
|
图 1 菊花‘雨花落英’ב奥运含笑’杂交组合F1群体各营养性状的次数分布 Figure 1 Frequency distributions for vegetative traits segregating in F1 population derived from a cross between 'Yuhualuoying' and 'Aoyunhanxiao' |
从表 1可以看出:除叶宽以外,株高、冠幅、株高/冠幅、叶长、叶长/叶宽、节间长度和花颈长度7个营养性状的中亲优势均达极显著水平,中亲优势率分别为28.62%, 41.49%, -11.76%, -8.84%, -8.45%, -33.06%和-13.95%。F1群体中,株高/冠幅、叶长、叶长/叶宽、节间长度和花颈长度的中亲优势均为负值,说明这5个营养性状的杂种优势在F1代呈下降趋势。同时由图 1可以看出:F1群体中各营养性状均存在超出亲本的个体,说明杂交后代超亲分离现象普遍存在,但是F1群体各性状的平均值都介于高亲和低亲之间(表 1),所以说这种超亲分离现象并没有形成超亲优势。
2.2 菊花各营养观赏性状最适遗传模型的适合性分析利用植物数量性状主基因+多基因混合遗传模型单个分离世代的分离分析方法,对本研究中菊花F1营养性状2年表型数据均值进行混合遗传模型分析。首先计算A,B类11种遗传模型与表型资料的配合结果,得到极大似然函数值和AIC值(表 2)。根据遗传模型选取的原则,即AIC值最小准则,选取AIC值最小及与最小AIC值比较接近的遗传模型作为备选最适模型。以株高为例,比较各模型下的计算结果,AIC值较小的模型有A-0, A-1和A-4 3种模型,其值分别为1 095.698 0, 1 096.778 8和1 096.778 8,可以作为备选最适模型。
|
|
利用U12, U22, U32, nW2和Dn对这3个备选模型进行适合性检验(表 3),选择统计量达到显著个数最少的模型作为最优模型,结果发现3个模型的统计量均未达到显著水平。但是A-0模型的AIC值最小,即A-0模型的适合性高于其他模型,表明A-0模型能够对菊花株高的遗传作出充分解释,可以作为菊花株高的最优模型。说明在本研究中,菊花株高无主基因控制,可能表现为受环境影响较大的多基因控制。
|
|
同理可知,冠幅表现为A-2模型,由1对主基因控制,主基因表现为加性,即显性效应等于0;株高/冠幅、叶长/叶宽和花颈长度3个性状表现为由2对主基因控制的B-2模型,主基因表现为加性-显性; 叶长和叶宽表现为A-0模型,与株高相同,无主基因控制; 节间长度表现为由1对主基因控制的A-4模型,主基因表现为负向完全显性,即显性效应等于负的加性效应。
2.3 遗传参数估计根据各性状遗传模型参数的极大似然估计值,估计最佳最适遗传模型的遗传参数(表 4)。结果表明冠幅和节间长度的主基因加性效应均表现为正向增效,分别为23.36和0.346,主基因遗传率分别为78.61%和51.46%。在株高/冠幅和叶长/叶宽2个性状上,2对主基因的加性效应都表现为正向增效; 但是在显性效应方面,主基因的显性效应均为负向效应,且在数值上等于其对应的加性效应的负值,主基因遗传率分别为40.33%和45.19%。控制花颈长度的2对主基因中,第1对主基因的加性和显性效应均表现为正向增效,分别为0.635和0.042;但是第2对主基因的加性效应等于其显性效应的绝对值,主基因遗传率为99.56%。
|
|
杂种优势利用是菊花杂交育种的重要途径之一。菊花杂种优势现象是普遍存在的,但是不同的杂交组合,各性状杂种优势表现程度是不同的(蒋甲福等,2003; 李辛雷等,2008)。从遗传基础上来说,杂种优势来源于亲本的遗传异质性,掌握遗传多样性材料,选择基因位点差异较大的材料做亲本,其组配的杂交组合后代群体出现杂种优势的可能性会比较大(周蓉等,1995; 陈四龙等,2009)。本研究选择表型差异较大的匍匐型地被菊品种‘雨花落英’与直立型盆栽小菊品种‘奥运含笑’进行杂交,其后代的遗传基础大大拓宽,各营养性状的变异系数为11.54%~ 41.89%。除叶宽以外,其他7个营养性状均表现出极显著的杂种优势。在8个营养性状中,株高/冠幅、叶长、叶长/叶宽、节间长度和花颈长度5个性状在F1群体杂种优势下降,这与已有研究结果相同(陈云志等,1991; 陈发棣等,2003; 李辛雷等,2008)。本研究中, 株高/冠幅、叶长、叶长/叶宽、节间长度和花颈长度5个性状的中亲优势为负值,说明这5个性状的杂种优势中存在显性遗传效应。F1代的杂种优势源于基因的杂合性。由于菊花本身是杂合性很高的植物,在很多性状上可能是纯合的,也可能是杂合的。杂合基因控制的性状在F1代发生广泛分离,从而F1代杂种优势衰退以及性状变异程度扩大,存在正向或负向的超亲分离现象,这为后代单株优良性状的选择提供了有利的条件。
3.2 菊花营养性状的遗传效应分析营养性状是菊花育种的重要目标。很多研究证明,菊花株高、冠幅、叶片和花器等性状属于数量性状,受多基因控制,其遗传机制十分复杂(徐文辉等,2000; 张飞等,2008),因此研究菊花营养性状的遗传规律就成为菊花株型育种的必要前提。本研究将主基因+多基因混合遗传体系应用于菊花营养性状的遗传分析,利用单个分离世代分离分析方法确定菊花8个营养性状的遗传模型。研究结果发现,株高、叶长和叶宽3个营养性状无主基因控制,冠幅、株高/冠幅、叶长/叶宽、节间长度和花颈长度5个性状符合主基因+多基因遗传模型,并检测到主效基因的存在,主基因遗传率分别达到了78.61%, 40.33%, 45.19%, 51.46%和99.56%,这些主基因存在的发现为通过QTL基因定位的方法找到同这些基因紧密连锁的分子标记,采用分子标记辅助选择育种的方法来提高育种效果提供了重要理论依据。其中,冠幅、节间长度和花颈长度3个性状的主基因遗传率(>50%)属于高度遗传力,受环境影响较小,在杂交育种中可以在早世代进行选择; 株高/冠幅比和叶长/宽比属于中度遗传力,受环境影响较大,早期选择的时候可以适当扩大入选率(顾万春,2004)。
本研究发现,控制菊花冠幅和节间长度的主基因表现为加性效应,而控制株高/冠幅比、叶长/宽比和花颈长度3个性状的主基因同时存在加性效应和显性效应。因此,可以通过主基因的加性效应对目标性状进行定向选择,同时显性效应可以为菊花杂种优势的利用提供遗传基础(陈四龙等,2009)。张飞等(2010)通过配合力分析发现,菊花株高和叶长主要由非加性(显性、超显性)基因控制,叶宽主要由加性基因和非加性基因控制。遗憾的是,本研究中没有检测到控制这3个性状的主基因,无法对相关遗传参数进行估计。另外,运用主基因+多基因混合遗传模型进行遗传分析时,需要考虑到不同的分离群体有不同的遗传背景,检测到的基因效应及相关遗传参数可能也会有所不同。
3.3 本文研究结果对今后菊花性状遗传基础研究的启示随着分子标记技术的发展,在很多作物上已经实现遗传图谱构建和基因定位工作(Dugo et al., 2005; Yagi et al., 2006; 齐靖等,2009),为相关的分子育种方法提供了重要理论基础。目前,栽培菊花上可供利用的分子标记较少(赵静媛等,2009a; 2009b),所以研究菊花数量观赏性状的遗传规律,找到控制相关性状的主效基因及其与之紧密连锁的分子标记将会加快菊花分子育种、缩短菊花育种周期。栽培菊花具有高度自交不亲和性,很难通过多代自交获得纯合或高度近交系,使菊花的遗传研究比较滞后。但是由于长期的无性栽培、繁殖,使菊花亲本具有高度异质性,在很多性状上都是杂合的,2个亲本杂交F1代群体性状即发生广泛分离,林木、果树和草坪草中也广泛存在这种现象,认为异交植物的F1代相当于近交作物的F2代(Grattapaglia et al., 1994)。鉴于此,本研究借助于盖钧镒等(2003)提出的植物数量性状主基因+多基因混合遗传模型单个分离世代(F2)的分离分析方法对菊花F1代8个营养性状2年的表型数据进行上述遗传分析。目前,主基因+多基因混合遗传模型的应用主要集中在亲本基因型高度纯合的大田农作物上(Tao et al., 2003; Guo et al., 2006; Zhang et al., 2006; 李河南等,2009),在菊花等异质性比较高的园林植物中本文属首次报道。然而,本研究虽然明确了菊花部分营养性状的主基因控制模式,但是单个分离世代无法像多世代联合分析方法估计多基因的存在及其效应值等相关遗传参数,而且目前尚无完善的针对异交作物的遗传分析方法。一般认为,菊花具有严重的自交不亲和现象,很难获得较为纯合菊花基因型。徐雁飞等(2009)报道了有些菊花品种存在自交亲和现象。笔者认为这一发现为菊花的遗传基础研究提供了良好机会,可以通过连续多年对这些自交亲和的菊花基因型进行自交以获得高代自交或近交系,从而对菊花数量观赏性状的遗传基础进行深入、系统研究。因此,要全面研究菊花等本身具有高度杂合性植物性状的遗传机制,最基本的思路应该是挖掘、创新遗传资源,建立科学、完善的多世代多环境分离群体。
陈发棣, 蒋甲福, 郭维明. 2003. 小菊花器若干性状在F1代的表现[J]. 园艺学报, 30(2): 175-182. |
陈云志, 金白谋, 吴淑芳, 等. 1991. 菊花种间杂交若干性状在F1代的表现[J]. 园艺学报, 18(3): 258-262. |
陈四龙, 李玉荣, 程增书, 等. 2009. 花生含油量杂种优势表现及主基因+多基因遗传效应分析[J]. 中国农业科学, 42(9): 3048-3057. DOI:10.3864/j.issn.0578-1752.2009.09.005 |
盖钧镒, 章元明, 王建康. 2003. 植物数量性状遗传体系[M]. 北京: 科学出版社: 96-102.
|
顾万春. 2004. 统计遗传学[M]. 北京: 科学出版社.
|
黄秦军, 苏晓华, 黄烈健, 等. 2004. 美洲黑杨×青杨木材性状QTLs定位研究[J]. 林业科学, 40(2): 55-60. DOI:10.11707/j.1001-7488.20040210 |
蒋甲福, 陈发棣, 郭维明. 2003. 小菊杂种一代部分性状的遗传与变异[J]. 南京农业大学学报, 26(2): 11-15. |
李河南, 汪霞, 李广军, 等. 2009. 大豆粒形的主基因+多基因混合遗传[J]. 大豆科学, 28(1): 16-20. |
李鸿渐. 1993. 中国菊花[M]. 南京: 江苏科学技术出版社.
|
李辛雷, 陈发棣, 赵宏波. 2008. 菊属种间杂种若干花器官性状的表现[J]. 中国农业科学, 41(3): 786-794. |
刘莉, 刘翔, 焦定量, 等. 2009. 西瓜强雌性的遗传效应分析[J]. 园艺学报, 36(9): 1299-1304. |
路昭亮, 柳李旺, 龚义勤, 等. 2009. 萝卜干物重和可溶性总糖含量的遗传分析[J]. 南京农业大学学报, 32(3): 25-29. |
齐靖, 董祯, 毛永民, 等. 2009. 枣高密度遗传图谱的构建与树干直径的QTL分析[J]. 林业科学, 45(8): 44-49. DOI:10.11707/j.1001-7488.20090808 |
孙磊, 张启翔, 周琳. 2008. 利用双T-DNA载体系统获得无选择标记转基因菊花[J]. 园艺学报, 35(5): 727-734. |
王建康, 盖钧镒. 1997. 利用杂种F2世代鉴定数量性状主基因-多基因混合遗传模型并估计其遗传效应[J]. 遗传学报, 24(5): 432-440. |
徐雁飞, 陈发棣, 陈素梅, 等. 2009. 菊花品种自交亲和性鉴定及其授粉后花柱内3种保护酶活性的变化[J]. 园艺学报, 36(1): 59-64. |
徐文辉, 高海卿, 陈华进. 2000. 菊花某些性状遗传规律的初步探讨[J]. 浙江林学院学报, 17(1): 37-41. |
阎立英, 娄丽娜, 冯志红, 等. 2009. 雌性同株黄瓜单性结实性主基因+多基因混合遗传分析[J]. 西北植物学报, 29(6): 1122-1126. |
张德强, 张志毅, 杨凯, 等. 2005. 毛新杨×毛白杨叶片表型和春季萌芽时间QTL分析[J]. 林业科学, 41(1): 42-48. DOI:10.11707/j.1001-7488.20050109 |
张飞, 房伟民, 陈发棣, 等. 2010. 菊花观赏性状的配合力分析[J]. 园艺学报, 37(4): 589-596. |
张飞, 陈发棣, 房伟民, 等. 2008. 切花菊花器性状的遗传变异与相关性研究[J]. 浙江林学院学报, 25(3): 293-297. |
章元明, 盖钧镒, 张孟臣. 2000. 利用P1P2F1和F2或F2: 3世代联合的数量性状分离分析[J]. 西南农业大学学报, 22(1): 6-9. |
赵静媛, 陈发棣, 藤年军, 等. 2009a. 地被菊匍匐性的遗传分析与RAPD标记研究[J]. 中国农业科学, 42(2): 734-741. |
赵静媛, 陈素梅, 陈发棣. 2009b. 与地被菊株型匍匐性连锁RAPD标记的SCAR转化[J]. 林业科学, 45(9): 147-150. |
周蓉, 段乃雄. 1995. 花生野生种的酯酶同工酶与种间杂种优势关系的研究[J]. 中国油料作物学报, 17(3): 29-33. |
Chen Sumei, Miao Hengbin, Chen Fadi, et al. 2009. Analysis of expressed sequence tags (ESTs) collected from the inflorescence of chrysanthemum[J]. Plant Molecular Biology Reporter, 27(4): 503-510. DOI:10.1007/s11105-009-0103-6 |
Dugo M L, Satovic Z, Millan T, et al. 2005. Genetic mapping of QTLs controlling horticultural traits in diploid roses[J]. Theoretical and Applied Genetics, 111(3): 511-520. DOI:10.1007/s00122-005-2042-4 |
Grattapaglia D, Sederoff R. 1994. Genetic linkage maps of Eucalyptus grandis and Eucalyptus urophylla using a pseudo-testcross: mapping strategy and RAPD markers[J]. Genetics, 137(4): 1121-1137. |
Guo Zaihua, Ding Ping, He Liyuan, et al. 2006. Genetic analysis of agricultural traits in rice related to phosphorus efficiency[J]. Acta Genetica Sinica, 33(7): 634-641. DOI:10.1016/S0379-4172(06)60093-0 |
Jiang Beibei, Chen Sumei, Chen Fadi, et al. 2009. The Lateral suppressor-like gene, DgLsL, alternated the axillary branching in transgenic chrysanthemum (Chrysanthemum × morifolium) by modulating IAA and GA content[J]. Plant Molecular Biology Reporter, 28(1): 144-151. |
Miao Hengbin, Jiang Beibei, Chen Sumei, et al. 2010. Isolation of a gibberellin 20-oxidase cDNA from and characterization of its expression in chrysanthemum[J]. Plant Breeding, 129(6): 707-714. DOI:10.1111/j.1439-0523.2009.01736.x |
Tao Ailin, Zeng Hanlai, Zhang Yuanming, et al. 2003. Genetic analysis of the low critical sterility temperature point in photoperiod-thermo sensitive genic male sterile rice[J]. Acta Genetica Sinica, 30(1): 40-48. |
Yang Yanfang, Wu Jian, Zhu Kai, et al. 2009. Identifcation and characterization of two chrysanthemum (Dendranthema × morifolium) DREB genes, belonging to the AP2/EREBP family[J]. Molecular Biology Reports, 36(1): 71-81. DOI:10.1007/s11033-007-9153-8 |
Yagi M, Onozaki T, Taneya M, et al. 2006. Construction of a genetic linkage map for the carnation by using RAPD and SSR markers and mapping quantitative trait loci (QTL) for resistance to bacterial wilt caused by Burkholderia caryophylli[J]. Journal of Japanese Society of Horticultural Science, 75(2): 166-172. DOI:10.2503/jjshs.75.166 |
Zhang Shufen, Ma Chaozhi, Zhu Jiacheng, et al. 2006. Genetic analysis of oil content in Brassica napus L. using mixed model of major gene and polygene[J]. Acta Genetica Sinica, 33(2): 171-180. |
 2011, Vol. 47
2011, Vol. 47