文章信息
- 付淑清, 屈庆秋, 唐明, 杨艳, 李翠
- Fu Shuqing, Qu Qingqiu, Tang Ming, Yang Yan, Li Cui
- 施氮和接种AM真菌对刺槐生长及营养代谢的影响
- Effects of Nitrogen and AM Fungi on the Growth and Nutrition Metabolism of Robinia pseudoacacia
- 林业科学, 2011, 47(1): 95-100.
- Scientia Silvae Sinicae, 2011, 47(1): 95-100.
-
文章历史
- 收稿日期:2009-10-30
- 修回日期:2010-01-17
-
作者相关文章
2. 西北农林科技大学林学院 杨凌 712100
2. College of Forestry, Northwest A & F University Yangling 712100
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)能够与80%以上的陆地植物根系建立共生关系,形成丛枝菌根(弓明钦等,1997)。AM真菌在与植物形成菌根之后,可促进植物对矿质营养元素的吸收和利用,改善植物营养状况,促进植物生理代谢(Oliveira et al., 2005)。Gupta等(2002)在田间条件下接种AM真菌,极显著地提高了薄荷(Mentha arvensis)茎叶中氮的含量。王倡宪等(2003)接种Glomus mosseae, Glomus versiforme和Glomus intraradice 3种AM真菌,都能提高黄瓜(Cucumis sativus)幼苗吸收氮和磷的能力,其中G. mosseae的作用最为显著,根系的全氮含量比对照提高11.69%。贺学礼等(2006)研究表明:在低氮水平下,接种AM真菌提高了烟叶中氮、钾、铁含量,在下位叶表现尤为显著;较高氮水平下,提高了磷含量,施氮量为0.05~0.2 g·kg-1时,接种效果最佳。刘媞等(2008)研究表明:不同施氮水平下接种AM真菌提高了黄芪(Astragalus membranaceus)菌根侵染率、生长量、植株叶片可溶性蛋白含量及SOD和CAT活性。卢彦琦等(2008)研究证明:接种AM真菌的白术(Atractylodes macrocephala)植株SOD和CAT活性随AM真菌的接种效应和施氮量不同而变化。
刺槐(Robinia pseudoacacia)是黄土高原分布广泛、适应性强、耐干旱和耐贫瘠的树种,在改善环境、维持生态平衡中有重要作用。AMF可以与刺槐和沙棘(Hippophae rhamnoides)形成良好的共生关系(徐辉等,2008),对刺槐根际微生物群落的稳定和功能多样性的增加具有促进作用(杜小刚等,2008)。关于AM真菌与施氮肥结合对刺槐生长及营养代谢的研究鲜见报道,本文在对刺槐菌根研究的基础上,采用AM真菌和施氮肥相结合的方法,初步研究了AM真菌和施氮肥对刺槐根系发育状况以及对刺槐叶片营养代谢的影响,探讨AM真菌与氮素对刺槐生长的影响,为AM真菌在黄土高原植被恢复中刺槐育苗中的应用提供科学依据。
1 材料与方法 1.1 供试材料供试土壤采自西北农林科技大学林学院苗圃的垆土,过2 mm筛,河沙用流水冲洗至洗液不再浑浊。沙土混合物(V:V=2:1)经高温高压蒸汽灭菌(121 ℃,2 h)。土壤养分含量为:有机质1.048%、速效氮45.18 mg·kg-1、速效磷38.89 mg·kg-1、速效钾232.96 mg·kg-1,pH 7.18 (水:土=1:2.5)。
供试植物为刺槐,挑选饱满的刺槐种子,用10% H2O2溶液浸泡10 min表面消毒,清洗干净,再用无菌水浸泡2 h后转入铺有灭菌纱布的瓷盘中,置于25 ℃培养箱中催芽,每天早晚用水冲洗,待种子发芽后挑取发芽一致的种子进行播种。
供试AM真菌为摩西球囊霉(Glomus mosseae)(简称GM)和缩球囊霉(G.constrictum)(简称GC),均由西北农林科技大学林学院微生物实验室提供。
1.2 试验方法 1.2.1 AM真菌菌剂的制备AM真菌用三叶草(Oxalis corniculata)扩繁。将三叶草种子用75%酒精进行表面消毒,然后用无菌水反复冲洗,置于催芽箱中催芽。基质为土壤:沙子=1:2,经湿热灭菌(121 ℃,2 h),放置2天后备用。在营养钵(15 cm×13 cm)内装入3/4基质后, 施入AM真菌菌剂30 g,上覆1.5 cm厚的基质,然后播种8~10粒三叶草种子,再覆盖0.5 cm厚的基质,1周后定苗,每盆择优留苗4株,将其余植株的地上部分剪去。再生长3个月后,去除地上部分和表层土,用含有孢子、菌丝及侵染根段的根土混合物作为接种菌剂。供试菌剂根系的侵染率为85.6%,平均孢子密度为18个·g-1的干菌剂。
1.2.2 试验设置试验采用随机区组设计,处理为3×5设计:单接种GM、GC和不接种CK,分别为5个氮素[尿素:w(N)=46%]水平,即0,0.2,0.4,0.6和0.8 g·kg-1。共15个处理,每处理30盆。将灭菌土壤装入塑料盆(15 cm×13 cm)至2/3处,施入AM真菌菌剂30 g,不接种施等量灭菌菌剂。接种后覆1 cm厚培养土,播种经催芽的刺槐种子(每钵10粒左右)后覆2 cm厚的培养土,每盆共装干土1 kg。待1周左右幼苗出土后,定苗至每钵4株,每天浇1次水。40天后追入氮肥,其他元素用肥参见Hoagland营养液(许学明等,1997)。生长期温度在25~35 ℃,光照为12~14 h·d-1,时间60天。
1.3 测定方法刺槐苗生长60天后,每个处理随机选取10盆进行分析。将植株从土壤中挖出,洗净根上的泥土,然后剪取新鲜刺槐根系和叶片浸在自来水中(换水3~4次),用镊子将表面杂物除去,用无菌水冲洗后作为根系和叶片指标测定样品。
菌根侵染率采用Phillips等(1970)的染色方法测定;根系活力采用氯化三苯基四氮唑(TTC)浸提比色法测定(郝再彬等,2004),丙二醛(MDA)按硫代巴比妥酸法测定,超氧化物歧化酶(SOD)活性按氮蓝四唑(NBT)法测定,过氧化氢酶(CAT)活性采用紫外吸收法测定,游离脯氨酸含量采用磺基水杨酸比色法测定,硝酸还原酶(NR)活性采用活体法测定(郝建军,2007)。
1.4 数据处理采用Windows Excel(Ⅴ 2003)和SAS (Ⅴ 8.0)系统分析软件进行数据分析和图形处理。
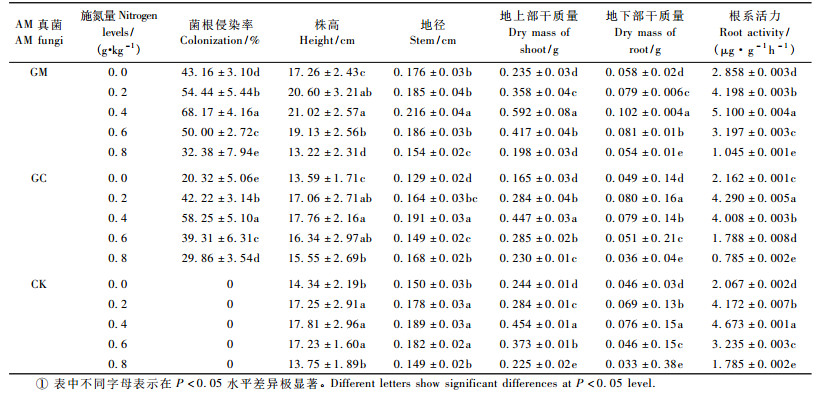
2 结果与分析 2.1 AM真菌对不同施氮水平刺槐生长的影响 2.1.1 AM真菌对刺槐菌根侵染率的影响由表 1看出:GM和GC刺槐根部均能形成典型的泡囊丛枝结构,不同处理刺槐菌根侵染率不同。GM和GC的菌根侵染率先随施氮量的升高而上升,施氮量为0.4 g·kg-1时达最高,分别为68.17%和58.25%,然后随着施氮量的增加逐渐减少,GM各施氮水平侵染率差异性显著,GC在0.2和0.6 g·kg-1水平与其他水平差异显著,表明适量的氮肥能促进菌根的侵染,而过量施氮反而抑制其侵染。在同一施氮水平下,GM菌根侵染率均高于GC,说明GM与植物的亲和力大于GC。GM在施入适量氮肥时,既促进了刺槐根系菌根的侵染,同时也有利于植物根系的生长。
|
|
由表 1可知:根系活力随着施氮量的增加先增加后减少,GM在施氮量0.4 g·kg-1时根系活力最强,与对照CK相比提高9.14%;GC在0.2 g·kg-1时活性最强,与对照相比提高2.83%,各施氮水平差异显著,说明施氮量过低或过高都不利于刺槐根系活力的增强,接种AM真菌能够有效提高植物的根系活力,GM更能促进植物生长。从表 2可知:GM菌根侵染率与根系活力呈极显著正相关,而GC菌根侵染率与根系活力相关性不显著,这可能是由于GM和GC与所处的环境、宿主等的适应性不同有关。
|
|
GM株高、地径、地上部和地下部干质量随施氮量的增加先增加后降低,在施氮量为0.4 g·kg-1时达最高,分别为21.02 cm、0.216 cm、0.592 g和0.102 g(表 1),同时GM的菌根侵染率与这4个指标呈正相关,达到显著水平(表 2),说明当GM菌根侵染率增大时,根系活力也增强,提高了植物从周围土壤中吸收营养物质和水分的能力,为植物的生长提供了充足的养分。GC株高、地径和地上部干质量在施氮量为0.4 g·kg-1时达最高,分别为17.76 cm、0.191 cm和0.447 g,地下部干质量在施氮量为0.2 g·kg-1时达最大,为0.080 g(表 1),其菌根侵染率与株高和地上部干质量的相关性显著,而与地径和地下部干质量相关性不显著(表 2),可能是因为GC的贮藏能力大于生长能力,植物根系吸收的营养物质首先在茎中贮藏,然后再用于新生器官的生长。
GM株高、地径、地上部和地下部干质量平均值分别比对照CK高13.5%、8.1%、13.9%和38.5%,而GC株高、地径和地上部干质量略低于对照CK,地下部干质量比CK高了9.3%。这说明不同菌剂对刺槐生长的影响不同,GM效果好于GC。
2.2 AM真菌对不同施氮量刺槐酶活性的影响 2.2.1 对刺槐超氧化物歧化酶(SOD)活性的影响GM和GC叶片SOD活性随着施氮量的增加呈先降后升再降的趋势(图 1A),在0.2 g·kg-1水平下达最低值。从表 2可知:GM和GC菌根侵染率与SOD活性呈正相关,但相关性不显著,说明施氮量低时,植株体内未产生过多的活性氧,合适的施氮量能够抑制活性氧的产生,而随着施氮量增高,活性氧增多,SOD活性也增强,在0.4 g·kg-1水平达到最大值,此时侵染率也达到最大,之后SOD活性开始下降,说明过高的施氮量使植物清除体内活性氧的效果开始下降。对照CK的SOD活性呈先升后降的趋势,说明接种AM真菌后能够抑制活性氧的大量产生。在同一施氮水平下,三者的差异性均达到显著水平(图 1A),GM最好,CK最差,GM和GC刺槐苗木SOD活性平均值分别比对照CK高11.1%和7.9%,表明接种株强于未接种株,而GM和合适施氮量结合效果最好。

|
图 1 施氮量对刺槐SOD,CAT,NR酶活性的影响 Figure 1 The effect of nitrogen levels on the SOD, CAT and NR activity of R.pseudoacacia |
从图 1B可以看出:GM,GC和对照CK的CAT活性都是随施氮量的增加先增加后下降,0.4 g·kg-1达最高点,说明适量的氮肥能够提高CAT活性,而施肥量过低或过高都使其清除自由基的效果减弱。同一施氮水平下,接种与不接种株CAT活性差异显著,GM和GC平均值分别比对照CK高41.3%和33.7%,同时二者的菌根侵染率与CAT活性相关性显著(表 2),说明不同施氮水平下接种AM真菌显著提高了刺槐的CAT活性,且在0.4 g·kg-1水平效果较好。
2.2.3 对刺槐硝酸还原酶活性(NR)的影响从图 1C可以得出:GM和GC的叶片NR活性首先随施氮量的增加而上升,0.4 g·kg-1水平下达最大值,此后随施氮量的增加逐渐下降,而施氮量对未接种株CK的NR活性影响不同于接种株,在0.2 g·kg-1水平时即达最大值,0.4 g·kg-1略低于0.2 g·kg-1,但二者差异不显著,GM和GC的菌根侵染率与NR活性成显著正相关(表 2),说明当施氮量为0.4 g·kg-1时,GM和GC的菌根侵染率达到最大,此时植物根系发达,提高了植株从土壤中吸收氮素的能力,硝酸还原酶活性也达到最大,有利于叶片的充分发育和展开。0.2 g·kg-1水平GM的NR活性低于GC和CK,其他水平均高于GC和CK,且差异性达到显著水平。所以,接种GM与适量的氮肥相结合更能促进植物对氮素的吸收。
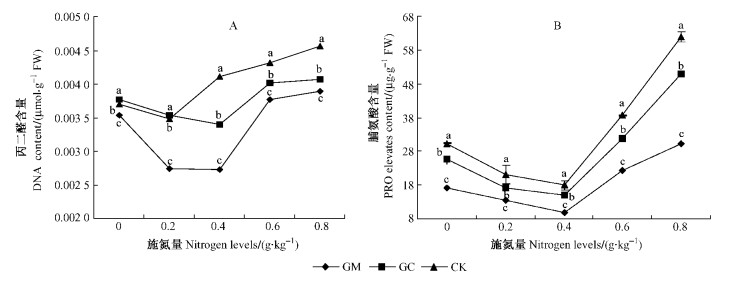
2.3 AM真菌对不同施氮量刺槐丙二醛和脯氨酸含量的影响 2.3.1 对刺槐丙二醛(MDA)含量的影响由图 2A得到:施氮量对刺槐丙二醛的含量有明显的影响,GM和GC的刺槐叶片丙二醛含量随施氮量的增加而下降,0.4 g·kg-1水平下达最小值,此后随施氮量的增加逐渐上升。GM和GC的刺槐根系菌根侵染率与丙二醛含量呈负相关,其中GM达到显著水平,GC不显著(表 2)。据调查刺槐在0和0.8 g·kg-1水平下叶片明显发黄,说明在0.4 g·kg-1水平时,刺槐生长势强,抗逆性较强,而施氮量过少或过多都会影响刺槐的生长,且会出现衰老标志,而接种AM真菌后能够缓解这种情况。同一施氮水平下各处理间差异性达到显著水平,GM和GC叶片MDA含量平均值比对照CK分别降低了21.1%和7.3%,说明GM能更好地降低刺槐叶片的MDA含量,促进刺槐生长,且在0.4 g·kg-1水平效果较好。
|
图 2 施氮量对刺槐丙二醛、游离脯氨酸含量的影响 Figure 2 The effect of nitrogen levels on MAD, PRO elevates content of R.pseudoacacia |
接种株和未接种株的刺槐叶片游离脯氨酸含量随施氮量的增加呈先下降后上升的趋势,0.4 g·kg-1水平达最小值(图 2B),GM和GC的刺槐根系菌根侵染率与游离脯氨酸含量呈负相关,其中GM达到显著水平,GC不显著(表 2)。同一施氮水平下各处理间差异性达到显著水平,GM和GC叶片游离脯氨酸含量平均值与对照CK相比分别降低了83%和21%,说明适量的氮肥与合适的AM真菌相结合能有效地降低超氧化物对细胞质膜的氧化伤害程度,使接种AMF的刺槐抗性增强,生长能力提高。
3 结论与讨论通过以上研究可以得出:AM真菌与氮素对各指标的影响具有交互作用,施氮量低会使刺槐生长所需营养不足,施氮量高会造成植株根系活力低,根系菌根侵染率下降;不同施氮水平下接种AM真菌显著提高了刺槐的生长量以及SOD, CAT和NR活性,降低了MDA和游离脯氨酸的含量,进而促进刺槐的生长和营养代谢;各指标随着施氮量的变化而变化,在施氮量为0.4 g·kg-1水平时效果最好;同一施氮水平下GM与刺槐的亲和力要强于GC。
菌根效应能否发挥取决于AM真菌与宿主之间的亲和力,侵染率表明真菌的感染情况和根系组织中生物量的多寡,是AM真菌功能发挥的基础(Koide et al., 2004)。Ames等(1984)研究表明:施用氮肥既会促进也会抑制AM真菌对植物根系的侵染,这与施氮量有关。刘媞等(2008)和卢彦琦等(2008)在非灭菌条件下接种AM真菌于黄芪和白术根系,菌根侵染率显著高于未接种植株,且随着施氮量的增加先增加,达到最高点时开始下降。本研究结果与之相同,说明在非灭菌或灭菌条件下适量施入氮肥均可使菌根菌发挥最大的有益效应,低氮会使AM真菌所需营养不足,而高氮则会抑制孢子萌发,菌丝生长受到抑制,AM真菌也就无法有效的侵染(朱红惠等,2004)。
刘媞等(2008)在非灭菌条件下采用盆栽试验表明不同施氮水平下接种AM真菌能有效提高黄芪的SOD和CAT活性,在施氮量为50~100 mg·kg-1时效果最好。卢彦琦等(2008)也认为非灭菌条件下接种GM后在施氮量为0.3~0.45 g·kg-1时白术SOD和CAT活性最强。本试验是在灭菌条件下对刺槐接种GM和GC,其SOD和CAT活性变化规律也得出与前人相同的结果,但在施氮量为0.4 g·kg-1时生长最好,可能是由于宿主不同的缘故。江龙等(2008)利用漂浮育苗技术研究表明,接种AM真菌显著增加了根系NR活性,本试验在不同施氮水平下接种AM真菌后,刺槐NR活性也显著增加,说明AM真菌能有效提高植物对土壤中氮素的吸收能力。
AM真菌的菌根效应取决于真菌、宿主、土壤生态条件、真菌与宿主之间的协调性等,其中真菌的因素尤为重要(Johnson et al., 1997)。同一种AM真菌的不同菌株,甚至同一菌株的不同生态小种或地缘小种在功能上都可能表现出较大差异(江龙等,2008)。在本项试验中,GM和GC都能侵染刺槐植株,但表现出的菌根效应却差别很大。刘文科等(2006)认为:宿主生长环境与菌种分离地环境的生态条件越接近,AM真菌的菌根效应越明显。所以,在不同施氮水平下培育菌根化刺槐时,应充分考虑菌种分离地的环境条件,最好就地分离和筛选出适宜的优良菌株。
杜小刚, 唐明, 陈辉, 等. 2008. 黄土高原不同树龄刺槐丛枝菌根与根际微生物的群落多样性[J]. 林业科学, 44(4): 78-82. DOI:10.11707/j.1001-7488.20080414 |
弓明钦, 陈应龙, 仲崇禄. 1997. 菌根研究及应用[M]. 北京: 中国林业出版社: 51-60.
|
郝建军, 康宗利, 于洋. 2007. 植物生理学实验技术[M]. 北京: 化学工业出版社.
|
郝再彬, 苍晶, 徐仲. 2004. 植物生理实验[M]. 哈尔滨: 哈尔滨工业大学出版社: 31-33.
|
贺学礼, 王东雪, 赵丽莉. 2006. AM真菌和施氮量对烟叶生长和部分矿质元素含量的影响[J]. 核农学报, 20(2): 154-158. |
江龙, 李竹玫, 黄建国, 等. 2008. AM真菌对烟苗生长及某些生理指标的影响[J]. 植物营养与肥料学报, 14(1): 156-161. |
刘媞, 贺学礼, 路丹. 2008. 施N量和AM真菌对黄芪生长和生理学特性的影响[J]. 河北农业大学学报, 31(3): 37-41. |
刘文科, 冯固, 李晓林. 2006. 三种土壤上六种丛枝菌根真菌生长特征和接种效应[J]. 植物营养与肥料学报, 12(4): 530-536. DOI:10.11674/zwyf.2006.0412 |
卢彦琦, 贺学礼, 李丽珍. 2008. AM真菌与施氮量对白术叶片保护酶的影响[J]. 湖北农业科学, 47(6): 659-660. |
王倡宪, 秦岭, 冯固, 等. 2003. 三种丛枝菌根真菌对黄瓜幼苗生长的影响[J]. 农业环境科学学报, 22(3): 301-303. |
徐辉, 唐明, 高瑞霞, 等. 2008. 土壤因子对府谷清水川流域砒砂岩区刺槐和沙棘AMF的影响[J]. 西北植物学报, 28(12): 2500-2505. DOI:10.3321/j.issn:1000-4025.2008.12.022 |
许学明, 岳凤荣. 1997. VA菌根真菌纯系增殖培养方法研究初报[J]. 山东农业大学学报, 28(4): 447-452. |
朱红惠, 姚青, 龙良坤, 等. 2004. 不同氮形态对AM真菌孢子萌发和菌丝生长的影响[J]. 菌物学报, 23(4): 590-595. |
Ames R N, Porter L K, John T V. 1984. Nitrogen sources and 'A' values for vesicular-arbuscular and non-mycorrhizal sorghum growth at three rates of 15N-ammonium sulphate[J]. New Phytologist, 97(2): 269-276. DOI:10.1111/nph.1984.97.issue-2 |
Gupta M L, Prasad A, Ram M, et al. 2002. Effect of the vesicular-arbuscular mycorrhizal(VAM)fungus Glomus fasciculatum on the essential oil yield related characters and nutrient acquisition in the crops of different cultivars of menthol mint(Mentha arvensis)under field conditions[J]. Bioresource Technology, 81(1): 71-79. DOI:10.1016/S0960-8524(01)00058-X |
Johnson N C, Graham J H, Smith F A. 1997. Function of mycorrhizal associations along the mutualism-parasitism continuum[J]. New Phytol, 135(4): 575-586. DOI:10.1046/j.1469-8137.1997.00729.x |
Koide R T, Mosse B. 2004. A history of research on arbuscular mycorrhizal[J]. Mycorrhiza, 14(3): 145-163. DOI:10.1007/s00572-004-0307-4 |
Oliveira R S, Vosátka M, Dodd J C, et al. 2005. Studies on the diversity of arbuscular mycorrhizal fungi and the efficacy of two native isolates in a highly alkaline anthropogenic sediment[J]. Mycorrhiza, 16(1): 23-31. DOI:10.1007/s00572-005-0010-0 |
Phillips J M, Hayman D S. 1970. Improved procedures for clearing and staining parasitic and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 55: 158-161. DOI:10.1016/S0007-1536(70)80110-3 |
 2011, Vol. 47
2011, Vol. 47