文章信息
- 李辛雷, 李纪元, 范正琪
- Li Xinlei, Li Jiyuan, Fan Zhengqi
- 杜鹃红山茶花色色素提取及其性质
- Extraction and Characterization of the Flower Pigment of Camellia azalea
- 林业科学, 2011, 47(1): 79-84.
- Scientia Silvae Sinicae, 2011, 47(1): 79-84.
-
文章历史
- 收稿日期:2009-07-07
- 修回日期:2009-08-30
-
作者相关文章
我国是山茶属(Camellia)植物的分布中心,种质资源丰富(张宏达等,1998)。山茶花瓣中含有丰富的维生素、氨基酸及微量元素等营养物质,其可食性和药用性早已为民间或资料所证实(李斌等,2000)。山茶的花色主要为白色、粉色、红色、深红、紫红等(高继银等,1998),其花红色色素的成分为花色素及其苷,可开发天然色素(坂田祐介,2004)。山茶属植物杜鹃红山茶(C.azalea)花深红色,在适宜的栽培条件下,一年四季都可以开花(高继银等,2005),是开发山茶天然色素的良好材料,但目前关于其花色色素开发利用的研究尚未见相关报道。本试验对杜鹃红山茶花色色素的提取条件及其理化性质进行研究,以期为其花色色素的开发利用提供一定的理论依据。
1 材料与方法 1.1 试验材料试验材料为杜鹃红山茶花瓣,取自中国林业科学研究院亚热带林业研究所山茶种质园。取杜鹃红山茶盛开期花瓣,洗净擦干后保存于-20 ℃冰箱中备用。
1.2 试验方法 1.2.1 杜鹃红山茶花色色素提取取5份-20 ℃冰箱中保存的杜鹃红山茶花瓣,每份2.0 g,研磨后按一定比例(质量:体积)加入提取剂,水浴锅内浸提一定时间,冷却后过滤,得红色澄清透明液体。各浸提液分别以相应提取剂作参比,适当稀释后,用上海光谱仪器有限公司的SP-755 PC紫外可见分光光度计在460~600 nm波长范围内扫描(坂田祐介,2004),比较其最大吸收波长(λvis max)和最大吸收波长处的吸光度值(Aλvis max)(赵昶灵等,2004a)。
1.2.2 杜鹃红山茶花色色素性质提取杜鹃红山茶花色色素在4 ℃、黑暗中冷藏备用。浸提液用提取剂适当稀释后,在紫外可见分光光度计460~600 nm波长范围内扫描,其吸收峰为520 nm。检测不同温度、光照下520 nm波长处的最大吸光度值,观察溶液颜色。
浸提液用纯净水适当稀释后加入具塞试管,调节pH 0~9.0,黑暗中静止2 h,在460~600 nm波长范围内扫描,检测最大吸收波长和最大吸收波长处的吸光度值,观察溶液颜色。
浸提液用纯净水适当稀释后,用紫外可见分光光度计在460~600 nm波长范围内扫描,其吸收峰为515 nm。取适量浸提液于具塞试管,分别加入不同浓度的金属离子、氧化剂、还原剂、螯合剂和常用食品添加剂等溶液,混匀后在黑暗中反应2 h,检测515 nm波长处的吸光度值,观察溶液颜色。
2 结果与分析 2.1 杜鹃红山茶花色色素的提取 2.1.1 提取溶剂对花色色素提取的影响杜鹃红山茶花瓣研磨后以料液比1:10分别加入纯净水、乙醇、甲醇、丙酮和甲酸乙酯的纯浸提溶剂,在pH 4.0,50 ℃条件下浸提1 h,浸提液过滤后适当稀释,紫外可见分光光度计扫描结果见图 1。各浸提液最大吸收波长范围分别为乙醇540~545 nm,甲醇530~535 nm,丙酮、甲酸乙酯525~530 nm,纯净水510~520 nm; 比较各浸提液的最大吸光度值,乙醇的提取效果最好,其次为甲醇和纯净水,而丙酮和甲酸乙脂的提取效果较差,因此选择提取效果较好、较经济且无毒的乙醇作为最佳浸提溶剂。
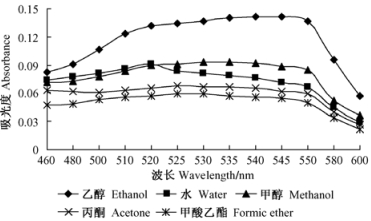
|
图 1 浸提溶剂对色素提取的影响 Figure 1 Effect of extractant on extraction of the pigment |
杜鹃红山茶花瓣研磨后以料液比1:10分别加入浓度为20%, 40%, 60%, 80%和99.7%的乙醇,在pH 4.0, 50 ℃条件下浸提1 h,浸提液过滤稀释后扫描结果见图 2。随乙醇浓度增加,浸提液最大吸收波长范围逐渐升高; 40%乙醇的浸提液最大吸光度值最高,提取效果最好,其次为20%和60%乙醇,80%和99.7%乙醇的提取效果稍差。
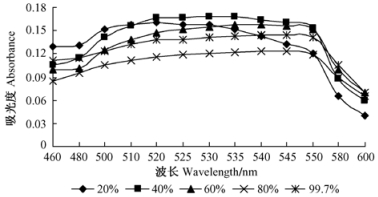
|
图 2 乙醇浓度对色素提取的影响 Figure 2 Effect of ethanol content on extraction of the pigment |
杜鹃红山茶花瓣研磨后以料液比1:10加入40%乙醇,在pH 4.0, 50 ℃时分别浸提0.25, 0.5, 1, 2和4 h,浸提液过滤稀释后扫描结果见图 3。浸提不同时间后浸提液最大吸光度值的波长范围基本上均介于530~535 nm; 比较各浸提液的最大吸光度值,浸提效果0.5 h>1 h>2 h>4 h>0.25 h。

|
图 3 浸提时间对色素提取的影响 Figure 3 Effect of extracted time on extraction of the pigment |
杜鹃红山茶花瓣研磨后以料液比1:10加入40%乙醇,pH 4.0,30, 40, 50, 60和80 ℃时分别浸提0.5 h,浸提液过滤稀释后扫描结果见图 4。不同温度下浸提0.5 h后浸提液最大吸光度值的波长范围基本上均介于530~535 nm; 比较各浸提液的最大吸光度值,浸提效果40 ℃>50 ℃>60 ℃>30 ℃>80 ℃。
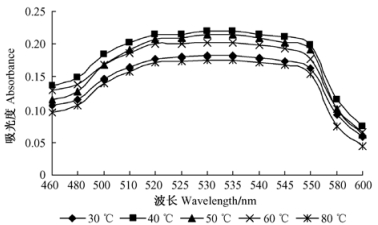
|
图 4 浸提温度对色素提取的影响 Figure 4 Effect of extracted temperature on extraction of the pigment |
杜鹃红山茶花瓣研磨后分别以料液比1:5, 1:10, 1:20, 1:30和1:40[质量:体积(g·mL-1)]加入40%乙醇,在pH 4.0, 40 ℃时浸提0.5 h,浸提液过滤稀释后扫描结果见图 5。料液比1:5时,浸提液最大吸光度值的波长范围在530~535 nm,其余料液比最大吸光度值的波长范围在535~540 nm处; 随料液比增大,各提取液的最大吸光度值逐渐降低,最佳料液比为1:5。
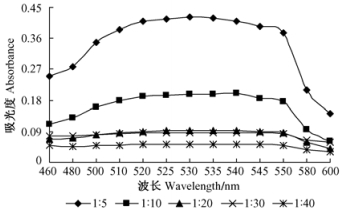
|
图 5 料液比对色素提取的影响 Figure 5 Effect of solid-liquid ratio on extraction of the pigment |
杜鹃红山茶花瓣研磨后以1:5的料液比加入40%乙醇,pH分别调节为2.0, 4.0, 6.0, 8.0和10.0,40 ℃浸提0.5 h,浸提液过滤稀释后扫描结果见图 6。pH 2.0时,浸提液最大吸光度值的波长范围在525~530 nm; pH 4.0时,最大吸光度值的波长范围为530~535 nm; pH 6.0, 8.0和10.0时,浸提液吸光度值随波长增加而降低,吸收峰消失。可见,杜鹃红山茶花色色素在强酸性范围内浸提效果较好,而碱性及弱酸性范围内浸提效果较差。
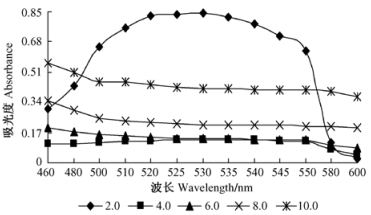
|
图 6 pH值对色素提取的影响 Figure 6 Effect of pH on extraction of the pigment |
通过单因素试验,初步确定影响杜鹃红山茶花色色素提取条件的各因素。考虑到各因素间可能存在互作,本试验以乙醇作为提取剂,用料液比(1:5, 1:10, 1:20, 1:30)、乙醇浓度(20%, 40%, 60%, 80%)、浸提温度(30 ℃, 40 ℃, 50 ℃, 60 ℃)和浸提时间(0.5 h, 1 h, 2 h, 4 h),进行5因素(包括1个空白列)4水平的正交试验,综合考虑各因素的影响,优化提取条件。正交试验结果见表 1,由极差(R)值可知,这4个因素的影响大小依次为:料液比>乙醇浓度>温度>时间; 最佳组合为正交设计中的第1个组合,即以20%的乙醇为提取溶剂,料液比1:5,30 ℃浸提1 h的提取效果最好。
|
|
不同温度下,随时间延长花色色素最大吸光度值的变化见图 7。15 ℃对花色色素影响不大; 但当温度达30 ℃以上时,A520即随处理时间延长而大幅下降,并且温度越高、处理时间越长,A520下降越明显,色素的红色越淡。说明杜鹃红山茶花色色素耐热性较差,这可能由于高温导致花色苷降解,生成无色的查尔酮(蒋新龙,2006)。
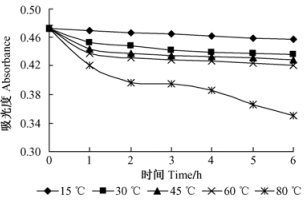
|
图 7 温度对色素稳定性的影响 Figure 7 Effect of temperature on the stability of the pigment |
不同光照下,随时间延长花色色素最大吸光度值的变化见图 8。日光、紫外光、日光灯光和室内自然光均导致花色色素不同程度降解,表现为红色变淡、A520持续下降。其中,日光的作用最强烈,表现较为明显,其次分别为为紫外光、日光灯光、室内自然光。说明杜鹃红山茶花色色素对光敏感,具光稳定性差的特点。
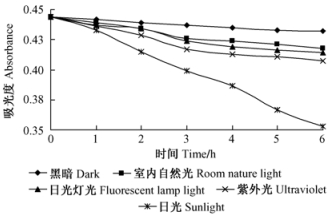
|
图 8 光照对色素稳定性的影响 Figure 8 Effect of light on the stability of the pigment |
不同pH对花色色素最大吸光度值及颜色的影响见表 2。pH 0~5.0时,最大吸收波长为515 nm,pH>6.0时吸收峰消失; A515在pH1.0时达最高,pH>1.0后随pH增高A515降低。pH 0.0~3.0时呈红色,pH 4.0~5.0时红色变淡,pH>6.0时逐渐显黑色。可见,杜鹃红山茶花色色素在低pH时较稳定,在pH为微酸近中性时变色。
|
|
氧化剂H2O2、还原剂Na2SO3对花色色素最大吸光度值的影响见图 9。随氧化剂H2O2体积分数增大,A515逐渐降低,花色色素颜色逐渐变淡,体积分数达1%时,花色色素由红色变为无色。还原剂Na2SO3影响色素稳定性,浓度为0.031 25%时A515即迅速下降,0.125%时色素变为无色,但浓度大于0.25%时,A515逐渐升高,色素呈现橙黄色,且浓度越高,橙黄色越浓。可见,杜鹃红山茶花色色素抗氧化、还原能力较差。
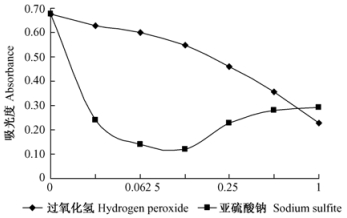
|
图 9 氧化剂、还原剂对色素稳定性的影响 Figure 9 Effect of oxidant, reductant on the stability of the pigment |
螯合剂EDTA、防腐剂苯甲酸钠对花色色素最大吸光度值的影响见图 10。随螯合剂EDTA体积分数增大,A515逐渐降低,花色色素红色逐渐变淡。苯甲酸钠体积分数增大时,A515逐渐降低,花色色素红色逐渐变淡,但浓度大于0.5%时,色素颜色由淡红色变为暗橙色,且浓度越高,颜色越深,而A515逐渐升高。可见,杜鹃红山茶花色色素对螯合剂、苯甲酸钠敏感。
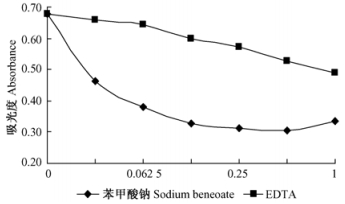
|
图 10 苯甲酸钠、EDTA对色素稳定性的影响 Figure 10 Effect of sodium beneoate, EDTA on the stability of the pigment |
葡萄糖、蔗糖及食盐对花色色素最大吸光度值的影响见图 11。杜鹃红山茶花色色素在葡萄糖、蔗糖溶液中均呈红色,随浓度增大,二者A515变化不大,颜色无明显差异。食盐浓度升高导致A515明显迅速增大,红色加深,但浓度>2.5%时,A515不再大幅变化。可见,葡萄糖、蔗糖对花色色素影响不大,而食盐引起其色泽加深。
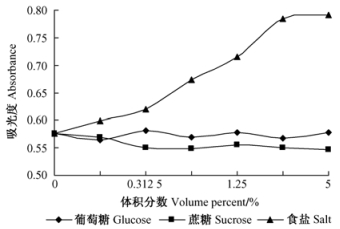
|
图 11 葡萄糖、蔗糖及食盐对色素稳定性的影响 Figure 11 Effect of glucose, sucrose, NaCl on the stability of the pigment |
食品中常用添加物柠檬酸、维生素C对花色色素最大吸光度值的影响见图 12。柠檬酸、维生素C均可使花色色素保持红色,随浓度(体积分数)升高,A515迅速增大,红色加深,且柠檬酸效果比维生素C明显。
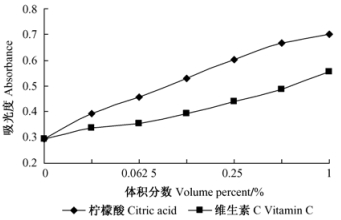
|
图 12 柠檬酸、维生素对色素稳定性的影响 Figure 12 Effect of citric acid and Vc on the stability of the pigment |
金属离子Co2+, Cu2+, Mg2+, Ca2+, Zn2+, Mn2+, K+等均可使杜鹃红山茶花色色素呈现红色,离子浓度越高,红色越深,A515越大; Al3+, Sn2+均使色素呈紫色,且离子浓度越高,紫色越深,A515越大(表 3)。低浓度Fe2+, Fe3+(3.125×10-4 mol·L-1)即使色素产生褐色沉淀; Pb2+在低浓度时色素呈红色,浓度达3.125×10-4 mol·L-1时色素呈暗绿色,12.50×10-4 mol·L-1时色素呈现蓝绿色,并出现混浊。可见,杜鹃红山茶花色色素随金属离子及其浓度的不同而呈现不同颜色,Fe2+, Fe3+, Pb2+影响杜鹃红山茶花色色素稳定性。
|
|
植物红色素主要有类胡萝卜素和花青素,类胡萝卜素为脂溶性色素,难溶于水和酒精,而花青素是水溶性色素,易溶于水和酸性溶液(吴龙奇等,2004)。杜鹃红山茶花色色素呈现红色,易溶于酸性醇溶液或酸性水溶液等极性溶剂中,难溶于丙酮和甲酸乙酯等有机溶剂,且在酸性和中性条件下的最大吸收波长介于510~545 nm之间,在花青素特征峰变动范围(Holton et al., 1995),与已有山茶属花色色素的研究一致(坂田祐介,2004; 蒋新龙,2006)。说明杜鹃红山茶的花色色素属于花青素,红色存在由于花色素及其苷(坂田祐介,2004; Sakata et al., 1992)。
不同种类的花青素具特定吸收峰,该吸收峰在不同的介质、环境中可能位移(吴龙奇等,2004)。杜鹃红山茶花色色素在不同提取剂、料液比时,其最大吸收峰所处的波长位置及偏移范围与花青素的光谱特征相符(Holton et al., 1995)。不同pH引起植物色素吸光度变化,可能由于花色素及其苷结构被破坏,当然这种变化具有可逆性(Waterhouse,2002)。浸提温度、时间对杜鹃红山茶花色色素最大吸收波长范围无影响,但低温或短时间及高温或长时间均导致色素吸光度值偏小,可能由于低温或短时间时,色素浸提不完全,而高温或长时间时,部分色素分解(Waterhouse,2002),从而其吸光度降低。
花色色素提取条件的研究有单因素试验(江丽芳等,2004; 蒋新龙,2006)、正交设计试验(唐克华等,2005)。本研究在单因素试验的基础上进行了正交设计试验,综合分析各因素对杜鹃红山茶花色色素提取的影响。试验结果表明:杜鹃红山茶花色色素的提取工艺以20%的乙醇为浸提溶剂、料液比1:5、30 ℃浸提1 h的提取效果最好,该结果与单因素试验不完全相符,说明各因素间存在互作,具体原因有待于进一步研究。
植物花色色素的性质受温度、光照、pH、氧化剂、还原剂及食品添加剂等影响(赵昶灵等,2004b; 毕见洲等,2007; Mazza et al., 1990; 党蕊叶等,2004; Sarma et al1997),但不同的花色色素变化不尽一致(彭子模等,1999; 金波等,1994; Weiss et al., 1992),可能在于植物中花青素种类、结构不同(于晓南等,2002; 白新祥等,2006),从而表现出不同性质。本试验中金属离子Co2+等对杜鹃红山茶花色色素有一定的增色效果,而Fe2+, Fe3+, Pb2+引起色素变色且出现沉淀,主要由于Fe2+等离子与花色色素形成金属络合物的原故(Kondo et al., 1992)。
杜鹃红山茶花色深红,适宜条件下一年四季开花。其花色色素提取容易,色泽自然鲜艳,水溶性好,常用食品添加剂葡萄糖、蔗糖对其无明显影响,食盐、柠檬酸等具增色作用。因此,杜鹃红山茶花色色素有望广泛用于食品、饮料等的着色。
白新祥, 胡可, 戴思兰, 等. 2006. 不同花色菊花品种花色素成分的初步分析[J]. 北京林业大学学报, 28(5): 84-89. |
坂田祐介. 2004. 植物色素研究法[M]. 日本: 大阪公立大学共同出版会.
|
毕见洲, 王长泉. 2007. 一品红花色素抗氧化性能的研究[J]. 西北植物学报, 27(3): 0521-0525. |
党蕊叶, 权清转, 王开锋. 2004. 矮牵牛花红色素的研究[J]. 西北植物学报, 24(11): 2150-2153. DOI:10.3321/j.issn:1000-4025.2004.11.034 |
高继银, ParksC R, 杜跃强. 2005. 山茶属植物主要原种彩色图集[M]. 杭州: 浙江科学技术出版社.
|
高继银, 陈绍云, 徐碧玉. 1998. 世界名贵茶花[M]. 杭州: 浙江科学技术出版社.
|
江丽芳, 刘代城. 2004. 杜鹃花色素的提取及稳定性研究[J]. 闽江学院学报, 25(2): 80-82. |
蒋新龙. 2006. 山茶花红色素的提取及其性质初探[J]. 园艺学报, 33(2): 344-348. |
金波, 东惠茹. 1994. 一品红花色的探讨[J]. 园艺学报, 21(1): 87-90. |
李斌, 罗永明. 2000. 山茶属植物化学成分及生物活性研究[J]. 江西中医学院学报, 12(1): 44-47. |
彭子模, 惠寿年, 李进, 等. 1999. 玫瑰花红色素及其稳定性研究[J]. 西北植物学报, 19(2): 349-353. |
唐克华, 于华忠, 龚剑, 等. 2005. 红继木花色素的微波提取与特性研究[J]. 西北植物学报, 25(3): 568-574. |
吴龙奇, 朱文学, 易军鹏, 等. 2005. 牡丹花红色素类型判定及提取工艺试验[J]. 农业机械学报, 36(10): 77-80. |
于晓南, 张启翔. 2002. 观赏植物的花色素苷与花色[J]. 林业科学, 38(3): 147-153. DOI:10.11707/j.1001-7488.20020326 |
张宏达, 任善湘. 1998. 山茶亚科, 中国植物志. 49卷3分册. 北京: 科学出版社.
|
赵昶灵, 陈俊愉, 刘雪兰, 等. 2004a. 理化因素对梅花'南京红须'花色色素颜色呈现的效应[J]. 南京林业大学学报, 28(2): 27-32. |
赵昶灵, 郭维明, 陈俊愉. 2004b. 理化因子导致梅花'南京红'花色色素的颜色变化[J]. 广西植物, 24(5): 471-477. |
Holton T A, Cornish E C. 1995. Genetics and biochemistry of anthocyanins biosynthesis[J]. Plant Cell, 7(7): 1071-1083. DOI:10.1105/tpc.7.7.1071 |
Kondo T, Yoshida K, Nakagewa T, et al. 1992. Structural basis of blue-color development in flower petals from Commelina communis[J]. Nature, 358: 515-518. DOI:10.1038/358515a0 |
Mazza G, Brouillard R. 1990. The mechanism of co-pigmentation of anthocyanins in equeous solutions[J]. Phytochemistry, 29(4): 1097-1102. DOI:10.1016/0031-9422(90)85411-8 |
Sakata Y, Arisumi K. 1992. Anthocyanins in Camellia polyodonta How, C. semiserrata Chi and C. chekiangoleosa Hu, and their phylogenic positions in section Camellia based on the pigmentation[J]. Japan Soc Hort Sci, 61(2): 375-381. DOI:10.2503/jjshs.61.375 |
Sarma A D, Sreelakshmi Y, Sharma R. 1997. Antioxidant ability of anthocyanins against ascorbic acid oxidation[J]. Phytochemistry, 45(4): 671-674. DOI:10.1016/S0031-9422(97)00057-5 |
Waterhouse A L. 2002. Wine phenolics[J]. Annals of the New York Academy of Sciences, 957(4): 21-36. |
Weiss D, Van Blokland R, Kooter J M, et al. 1992. Gibberellic acid regulates chalcone synthase gene transcription in the corolla of Petunia hybrida[J]. Plant Physiol, 98(1): 191-197. DOI:10.1104/pp.98.1.191 |
 2011, Vol. 47
2011, Vol. 47