文章信息
- 郭红彦, 彭方仁, 吴青霞, 白晋华
- Guo Hongyan, Peng Fangren, Wu Qingxia, Bai Jinhua
- 银杏枝条营养贮藏蛋白质的免疫细胞化学鉴定
- Immunocytochemical Identification of Vegetative Storage Proteins in the Branch of Ginkgo biloba
- 林业科学, 2011, 47(1): 68-72.
- Scientia Silvae Sinicae, 2011, 47(1): 68-72.
-
文章历史
- 收稿日期:2009-11-26
- 修回日期:2010-01-05
-
作者相关文章
2. 南京林业大学森林资源与环境学院 南京 210037
2. College of Forest Resources and Environment, Nanjing Forestry University Nanjing 210037
营养器官中的季节性氮素贮藏是树木氮代谢的显著特征,在树木的生长发育及对逆境的反应方面起重要作用(田维敏等,2003; Tian et al., 2002; 2003)。20世纪80年代中期以来,在温带和热带硬材树木的营养器官中发现一类专门的贮藏蛋白质,称为营养贮藏蛋白质(vegetative storage proteins, VSPs)(Stepien et al., 1994)。有关木本植物VSPs的分类和定位、生化特性、生理功能、合成与降解机制、基因表达与调控等方面进行过系统而深入的研究,积累了丰富的资料(彭方仁等,2001; 田维敏等,1999; 2002;郭红彦等,2006)。对营养贮藏蛋白质季节变化已有研究报道,充分肯定了营养贮藏蛋白质的氮素贮藏功能(彭方仁等,2006; 田维敏等,2002; 郭红彦等,2009)。有研究发现无患子科(Sapindaceae)树种荔枝(Litchi chinensis)和无患子(Sapindus mukorossi)的营养贮藏蛋白质是一种有活性的胰蛋白酶抑制剂(Tian et al., 2007; Liu et al., 2009),营养贮藏蛋白质可能还有某些特殊的生物学功能。这些研究表明树木VSPs的细胞学和生物化学性质具有多样性。银杏(Ginkgo biloba)为落叶乔木,是现存种子植物中最古老的孑遗植物,是我国重要的经济林树种。有关银杏营养贮藏蛋白质的组成成分和细胞学已进行了相关报道,研究发现银杏中存在有季节变化的32和36 ku蛋白质(郭红彦等,2007; 2009;吴青霞等,2006)。本文对银杏枝条中的这2种蛋白质进行免疫组织细胞化学定位,旨在鉴定其营养贮藏蛋白质性质,为进一步研究研究银杏营养贮藏蛋白质的生物化学性质和生物学功能打下良好基础。
1 材料与方法 1.1 试验材料选自南京林业大学树木园内成年银杏雄株的当年生枝条,在树木休眠期12月中旬采样,重复3次。
1.2 试验方法 1.2.1 银杏32和36 ku蛋白质抗原分离、纯化和回收银杏营养贮藏蛋白质干粉制备采用郭红彦等(2007;2009) 方法。用制备性SDS-PAGE分离银杏32和36 ku蛋白质,上样量1 600 μg,浓缩胶浓度4.4%,分离胶浓度是15%,在80 V,30 min; 300 V,3.5 h的电泳条件下分离银杏32和36 ku蛋白质。电泳结束,剥取凝胶,移入17 cm培养皿内,用冰冷的0.25 mol·L-1 KC1显色5~6 min。在黑色背景和透射的日光灯上观察并切下目标谱带,分别取银杏32和36 ku蛋白质的小块胶带(胶带长度和上样槽的宽度一致),放入凝胶的上样槽中,再次进行SDS-PAGE。用0.25%考马斯亮蓝R-250染色2.5 h,脱色至背景干净为止以鉴定抗原的纯度。经BIO-RAD Quantity one软件分析,如果在凝胶上32和36 ku相应位置仅出现1条谱带,则可以用作免疫的抗原(Tian et al., 2002; 郭红彦,2007)。
1.2.2 银杏32和36 ku蛋白质抗血清制备将切下的32和36 ku蛋白质胶带分别在液氮下充分研磨。用Ball(1986)的方法测定胶粉中蛋白质(抗原)含量。胶粉中抗原含量约180 μg·g-1。将胶粉(约含250 μg抗原)溶解在0.9%的生理盐水中,与弗氏完全佐剂(加强注射用弗氏不完全佐剂)按1:1的比例充分乳化,在适龄新西兰大白兔(购于江苏省农科院种兔中心)皮下多点注射免疫,每点0.1 mL。每只注射体积为2 mL。其中2只注射32 ku蛋白质,另2只注射36 ku蛋白质,1只作为对照。第1次注射15天后加强注射一次,注射抗原量为第1次的1/5;7天后第2次加强注射; 7天自耳静脉采血2 mL,用双向琼脂扩散试验进行抗血清效价的测定,接着第4次注射(直接用0.9%生理盐水溶解抗原),10天后从心脏采血。37 ℃下倾斜静置1 h后,于4 ℃冰箱中放置2 h。然后室温,4 000 r·min-1条件下离心10 min,收集抗血清(Tian et al., 2002; 吕建敏等,2004)。二抗为辣根过氧化物酶偶联的羊抗兔IgG-HRP制剂(购于博士德生物工程有限公司)。对照组不加一抗,直接在对照组血清中加二抗孵育。
1.2.3 银杏32和36 ku蛋白质的间接免疫组织细胞化学定位1) 将当年生枝条末端小枝,切成0.5~1 cm的小块。标本用FAA (50%乙醇)溶液室温固定24 h或含6%戊二醛的0.1 mol·L-1磷酸盐缓冲液(pH 7.2) 4 ℃下固定24 h,乙醇/正丁醇系列脱水,石蜡包埋,切片厚度20 μm。2) 脱蜡前,将切片在室温中放置60 min或60 ℃恒温箱中烘烤20 min。用二甲苯脱蜡30 min,各梯度酒精(100%, 95%, 85%, 70%, 50%, 30%, 0) 依次脱蜡脱水5 min左右。3) 将切片放入3% H2O2中10 min,蒸馏水冲洗3次(每次2 min),转移至0.01 mol·L-1柠檬酸盐缓冲液(pH 6.0,1 000 mL)中10~15 min(缓冲液温度保持在92~98 ℃之间),之后冷却10~20 min至室温,将切片用蒸馏水冲洗2次,再用TBS(pH7.5) 溶液冲洗3次(每次5 min)。4) 将切片放入TBS(含0.1 mol·L-1 NH4Cl)溶液中1 h,用TBS(含0.2%Tween20) 溶液冲洗3次(每次5 min),再用TBS(含10 mmol·L-1甘氨酸)溶液浸洗3次(每次5 min),之后浸入TBS(含5%脱脂奶粉和10 mmol·L-1甘氨酸)溶液中,室温1 h,转移至以TBS(含0.02%Tween20、5%脱脂奶粉和10 mmol·L-1甘氨酸)稀释的一抗中(1:100),室温孵育1 h(或4 ℃孵育过夜),用TBS(含0.02%Tween20、5%脱脂奶粉和10 mmol·L-1甘氨酸)溶液浸洗3次(每次5 min),与以TBS(含0.02%Tween20、5%脱脂奶粉和10 mmol·L-1甘氨酸)稀释的辣根过氧化物酶偶联的羊抗兔二抗室温作用1 h,用TBST清洗2次(每次5 min),用TBS清洗2次(每次5 min),最后加DAB-H2O2显色液显色3~5 min,蒸馏水冲洗,过夜晾干,白胶封片,用于观察。阴性对照以免疫前新西兰白兔血清取代一抗,其余步骤与试验组相同。
2 结果与分析 2.1 银杏32和36 ku蛋白质抗原的制备采用制备型SDS-PAGE制备抗原,蛋白质上样量很关键。上样过少,制备的抗原量少,浓度小,达不到注射抗原量的要求; 上样量过多,银杏32和36 ku蛋白质谱带之间有重叠部分(图 1-1),不利于针对性地切取目标谱带,这样制备得到的抗原纯度不够。只有确定适宜的上样量,经SDS-PAGE才能得到浓度大又易区分的蛋白质抗原。研究结果表明:银杏营养贮藏蛋白质的上样量为1 600 μL时,经考马斯亮蓝R-250染色后,银杏32和36 ku蛋白质谱带清晰(图 1-2),经KCl染色后,在黑色背景和透射的日光灯上能明显观察到清晰的2条谱带,便于切取目的胶条。
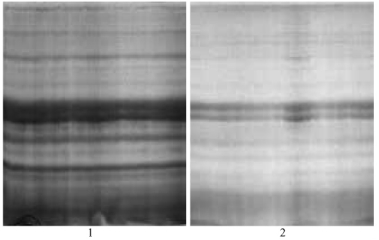
|
图 1 银杏32和36 ku蛋白质上样量 Figure 1 Sampling volume of 32 and 36 ku protein in G. biloba by preparative electrophoresis 1.上样量为2 000 μL Sampling volume of 2 000 μL; 2.上样量为1 600 μL Sampling volume of 1 600 μL. |
提取银杏树皮可溶性蛋白,进行SDS-PAGE,转至PVDF膜上,分别用这2种蛋白质的抗血清进行Western blot分析。结果表明:经免疫前新西兰白兔血清进行Western blot分析,未发现免疫相关谱带(对照组)(图 2-1)。36 ku蛋白质多克隆抗体与36 ku蛋白质发生强免疫反应,与32 ku蛋白质发生微弱免疫反应,免疫相关的蛋白质谱带有2条,36 ku蛋白质谱带清晰,染色深(图 2-2),而32 ku蛋白质谱带颜色很浅,说明36 ku蛋白质抗血清专一性强,适合进行细胞定位研究。

|
图 2 银杏32和36 ku蛋白质Western blot图谱 Figure 2 Western blot of 32 and 36 ku protein in G. biloba 1.用免疫前新西兰白兔血清进行Western blot Western blot of new Zealand white rabbit serum before immunization; 2-6.用36 ku蛋白质的抗血清进行Western blot Wester blot of 36 ku protein antiserum; 7-11.用32 ku蛋白质的抗血清进行Western blot Western blot of 32 ku protein antiserum. |
32 ku蛋白质多克隆抗体与32 ku蛋白质发生免疫反应,免疫相关的蛋白质谱带有2条,32 ku蛋白质谱带染色深,而36 ku蛋白质谱带颜色较浅(图 2-3),32 ku蛋白质抗血清专一性好,32和36 ku蛋白质具有一定的免疫相关性,适合进行细胞定位研究。
2.3 银杏32和36 ku蛋白质的间接免疫组织细胞化学定位采用间接免疫组织细胞化学定位技术对32和36 ku蛋白质在银杏当年生枝条细胞中的位置进行研究。结果表明:银杏当年生枝条加入36 ku蛋白质抗血清后,在一些皮层薄壁细胞和韧皮部的韧皮薄壁细胞中有被染成褐色的内含物(图 3-2),它们存在于这些细胞的小液泡里(图 3-3,4)。而不加36 ku蛋白质抗血清,加入免疫前新西兰白兔血清,再加辣根过氧化物酶偶联的羊抗兔二抗制剂的枝条细胞(对照组),相应亚细胞部位未见被染成褐色的内含物(图 3-1)。由此可见:银杏36 ku蛋白质定位于银杏枝条皮层薄壁细胞和韧皮部的韧皮薄壁细胞中,存在于这些细胞的小液泡里。
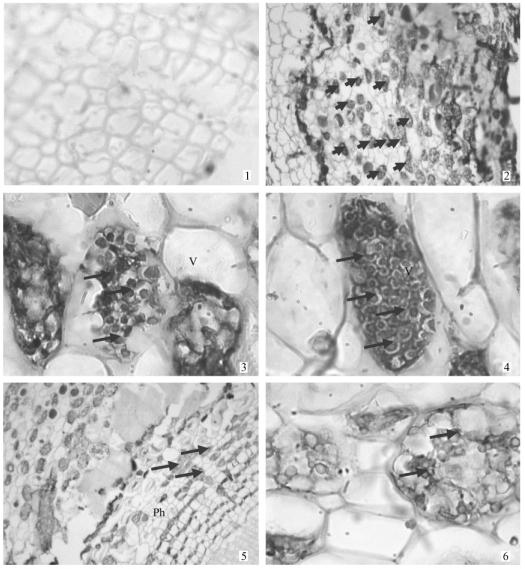
|
图 3 银杏枝条32和36 ku蛋白质的DAB-免疫光镜定位 Figure 3 Localization of 32 and 36 ku VSPs in branches of G. biloba by immuno-DAB by microscope 箭头示被染色成褐色的蛋白质Arrews indicate dyed brown proteins; 1.对照,×400 CK, ×400;2.36 ku蛋白质抗血清处理,×40 Treat with 36 ku protein antisetum, ×40;3, 4.36 ku营养贮藏蛋白质抗血清处理,×1 000 Treat with 36 ku protein antiserum, ×1 000k; 5. 32 ku蛋白质抗血清处理,×40 Treat with 32 ku protein antiserm, ×40;6.32 ku蛋白质抗血清处理,×1 000k Treat with 32 ku protein antiserum, ×1 000k;Ph:韧皮薄壁细胞Phloem parenchyma cell;V:液泡Vacuole. |
银杏当年生枝条加入32 ku蛋白质抗血清后,在一些皮层薄壁细胞和韧皮部的韧皮薄壁细胞中有被染成褐色的内含物(图 3-5),它们存在于这些细胞的小液泡里(图 3-6)。而不加32 ku蛋白质抗体,加入免疫前新西兰白兔血清,再加辣根过氧化物酶偶联的羊抗兔二抗制剂的枝条细胞(对照组),在皮层薄壁细胞和韧皮部的韧皮薄壁细胞中均未发现被染成褐色的内含物(图 3-1)。由此可见:银杏32 ku蛋白质定位于银杏枝条皮层薄壁细胞和韧皮部的韧皮薄壁细胞中,存在于这些细胞的小液泡里。
枝条皮层薄壁细胞和韧皮部的韧皮薄壁细胞中被染成褐色的内含物就是贮藏蛋白质细胞的液泡内含物。36 ku蛋白质抗血清处理的光镜切片,液泡内含物聚集在一起,被均一染色,枝条中36 ku蛋白质含量丰富(图 3-2,3,4);而32 ku蛋白质抗血清处理的光镜切片,褐色物质没有36 ku蛋白质分布致密,染色程度浅于36 ku蛋白质(图 3-5,6),结果表明:36 ku蛋白质比32 ku蛋白质在枝条中含量丰富。这一结果与SDS-PAGE图谱和细胞学观察结论一致(郭红彦等,2009)。
3 结论与讨论 3.1 银杏枝条32和36 ku蛋白质的免疫细胞化学鉴定一般认为树木营养贮藏蛋白质具有以下3个特点: 1) 积累在液泡中; 2) 在贮藏组织的可溶性蛋白质中相对含量高; 3) 有明显的季节变化,在休眠季节大量积累,在树木重新生长后消失(Clausen et al., 1991)。落叶期银杏枝条树皮和木质部中存在相对含量高的32和36 ku蛋白质,春季随着芽的萌发,积累在枝条中的这2种蛋白质明显消失(郭红彦等,2009); 本文采用间接免疫组织细胞化学定位技术,对这2种蛋白质进行细胞化学定位,32和36 ku蛋白质具有一定的免疫相关性,它们分布在一些皮层薄壁细胞和韧皮部的韧皮薄壁细胞中,存在于这些细胞的小液泡里。研究结果揭示这2种蛋白质的组织分布式样,并为这2种蛋白质是银杏的营养贮藏蛋白质提供有力证据。因此,这2种蛋白质应当是银杏的营养贮藏蛋白质。有研究者认为:40和45 ku蛋白质是银杏的营养贮藏蛋白质组分(Shim et al., 1985),但未经过免疫定位进行印证,这可能是与不同时期银杏不同的生长环境有关,因此40和45 ku蛋白质是否是银杏的营养贮藏蛋白质组分有待于进一步研究。
不少学者已对部分木本植物中发现的营养贮藏蛋白质进行免疫细胞化学定位(Herman et al., 1988; Greenwood et al., 1986; Wetzel et al., 1991; Clausen et al., 1991; Stepien et al., 1992)。但对银杏营养贮藏蛋白质进行免疫细胞化学定位尚属首例,这为其功能和生化性质的研究提供重要的依据。
3.2 银杏枝条32和36 ku蛋白质的合成部位有研究发现:银杏营养贮藏蛋白质在细胞质内合成,由内质网膨大的槽库、质膜内折或高尔基体小泡发育形成贮藏蛋白质的液泡,线粒体和高尔基体参与营养贮藏蛋白质的运输(Peng et al., 2004),本研究发现银杏32和36 ku蛋白质定位于皮层薄壁细胞和韧皮部的薄壁细胞,存在于这些细胞的液泡内,因此可以推断银杏32和36 ku蛋白质是在细胞内合成,在液泡内积累。
3.3 银杏枝条32和36 ku蛋白质的免疫相关性不同科的硬材树种之间,营养贮藏蛋白质缺乏免疫相关性。Wetzel等(1991)使用杨树32 ku蛋白质的抗血清检测6科11种温带硬材树种,结果表明:除杨柳科(Salicaceae)树木外,其他科树木的营养贮藏蛋白质与该32 ku蛋白质缺乏免疫相关性。陈月异等(2007)发现同属无患子科的荔枝和无患子的营养贮藏蛋白质存在免疫相关性,而不同科树木的营养贮藏蛋白质之间缺乏免疫相关性。在楝科(Meliaceae)树木中,同一亚科树木的营养贮藏蛋白质较不同亚科树木的营养贮藏蛋白质具有相对高的免疫相关性(田维敏等,2002)。同一属树木的营养贮藏蛋白质高度同源的证据来自对杨属植物加拿大杨(Populus ×canadoncis)和美洲黑杨(P.deltoids)的32 ku蛋白质的研究(Wetzel et al., 1991)。本文发现银杏32和36 ku蛋白质存在一定免疫相关性,这可能是由于同一种树种中两相邻分子质量蛋白质具有相似化学结构所致。另一方面,不同科的软材树种间的营养贮藏蛋白质是免疫相关的(Harms et al., 1991)。
陈月异, 史敏晶, 田维敏. 2007. 印度紫檀营养贮藏蛋白质的主要特性[J]. 林业科学, 43(9): 717-725. |
郭红彦, 郭彦青, 彭方仁. 2006. 木本植物营养贮藏蛋白质代谢机理的研究进展[J]. 南京林业大学学报, 30(4): 121-128. |
郭红彦, 谭鹏鹏, 吴青霞, 等. 2007. 银杏营养贮藏蛋白质的SDS-聚丙烯酰胺凝胶电泳研究[J]. 山西农业大学学报, 27(1): 16-20. |
郭红彦, 吴青霞, 彭方仁. 2009. 银杏枝条营养贮藏蛋白质的组分及动态变化[J]. 林业科学, 45(3): 24-28. DOI:10.11707/j.1001-7488.20090305 |
郭红彦. 2007. 银杏营养贮藏蛋白质的分离鉴定及特性研究. 101-102. http://www.cnki.com.cn/Article/CJFDTOTAL-ZNTB200612107.htm
|
吕建敏, 王德军, 徐剑钦, 等. 2004. 实验用兔的取血方法[J]. 中国养兔, (6): 30, 22-22. |
彭方仁, 王改萍, 郭娟. 2006. 银杏营养贮藏蛋白质的细胞学及生物化学分析[J]. 南京林业大学学报:自然科学版, 30(4): 109-113. |
彭方仁, 郭娟, 徐柏森. 2001. 木本植物营养贮藏蛋白质研究进展[J]. 植物学通报, 18(4): 445-450. |
田维敏, 吴继林, 郝秉中. 1999. 大叶桃花心木营养贮藏蛋白质的细胞学研究[J]. 热带作物学报, 20(4): 25-36. |
田维敏, 闫兴富, 胡正海. 2003. 杨树新梢积累营养贮藏蛋白质的细胞学研究[J]. 西北植物学报, 23(7): 1143-1147. |
田维敏, 吴继林. 2002. 楝科树木营养贮藏蛋白质的研究[J]. 植物学报, 44(2): 242-245. |
吴青霞, 樊莉丽, 彭方仁. 2006. 银杏营养贮藏蛋白质的细胞学研究[J]. 林业科技开发, 20(6): 19-22. |
Ball E H. 1986. Quantitation of proteins by elution of coomassie brilliant blue R from stained bands after sodium dodecyl sulfate-polyacrlamide gel electrophoresis[J]. Anal Biochem, 155: 23-27. DOI:10.1016/0003-2697(86)90218-6 |
Clausen S, Apel K. 1991. Seasonal changes in the concentration of the major storage protein and its mRNA in xylem ray cells of poplar trees[J]. Plant Mol Biol, 17: 669-678. DOI:10.1007/BF00037052 |
Greenwood J S, Stinissen H M, Peumans W J, et al. 1986. Sambucus nigra agglutinin is located in protein bodies in the phloem parenchyma of the bark[J]. Planta, 167: 275-278. DOI:10.1007/BF00391426 |
Harms U, Sauter J J. 1991. Storage proteins in the wood of Taxodiaceae and of Taxus[J]. J Plant Physiol, 138: 497-499. DOI:10.1016/S0176-1617(11)80530-4 |
Herman E M, Charles H N, Leland S M. 1988. Bark and leaf lectins of Sophora japonica are sequestered in protein-storage vacuoles[J]. Plant Physiol, 86: 1027-1031. DOI:10.1104/pp.86.4.1027 |
Liu S B, Wang X C, Shi M J, et al. 2009. Vegetative storage protein with trypsin inhibitor activity occurs in Sapindus mukorassi, a Sapindaceae Deciduous Tree[J]. Journal of Integrative Plant Biology, 51(4): 352-359. DOI:10.1111/jipb.2009.51.issue-4 |
Peng F R, Guo J, Wan G P. 2004. Subcellular localization of vegetative storage protein of Ginkgo biloba[J]. Acta Botanica Sinica, 46(1): 77-85. |
Shim K K, Titus J S. 1985. Accumulation and mobilization of storage proteins in Ginkgo shoot bark[J]. J Kor Soc Hortic Sci, 26: 350-360. |
Stepien V, Martin F. 1992. Purification, characterization and localization of the bark storage proteins of poplar[J]. Plant Physiol Biochem, 30: 399-407. |
Stepien V, Sauter J J, Martin F. 1994. Vegetative storage proteins in woody plants[J]. Plant Physiol Biocem, 32: 185-192. |
Tian W M, Peng S Q, Wang X C, et al. 2007. Vegetative storage protein in Litchi chinensis, a subtropical evergreen fruit tree, possesses trypsin inhibitor activity[J]. Annals of Botany, 100: 1199-1208. DOI:10.1093/aob/mcm216 |
Tian W M, Wu J L, Hao B Z, et al. 2002. Vegetative storage proteins in Meliaceae[J]. Acta Bot Sin, 44(2): 242-245. |
Tian W M, Wu J L, Hao B Z, et al. 2003. Vegetative storage proteins in the tropical tree Swietenia macrophylla: seasonal fluctuation in relation to a fundamental role in the regulation of tree growth[J]. Can J Bot, 81: 492-500. DOI:10.1139/b03-045 |
Wetzel S, Greenwood J S. 1991. The 32KD vegetative storage protein of Salix microstachya Turz characterization and immuno-localization[J]. Plant Physiol, 97: 771-777. DOI:10.1104/pp.97.2.771 |
 2011, Vol. 47
2011, Vol. 47

