文章信息
- 范桂枝, 翟俏丽, 于海娣, 王晓东, 王博, 詹亚光
- Fan Guizhi, Zhai Qiaoli, Yu Haidi, Wang Xiaodong, Wang Bo, Zhan Yaguang
- 白桦细胞悬浮培养产三萜及其营养成分消耗的动态
- Kinetics of Triterpenoid Production and Nutrient Consumption in Birch (Betula platyphylla) Suspension Cell
- 林业科学, 2011, 47(1): 62-67.
- Scientia Silvae Sinicae, 2011, 47(1): 62-67.
-
文章历史
- 收稿日期:2009-12-02
- 修回日期:2010-02-08
-
作者相关文章
白桦(Betula platyphylla)主要分布在温带的日本、朝鲜、俄罗斯和中国等亚欧大陆。白桦树皮的主要活性成分之一为三萜类物质(范桂枝等,2008a; 尹静等,2009a),白桦三萜具有抗菌、抗病毒、抗肿瘤、降脂、利胆和保肝等作用,特别是白桦酯醇、白桦酯酸等三萜物质作为天然药物在抗肿瘤和抗HIV等方面显示出与以往药物不同的作用机制,具有靶向作用性更强、几乎无不良反应等特点(Malgorzata et al., 2005; Alakurtti et al., 2006; Chen et al., 2009)。因此,白桦三萜作为药物化学中的先导化合物逐步受到研究者的注视。
当前白桦三萜的获得主要从白桦树皮中提取和分离,不仅造成白桦资源的破坏,而且作为新型药剂的临床研究,特别是推广应用的数量受到限制。因此,研究利用白桦细胞培养技术生产三萜类物质对大规模商业化生产白桦活性成分具有重要的现实意义。
笔者研究室前期的研究表明:白桦酯醇和齐墩果酸等三萜物质可以在白桦愈伤组织中积累(王博等,2008; 尹静等,2009b),但白桦三萜的积累与细胞生长、营养物质的消耗之间存在密切的关系,此关系的解析将为细胞由摇瓶放大到生物反应器的培养提供重要的技术参数,而生物反应器技术则是植物细胞培养生产次级代谢产物、实现大规模工业化生产的关键技术之一。因此,本文将研究在悬浮培养过程中,细胞的生长、三萜的合成以及主要营养成分(如蔗糖、硝酸盐、磷酸盐)的消耗,以便了解白桦悬浮细胞培养的特性以及白桦细胞的生长及营养物质消耗之间存在的对应关系,为提高白桦悬浮细胞中三萜的积累以及大规模培养提供理论依据。
1 材料与方法 1.1 白桦悬浮细胞白桦愈伤组织来自于白桦组培苗的茎段,筛选生长快、分散性好的白桦愈伤组织,将其继代若干次后转到液体培养基中悬浮培养。通过不断选择获得分散性好的细胞悬浮物,经过6代以上的转接,建立稳定的悬浮细胞系。
1.2 培养条件固体培养基为: NT培养基+0.1 mg·L-16-benzyladenine (6-BA)+0.01 mg·L-1 thidiazuron (TDZ) (范桂枝等,2008b),蔗糖20 g·L-1,5.3 g·L-1琼脂粉,pH 5.6~5.8。液体培养基为不加琼脂粉的固体培养基。培养基均以121 ℃高压灭菌20 min,培养温度为25~27 ℃,光照强度为2 000 lx,光照16 h·d-1,湿度为40%~50%,摇床转速为120 r·min-1。
1.3 不同培养基和接种量对悬浮细胞的处理选择适于悬浮细胞生长和三萜积累的基本培养基与接种量,将获得的分散性好的悬浮细胞在第7次继代时,进行不同培养基和接种量处理。
不同培养基的处理条件为: MS, NT, IS, WPM, 1/2MS, B5;不同接种量为: 10, 20, 30, 40 g·L-1。
采用250 mL三角瓶装100 mL培养基,培养21天收集细胞,测定细胞的生物量与三萜含量。每个试验1个摇瓶均重复3次。
1.4 测定方法 1.4.1 细胞生长测定悬浮培养细胞经350目不锈钢筛网过滤,蒸馏水洗涤3次,称得细胞鲜质量(FW),60 ℃烘干至恒重即得干质量(DCW)。细胞增长率=(收获细胞量-接种细胞量) /接种细胞量×100%。生长速率=dCx/ dt≈ΔCx/Δt,比生长速率μ≈ΔCx/(Cx×Δt),式中x是细胞量,t是时间。
1.4.2 三萜样品的制备及检测1) 三萜样品制备精确称取0.1 g样品,放入50 mL离心管中加入95%乙醇10 mL浸泡过夜(3次),合并提取液后加入0.5 g活性碳于40 ℃下超声(超声频率为10 kHz) 40 min,以10 000 r·min-1离心10 min取上清液过滤纸浓缩蒸干,以2 mL乙酸乙酯复溶后即得到样品。
2) 三萜样品测定 三萜类物质含量以紫外分光光度法测定(孙宏等,2005)。精密移取待检测样品100~200 μL,置于试管中于70 ℃水浴中蒸干。加入200 μL新配制的5%香草醛-冰醋酸溶液,再加入800 μL高氯酸后摇匀,置于70 ℃的恒温水浴中15 min,流水冷却至室温,加乙酸乙酯定容至5 mL,摇匀,同时以试剂为空白对照,用1 cm比色皿测定551 nm处的吸光值。回归方程为: Y=0.105 6X-0.016 5,R2=0. 998 4 (Y为浓度, X为吸光度)。
1.4.3 营养物质分析收集摇瓶中的培养液和悬浮细胞,葡萄糖采用长春汇力生物技术有限公司生产的氧化酶法试剂盒测定,蔗糖和果糖采用盐酸和间苯二酚显色法测定(马溶慧等,2008),硝酸根、铵根离子和磷酸根的定量分别采用水杨酸-浓硫酸法(董晓英等,2003)、苯酚-次氯酸盐反应(Weatherbum,1967)和磷钼蓝比色法(Chen et al., 1956),可溶性蛋白采用Bradford的考马斯亮蓝G-250染色法测定(李合生,2000)。
2 结果与分析 2.1 优化白桦悬浮细胞生长与三萜积累的培养基种类和接种量 2.1.1 培养基种类对白桦悬浮培养细胞生长和三萜含量的影响从图 1A可以看出:收获时的干质量积累依次为B5(6.40 g·L-1)>WPM(5.97 g·L-1)>1/2MS(5.73 g·L-1)>MS(5.40 g·L-1)>IS(5.27 g·L-1)≈NT(5.23 g·L-1); 同样,培养在6种培养基内的悬浮细胞的三萜含量也不同,收获时的三萜含量依次为NT(11.96 mg·g-1)>IS(11.33 mg·g-1)>WPM(11.29 mg·g-1)>B5(11.26 mg·g-1)>MS(10.91 mg·g-1)>1/2MS(10.71 mg·g-1)。由此可见:最有利于白桦悬浮细胞生长的培养基种类为B5,最有利于三萜积累的培养基为NT。

|
图 1 不同培养条件对白桦悬浮细胞和三萜含量的影响 Figure 1 The effect of different culture conditions on birch cell growth and triterpenoid content |
综合干质量和三萜指标,进一步对三萜产量的分析表明:白桦悬浮细胞在B5和NT培养基下的三萜产量分别为72.09和63.02 mg·L-1,因此建议有利于白桦三萜生产的培养基种类为B5。
2.1.2 接种量对白桦悬浮培养细胞生长和三萜含量的影响以上述优化的B5培养基为基本培养基,分析10, 20, 30, 40 g·L-1的接种量对白桦悬浮细胞生长和三萜含量的影响(图 1B)。在一定范围内,随着细胞接种量的增加,收获时细胞的干质量呈增加趋势,其中干质量积累最大的接种量为40 g·L-1,干质量为9.07 g·L-1。但三萜含量的积累并没有随接种量的增加而增加,三萜含量最高的接种量为20 g·L-1,三萜含量为11.26 mg·g-1。由此可见:在一定范围内随着接种量的增加,细胞的比生长速率大,但代谢产物并不随着增加,综合考虑接种量对白桦细胞生长和三萜积累的影响,建议接种量为20~30 g·L-1FW。
2.2 白桦悬浮细胞培养过程中细胞生长和三萜积累的动力学分析 2.2.1 白桦悬浮细胞培养中三萜积累的变化在激素种类和浓度、培养基种类和接种量都优化的基础上,考察1个培养周期内白桦细胞的生长和三萜积累的变化(图 1C)。在1个培养周期内,白桦细胞的干质量呈增加趋势。其中,0~9天干质量积累缓慢,增长率为38.1%,9~15天干质量显著增加,增长率为168.7%,15~24天干质量积累缓慢,增长率为28.3%。白桦悬浮细胞内的三萜含量在1个培养周期内呈现先升高后降低趋势,其中,三萜含量在培养的第9天达最大值,为14.3 mg·g-1DW;而三萜产量的变化趋势与干质量积累相同,3~15天三萜产量呈显著增加趋势,15天后产量增加缓慢,甚至在第24天表现为下降趋势。
2.2.2 白桦悬浮细胞生长与三萜积累的动力学分析为了进一步考察白桦悬浮细胞生长规律和细胞合成三萜的规律,计算培养过程中细胞的生长速率(dCx/dt≈ΔCx/Δt)、比生长速率(μ≈ΔCx/(Cx×Δt))、三萜合成速率(γQ=dZ/dt≈ΔZ/Δt)和比合成速率(ZQ/X =γQ/Z),结果如图 2所示。在1个培养周期内,白桦细胞的生长速率与比生长速率变化趋势相同,3~12天为上升趋势,15~24天为下降趋势,其中在12天比生长速率达到最高,为每天0.18。三萜合成速率与比合成速率的变化趋势与细胞生长规律不一致,在细胞生长最快的第12天,三萜合成速率和比合成速率为最低点,而在第9天三萜合成速率和比合成速率达到最高值,分别为0.73 mg· g-1和0.06。
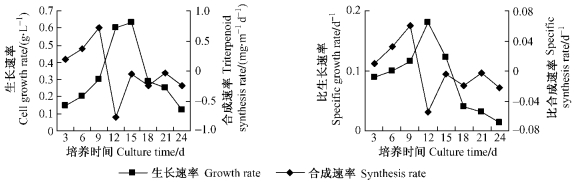
|
图 2 白桦悬浮细胞生长和三萜积累的动态变化 Figure 2 Dynamic changes of cell growth and triterpenoid content in birch |
糖类在植物细胞培养中具有重要的作用,既为细胞生长提供能量,也为初级、次级代谢物合成提供碳架,同时对渗透压的调节有一定作用。因此,各种糖类在培养过程中的转化、吸收是比较有意义的。在先前的研究中笔者发现:蔗糖对白桦愈伤组织中三萜类物质的积累最为有利(王博等,2008),因此,蔗糖是白桦悬浮细胞生长代谢的主要碳源。
在1个培养周期内,由白桦悬浮细胞及其培养液中的糖含量变化趋势如图 3所示。白桦悬浮细胞接种到培养液后的前9天,培养液中的蔗糖已基本被细胞吸收和利用。而蔗糖水解的产物葡萄糖和果糖的变化趋势与蔗糖不同,呈现0~6天为升高趋势,6~15为降低趋势,15天后已基本被细胞吸收和利用。其中,果糖在第3天含量最高,为7.4 mg·g-1,葡萄糖在第6天含量最高,为6.5 mg·g-1; 白桦细胞内的葡萄糖与果糖含量变化趋势与培养液中的基本一致,0~9天为升高趋势,9~15天为降低趋势,15天后含量维持在一定浓度。其中,果糖和葡萄糖含量在第6天达最大值,分别为104.9和113.5 mg·g-1。

|
图 3 糖含量的动态变化 Figure 3 Dynamic changes of sugar content in birch |
在植物组织培养中,NO3-和NH4+是植物细胞生长代谢的主要氮来源,调节培养基中氨态氮和硝态氮的比例或者改变总氮浓度都可显著影响在植物离体培养过程中次生代谢物的生物合成(Panda et al., 1992; Moreno et al., 1995)。白桦悬浮细胞及其培养液中的NO3-和NH4+离子含量的动态变化如图 4A,B所示。在培养的前9天,培养液中的NO3-和NH4+离子含量急剧降低,分别从1 221.6和185.0 mg·L-1降低到102.6和5.6 mg·L-1,而且NH4+离子下降的幅度大于NO3-离子。9天后,培养液中的NO3-和NH4+离子含量分别保持在50.9~72.5和2.5~4.4 mg·L-1之间。随着培养液中NO3-和NH4+离子含量的降低,细胞内的NO3-和NH4+离子含量呈先升高后降低的趋势。其中,NH4+离子含量在第3天达最大值,为1.3 mg·L-1,NO3-离子含量在第6天达最大值,为2.0 mg·L-1,可见白桦细胞对NH4+离子的吸收快于NO3-离子。
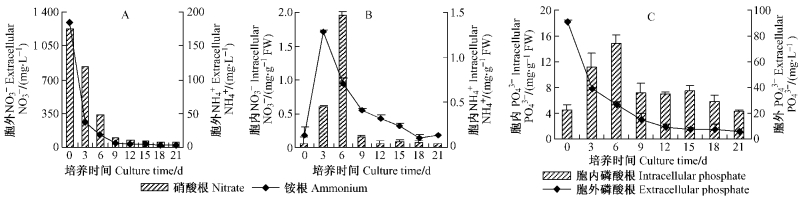
|
图 4 NO3-, NH4+, PO43-离子含量的动态变化 Figure 4 Dynamic changes of NO3-, NH4+, PO43- content in birch |
PO43+是植物细胞内重要的营养成分之一,参与核苷酸、DNA、RNA、磷酸化糖和蛋白质等的形成,是植物细胞内萜类和甾类物质合成途径的中间组分。白桦悬浮细胞及其培养液中的PO43-离子含量的动态变化如图 4C所示。在1个培养周期内,培养液中的PO43-离子含量呈降低趋势,而白桦悬浮细胞内的PO43-离子含量为先升高后降低趋势。在细胞培养的前12天,培养液中的PO43-离子含量从91.0降低到8.9 mg·L-1,12天后PO43-离子含量维持在6.1~8.9 mg·L-1。白桦细胞内的PO43-离子含量,在细胞培养的第6天达最大值,为14.8 mg·L-1,随着培养时间的延长,PO43-离子含量变幅很小,在21天积累量最低,为4.4 mg·L-1。
3 结论与讨论在植物组织培养中,基本培养基的选择对愈伤组织生长和次生代谢的积累具有重要影响。陈学森等(1997)的研究发现: MT培养基有利于银杏(Ginkgo biloba)叶片愈伤组织的生长,易获得较高的愈伤组织生物量,但愈伤组织中的黄酮含量较低;而White培养基虽然对愈伤组织生长不利,但有利于黄酮的产生和积累。对于胡萝卜愈伤组织而言,在B5, MG5, ER和White培养基中,MG5培养基最适宜于茄红素合成代谢(梁燕等,2003)。本试验结果也同样表明:在MS, NT, IS, WPM, 1/2MS和B5 6种培养基中,B5培养基最有利于白桦悬浮细胞的培养,收获时的干质量达到6.40 g·L-1。而悬浮细胞中的三萜含量在这6种培养基中表现为NT培养基中的积累量最高,达11.96 mg·g-1。由此可见:适宜于细胞生长的培养基不一定有利于次生代谢物的积累,选择既适合植物细胞生长,又有利于目标次生代谢产物合成的培养基是成功的关键所在。
在悬浮培养中,悬浮细胞的生长具有群聚效应,在一定的接种密度下,细胞才能生长;同时也发现接种量与次生代谢物的积累有关,当接种量为20%时,Vitex glabrata悬浮培养细胞中20-羟基蜕皮激素的含量最高(Sinlaparaya et al., 2007),本试验结果也表明:三萜含量最高的接种量为20 g·L-1,三萜含量为11.26 mg·g-1。但关于接种量与次生代谢物积累的关系还不清楚,目前存在的主要2种解释为: 1) 接种量对细胞生长以及次级代谢产物形成的影响可能与参与代谢途径的酶活性的提高有关; 2) 通过提高接种量来刺激次生代谢物形成的原因可能是细胞之间的交流以及通过接种量所释放的未知的影响因子(Akalezi et al., 1999)。
在植物细胞培养生产次级代谢物的过程中,研究细胞生长规律和次生代谢物的积累规律,对于植物细胞培养的进一步放大,提高次生代谢产物的产率等方面具有重要意义(王莉等,2007)。本研究在白桦悬浮细胞培养体系优化的基础上,分析白桦悬浮细胞生长与三萜积累的动力学关系,发现白桦悬浮细胞培养过程中三萜的产量与细胞生物量是相偶联的,随着生物量的增加三萜产量呈增长趋势。但白桦悬浮细胞的比生长速率在12天时达到最高,为0.18,而在第9天三萜合成速率和比合成速率达到最高值,分别为0.73 mg· g-1和0.06。可见,白桦三萜的合成与细胞生长不同步,三萜主要在细胞快速生长前期合成。同样,Thanh等(2006)的研究也发现:人参(Ginseng)细胞的生长与皂苷的积累不同步。可见,在确定植物细胞生长与次生代谢物的积累规律时,要明确细胞生长与次生代谢物的含量还是产量的关系,次生代谢物含量或产量与细胞生长得出的规律可能完全不同。
另外,在植物细胞生产次生代谢物的过程中,细胞对培养液营养成分的消耗动态直接影响细胞的生长和次生代谢物的合成(Azevedo et al., 2008; 董诚明等,2009)。在1个培养周期内,分析白桦悬浮细胞内和培养液中主要营养成分的变化,对白桦细胞在液体环境下的生长状况进行较为全面的分析。在白桦细胞培养的1个周期内,白桦细胞对营养成分的消耗进程与其生长进程的3个阶段是吻合的,与细胞的生长是一致的。随着细胞快速生长,培养基中的蔗糖,NO3-, NH4+离子和PO43-离子等营养物质开始被细胞大量的吸收利用,此时胞内这些营养成分的含量逐渐升高,但随着细胞进入快速生长阶段也被大量的消耗掉。同时,发现在白桦三萜比合成速率最高的第9天,白桦培养液中的营养物质已被基本消耗掉。可见培养液和细胞中营养成分的不足限制了白桦细胞的进一步增殖和白桦三萜的合成。该结果为进一步提高白桦悬浮细胞中的三萜含量提供了营养成分依据。
陈学森, 邓秀新, 章文才. 1997. 培养基及培养条件对银杏愈伤组织黄酮产量的影响[J]. 园艺学报, 24(4): 373-377. |
董诚明, 苏秀红, 王伟丽. 2009. 氮碳源对冬凌草再生植株生长及次生代谢产物的影响[J]. 西北植物学报, 29(3): 494-498. |
董晓英, 李式军, 沈仁芳. 2003. 白菜不同品种对硝酸盐吸收积累差异原因初探[J]. 园艺学报, 30(4): 470-472. |
范桂枝, 詹亚光. 2008a. 白桦酯醇的研究进展[J]. 中草药, 39(10): 1591-1593. |
范桂枝, 詹亚光, 王博, 等. 2008b. 激素配比对白桦悬浮细胞中三萜积累的影响[J]. Journal of Agricultural and Technology, 2(12): 1-4. |
李合生. 2000. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社: 123-124, 184-185.
|
梁燕, 陈大明, 王鸣, 等. 2003. 培养基对胡萝卜悬浮系茄红素合成代谢活性的影响[J]. 园艺学报, 30(5): 545-548. |
马溶慧, 许乃银, 张传喜, 等. 2008. 氮素调控棉花纤维蔗糖代谢及纤维比强度的生理机制[J]. 作物学报, 34(12): 2143-2151. |
孙宏, 张泽. 2005. 分光光度法测定白桦三萜类物质总量[J]. 南京林业大学学报:自然科学版, 29(1): 110-112. |
王博, 范桂枝, 詹亚光, 等. 2008. 不同碳源对白桦愈伤组织生长和三萜积累的影响[J]. 植物生理学通讯, 44(1): 97-99. |
王莉, 史玲玲, 刘玉军, 等. 2007. 不同光质对长鞭红景天悬浮细胞生长及苯丙氨酸解氨酶活性的影响[J]. 林业科学, 43(6): 52-56. |
尹静, 詹亚光, 李新宇, 等. 2009a. 不同树龄白桦的不同器官及其组培苗诱导的愈伤组织中白桦酯醇和齐墩果酸的分布和含量变化[J]. 植物生理学通讯, 45(6): 610-614. |
尹静, 詹亚光, 肖佳雷. 2009b. 白桦三萜的合成和调控[J]. 植物生理学通讯, 45(5): 520-526. |
Akalezi C O, Liu S, Li Q S, et al. 1999. Combined effects of initial sucrose concentration and inoculum size on cell growth and ginseng saponin production by suspension cultures of Panax ginseng[J]. Process Biochemistry, 34(6/7): 639-642. |
Alakurtti S, Taru M K, Salme K, et al. 2006. Pharmacological properties of the ubiquitous natural product betulin european[J]. J pharmaceutical sci, 29(1): 1-13. |
Azevedo H, Dias A, Tavares R M. 2008. Manuel tavares establishment and characterization of Pinus pinaster suspension cell cultures[J]. Plant Cell Tiss Organ Cult, 93: 115-121. DOI:10.1007/s11240-008-9349-1 |
Chen P S, Toribara T Y, Huber W. 1956. Microdetertnination of phosphorus[J]. Analynic Chemisty, 28(11): 1756-1759. |
Chen Q H, Liu J, Zhang H F, et al. 2009. The betulinic acid production from betulin through biotransformation by fungi[J]. Enzyme and Microbial Technology, 45(3): 175-180. DOI:10.1016/j.enzmictec.2009.06.005 |
Malgorzata K, Jan Z, Cezary P, et al. 2005. The formation of sugar chains in triterpenoid saponins and glycoalkaloids[J]. Phytochem Reviews, 4(2/3): 237-257. |
Moreno P R H, van der Heijden R, Verpoorte R. 1995. Cell and tissue cultures of Catharanthus roseus: a literature survey Ⅱ.Updating from 1998 to 1993[J]. Plant Cell Tiss Org Cult, 42(1): 1-25. |
Panda A K, Mishra S, Bisaria V S. 1992. Alkaloid production by plant cell suspension cultures of Holarrhena antidysenterica:Effect of major nutrients[J]. Biotechnol Bioeng, 39(10): 1043-1051. DOI:10.1002/(ISSN)1097-0290 |
Sinlaparaya D, Duanghaklang P, Panichajaku S, et al. 2007. Vitex glabrata R. Br. 悬浮培养细胞的生长条件优化及202羟基蜕皮激素的生产. 张玉霞, 译. 生物工程学报, 23 (6): 1033-1036.
|
Thanh N T, Murthy H N, Yu K W, et al. 2006. Effect of oxygen supply on cell growth and saponin production in bioreactor cultures of Panax ginseng[J]. Journal of Plant Physiology, 163(12): 1337-1341. DOI:10.1016/j.jplph.2005.08.014 |
Weatherbum M V. 1967. Phenol hypochlorite reaction for determination of ammonia[J]. Analynic Chemistry, 39(8): 971-974. DOI:10.1021/ac60252a045 |
 2011, Vol. 47
2011, Vol. 47

