文章信息
- 谢寅峰, 张志敏, 尚旭岚, 杨万霞, 王纪, 方升佐
- Xie Yinfeng, Zhang Zhimin, Shang Xulan, Yang Wanxia, Wang Ji, Fang Shengzuo
- 青钱柳茎段腋芽萌发和丛生芽增殖
- Germination of Axillary Buds from Stem Segments and Proliferation of Multiple Shoots of Cyclocarya paliurus
- 林业科学, 2011, 47(1): 50-55.
- Scientia Silvae Sinicae, 2011, 47(1): 50-55.
-
文章历史
- 收稿日期:2009-10-30
- 修回日期:2010-01-13
-
作者相关文章
青钱柳(Cyclocarya paliurus)又名青钱李、山麻柳、甜茶树、一串钱等(吴群英等,2008),为胡桃科(Juglandaceae)青钱柳属落叶乔木,是我国特有的珍稀濒危单种属植物,集药用、保健、材用、观赏等多种功效于一体,具有很高的开发应用价值(方升佐等,2007)。由于青钱柳种子具有深休眠特性,并且种子败育很严重(上官新晨等,2006),严重影响了其有性繁殖进程。无性繁殖由于能保持母体的遗传特性,是种群扩繁的常用方法。尤其通过组织培养方法对珍稀植物进行快繁研究,不仅可以克服种子繁殖中存在的诸多问题,而且可以克服扦插繁殖速度慢、难生根、繁殖率低的缺点,再加上组织培养具有繁殖快、不受场地、季节和环境条件限制等诸多优点(吴安湘等,2006),因此利用组织培养技术,建立完整的青钱柳组培快繁体系,使其苗木产业化,显得尤为重要。但目前有关青钱柳组培快繁的研究报道甚少,快繁过程中存在外植体易污染、褐变、难生根等难题,至今尚未建立其组培快繁的完整体系(谢明勇等,2008)。现有的研究多集中在愈伤组织的诱导和培养方面(上官新晨等,2006; 郭春兰等,2008),或以离体胚为外植体的研究(王莹,2008; 尚旭岚等,2007),但通过离体胚培养获得的快繁体系不能保持母树的优良性状,在生产实际应用中受到限制。
本文以田间栽培青钱柳母树的茎段腋芽为外植体,在探讨了外植体消毒方法及基本培养基(张志敏等,2010)等预试验的基础上,进一步从植物生长调节剂的种类、浓度及配合方面,对腋芽萌发的诱导、丛生芽增殖和继代培养进行了系统的研究,旨在建立完整高效实用的青钱柳组培快繁体系,为解决青钱柳资源匮乏问题提供理论和技术基础。
1 材料与方法 1.1 供试材料采自江苏镇江南京林业大学森林资源与环境学院教育基地。取3年生青钱柳幼树当年生嫩枝条的带腋芽的茎段作外植体。
1.2 试验方法 1.2.1 外植体处理与消毒取3年生青钱柳幼树上当年嫩枝条,剪去叶片,保留0.5~1.0 cm长的叶柄,再切成2~5 cm长的带腋芽的茎段,流水冲去表面的脏物,用体积分数为1%的洗洁精溶液浸泡3 min,再用软刷轻轻刷洗外植体表面,除去附着在外植体表面的尘土和部分菌体; 流水冲洗约1~2 h。沥水后,在超净工作台上消毒灭菌处理。先用70%酒精浸泡灭菌30 s,无菌水冲洗3次,再用0.1%升汞消毒12 min,无菌水冲洗6~10次,再剪成1.0~1.5 cm带腋芽的小段,即可接种到预先配好的培养基中培养。
1.2.2 基本培养基与培养条件基本培养基为WPM培养基,附加柠檬酸50 mg·L-1+叶酸0.5 mg·L-1+蔗糖3%+琼脂0.6%;pH调至5.8;121 ℃高压灭菌20 min; 培养温度25 ℃; 光照强度50 μmol·m-2s-1; 光期14 h,暗期10 h; 相对湿度50%~70%。
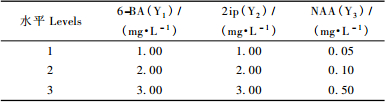
1.2.3 植物生长调节剂处理与试验方案1) 6-BA,2ip(2-异戊烯基腺嘌呤)和NAA对青钱柳腋芽萌发的影响 以WPM为基本培养基,生长调节剂种类和浓度采用L9(3)3正交试验设计(表 1),三因素三水平(通过预试验表明无调节剂处理萌芽率较低,芽生长状况较差,因此未设置不加调节剂的处理),生长调节剂种类分别为6-BA(记为Y1),2ip(记为Y2),NAA(记为Y3)。附加柠檬酸50 mg·L-1+叶酸0.5 mg·L-1+蔗糖3%+琼脂0.6%;pH调至5.8;每处理接种5瓶,每瓶接3个外植体,试验重复3次。接种后定期观察,培养期间及时取出污染的培养瓶,以避免交叉污染。15天后统计各处理的接种数(除去污染数目)、萌芽率、愈伤率,比较芽的长势,筛选出最佳的植物生长调节剂种类及其浓度。
|
|
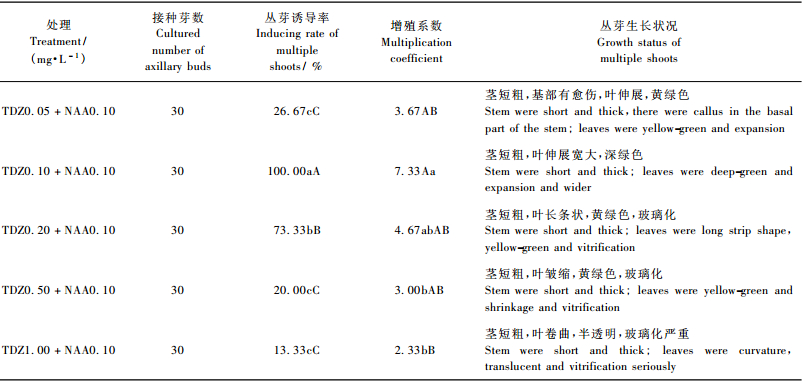
2) TDZ和NAA对青钱柳丛生芽增殖的影响 以WPM为基本培养基,添加0.1 mg·L-1NAA和不同浓度的TDZ(0.05,0.1,0.2,0.5,1.0 mg·L-1)。附加柠檬酸50 mg·L-1+叶酸0.5 mg·L-1+蔗糖3%+琼脂0.6%;pH调至5.8;每处理接种10瓶,每瓶1个芽。试验重复3次。15天后统计丛芽诱导率、增殖系数,筛选增殖的最佳植物生长调节剂配比。
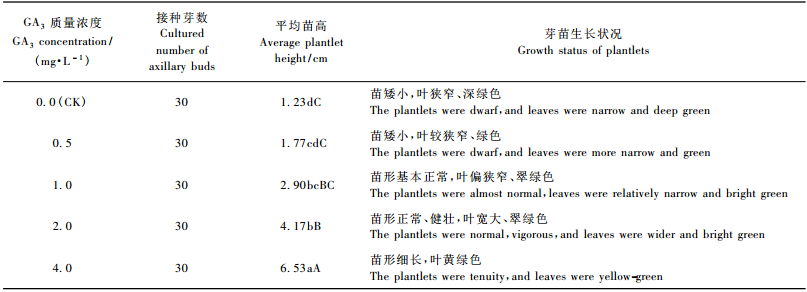
3) GA3对丛生芽继代培养的影响 以WPM为基本培养基,添加0.0(CK),0.5,1.0,2.0,4.0 mg·L-1 GA3,附加柠檬酸50 mg·L-1+叶酸0.5 mg·L-1+蔗糖3%+琼脂0.6%;pH调至5.8;研究GA3对青钱柳芽苗伸长生长的影响。GA3采用过滤灭菌,其他植物生长调节剂均高压灭菌。每处理接种10瓶,每瓶1个芽。试验重复3次。接种后定期观察,15天后统计苗高、苗的生长状况。
1.3 测定指标培养15天后统计各个处理的腋芽萌发率、愈伤诱导率、丛芽诱导率、增殖系数等指标。指标计算方法如下:萌发率(%)=腋芽萌动数目/接种数目(去除污染数)×100%;愈伤诱导率(%)=诱导出愈伤组织的腋芽数目/接种的腋芽数目(去除污染数)×100%;丛芽诱导率(%)=诱导出丛生芽的腋芽数目/接种的腋芽数目×100%;增殖系数=诱导后的丛生芽的数目/诱导前芽的数目。
1.4 统计分析用Excel,STST统计分析软件对数据进行处理,用Duncan氏法进行差异显著性检验。
2 结果与分析 2.1 6-BA,2ip和NAA对青钱柳腋芽萌发的影响将消毒后的茎段接种在不同植物生长调节剂及其浓度配比的培养基中,接种后7天就发现茎基部膨大增粗,节部有腋芽萌动,叶柄基部愈伤化,叶柄脱落。15天以后腋芽开始长新叶,统计其腋芽萌发率。表 2结果显示,不同种类生长调节剂及其浓度对腋芽的萌发均有诱导作用,诱导效果存在一定的差异。在设计的9种处理中,处理7(6-BA 3.0 mg·L-1 +2ip 1.0 mg·L-1 +NAA 0.1 mg·L-1)为最优组合,效果最佳,萌发率达83.33%,且芽长势最好,新芽粗壮叶大,颜色深绿,叶片舒展。其次是处理4和9,都达到80%,与处理7差异不显著(P>0.05)。极差分析结果表明:6-BA对腋芽的萌发率影响最大,是诱导腋芽萌发的主要因素,其次是NAA,2ip对腋芽的萌发率影响最小,但6-BA与2ip合用比单用6-BA效果好。说明在诱导芽的生成时6-BA的浓度是一个关键因素,浓度过低芽萌发率偏低; 随着6-BA浓度的增大腋芽萌发率增加。综合以上数据可以得出,腋芽萌发率不仅与6-BA的绝对量有关,而且还与细胞分裂素和生长素的比值有关,其比值在6~50倍范围内,萌发率较高。各处理诱导出的芽以单芽为主(图 1a),30天后长出2片复叶(图 1b),长势差异显著。继代培养不易萌发丛生芽,并且随着培养时间的延长,部分叶片脱落,芽苗易褐化死亡。
|
|

|
图 1 植物生长调节剂对青钱柳茎段腋芽诱导和增殖的影响 Figure 1 Effects of plant growth regulators on induction and proliferation of axillary buds from stem segments of C. paliurus a.萌发15天的腋芽(6-BA 3.0 mg·L-1+2ip 1.0 mg·L-1+NAA 0.1 mg·L-1); b.萌发30天的腋芽(6-BA 3.0 mg·L-1+2ip 1.0 mg·L-1+NAA 0.1 mg·L-1); c. 15天的丛芽增殖(TDZ 0.1 mg·L-1+NAA 0.1 mg·L-1); d. 30天的丛芽增殖(TDZ 0.1 mg·L-1+NAA 0.1 mg·L-1); e.对照(GA3 0 mg·L-1); f.添加GA3(GA3 2 mg·L-1); g.添加GA3(GA3 4 mg·L-1)。以上各处理均以WPM为基本培养基,此外,添加相同的柠檬酸50 mg·L-1、叶酸0.5 mg·L-1、蔗糖3%、琼脂0.6%。 a. Axillary buds germination after 15 days (6-BA 3.0 mg·L-1+2ip 1.0 mg·L-1+NAA 0.1 mg·L-1); b. Axillary buds germination after 30 days (6-BA 3.0 mg·L-1+2ip 1.0 mg·L-1+NAA 0.1 mg·L-1); c. Multiple buds proliferation after 15 days(TDZ 0.1 mg·L-1+NAA 0.1 mg·L-1); d. Multiple buds proliferation after 30 days(TDZ 0.1 mg·L-1+NAA 0.1 mg·L-1); 5. Control (GA3 0 mg·L-1); 6. Adding GA3 (GA3 2 mg·L-1); 7. Adding GA3 (GA3 4 mg·L-1). WPM as the basic medium supplemented with citric acid 50 mg·L-1 +folic acid 0.5 mg·L-1 +sucrose 3%+agar 0.6% identically for all the above treatments. |
TDZ具有很强的细胞分裂素活性,在培养基中添加适宜浓度的TDZ,可以强烈促进侧芽及不定芽的发生。但随着TDZ浓度的增加,玻璃化苗出现的频率增加,玻璃化程度加重(沈海龙,2005)。将诱导出的单芽,基部切一字样切口(孟艳琼等,2007)接种于不同浓度组合的增殖培养基中培养。表 3结果显示,不同浓度TDZ和0.1 mg·L-1 NAA组合,对丛生芽诱导和增殖的促进作用存在着一定的差异。TDZ 0.1 mg·L-1+NAA 0.1 mg·L-1组合效果最佳(图 1c),诱导率和增殖系数均达到峰值(100%,7.33),和其他处理相比,差异极显著(P < 0.01);同时芽苗生长茁壮,叶伸展宽大,深绿色。而低浓度时(TDZ 0.05 mg·L-1),虽然能使单芽增殖为丛芽,但丛生芽诱导率、增殖系数低(26.67%,3.67),并且基部产生愈伤组织,苗的生长状况也较差; 随着浓度的增大,诱导率和增殖系数迅速下降,芽苗出现玻璃化。浓度最大时(TDZ 1.00 mg·L-1),丛生芽诱导率、增殖系数都达最低(13.33%,2.33),并且芽苗生长不正常,叶皱缩,玻璃化严重。不正常苗在继代培养中逐渐褐化死亡。
|
|
增殖培养后的丛芽矮小、节间短(图 1d),为促进芽伸长展叶,快速生长,抑制侧芽分化,调整株型,将增殖培养后的丛生芽切成单芽,接种于添加不同浓度的GA3继代培养基上。表 4结果显示,培养基中添加不同浓度的GA3对青钱柳幼苗的高生长及苗形均有明显影响,随着处理浓度的增大,对高生长的促进作用越明显。但浓度过高时,如4.0 mg·L-1处理(图 1g),虽然苗高的平均生长量最大(6.53 cm),但幼苗生长细弱、叶黄; 而2.0 mg·L-1处理时(图 1f),不仅平均苗高达4.17 cm,与对照(图 1e)相比差异极显著(P < 0.01),而且苗形正常,生长健壮,叶宽大、翠绿色。GA3的最佳处理浓度为2.0 mg·L-1。
|
|
植物生长调节剂对器官的分化调节起重要作用,就形态学而言6-BA能够促进芽的分化、侧芽的生长(Song et al., 1995)。并且生长调节剂中的细胞分裂素与生长素配比是诱导器官发生的关键因素(Xu et al., 2008)。李建军等(2005)在对美国黑核桃(Juglans nigra)腋芽诱导和继代时发现,6-BA/NAA比值为20~30时,芽的萌动较快,而继代培养的最佳组合为6-BA 1.0 mg·L-1 +NAA 0.05 mg·L-1+2ip 1.0 mg·L-1。本文首次以青钱柳茎段为材料对腋芽萌发诱导和增殖进行研究。在前期的预试验中发现,不添加任何生长调节剂的腋芽萌发率很低(25%以下); 而本文中9个处理的腋芽萌发率都明显高于不加调节剂的,表明外源植物生长调节剂具有促进腋芽萌发的作用,只是浓度和配比不同诱导效果存在明显的差别。极差分析结果表明,3种调节剂的效果为6-BA>NAA>2ip。说明6-BA在芽的诱导过程中起主导作用,但芽的诱导不仅仅取决于6-BA的绝对量,而且还取决于三者的相对比例。9个处理的诱导结果以单芽为主,而邓杰等(2009)对葡萄(Vitis vinifera)茎段丛生芽诱导时6-BA和NAA组合诱导的不定芽均为丛生芽,这种不同可能与植物的遗传特性有关。此外研究结果还表明6-BA与2ip合用比单用6-BA效果要好,但仍存在较为严重的褐化现象,与Karam等(2000)对仙客来(Cyclamen persicum)叶片不定芽诱导的试验结果类似。
TDZ是人工合成的苯基脲衍生物之一,具有很高的细胞分裂素活性。TDZ不仅能促进芽繁殖,还有利于芽的再生(宋晓娣等,2009)。尽管TDZ对各种外植体芽的再生诱导效果较好,但浓度高时易产生玻璃化和畸形现象(Bretagne et al., 1994)。针对芽的诱导过程中出现的新生芽为单芽以及易褐化死亡的现象,本试验调整了培养基中的生长调节剂的种类和浓度,以达到提高丛生芽诱导率和增殖系数的效果。结果表明添加适宜浓度的TDZ,能有效促进芽的再生,并且明显抑制了褐化现象。低浓度促进愈伤组织的生长,高浓度反而抑制芽的再生,并且芽苗质量差,叶片卷曲,玻璃化严重,与周连霞等(2006)用不同浓度TDZ对仙客来子叶节诱导不定芽的研究结果一致。各处理浓度诱导的均为丛生芽,除了茎基部叶腋里有新芽形成外,在伸长茎上以及新芽的叶腋里也都有小芽出现,因此提高了增殖系数。说明TDZ具有极强的细胞分裂素活性,其促进作用强于6-BA,细胞长时间保持较高的分裂、分化能力,芽得以再生和生长。综合以上可以得出,TDZ具有良好的诱导丛芽增殖和控制褐变的效果,但要合理地控制浓度,才能达到既提高增殖系数又降低玻璃化的最佳效果。
GA3的生理作用是加速细胞的伸长生长、促进细胞分裂。在大多数情况下,对已形成的器官和胚状体的生长有促进作用(沈海龙,2005)。针对诱导出的丛生芽苗玻璃化严重,节间短小,苗生长不正常的现象,在培养基中添加不同浓度的GA3,研究其对继代苗伸长生长的影响。结果表明,培养基中添加2.0 mg·L-1GA3对芽苗伸长生长有明显的促进作用,苗生长正常健壮。
本文首次以青钱柳茎段为外植体直接诱导腋芽萌发,通过以芽繁芽的方式增殖,具有取材方便、直接,减少变异,成苗速度快等优点,并且避免了离体胚培养不能保持母树优良性状的缺陷,为青钱柳苗木优良无性快繁体系的建立提供前期基础。但尚有许多问题需进一步完善,如控制芽苗玻璃化、褐化等问题,其中生根将是下一步需要重点研究的难题。
邓杰, 刘新, 薛仁镐. 2009. 霞多丽葡萄茎段丛生不定芽的诱导[J]. 果树学报, 26(2): 222-225. |
方升佐, 洑香香. 2007. 青钱柳资源培育与开发利用的研究进展[J]. 南京林业大学学报, 31(1): 95-100. |
郭春兰, 上官新晨, 蒋艳, 等. 2008. 不同理化因子对青钱柳愈伤组织生长和黄酮类化合物合成的影响[J]. 安徽农业大学学报, 35(3): 430-435. |
李建军, 李明军. 2005. 美国黑核桃离体培养的初步研究[J]. 河南农业科学, (9): 64-66. |
孟艳琼, 李仁杰, 伊兴凯, 等. 2007. 红星茵芋离体花梗腋芽诱导及丛生芽增殖研究[J]. 中国农学通报, 23(11): 81-85. DOI:10.3969/j.issn.1000-6850.2007.11.020 |
上官新晨, 郭春兰, 蒋艳, 等. 2006. 培养基和植物激素对青钱柳茎段和叶片愈伤组织诱导的研究[J]. 江西农业大学学报, 28(5): 678-682. |
尚旭岚, 徐锡增, 方升佐. 2007. 青钱柳离体胚的培养及快速繁殖[J]. 南京林业大学学报, 31(1): 101-105. |
沈海龙. 2005. 植物组织培养[M]. 北京: 中国林业出版社: 42.
|
宋晓娣, 陈建华. 2009. 红哺鸡竹丛生芽诱导的初步研究[J]. 湖南林业科技, 36(1): 18-20. |
王莹. 2008. 青钱柳离体快繁及生根机理的初步研究. 南京: 南京林业大学硕士学位论文.
|
吴群英, 徐庆, 李丽亚, 等. 2008. 青钱柳不同外植体组织培养及褐变防止的研究[J]. 时珍国医国药, 19(8): 1872-1874. |
吴安湘, 金晓玲, 熊芳. 2006. 珍稀濒危植物组织培养研究进展[J]. 西北植物学报, 26(1): 211-216. |
谢明勇, 谢建华. 2008. 青钱柳研究进展[J]. 食品与生物技术学报, 27(1): 113-121. |
张志敏, 尚旭岚, 王纪, 等. 2010. 消毒方法和培养基对青钱柳茎段腋芽萌发的影响[J]. 林业科技开发, 24(3): 87-90. |
周连霞, 马锋旺, 陈登文, 等. 2006. TDZ对仙客来不同外植体再生的影响[J]. 西北农林科技大学学报:自然科学版, 34(4): 39-42. |
Bretagne B, Chupeau M C, Chupeau Y, et al. 1994. Improved flax regeneration from hypocotyls using thidiazuron as a cytokin in source[J]. Plant Cell Rep, 14(2/3): 120-124. |
Karam N S, Al-Majathoub M. 2000. In vitro shoot regeneration from mature tissue of wild Cyclamen persicum Mill[J]. Scientia Horticulturae, 86(4): 323-333. DOI:10.1016/S0304-4238(00)00160-6 |
Song J T, Choi J N, Song S I, et al. 1995. Identification of a potexvirus in Korean garlic plants[J]. Agricultural Chemistry and Biotechnology, 38(1): 55-62. |
Xu M Y, Zhong S Q. 2008. Buds induction and high-frequency plant regeneration of Salivia miltiorrhiza Bunge[J]. Journal of Agricultural Science and Technology, 10(1): 76-80. |
 2011, Vol. 47
2011, Vol. 47