文章信息
- 商靖, 刘雪峰, 阿地力·沙塔尔, 潘存德, 赵震宇, 马红霞
- Shang Jing, Liu Xuefeng, Adlisattar, Pan Cunde, Zhao Zhenyu, Ma Hongxia
- 核桃基腐病的病原鉴定
- Pathogen Identification of Walnut Stalk Rot Disease
- 林业科学, 2010, 46(12): 97-100.
- Scientia Silvae Sinicae, 2010, 46(12): 97-100.
-
文章历史
- 收稿日期:2010-03-03
- 修回日期:2010-10-11
-
作者相关文章
2. 东北林业大学林学院 哈尔滨 150040
2. Forestry School, Northeast Forestry University Harbin 150040
核桃(Juglans regia)是世界著名的四大坚果之一,属落叶乔木,其种仁具有较高的营养价值和保健功能,可制取食用油和制作各种食品。核桃又是重要的用材树种、生态树种和生物质能源树种,被广泛种植于山区和田园。目前在新疆南疆地区生态环境保护和农民增收方面发挥着重大作用。近几年以来,随着新疆核桃种植面积逐年扩大,因粗放管理、栽培模式由建园式发展到核桃与多种农作物的间作模式等原因,病虫害问题日益突出,影响了核桃产业的稳步健康发展。
笔者于2008年春季在阿克苏市托普鲁克、库木巴什等乡调查核桃病害的过程中发现在核桃树基干部位出现腐烂并流黑水的症状,剥开树皮后发现,不仅韧皮部腐烂,而且木质部也变黑,此症状与核桃腐烂病有明显的不同,因此,将该病初步命名为核桃基腐病(在新疆南疆地区俗称核桃黑水病)。据调查,2008—2009年核桃基腐病在阿克苏地区部分县市发病率达到了5.94%,导致核桃树整棵死亡,严重影响了当地核桃产业的发展,成为农民增收和经济发展的制约因素。
关于类似病害,国外板栗和核桃黑水病(墨汁病)在意大利、法国、葡萄牙和西班牙早已发现。1838年葡萄牙首次发现墨汁病,但早在1726年西班牙对此病就有报道(Brasier,2004)。墨汁病的病原在欧洲主要为疫霉属(Phytophthora)的P.cambivora和P.cinnamomi; 1938年英国也发现类似症状,后确定病原菌为P.cambivora(Vannini et al., 2001)。国内板栗黑斑干枯病是安徽省的新记录病害(曹恒生等,1997),该病害与核桃基腐病症状相似,由Phytophthora castaneae引起。腐霉菌引起的苗猝倒病在全世界广泛分布,常见的是苗床上幼苗因猝倒病而全部死亡,或移植后不久死亡。植株被猝倒病菌为害后,通常只在茎上表现很小的坏死斑,如果病斑大而数量多,可以环绕植株致其死亡,在已生长多年的木本植物上未见此病原侵染的报道(蔡三山,2008)。再者核桃遭受严重冻害或土壤盐碱反应也会引起生理性的流黑水。因此,分离和鉴定核桃基腐病病原菌具有重要的意义。传统的病原学检测方法是通过显微镜观察病原菌形态特征,以确定病害类型。但腐霉的培养需要特殊的培养条件,而且有些形态特征难以观察到,给鉴定工作带来很大困难,因而分子生物学技术以其优势在植物病原菌的检测及鉴定方面得到了广泛应用。
本文根据核桃基腐病发病症状、病原菌形态特征、生物学特性和病原菌的核糖体DNA内转录间隔(internal transcribed spacer,ITS)的序列等对核桃基腐病病原菌标本进行了鉴定,旨在研究核桃基腐病病原菌,为制定综合防治措施提供参考依据。
1 材料与方法 1.1 材料 1.1.1 标本的采集2008年10—11月从新疆阿克苏地区托普鲁克乡、库木巴什乡采集病样,取整段基干木,带回实验室备用。
1.1.2 培养基胡萝卜培养基(CA)、燕麦培养基(OMA)、番茄汁培养基(TA)、没食子酸培养基、玉米培养基(CMA)、PDA培养基、皮氏液(petris solution,PS)、游动孢子诱生液(池塘水:蒸馏水为1: 1)(郑小波,1995)。
1.1.3 引物真菌核糖体基因转录间隔区ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。
1.2 试验方法 1.2.1 病害症状观察在新疆阿克苏托普鲁克乡、库木巴什乡等核桃园选择不同发病程度的核桃树,定期、定点观察发病核桃树在园地的表现症状,并作详细记录。
1.2.2 病原菌的分离纯化用常规组织分离方法,在实验室用选择培养基进行分离,15 ℃和25 ℃下培养,纯化后对分离物进行归类、编号和转管保存。
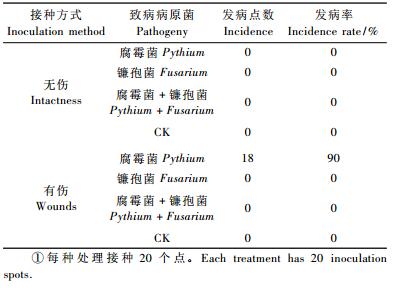
1.2.3 致病性测定致病性测定采用室外有伤接种和无伤接种2种方法(方中达,1998)。1)接种体:将PDA上培养3天的分离物,取菌饼(Φ6 mm)放入150 mL液体PDA培养基内在恒温振荡器上培养5天备用。2)伤口接种:用湿棉球清洁树干表皮,再用蘸有75%酒精的棉球消毒树干,待酒精挥发后,用刀片划伤表皮,用50 mL分离物悬浮液浸湿棉球,贴于接种点上后用透明胶带包裹接种点,防止水分散失,待48 h后取下。对照用同样方法接入50 mL无菌水,每个处理4次重复。3)无伤接种:接种处表面消毒,用50 mL分离物悬浮液浸湿棉球,包裹在树干表面,后用透明胶带包裹接种点,对照用同样方法接入50 mL无菌水,每个处理4次重复。4)调查统计方法:接种发病率(%)=接种发病点数/接种点数×100%。5)致病性验证:根据柯赫氏法则,对发病的核桃树皮上的病原进行再分离,显微镜下观察分离得到的病菌是否与原接种菌一致。
1.2.4 病原菌形态特征和培养性状观察将分离得到的菌种接到CMA培养基上,于25 ℃培养3天,记录菌落形态; 培养5天后镜检藏卵器、厚垣孢子等器官的产生情况。在此同时,诱生液(池塘水:蒸馏水=1: 1)中加入数片1 cm2的核桃叶片(煮沸10 min),将菌块放入诱生液或PS液中,20 ℃培养7~10天,挑取菌丝观察孢子囊诱导情况(王晓鸣等,1994)。
1.2.5 病原菌的分子鉴定用真菌通用引物ITS1/ITS4对病原菌进行PCR扩增,对获得的产物进行测序,将得到的序列在GenBank中进行比对,通过同源性分析对病原菌进行鉴定。
1) 病原菌总DNA提取 将病原菌接种到液体培养基中,在震荡箱中培养5天后收集菌丝。采用CTAB法提取和纯化基因组DNA。
2) rDNA ITS的扩增与序列测定 采用真菌通用引物ITS1/ITS4扩增,PCR反应体系总体积25μL,反应液为: BSA 2.5 μL; 10×PCR buffer 2.5μL,25 mmol·L-1 MgCl2 5 μL,2.5 mmol·L-1 dNTP1.8 μL,5 U·μL-1 Taq酶0.15 μL,模板DNA 3 ng,引物ITS1和ITS4(由上海Sango公司合成)各1 μL(25 μmol· L-1),加入ddH2O使总体积达到12.05 μL,在PCR扩增仪上进行扩增。扩增条件:94 ℃预变性3 min; 94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共35个循环; 最后72 ℃延伸10 min。序列测定委托上海生工生物工程技术服务有限公司测序。
病原菌 rDNA-ITS序列在NCBI网站(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中的相关序列的ITS区进行同源性比较。
2 结果与分析 2.1 病害症状特点该病害主要出现在树木的主干上,树干基部向上40 cm的范围内均可出现病斑,干基6~10 cm处较多,1株树上可产生1到多个病斑。4月上旬至五月中旬,在发病初期,树皮表面看不出症状,在韧皮部和木质部交界处腐烂变黑,随着温度的升高,病斑逐渐扩展,皮层与木质部剥离,病部皮层呈纵向开裂,裂口处有大量黑褐色液体流出(图版Ⅰ-A,B),8月份液流最多,对树干进行纵、横切发现韧皮部变黑坏死,木质部也变黑,并且向上下发展,严重时木质部全部变黑,病健交界处颜色对比明显。发病后期,病情迅速扩展至根部,主根呈褐色腐烂,在干基部病斑扩展至树体一周时,导致树叶失绿,枝条干枯,最后死亡。病害在10月上旬停止发展,至第2年5月份在先年病斑的边缘向外扩展,流出褐色液体。

|
图版Ⅰ Plate Ⅰ |
对病组织分离纯化后,得到2种病原菌菌株,分别为镰孢属(Fusarium sp.)和腐霉属(Pythium sp.),编号为L1和F1。
2.3 致病性测定于2009年4月15日,经室内分离培养的2种菌进行田间活体接种,结果见表 1。L1菌种无致病力,F1菌种具有强致病力(图Ⅰ-C,D)。
|
|
伤皮接种中,L1无致病力,F1的菌株则具有强致病力,接种14天后发病率达到了90%。接种后第14天在接种点纵向、横向扩展明显,纵向扩展2~10 mm,横向扩展0.5~4 mm,其后扩展加速,第20天,纵向扩展达到8~15 cm,横向扩展到4 ~7 cm。第30天皮层与木质部分离,且木质部变褐,流出少量褐色液体,第35天汁液较多。对照伤皮处无扩展现象,伤口1周变褐,接种点以外其余皮层组织为绿色。从发病株病斑病健交接处分离得到与接种菌相同的培养物,编号F2,据此认为F1为核桃基腐病的病原菌,病菌可通过伤口侵入。
2010年4月30日观察接种试验地,有伤接种方法中病斑在2个接种点之间扩展明显,纵向扩展10 cm,横向扩展5 cm,韧皮部与木质部剥离,之间有大量积水。
2.4 病原菌的培养特性、形态特征在CMA培养基上,初期无明显的气生菌丝,后期气生菌丝成膜状覆于培养基表面。菌落放射状,周缘平滑,白色,培养基正反面颜色一致,无色素分泌。生长速度为直径日生长25~30 mm(图版Ⅰ-E,F)。主菌丝直径3.0~6 μm; 菌丝膨大体球形至近球形瘤状膨大,常单生。孢子囊球形至近球形,少部分形状不规则,常有短菌丝连成复合体。藏卵器球形,顶生或间生,有时侧生或间侧生,直径15 ~30 μm(平均21.2 μm); 藏卵器外壁具锥形突起物,突起物高2.5~7.8 μm(平均4.20 μm),基部宽1.5~2.5 μm(平均2 μm)。雄器较少形成,形成时呈短棒形或曲颈形,异丝生,以顶端或侧面与藏卵器接触,(7~18)μm×(3~12)μm。卵孢子球形,平滑,不充满藏卵器或几乎满器,直径13~28 μm(平均20 μm),壁厚1.4~1.8 μm(图版Ⅰ-G,H,I)(余永年,1998; 魏景超,1979)。
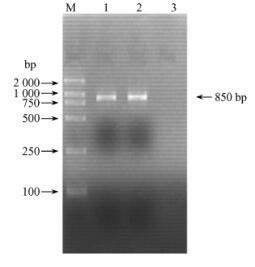
2.5 ITS区序列分析经分子生物学辅助鉴定得到,F1和F2均能扩增得到单一片段,而用水做为阴性对照的CK未能扩增到该片段。通过对ITS区的双向测序,获得了长度为850 bp的rDNA-ITS基因序列,将此序列与GenBank中的序列进行同源性比较,结果表明核桃基腐病病原与寡雄腐霉(Pythium oligandrum)同源性高达99%(登录号GU323340)。
|
图 1 ITS区PCR扩增产物 Figure 1 PCR-amplified product of ITS region M. DNA marker; 1. PCR product of F1strain; 2. PCR product of F2; 3. CK. |
根据病害症状、病原培养特性、形态特征、致病性测定及ITS基因序列同源性对比等进行综合分析,参考有关资料认为,引起核桃基腐病病原应为寡雄腐霉。
2.7 与近缘种之间的比较根据形态特征与资料所描述的特征进行比对,P.oligandrum和P.anandrum的主要区别是前者孢子囊球形或由菌丝状结构联结球状结构共同组成复合体,后者孢子囊椭圆形或长形,通常具一乳突。与P.sinesse的主要区别是P.sinesse孢子囊球形,不形成复合体。与P.amasculinum的主要区别是P.amasculinum雄器未见(余永年,1998)。
经试验所得,P.oligandrum菌丝生长的最低、最适、最高温度分别为10,33和40 ℃。与文献所记载的最高生长温度44 ℃有出入,P.sinesse和P.amasculinum的最高生长温度分别为36,40 ℃(余永年,1998)。
3 小结与讨论本文首次将新疆阿克苏地区核桃基腐病的病原菌鉴定为腐霉属,并根据病害症状、病原培养性状、形态学特征和ITS序列同源性比较将该病原菌确定为寡雄腐霉,明确了该病菌是引起核桃基腐病的病原菌。在新疆广大核桃产区多年以来将该病误认为核桃腐烂病,在有些文献当中把核桃腐烂病又叫核桃黑水病(白岗栓,2000)。两者的区别是:首先,2种病害的症状不同,核桃腐烂病主要危害枝干的皮层,皮层上面产生小黑点,天气潮湿时,分生孢子器内涌出桔红色分生孢子角,病斑沿树干的纵向发展,后期病部皮层纵裂,流出大量黑水。在大树主干上,病斑初期隐藏在韧皮部,有时许多病斑呈小岛状互相串联,一般从外表看不出明显症状,当皮层溢出“黑水”时,皮下已扩展为较大的病斑。在大树主干上出现的症状与在阿克苏地区发生的核桃基腐病的症状相同,病斑处也流出大量黑水,但严重时韧皮部、木质部变黑腐烂,在病斑发病后期无小黑点及分生孢子角产生。其次,2种病害的病原菌不同,核桃腐烂病的病原为Cytospora juglandis,而本研究分离所得到的核桃基腐病的病原为Pythium oligandrum。长期以来,将核桃腐烂病与核桃基腐病混为一谈,没有从病原上区分这2种病害,导致长期存在错误认识。
由寡雄腐霉引起的核桃基腐病在国内外未见报道,由疫霉属(Phytophthora)引起的病害有相似的症状。董文汉等(2002)报道,宝珠梨疫腐病是云南省的一种新记录病害,其病原菌是恶疫霉(Ph.cactorum); 王汝贤等(2000)报道,陕西省猕猴桃疫霉病的病原菌也为恶疫霉。本研究进行病原菌分离时,未分离到疫霉菌,但分离到镰孢菌,对此病原菌进行单独培养后接种到健康植株上,植株并没有发病,说明它不是引起核桃基腐病的病原菌。将镰孢菌与腐霉菌混合接种到健康植株上,植株并没有发病,说明也不是由2种菌复合侵染所致。鉴于本试验采集的病害标本仅局限于阿克苏地区的核桃产区,其他地方是否为同类型的病害,还需对病害发生的范围进行广泛调查。
ITS是介于18S rDNA,5.8S rDNA和28S rDNA之间的区域,该区域进化速度较编码区快,已有的研究表明ITS在真菌的种间存在着丰富的变异,而在种内不同菌株间却高度保守,可以为真菌的系统发育和分类鉴定提供丰富的遗传信息。本研究采用分子生物学方法对核桃基腐病病原的核糖体DNA-ITS序列进行分析,所分离菌种F1的核糖体DNA-ITS序列与腐霉菌的同源性最高,与寡雄腐霉的同源性达99.0%,从分子生物学水平上进一步鉴定所分离的菌种为寡雄腐霉。
白岗栓. 2000. 核桃腐烂病的发生与防治[J]. .陕西林业科技, (1): 38-40. |
蔡三山, 陈京元. 2008. 苗木猝倒病及研究进展[J]. 湖北林业科技, (6): 38-41. |
曹恒生, 蔡华. 1997. 安徽板栗病害及其新记录[J]. 安徽农业大学学报, 24(4): 327-331. |
董文汉, 何永宏, 赵永安, 等. 2002. 宝珠梨疫腐病病原菌研究[J]. 云南农业大学学报, 17(2): 143-146. |
方中达. 1998. 植病研究法[M]. 3版.北京: 中国农业出版社.
|
陕西果树研究所. 1980. 核桃[M]. 北京: 中国林业出版社: 56-60.
|
王晓鸣, 吴全安, 刘晓娟, 等. 1994. 寄生玉米的6种腐霉及其致病性研究[J]. 植物病理学报, (4): 343-346. |
王汝贤, 曹张军. 2000. 陕西省猕猴桃疫霉病的诊断及病原鉴定[J]. 西北农业大学学报, 30(2): 190-191. |
魏景超. 1979. 真菌鉴定手册[M]. 上海: 上海科学技术出版社: 30-34.
|
余永年. 1998. 中国真菌志:第6卷霜霉目[M]. 北京: 科学出版社: 55-65.
|
郑小波. 1995. 疫霉菌及其研究技术[J]. 北京:中国农业出版社: 1-86. |
Brasier C. 2004. Progress in research on Phytophthora diseases of forest trees[J]. Forest Research: 1-4. |
Brasier C, Jung T. 2001. Recent developments in Phytophthora diseases of trees and natural ecosystems in Europe[J]. Phytophthora Diseases: 5-16. |
Vannini A, Vettraino A M. 2001. Ink disease in chestnuts: impact on the European chestnut[J]. For Snow Landsc Res, 76(3): 345-350. |
 2010, Vol. 46
2010, Vol. 46