文章信息
- 王胜坤, 王军, 康丽华, 徐大平
- Wang Shenkun, Wang Jun, Kang Lihua, Xu Daping
- 不同温度、pH值和接种浓度对青枯菌在尾巨桉苗木根部吸附和侵入的影响
- Influences of Temperatures, pH Values and Inoculum Concentrations on the Adsorption and Ingression of Ralstonia solanacearum to Eucalyptus urophylla × E.grandis Seedling Root
- 林业科学, 2010, 46(12): 80-85.
- Scientia Silvae Sinicae, 2010, 46(12): 80-85.
-
文章历史
- 收稿日期:2010-03-03
- 修回日期:2010-09-17
-
作者相关文章
2. 华南农业大学林学院 广州 510640
2. College of Forest, Southern China Agricultural University Guangzhou 510642
桉树(Eucalyptus spp.)青枯病是由青枯菌(Ralstonia solanacearum)引起的一种系统性土壤传播病害(曹季丹,1982),对华南地区的桉树生产带来很大危害。青枯菌主要从植物根部侵染(Kelman,1954),其中,对寄主根部的吸附侵入和根内定殖扩散是其侵染过程的2个重要环节,吸附侵入是其成功侵染的必要条件(罗焕亮等,2002)。微生物和植物之间的吸附侵入是在不断变化的环境条件下完成的,温度、pH值和接种浓度在微生物的吸附侵入过程中发挥着重要作用,在极大程度上决定微生物能否在植物体内成功定殖,如根癌农杆菌(Agrobacterium tumefaciens)对曼陀罗(Datura stramonium)(Ohyama et al., 1979)和根瘤菌(Rhizobium sp.)对花苜蓿(Medicago ruthenica)(Munns,1969)的侵入条件进行试验,运用组织学技术研究青枯菌在寄主根表、表皮和木质部的定殖情况,青枯菌对木麻黄(Casuarina spp.)(Álvarez,2008)和桉树及非寄主树木(王军等,2007)的吸附识别进行研究,但对青枯菌与桉树之间的吸附侵入机制的影响因素还没有报道。为更深入探究桉树青枯病的发生机理,本研究通过测定不同温度、pH值和接种浓度下,青枯菌强弱2个菌株接种尾巨桉苗木后的根部吸附量和侵入量,以了解温度、pH值和接种浓度对青枯菌根部吸附侵入过程的影响,进一步探索青枯菌与尾巨桉的识别机制,为桉树青枯病的防控提供支持。
1 材料与方法 1.1 试验材料 1.1.1 菌种选用从桉树分离的2青枯菌菌株5号(强毒菌株)和12号(弱毒菌株),由华南农业大学林学院提供。
1.1.2 试验用苗由中国林业科学研究院热带林业研究所组培中心提供的尾巨桉196(Eucalyptus urophylla×E.grandis,感病品种)组培苗,高度约15~25 cm,除去袋土,水培15~20天,待新根长出后使用。
1.2 试验方法 1.2.1 菌种制备将供试菌株5号和12号在TTC培养基(Kelman,1954)上30 ℃培养36~48 h,用无菌水配制成3×108个·mL-1的细菌悬浮液,血球计数板计数,备用。
1.2.2 不同温度条件下青枯菌在尾巨桉根表吸附量和根部侵入量测定取配好的浓度为3×108个·mL-1细菌悬浮液600 mL装入1 L烧杯中,分别置于15,20,25,30,35 ℃的光照培养箱内,待菌悬液的温度与培养箱内温度一致后,将桉苗放入其中,根部完全浸没到水中,每个处理5株桉苗,在浸根接种后0.5,1.0,2.0,4.0,6.0 h分别剪取幼根,测定不同温度条件下青枯菌根表吸附量和根部侵入量。3次重复,结果取平均值,利用Excel和DPS系统进行数据处理和分析。
1.2.3 不同pH值条件下青枯菌在尾巨桉苗木根表吸附量和根部侵入量测定先用10% NaOH和10% HCl将无菌水pH值调节为5.0,6.0,7.0,8.0,9.0,分别配制成浓度为3×108个·mL-1的细菌悬浮液,然后取600 mL相应pH值的细菌悬浮液放入1 L烧杯中,接种水培桉苗。将桉苗根部完全浸没到水中,每个处理5株桉苗,置于30 ℃的光照培养箱中,在0.5,1.0,2.0,4.0,6.0 h分别剪取幼根,测定不同pH值条件下青枯菌根表吸附量和根部侵入量。3次重复,结果取平均值,利用Excel和DPS系统进行数据处理和分析。
1.2.4 不同接种浓度下青枯菌在尾巨桉苗木根表吸附量和根部侵入量测定用无菌水分别配制浓度为3×105,3×106,3×107,3×108,3×109个·mL-1的细菌悬浮液,取600 mL装入容积为1L烧杯中,然后接种水培桉苗。将水培好的桉苗根部完全浸没到水中,每个处理5株桉苗,置于30 ℃的光照培养箱中,在接种后0.5,1.0,2.0,4.0,6.0 h分别剪取幼根,测定不同接种浓度条件下青枯菌根表吸附量和根部侵入量。3次重复,结果取平均值,利用Excel和DPS系统进行数据处理和分析。
1.2.5 根表吸附量和根部侵入量测定方法苗木根表吸附量测定(王军,2007):每株每次剪取1条幼根,距离幼根末端约2 cm,将截取的根尖浸入10 mL无菌水中,涤荡1 min后,取出根尖,用灭菌滤纸吸干外表水分,称质量,用血球计数板计数悬浮液中的细菌数量,即为青枯菌的根表吸附量。
苗木根部侵入量测定:将称重后的根尖放入10 mL无菌水中,磨碎,用血球计数板计数悬浮液中的细菌数量,即为青枯菌的根部侵入量,计算公式为:
细菌浓度(个·mL-1)=80小格内细菌总数(个)/80×400×10 000×稀释倍数(mL),
吸附或侵入量(个·g-1鲜质量)=细菌浓度(个·mL-1)×分离用水量(mL)/根质量(g鲜质量)。
2 结果与分析 2.1 温度对青枯菌在尾巨桉苗木根部吸附侵入的影响 2.1.1 温度对青枯菌在尾巨桉苗木根表吸附量的影响由图 1和2可知:在5个温度梯度中,12号和5号2菌株表现出相似的变化趋势。30 ℃时2菌株的根表吸附量最高,12号在6.0 h最高可达到1.02×109个·g-1 FW,5号在6.0 h最高可达到1.17×109个·g-1 FW,35 ℃时次之,25 ℃时有所下降,20和15 ℃时吸附量最低。所有温度梯度范围内,2菌株的吸附量都随时间的延长呈上升趋势,在相同条件下,5号菌株的根表吸附量总体高于12号菌株,表明强毒菌株的吸附能力强于弱毒菌株。分别对2菌株在不同温度下的根表吸附量进行方差分析,结果表明:不同温度下青枯菌在尾巨桉根表的吸附能力有极显著差异(P < 0.01)。多重比较结果显示: 12号和5号菌株在30 ℃时的根表吸附量与其他温度下的吸附量相比均具有极显著差异。
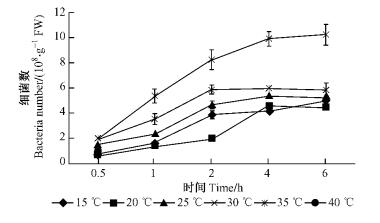
|
图 1 不同温度条件下12号青枯菌菌株对尾巨桉苗木的根表吸附量 Figure 1 Adsorption number of No.12 R.solanancerum isolate to eucalypt roots at different temperatures |
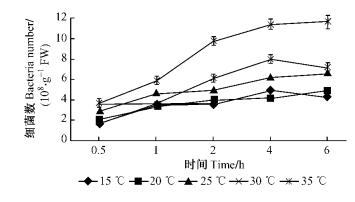
|
图 2 不同温度条件下5号青枯菌菌株对尾巨桉苗木的根表吸附量 Figure 2 Adsorption number of No.5 R.solanancerum isolate to eucalypt roots at different temperatures |
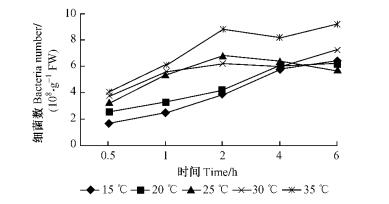
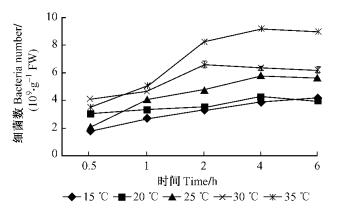
由图 3和4可知:在30 ℃时,12号和5号菌株的根部侵入量都达到最高,35 ℃时次之,在25 ℃时中等,15 ℃时最低。随着时间的延长,2菌株的根部侵入量都逐渐增大。在5个温度梯度中,12号和5号菌株根部侵入量具有相似的变化趋势,但2者略有差异,在30 ℃时,12号在6.0 h达到最高9.19×109个·g-1 FW,而5号在4.0 h已达到最高9.22×109个·g-1 FW。分别对不同温度下2菌株的根部侵入量进行方差分析,结果表明:温度对青枯菌在尾巨桉根部侵入能力具有显著影响,不同温度下12号菌株的根部侵入量具有显著差异(P=0.014 3 < 0.05),不同温度下5号菌株的根部侵入量具有极显著差异(P=0.000 5 < 0.01)。多重比较结果显示:在30 ℃时2菌株的根部侵入量最高,与其他温度下的侵入量相比均具有极显著差异。
|
图 3 不同温度条件下12号青枯菌菌株对尾巨桉苗木的根部侵入量 Figure 3 Ingression number of No.12 R.solanacearum isolate to eucalypt roots at different temperatures |
|
图 4 不同温度条件下5号青枯菌菌株对尾巨桉苗木的根部侵入量 Figure 4 Ingression number of No.5 R.solanacearum isolate to eucalypt roots at different temperatures |
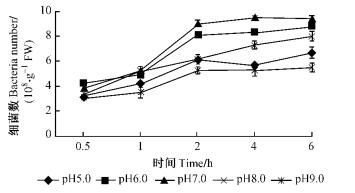
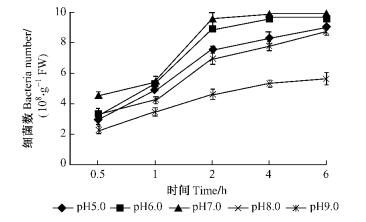
如图 5和6所示:在pH7.0时,2菌株的根表吸附量都最高,12号菌株和5号菌株最高分别为9.60×108和1.02×109个·g-1 FW,在pH6.0时,吸附量比pH7.0时都有所下降,pH8.0吸附量低于pH6.0但高于pH5.0时的吸附量,pH9.0时青枯菌的吸附量最少,12号和5号在6.0 h最高仅为5.51×108和5.67×108个·g-1 FW。分别对2菌株在不同pH条件下的根表吸附量进行方差分析,结果表明:不同的pH值条件对强弱菌株在尾巨桉的根表吸附量都具有极显著影响(P=0.000 1 < 0.01,P=0.000 1 < 0.01)。多重比较结果显示: 12号菌株在pH7.0和pH6.0时的根表吸附量没有显著差异,但与其他pH值时相比均有极显著差异,5号菌株在pH7.0和pH6.0时的根表吸附量也没有显著差异,但与其他pH值时相比均有极显著差异。
|
图 5 不同pH条件下12号青枯菌菌株对尾巨桉苗木的根表吸附量 Figure 5 Adsorption number of No.12 R.solanacearum isolate to eucalypt roots at different pH values |
|
图 6 不同pH条件下5号青枯菌菌株对尾巨桉苗木的根表吸附量 Figure 6 Adsorption number of No.5 R.solanacearum isolate to eucalypt roots at different pH values |
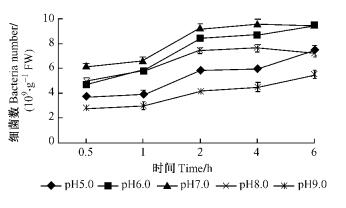
如图 7和8所示:在pH7.0时2菌株的根部侵入量最高,12号在6.0 h时达最高9.41×109个·g-1 FW,5号在6.0 h时最高达到9.63×109个·g-1 FW; 在pH6.0时根部侵入量与pH7.0相比都有所下降,12号菌株下降程度不如5号明显; 在pH8.0时,在开始的1.0 h内,2菌株的侵入量与pH6.0基本一致,在之后的时间里,二者的侵入量均小于pH6.0时的侵入量; 在pH5.0时,青枯菌的侵入量进一步下降,在pH9.0时,菌株的侵入量降到最低,12号和5号的降幅不同,12号下降更明显。分别对2菌株在不同pH条件下的根部侵入量进行方差分析,结果表明:不同的pH条件青枯菌在尾巨桉根部侵入量具有极显著差异(P=0.000 1 < 0.01,P=0.000 1 < 0.01)。2菌株在pH7.0时的根部吸附量与其他pH值时相比均具有极显著差异。
|
图 7 不同pH条件下12号青枯菌菌株对尾巨桉苗木的根部侵入量 Figure 7 Ingression number of No.12 R.solanacearum isolate to eucalypt roots at different pH values |
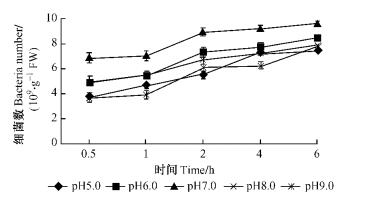
|
图 8 不同pH条件下5号青枯菌菌株对尾巨桉苗木的根部侵入量 Figure 8 Ingression number of No.5 R.solanacearum isolate to eucalypt roots at different pH values |
由图 9和10可知:当接种浓度为3.0×109个·mL-1时,12号和5号2菌株的吸附量都最高,12号在6.0 h时达到最高1.16×109个·g-1 FW,5号在6.0 h时达到最高1.25×109个·g-1 FW; 当接种浓度为3.0×108个·mL-1时,2菌株的吸附量都有所下降; 浓度为3.0×107个·mL-1时,2菌株的吸附量进一步降低; 当接种浓度为3.0×105个·mL-1时,2菌株的吸附量亦最低。随时间延长2菌株的根表吸附量都呈上升趋势,5号菌株的吸附量总体高于12号菌株。分别对2菌株在不同接种浓度时的根表吸附量进行方差分析,结果表明:不同接种浓度下青枯菌在尾巨桉根表吸附量具有极显著差异(P=0.000 1 < 0.01,P=0.000 1 < 0.01),多重比较结果显示: 2菌株在浓度为3.0×109个·mL-1时的根表吸附量与其他接种浓度相比均有极显著差异。
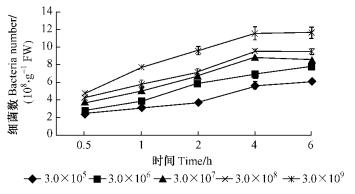
|
图 9 不同接种浓度条件下12号青枯菌菌株对尾巨桉苗木的根表吸附量 Figure 9 Adsorption number of No.12 R.solanacearum isolate to eucalypt roots with different inoculum |
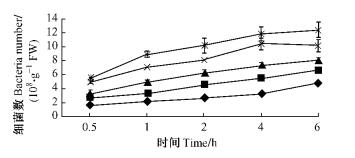
|
图 10 不同接种浓度条件下5号青枯菌菌株对尾巨桉苗木的根表吸附量 Figure 10 Adsorption number of No.5 R.solanacearum isolate to eucalypt roots with different inoculum |
由图 11和12可知:当接种浓度为3.0×109个·mL-1时,2菌株的根部侵入量达最高,12号的根部侵入量在4.0时达最高9.92×109个·g-1 FW,5号在6.0 h时达到最高1.06×10 10个·g-1 FW; 当接种浓度为3.0×108个·mL-1时,12号在4.0 h前,侵入量低于3.0×109个·mL-1时的侵入量,在4.0和6.0 h时侵入量变化较小,5号在整个接种时间内,侵入量与浓度为3.0×109个·mL-1时相比下降不明显; 接种浓度降低为3.0×107个·mL-1时,2菌株的根部侵入量明显降低; 当接种浓度为3.0×105个·mL-1时,2菌株的侵入量最低,12号和5号在6.0 h分别仅为5.38×109和6.16×109个·g-1 FW。在整个接种时间内,随着时间延长,2菌株根部侵入量都呈现上升趋势,5号菌株的根部侵入量基本都高于12号菌株。分别对2菌株在不同接种浓度时的根部侵入量进行方差分析,结果表明:不同接种浓度下青枯菌在尾巨桉根部侵入量具有极显著差异(P < 0.01)。多重比较结果表明: 12号菌株3.0×108和3.0×109个·mL-1 2浓度之间差异不显著,而与其他3个浓度相比根部侵入量具有极显著差异,5号菌株结果类似。表明在一定浓度范围内,接种浓度越高,根部侵入量也越高,但过高的接种浓度,其侵入量并不继续增加。
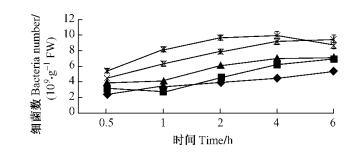
|
图 11 不同接种浓度条件下12号青枯菌菌株对尾巨桉苗木的根部侵入量 Figure 11 Ingression number of No.12 R.solanacearum isolate to eucalypt roots with different inoculum concentrations |
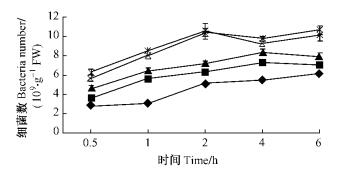
|
图 12 不同接种浓度条件下5号青枯菌菌株对尾巨桉苗木的根部侵入量 Figure 12 Ingression number of No.5 R.solanacearum isolate to eucalypt roots with different inoculum concentrations |
识别作用是病原和寄主相互感知的第一个环节,是通过病菌对寄主的吸附来实现的(Lippincott et al., 1984),吸附识别作用发生在病菌和寄主植物的细胞之间。在植物表面周围,当细菌借趋向运动与寄主接近到一定程度时,菌体与植物表面的正向和反向物理作用力达到平衡,菌体与植物细胞间的接触不牢固,容易受到机械力吸附,这个阶段称为可逆性吸附,一般时间较短。随着时间的延长,吸附作用增强,菌体与寄主表面的作用力由热力学力转变为生化结合力,借助菌毛或纤维素微纤丝的作用,吸附由可逆状态转变为不可逆状态(Marshall,1975)。在自然条件下,青枯菌在尾巨桉根部的吸附侵入时刻受到环境中温度、pH值、细菌的数量及湿度等不同因子的影响。在环境条件适宜时,有利于病菌的吸附和侵入,在环境条件不适宜时识别受阻甚至失败。
本试验结果表明:青枯菌对尾巨桉苗木根部吸附侵入的最适温度为30 ℃,此时强弱菌株的根表吸附量和根部侵入量都达到最高,35 ℃时次之,25 ℃时更少。这可能是在30 ℃的温度条件下,青枯菌代谢更活跃,运动能力更强,菌体与细胞表面的热力学力更容易转变为生化结合力,因而有利于青枯菌的吸附侵入。而过高或过低的温度,可能不利于菌体的代谢和活动。有研究表明:根瘤菌(Rhizobium japonicum)对大豆(Glycine max cv.Hardee)根部的吸附最适温度为27 ℃,温度高于或低于27 ℃,其吸附能力均呈现衰减趋势(Steven,1984)。使用浓度为3×108 CFU·mL-1青枯菌悬浮液接种番茄(Lycopersicon esculentum)发现:在25 ℃以上时,9天或更短时间就表现青枯病症状,在温度30与25 ℃的病情指数没有显著差别,但30 ℃潜育期短,只需5天,25 ℃潜育期稍长,则需9天(卓国豪,2005)。说明适宜的条件不仅有利于青枯菌的吸附,也有利于侵入,这与本试验的结果相一致。在我国华南地区,夏季高温多雨的气候条件,为青枯病的发生提供有利条件。
在对pH值的研究中发现:在pH6.0或pH7.0的环境中,强弱菌株的根表吸附量和根部侵入量都很高,说明中性或弱酸性的环境有利于青枯菌的侵入和增殖。微生物和寄主发生吸附侵入作用部位的pH值能够影响微生物的新陈代谢活性和作用部位的各分子的电荷数,在适宜的pH值条件下,细菌的新陈代谢活跃,运动能力强,有利于细菌的运动。pH值的不同能够改变细胞表面各分子的电荷数,影响氢键的形成,对吸附侵入有促进或抑制作用。Munns(1969)发现当pH值由4.5增加至5.6时,根瘤菌对花苜蓿(Medicago ruthenica)的致瘤能力由无增至最大。根癌农杆菌对培养的曼陀罗细胞吸附的最适pH值为6.0(Ohyama et al., 1979),青枯菌与桉树苗木发生吸附识别的部位是在植物的根际,根际环境的pH值在一定程度上决定细菌能否成功对寄主进行吸附识别,当根际周围形成适宜的pH值条件时,有利于青枯菌的吸附和侵入,容易引起寄主发病。因此,在防治青枯病时可采取一定的措施,改变根围环境的酸碱度,创造不利于青枯菌吸附侵入的环境条件,降低青枯菌的侵染能力,从而一定程度上减少青枯病的危害。
浓度接种试验结果显示:当接种浓度为3.0×108和3.0×109个·mL-1时,强弱菌株的吸附量和侵入量都很高,说明高接种浓度有利于青枯菌在尾巨桉根部的吸附侵入。卓国豪(2005)的研究也表明:接种高浓度的青枯菌,番茄的病情指数也相对较高,与本试验结果相一致,分析可能是高浓度的青枯菌能克服细胞表面的防卫机制,在细胞表面吸附定殖的机率更大。试验中还发现:随着接种浓度的逐渐升高(3.0×105,3.0×106,3.0×107,3.0×108个·mL-1),青枯菌的根表吸附量和根部侵入量都呈上升趋势,但是当接种浓度为3.0×109个·mL-1时,与3.0×108个·mL-1相比,青枯菌的根表吸附量和根部侵入量都没有明显上升,分析可能是受根表吸附位置的影响,当细菌浓度较低时,根表有相对多的吸附位置可占用,有相对多的细菌就可以吸附到根表; 而使用过高浓度的菌悬液进行接种时,受根表吸附位置的限制,青枯菌的根表吸附量和根部侵入量没有明显增加。
在温度、pH值和接种浓度条件改变时,尽管强毒弱毒菌株的吸附量和侵入量的变化趋势基本一致,但2者受到的影响程度有一定差异,12号菌株受外界条件改变的影响要大于5号菌株,在pH5.0时,12号菌株的根部侵入量的下降幅度比5号菌株明显。这可能是由于弱毒菌株侵入寄主的能力较差,抵抗外界环境条件改变的能力也弱,使得外界环境条件的改变对弱毒菌株的影响大于强毒菌株。
综上所述,温度、pH值和接种浓度是影响青枯菌对尾巨桉根部吸附和侵入的3个重要因素,其在病原菌和寄主的互作过程中发挥重要作用,这对深入研究青枯菌对桉树的吸附识别过程具有重要参考意义。
曹季丹. 1982. 巴西柳桉、巨桉青枯病调查初报[J]. 广西林业科学, (4): 30-31. |
罗焕亮, 王军, 邵志芳, 等. 2002. 木麻黄青枯菌的根表吸附及根内增殖与其致病性的关系[J]. 林业科学研究, 15(1): 21-27. |
王军, 韦爱梅, 孙思. 2007. 青枯菌对桉树及非寄主树木根部吸附和侵入的比较[J]. 林业科学, 43(7): 51-54. |
卓国豪. 2005. 温度和病原接种浓度对番茄青枯病菌侵染的影响[J]. 植物检疫, 19(3): 143-144. |
Kelman A. 1954. The relationship of pathogenicity in Pseudomonas solanacearum to colony appearance on a tertrazolium medium[J]. Phytopathology, 64: 293-295. |
Lippincott J L, Lippincott B B. 1984. Concepts and experimental approaches in host-microbe recognition//Kosuge T, Nester E W.Plant-Microbe Interactions, Molecular and Genetic Perspectives: Vol.11 MPC[J]. New York, CMP, London: 195. |
Marshall K C. 1975. Clay mineralogy in relation to survival of soil bacteria[J]. Annual Review of Phytopathology, 13: 357-373. DOI:10.1146/annurev.py.13.090175.002041 |
Munns D N. 1969. Enzymatic breakdown of pectin and acid-inhibition of the infection of Medicago roots by Rhizobium[J]. Plant and Soil, 30(1): 117-120. DOI:10.1007/BF01885269 |
Ohyama K, Pelcher L E, Schaefler A, et al. 1979. In vitro binding of Agrobacterium tumefaciens to plant cells from suspension culture[J]. Plant Physiology, 63: 382-387. DOI:10.1104/pp.63.2.382 |
Steven G P. 1984. Adsorption of slow-and fast-growing Rhizobia to soybean and cowpea roots[J]. Plant Physiology, 75: 924-928. DOI:10.1104/pp.75.4.924 |
 2010, Vol. 46
2010, Vol. 46

