文章信息
- 李雪飞, 胡静静, 王庆菊, 沈向, 毛志泉
- Li Xuefei, Hu Jingjing, Wang Qingju, Shen Xiang, Mao Zhiquan
- 微量元素喷施对紫叶桃叶片花色苷含量及其合成酶活性的影响
- Effects of Spraying Microelement on Anthocyanin and the Relevant Biosynthesis Enzymes in Prunus persica f.atropurpurea Leaves
- 林业科学, 2010, 46(12): 75-79.
- Scientia Silvae Sinicae, 2010, 46(12): 75-79.
-
文章历史
- 收稿日期:2009-11-23
- 修回日期:2010-03-31
-
作者相关文章
植物生长发育除需要大量元素氮、磷、钾等以外,还需要微量元素硼、钼、铜、锌、铁等。这些元素在植物体内虽然含量很少,但它对植物的生长发育起着至关重要的作用。有研究表明:茶树(Melaleuca alternifolia)新梢黄化叶中Mn元素含量显著低于茶树叶片正常范围的低限值,是导致其叶片中色素含量变化的原因(姚元涛等,2009)。而且微量元素是植物体内酶或辅酶的组成部分,对于酶活性的调控作用明显,是作物生长发育不可缺少的和不可相互代替的。
花色苷和其他类黄酮色素是植物中一大类次生代谢产物,它们可以使植物的花、叶、果、茎产生丰富的色彩。花色苷存在于细胞液泡中,以糖苷的形式存在,具有吸光性而表现出粉色、紫色、红色及蓝色等(于晓南等,2002)。花色苷是一类广泛存在于植物中的类黄酮化合物,花色苷与叶绿素、类胡萝卜素等其他色素共同决定植物器官的着色。花色苷的合成一直受到关注,其生物合成途径已经基本清楚(Awad et al., 2001; Takos et al., 2006),主要是在一系列酶的作用下,在细胞质中转化为花色苷,通过液泡膜进入液泡中。研究表明:苯丙氨酸解氨酶(phenylalanine ammoni-alyase,PAL)、查耳酮异构酶(chalcone isomerase,CHI)、二氢黄酮醇还原酶(dihydroflavonol 4-reductase,DFR)和尿苷二磷酸-葡萄糖-类黄酮糖基转移酶(UDP glucose flavonoid glucosyltransferase,UFGT)与花色苷的合成密切相关,但对不同酶在花色苷合成中的作用研究结果不尽一致。油茶(Camellia oleifera)果皮花青素与PAL酶活性呈显著线性正相关(杨光道等,2007)。对紫叶稠李(Prunus virginiana ‘Schubert’)花色苷的合成过程研究表明:花色苷积累由DFR启动,CHI对花色苷合成起促进作用,可能导致PAL活性的提高(王庆菊等,2008)。UFGT酶在草莓(Fragaria)果实发育的绿熟期和全红期活性相对较高,果实发育后期UFGT活性很高,催化花色苷的大量合成,而果实发育前期没有花色苷的积累,其活性还相对较高(Halbwirth et al., 2006)。UFGT起到糖基转移的作用,它可提高花色苷稳定性,是花色苷合成过程的延续,促进花色苷的大量积累(张琼等,2008)。影响花色苷合成的因素有许多,施肥水平对花色苷合成有较大的影响。在元宝枫(Acer truncatum)变色前期对其增施钾肥可以明显地促进叶片中花色苷和可溶性糖的积累(王志红等,2009)。‘三月红’荔枝(Litchi chinensis ‘Sanyuehong’)果皮着色由花色苷含量上升,而光合色素含量下降引起; PK,Ca和PK+Ca处理可以促进果皮着色(周开兵等,2007)。而微量元素对红叶树种叶片中花色苷含量的影响少见报道。
紫叶桃(Prunus persica f.atropurpurea)亦称红叶碧桃,系蔷薇科李属(Prunus)落叶小乔木,株高3~5 m,树皮灰褐色,小枝红褐色。单叶互生,卵圆状披针形,幼叶鲜红色。花重瓣、桃红色。为我国北方常见观赏树木。叶面喷施微量元素浓度低,用量少,易于吸收,且不会造成土壤中重金属残留。因此本研究以紫叶桃为试材,选择几种微量元素对紫叶桃叶片进行喷施处理,以研究微量元素对紫叶桃叶片花色苷含量及其合成相关酶活性的影响,从而为红叶树种叶色的调控以及为红叶树育种提供理论参考。
1 材料与方法 1.1 试验材料试验于2007年山东农业大学观赏果树实验园内进行,以3年生的单株盆栽紫叶桃为试材。
1.2 试验方法微量元素Fe,Mn,Zn,B分别使用分析纯FeSO4,MnSO4,ZnSO4、硼砂,喷施浓度均为0.2%,以叶面喷施清水作为对照,每个处理20盆,共5个处理。2007年5月24日,紫叶桃新梢旺长,中部以下叶片发育成熟,自下午5点开始进行叶面喷施微量元素试验,每10天喷1次,处理10天后取样再进行下1次喷施,共喷施5次。采样时,取各处理自顶端数第7~9片健康成熟叶,每株取5片,混合后装入带冰保温箱运回实验室,分为2部分:花色苷测定样品置4 ℃冰箱保存; 花色苷合成相关酶活性测定样品直接用液氮速冻,-70 ℃保存。
1.3 测定指标及方法 1.3.1 花色苷的测定参考王庆菊等(2008)的方法,将所取叶片洗净、擦干、剪碎后,采用1.5 mol·L-1 HCl: 95%乙醇=15 : 85(v/v)混合液,在黑暗条件下浸提24 h,后用岛津UV-2450紫外可见分光光度计检测535 nm波长的光密度值,进行花色苷含量的计算。
1.3.2 花色苷合成相关酶活性测定待测酶液的提取参照王惠聪等(2004)的方法。取0.5 g样品液氮研磨,转入离心管后加入5 mL提取液[0.05 mol·L-1磷酸缓冲液(pH 7.0),0.05 mol·L-1抗坏血酸,0.018 mol·L-1巯基乙醇],4 ℃下15 000 g离心20 min,上清液为酶粗提液用于测定PAL,CHI。取样品1 g加液氮研磨后,加入5 mL-20 ℃的丙酮混匀离心,弃去上清液,用4 mL-20 ℃丙酮再提取1次,沉淀用4 mL[0.1 mol·L-1硼酸缓冲液(pH 8.8),5 mmol·L-1抗坏血酸]溶液提取,上清液为DFR和UFGT酶的粗提液。
PAL,CHI,UFGT酶活性的测定参照Lister等(1996)的方法,DFR活性测定参照Stafford等(1982; 1984)的方法。测定重复3次。
1.4 数据处理数据采用Excel2003及DPSv3.01专业版统计软件进行统计分析。
2 结果与分析 2.1 微量元素喷施对花色苷含量的影响春季紫叶桃幼叶因含有大量的花色苷而呈紫红色,随着时间的变化,环境温度、光照等条件发生相应的变化,花色苷的含量降低,紫叶桃叶片的紫红色逐渐变淡。叶片中花色苷在6月中旬以前含量较高,6月中旬叶片中花色苷的含量迅速降低,6月下旬紫叶桃叶片中花色苷含量有所上升,但上升缓慢。喷施不同的微量元素,对紫叶桃叶片中花色苷的含量有不同的影响。如图 1所示,喷施微量元素初期,即6月3日左右各个处理之间叶片花色苷的含量差异不显著(P > 0.05),6月13日左右除喷硼的处理以外叶片中花色苷的含量均低于对照,6月23日以后对照,喷施Mn,Zn,B处理叶片中花色苷的含量均有所增加,到7月14日为止分别增加20.1%,96.4%,54.5%,27.5%,说明喷施Mn和Zn的处理叶片中花色苷的含量增加量更多,喷施B处理与对照差异不显著。喷施Fe的相比对照有下降趋势。由此可见:喷施微量元素并不能改变紫叶桃花色苷的动态变化进程,但对其存在不同的后续影响。喷施初期紫叶桃叶片中花色苷的含量低于对照可能是由于叶片对元素的吸收、运输引起,6月23日以后,除喷施Fe处理外,不同处理紫叶桃叶片中花色苷的含量表现出了不同程度的增幅,可能是不同元素在植物体内参与花色苷的生物合成而引起。
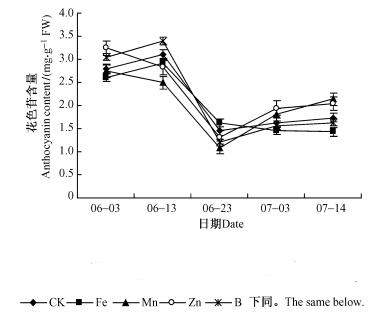
|
图 1 不同处理花色苷含量变化 Figure 1 Changes of anthocyanin content on different treatments |
不同微量元素喷施处理对花色苷合成过程中几个酶的活性产生不同的影响。如图 2A所示,6月13日之前,不同处理间PAL酶的活性无显著的差异,喷施微量元素的处理的活性低于对照; 6月23日以后喷施Fe,B的紫叶桃叶片中PAL酶的活性逐渐高于对照,但喷施Mn,Zn的紫叶桃叶片中PAL酶活性变化幅度较小,且均低于对照; 7月3日以后各处理紫叶桃叶片中PAL酶的活性均降低,但喷施Mn,Zn的处理PAL酶活性降低幅度低于喷施Fe,B,对照的处理。
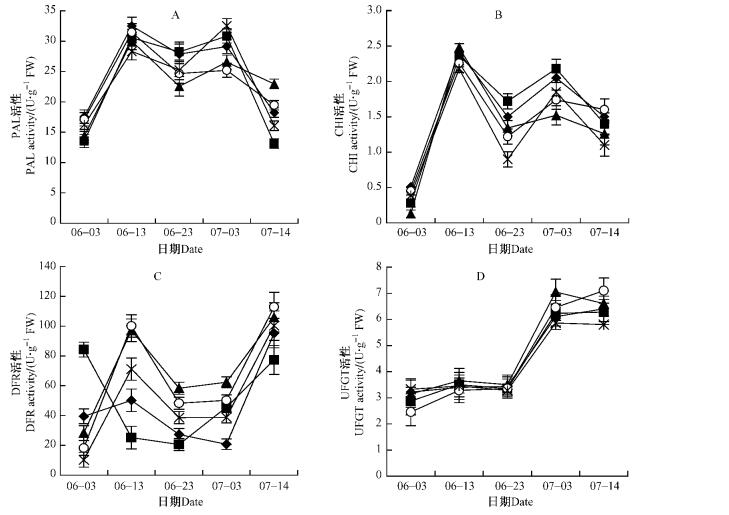
|
图 2 不同处理PAL,CHI,DFR,UFGT活性变化 Figure 2 Changes of PAL, CHI, DFR, UFGT activities on different treatment |
不同处理紫叶桃叶片中CHI酶活性的变化与PAL酶活性的变化类似,6月13日之前不同处理间CHI酶的活性差异不显著; 6月23日以后,除喷施Fe的处理外其他处理均低于喷清水的处理。
不同微量元素喷施处理后,花色苷合成过程的4个相关酶中DFR酶的活性变化最显著。喷施Fe后紫叶桃叶片中DFR酶的活性首先升高但迅速降低,6月23日DFR酶的活性达到最低值,之后逐渐升高。喷施Mn,Zn后,紫叶桃叶片中DFR酶活性的变化基本一致,6月13日之前DFR酶的活性迅速升高,在6月13日左右出现DFR活性的高峰,而后迅速降低,6月23日之后DFR酶活性逐渐升高。喷施B的处理与喷施Mn,Zn的处理变化规律类似,但喷B处理在整个测定过程中DFR酶的活性均低于喷施Mn,Zn的处理,6月13日左右喷B处理紫叶桃叶片中DFR酶的活性也出现峰值,但DFR酶活性的增幅远低于喷施Mn,Zn的处理。清水处理的紫叶桃叶片中DFR酶活性在7月3日之前变化幅度较小,且DFR活性的平均值低于Mn,Zn,B处理中DFR酶的活性。DFR酶活性的差异出现在花色苷含量的差异之前,因此本试验进一步证明DFR酶对花色苷合成的启动作用。
整个测定过程中,各个处理间紫叶桃叶片中UFGT酶活性差异不显著,6月23日之后,Mn,Zn处理的紫叶桃叶片中UFGT酶的活性高于其他处理(图 2D)。
3 讨论在色叶树种的花色苷发育中,PAL,CHI,DFR和UFGT几个酶均起到一定作用(王庆菊等,2008)。对水稻(Oryza sativa)矿质元素对花色苷含量的影响做过大量的研究,张名位等(1995)研究报道,黑米稻(Oryza sativa)籽粒花色苷含量与铁、锰含量表现正相关,与锌含量表现负相关。Zheng(2000)研究表明,黑米稻籽粒花色苷含量与Mg2+和Ca2+含量呈显著正相关。孙明茂(2006)的研究表明,水稻籽粒花色苷含量与Mn,Ca含量均呈极显著正相关。李颖畅等(2009)在金属离子对蓝莓(Vaccinium vitisidaea)花色苷稳定性的影响的研究中发现,高浓度的Zn2+,Mn2+具有增色作用,而且能够增强花色苷的稳定性; Fe2+,Fe3+,Pb2+对花色苷具有破坏作用,使花色苷的稳定性下降。但矿质元素对红叶树种叶片中花色苷含量的影响却未见报道,本研究选择几种微量元素对紫叶桃叶片进行喷施处理,并检测喷施微量元素后紫叶桃叶片花色苷含量的变化,结果表明:喷施B对紫叶桃叶片中花色苷含量及相关酶活性影响并不显著。喷施Mn,Zn的处理花色苷的含量在处理20天以后叶片花色苷的含量增加幅度高于其他处理,此结果进一步证明Mn,Zn与花色苷含量的正相关关系,同时喷施Fe处理对紫叶桃叶片中花色苷合成有抑制作用,这与李颖畅等(2009)的研究结果一致。而郭世乾等(2006)研究认为钾、铁能促进南果梨(Cyclamen persicum)果皮花青素的合成,有利于PAL活性的提高。结果不一致的原因推断可能与试验材料有关,也可能与Fe2+浓度有关,这有待于进一步研究。
另外,喷施微量元素后笔者检测花色苷合成相关酶的活性变化,结果表明: PAL,CHI,DFR,UFGT 4个酶中,DFR酶活性变化最为显著,Mn,Zn处理后DFR酶的活性显著高于对照。DFR酶活性的差异出现在花色苷含量的差异之前,因此本试验进一步证明DFR酶对花色苷合成的启动作用。
有研究表明:外部因素影响花色苷的积累大都是通过诱导相关转录因子的表达,然后通过这些转录因子调控花色苷途径结构基因的表达,进而影响花色苷的合成和积累(李春雷等,2009)。微量元素可以调控花色苷含量及相关酶活性,这可能是由于微量元素促进或抑制某些相关酶基因的表达,其机理有待于进一步研究。
郭世乾, 王春枝, 李瑛, 等. 2006. 施肥对南果梨花青素含量及苯丙氨酸解氨酶活性的影响[J]. 中国农学通报, 22(2): 313-315. |
胡位荣, 张昭其, 季作梁, 等. 2004. 酸处理对采后荔枝果皮色泽与生理活性的影响[J]. 食品科学, 25(7): 176-180. |
李春雷, 崔国新, 许志茹, 等. 2009. 植物二氢黄酮醇4-还原酶基因的研究进展[J]. 生物技术通讯, 39(3): 442-445. |
李颖畅, 孟宪军, 周艳. 2009. 金属离子和食品添加剂对蓝莓花色苷稳定性的影响[J]. 食品科学, 30(9): 80-84. |
孙明茂. 2006. 水稻籽粒铁、硒、锌、铜等矿质元素和花色苷含量的遗传及QTL分析. 山东农业大学硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10434-2006102600.htm
|
王惠聪, 黄旭明, 胡桂兵, 等. 2004. 荔枝果皮花青苷合成与相关酶的关系研究[J]. 中国农业科学, 37(12): 2028-2032. DOI:10.3321/j.issn:0578-1752.2004.12.043 |
王庆菊, 李晓磊, 王磊, 等. 2008. 紫叶稠李叶片花色苷及其合成相关酶动态[J]. 林业科学, 44(3): 45-49. DOI:10.11707/j.1001-7488.20080312 |
王志红, 蔺银鼎. 2009. K元素对元宝枫秋叶变色的影响研究[J]. 山西农业大学学报:自然科学版, 29(2): 139-142. |
杨光道, 段琳, 束庆龙, 等. 2007. 油茶果皮花青素、糖含量和PAL活性与炭疽病的关系[J]. 林业科学, 43(6): 100-104. |
姚元涛, 刘谦, 张丽霞, 等. 2009. 山东棕壤茶园幼龄茶树叶片黄化病因诊断与防治研究[J]. 植物营养与肥料学报, 15(1): 219-224. |
于晓南, 张启翔. 2002. 观赏植物的花色素苷与花色[J]. 林业科学, 38(3): 147-153. DOI:10.11707/j.1001-7488.20020326 |
张名位, 赖来展, 杨雄, 等. 1995. 中国黑米种质资源的评价与利用研究进展[J]. 湖北农学院学报, 15(4): 310-318. |
张琼, 王红清, 冷平, 等. 2008. 草莓果实发育过程中花色苷和黄酮醇类物质的形成机制[J]. 园艺学报, 35(12): 1735-1741. DOI:10.3321/j.issn:0513-353X.2008.12.003 |
周开兵, 苏举, 徐远锋. 2007. 磷、钾和钙元素对三月红荔枝果皮着色的影响[J]. 中国土壤与肥料, (6): 54-57. DOI:10.11838/sfsc.20070614 |
Awad M A, Jager A D E, Plas L H W, et al. 2001. Flavonoid and chlorogenic acid changes in skin of Elstar and Jonagole apples during development and riping[J]. Scientia Horticulture, 90(1/2): 69-83. |
Halbwirth H, Puhl I, Haas U, et al. 2006. Two-phase flavonoid formation in developing strawberry(Fragaria×ananassa)fruit[J]. Journal of Agriculture and Food Chemistry, 54(4): 1479-1485. DOI:10.1021/jf0524170 |
Lister C E, Lancaster J E. 1996. Developmental changes in enzymes of fl avonoid biosynthesis in the skins of red and green apple cultivars[J]. Journal Science of Food and Agriculture, 71(3): 313-320. DOI:10.1002/(ISSN)1097-0010 |
Stafford H A, Lester H H. 1982. Enzymic and nonenzymic reduction of(+)dihydroquercetin to its 3, 4-diol[J]. Plant Physiology, 70: 695-698. DOI:10.1104/pp.70.3.695 |
Stafford H A, Lester H H. 1984. Flavan-3-ol biosynthesis The conversion of(+)dihydroquercetin and flavan-3, 4-cis-diol(leuocyanidin)to(+)catechin by reductases extracted from cell suspension cultures of Douglas Fir[J]. Plant Physiology, 76: 184-186. DOI:10.1104/pp.76.1.184 |
Takos A M, Jaffe F W, Jacob S R, et al. 2006. Light-induced expression of a MYB gene regulates anthocyanin biosynthesis in red apples[J]. Plant Physiology, 142(3): 1216-1232. DOI:10.1104/pp.106.088104 |
Zheng G Z. 2000. Effects of blackish purple colored seed coat on grain quality and yield associated characters in rice(Oryza sativa L.)[J]. MS thesis, Seoul University(Korea): 1-41. |
 2010, Vol. 46
2010, Vol. 46

