文章信息
- 杨虎清, 吴峰华, 周存山, 王允祥
- Yang Huqing, Wu Fenghua, Zhou Cunshan, Wang Yunxiang
- NO对杨梅采后活性氧代谢和腐烂的影响
- Effects of Nitric Oxide on Active Oxygen Metabolism and Fruit Decay in Postharvest Chinese Bayberry
- 林业科学, 2010, 46(12): 70-74.
- Scientia Silvae Sinicae, 2010, 46(12): 70-74.
-
文章历史
- 收稿日期:2009-10-20
- 修回日期:2010-01-06
-
作者相关文章
 含量的增加,降低MDA的含量和膜透性的升高,防止膜脂过氧化,延缓果实的衰老。适宜浓度的NO处理可维持杨梅采后活性氧代谢的平衡,从而延缓果实的衰老进程和抑制果实腐烂,保持杨梅良好的贮藏品质。
含量的增加,降低MDA的含量和膜透性的升高,防止膜脂过氧化,延缓果实的衰老。适宜浓度的NO处理可维持杨梅采后活性氧代谢的平衡,从而延缓果实的衰老进程和抑制果实腐烂,保持杨梅良好的贮藏品质。杨梅(Myrica rubra)为我国著名特产水果,味道鲜美,风味独特,具有很高的营养和医疗保健价值。但杨梅一般在初夏高温、高湿的梅雨季节收获,且无外果皮包裹,易受机械损伤和青霉菌(Penicillium)等病原真菌的侵染,采后极易腐烂变质。因此,开展杨梅的贮运保鲜技术研究具有积极意义。国内对杨梅采后生理和贮运保鲜技术的研究已取得较大的进展,但较高的腐烂率和有限的流通半径仍然限制杨梅产业的发展。一氧化氮(NO)是植物中普遍存在的信号分子,参与调控植物的生长、发育、成熟衰老及其胁迫响应等生理过程(Leshem,2000)。Leshem等(1998)通过对一些果蔬、花卉的研究发现:果实采后可以产生NO,随着果实的成熟和衰老,组织内源NO的释放量逐渐降低,乙烯的释放量逐渐升高。对采后果蔬如花椰菜(Brassica oleracea var.botrytis)(Will et al., 2004)、梨(Pyrus)(Sozzi,2003)、草莓(Fragaria)(Wills et al., 2000; Zhu et al.,2007)等采用外源低浓度NO熏蒸处理,结果表明:果蔬内源乙烯合成受到抑制,成熟和衰老有所延缓,果蔬的货架寿命被延长,表明NO可能是一种可延缓果实衰老的天然植物生长调节物质。迄今NO对杨梅的保鲜作用尚未见系统研究。本试验选用“东魁”杨梅进行浸果处理,研究NO对杨梅采后活性氧代谢和贮藏品质的影响,以期从活性氧伤害学说的角度探讨NO抑制杨梅衰老和减少腐烂的机制,为NO应用于杨梅的贮藏保鲜提供科学依据。
1 材料与方法 1.1 试验材料供试材料为浙江仙居“东魁”杨梅,2008年6月28日采收并于当天运回实验室。选择大小、成熟度基本一致,无病虫害,无机械损伤的果实,在5 ℃预冷12 h后进行处理。
1.2 试验方法用无氧重蒸水分别配制0(对照),10,25和50 μmol·L-1的SNP溶液,共4个处理,3次重复,每个重复杨梅1 500 g,室温浸泡2 h,由于SNP释放NO速度较慢,本试验参考朱树华等(2005)的方法,保证杨梅果实能够充分吸收NO,但长时间浸泡会伤害杨梅。待果实表面水分晾干后单层随机摆放在白瓷盘中,用保鲜膜封口,在(0±0.5)℃,相对湿度90%~95%的冷库贮藏。贮藏期间每隔4天取样测定以下指标。
1.3 测定方法 1.3.1 杨梅果实腐烂指数参考杨震峰等(2005)方法。以杨梅果实表面出现病斑作为果实腐烂的判别依据。按果实腐烂面积大小将果实划分为4级,0级:无腐烂; 1级:果面有1~3个小腐烂斑点; 2级:腐烂面积占果实面积的25%~50%;3级:腐烂面积大于果实面积的50%。按下式计算腐烂指数:
腐烂指数=Σ [(腐烂级别×该级果实数)/(总果实数×最高腐烂级别)]×100%
1.3.2 总糖、总酸和维生素C含量测定杨梅压榨取汁,经活性炭脱色后,分别用蒽酮比色法和NaOH滴定法测定果汁中的总糖(以葡萄糖计量)和总酸(以柠檬酸计量)含量。
维生素C:用2,6-二氯靛酚法测定,含量以mg·(100 g)-1 FW表示。
1.3.3 电导率测定参考茅林春等(2004)方法,随机取5只杨梅果实,用蒸馏水冲洗果实表面3 s,然后将果实放入500 mL烧杯中,加入400 mL蒸馏水,轻轻振荡0.5 h后,用Ec215 ConductivityMeter测定浸泡液的电导值。然后,再测定煮沸10 min以后(补足蒸发掉的水,冷却至室温)的电导值。以相对电导率(%)表示杨梅果实细胞结构的完整性。
1.3.4 丙二醛(MDA)含量的测定采用硫代巴比妥酸法,单位为μmol·g-1 FW。
1.3.5 超氧阴离子(
按照王爱国等(1990)的方法测定。
1.3.6 过氧化氢含量采用林植芳等(1988)的方法测定。
1.3.7 酶液的提取及活性测定取5 g果肉,加25 mL 0.05 mol·L-1磷酸缓冲液(pH 7.8)匀浆,4 ℃15 000 g离心15 min,取上清液。酶活性测定参考曹健康等(2007)方法。
超氧化物歧化酶(SOD)以抑制NBT光化还原50%为1个酶活单位,计为U·g-1 FW h--1。过氧化氢酶(CAT)活性以每克果肉1 min OD240值变化0.1为1个酶活单位,表示为△OD240·g-1FW min-1。
过氧化物酶(POD)活性以每克杨梅样品(鲜质量)每分钟吸光度变化值增加1时为1个活性单位,单位△OD470·g-1 FW min-1。
1.4 数据分析所有试验均重复3次,结果所列的数据是3次重复的平均值。采用SPSS 13.0对数据进行处理,试验数据采用ANOVA进行邓肯氏多重差异分析(P < 0.05)。
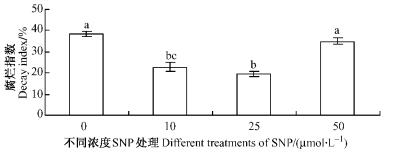
2 结果与分析 2.1 NO处理对杨梅果实腐烂的抑制作用如图 1所示:经过16天贮藏后4个处理的杨梅果实都出现腐烂,高浓度NO(50 μmol·L-1)处理的果实腐烂指数与对照之间差异不显著,10和25 μmol·L-1处理的腐烂指数均显著低于对照(P < 0.05),但以25 μmol·L-1处理的腐烂指数最低,仅为对照果实的51.3%,说明NO处理能够抑制杨梅的腐烂,但抑制效果与处理浓度有关,高浓度NO处理可能对杨梅果实产生一定程度的伤害。
|
图 1 不同浓度SNP处理对杨梅果实腐烂指数的影响 Figure 1 Effect of different concentration SNP on decayindex of Chinese Bayberry fruit 图中所列数据是3次重复的平均值。柱形图中所列的字母完全不同时,说明通过邓肯氏多重差异分析(P < 0.05)。 Each valuerepresents the mean±S.E.of three replicates.The numerical valueswith different letters are significantly different(P < 0.05). |
果实中总糖、总酸和维生素C的含量是影响风味和品质的主要因素之一。如表 1所示:随着贮藏进程,杨梅果实的总糖、总酸和维生素C含量逐渐下降。贮藏前4天,NO处理对总糖、总酸和维生素C含量变化无显著影响,而在第8天NO处理果实的总糖、总酸和维生素C含量显著高于对照,尤其25 μmol·L-1处理的总糖、总酸和维生素C含量最高。贮藏末期各处理果实的总糖、总酸和维生素C含量无显著差异。
|
|
2.3 NO处理对相对膜透性、MDA含量的影响
杨梅在(0±0.5)℃下贮藏16天,所有果实的相对电导率逐渐增加(图 2),这是细胞膜结构被破坏导致膜透性增加的结果。NO处理果实的相对电导率的变化趋势与对照一致,但25 μmol·L-1处理的相对电导率显著低于对照(P < 0.05)。杨梅果实中MDA的含量随贮藏时间逐渐增加,贮藏4天后25和10 μmol·L-1 NO处理果实的MDA含量显著低于对照(P < 0.05),而50 μmol·L-1 NO处理果实的MDA含量与对照无显著差异。说明25 μmol·L-1 NO处理可减少杨梅果实内MDA的含量,能有效地保护细胞膜结构,延缓果实衰老。

|
图 2 NO处理对相对电导率和MDA含量的影响 Figure 2 Effect of NO treatment on the relative conductivity and MDA content of Chinese Bayberry fruit |
在电子链中,超氧阴离子被催化生成H2O2,当这2种物质积累到一定程度则转化为活性更强的·OH-离子,从而诱发膜脂过氧化。杨梅在采后贮藏过程中,
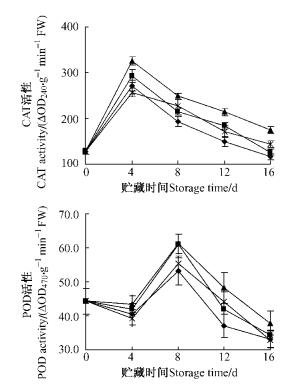
采后杨梅果实的SOD活性在开始时较低,随着贮藏时间的延长逐渐上升,在贮藏第8天不同处理的SOD活性均达到最大值。贮藏8天以后,25 μmol·L-1处理果的SOD活性显著高于对照(P < 0.05),但10和50 μmol·L-1处理的SOD活性与对照之间没有显著差异。
杨梅果实的CAT活性在贮藏第4天达到最大值,以后持续下降。NO处理有效延缓CAT活性的降低,在贮藏后期NO处理果的CAT活性一直高于对照,但只有25 μmol·L-1处理与对照之间存在显著差异。

|
图 3 NO处理对杨梅果实超氧阴离子产生速率和H2O2含量的影响 Figure 3 ffect of NO treatment on  |
|
图 4 NO处理对杨梅果实SOD,CAT和POD活性的影响 Figure 4 Effects of NO treatment on the SOD, CAT and POD activities in Chinese Bayberry fruit |
采后杨梅果实的POD活性呈现稍微上升再下降趋势,而后迅速上升到最大值再下降。对照果的POD活性在贮藏第8天达到最大值53.07 △OD470·g-1FW min-1,而后POD活性逐渐降低。NO处理果的POD活性变化趋势与对照相似,也在第8天达到最大值,而后又逐渐降低,但其峰值均高于对照果,从第8天开始25 μmol·L-1处理的POD活性显著高于对照(P < 0.05),而10和50 μmol·L-1处理的POD活性与对照之间显著不差异。
3 讨论采后果实的后熟衰老是一种复杂的生理生化过程。伴随着果实的成熟衰老,抗氧化酶系统活性的下降和丧失,会导致自身活性氧代谢的失调而积累活性氧,诱导膜脂中不饱和脂肪酸发生过氧化作用,造成膜脂过氧化产物MDA含量和细胞膜透性的增加,加速衰老过程。本试验结果表明:杨梅在贮藏过程中,
果实在成熟衰老过程中,随着活性氧的产生和累积,果实机体内部存在着相应的活性氧清除体系以保证正常的生理代谢活动。SOD,CAT,POD是植物体内活性氧自由基的酶促清除体系的主要酶类。SOD的主要功能是清除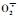
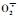
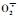
NO作为一种自由基,不仅可以与活性氧直接发生复合反应,而且可以调节与活性氧代谢密切相关的酶活性,从多方面多层次地调节细胞内活性氧的水平。首先,NO具有直接清除活性氧的作用,例如,NO与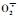
曹健康, 姜微波, 赵玉梅. 2007. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社.
|
柯德森, 王爱国. 1998. 成熟香蕉果实活性氧与乙烯形成酶活性的关系[J]. 植物生理学报, 24(4): 313-319. |
林植芳, 李双顺, 林桂珠. 1988. 衰老叶片和叶绿体中H2O2的累积和膜质过氧化的关系[J]. 植物生理学通讯, 14(1): 16-22. |
茅林春, 方雪花, 庞华卿. 2004. 1-MCP对杨梅果实采后生理和品质的影响[J]. 中国农业科学, 37(10): 1532-1536. DOI:10.3321/j.issn:0578-1752.2004.10.022 |
王爱国, 罗广华. 1990. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 26(6): 55-57. |
徐晓静, 张培正. 1994. 桃、李果实耐贮藏性与呼吸、乙烯和脂质过氧化作用的关系[J]. 果树科学, 11(1): 38-40. |
杨震峰, 郑永华, 曹士锋, 等. 2005. 纯氧对采后杨梅果实腐烂的抑制与抗病相关酶的诱导[J]. 植物生理与分子生物学学报, 31(4): 425-430. |
朱树华, 周杰, 束怀瑞, 等. 2005. 一氧化氮延缓草莓成熟衰老的生理效应[J]. 中国农业科学, 38(7): 1418-1424. |
Brown G C. 1995. Nitric oxide regulates mitochondrial respiration and cell functions by inhibiting cytochrome oxidase[J]. FEBS Leet, 369(23): 136-139. |
Leshem Y Y, Wills R B H, Ku V V V. 1998. Evidence for the function of the free radical gas-nitric oxide(NO *)as an endogenous maturation and senescence regulating factor in higher plants[J]. Plant Physiology and Biochemistry, 36(11): 825-833. DOI:10.1016/S0981-9428(99)80020-5 |
Leshem Y Y. 2000. Nitric oxide in plants: Occurrence, function and use[J]. Boston: Kluwer Academic Publisher. |
Ruan H H, Shen W B, Ye M B, et al. 2002. Protective effects of nitric oxide on salt stress-induced oxidative damage to wheat(Triticum aestivum L) leaves[J]. Chinese Science Bulletin, 47(8): 677-681. DOI:10.1360/02tb9154 |
Sozzi G O, Trinchero G D, Fraschina A A. 2003. Delayed ripening of 'B artlett' pears treated with nitric oxide[J]. Journal of horticultural Science & Biotechnology, 78(6): 899-903. |
Squadrito G L, Pryor W A. 1998. Oxidative chemistry of nitric oxide: The roles of superoxide, peroxynitric, and carbon dioxide[J]. Free Radic Biology & medicine, 25(4/5): 392-403. |
Wills R B H, Ku V V V, Leshem Y Y. 2000. Fumigation with nitric oxide to extend the postharvest life of strawberries[J]. Postharvest Biology and Technology, 18(1): 75-79. DOI:10.1016/S0925-5214(99)00061-7 |
Wills R B H, Soegiarto L. 2004. Short term fumigation with nitric oxide gas in air to extend the postharvest life of broccoli, green bean and bokchoy[J]. Horttechnology, 14(4): 538-540. |
Zhu S H, Zhou J. 2007. Effect of nitric oxide on ethylene production in strawberry fruit during storage[J]. Food Chemistry, 100(4): 1517-1522. DOI:10.1016/j.foodchem.2005.12.022 |
 2010, Vol. 46
2010, Vol. 46


