文章信息
- 胡晓立, 杨建民, 陈东亮, 冯晨静, 孟庆瑞, 李彦慧
- Hu Xiaoli, Yang Jianmin, Chen Dongliang, Feng Chenjing, Meng Qingrui, Li Yanhui
- NaCl胁迫对紫叶李叶片色泽的影响
- Effect of NaCl Stress on Leaf Coloration of Prunus cerasifera var. atropurea
- 林业科学, 2010, 46(12): 64-69.
- Scientia Silvae Sinicae, 2010, 46(12): 64-69.
- DOI: 10.11707/j.1001-7488.20101210
-
文章历史
- 收稿日期:2009-10-27
- 修回日期:2010-04-18
-
作者相关文章
2. 国际竹藤网络中心 北京 100102
2. International Centre for Bamboo and Rattan Beijing 100102
紫叶李(Prunus cerasifera var. atropurea)为蔷薇科李属(Prunus)植物,叶色红紫,观赏期长,在园林绿化中应用广泛。紫叶李叶片色泽表达的基础物质是色素,包括花青苷、叶绿素、类胡萝卜素、类黄酮等,因此用单一色素含量来表示其色泽具有局限性,而运用感观评定叶片的色泽,则存在很大的主观因素,容易产生误差,通过色差计测定CIELAB表色系的色泽参数,即用明度L*值、色相a*值、色相b*值、彩度C*值、色相角h值表示色泽,可以消除人为因素对测定结果的影响,使人们对色泽的判定更加客观(庞文龙等,2008; 葛雨萱等,2008)。叶片色泽的表达主要由色素的含量、种类及其分布决定(王庆菊等,2008)。植物通过调节与色素形成相关的酶活性及色素前体物质的含量来改变色素的含量和色素之间的比值来改变色泽。关于胁迫对彩叶植物色泽的影响,李云飞等(2009)认为短期的轻度干旱胁迫能增加紫叶矮樱(P. × cistena ‘Pissardii’)中的花青苷含量,李彦慧(2008)证实轻度的SO2处理能够增加紫叶李和紫叶矮樱中的花青苷含量。关于NaCl胁迫对植物叶色的影响,前人的研究主要集中在绿叶植物上(董晓霞等,1998; 王仁雷等,2008; 赵利等,2006),而NaCl胁迫对彩叶植物色泽的影响未见报道。本研究以4年生紫叶李为试材,经不同浓度梯度的NaCl处理后,调查其叶片的各色泽参数、色素含量、可溶性糖含量和PAL酶活性的变化情况,探究NaCl胁迫对紫叶李色泽的影响,为彩叶植物以后在盐碱地中的选择应用提供一定的理论依据。
1 材料与方法 1.1 试验材料试验于2009年在河北农业大学科研基地进行。试材为长势一致,生长良好的4年生嫁接苗紫叶李,砧木为毛桃(Amygdalus davidiana)。试验用盆高40 cm,上、下直径分别为30和26 cm,每盆1株。盆内装7.0 kg基质; 基质由草炭土、洗净河砂和园土按1: 1: 3的比例混合而成; 速效氮5.88 mg·kg-1,速效磷5.72 mg·kg-1,速效钾2.34 mg·kg-1,基质含盐量为0.42 g·kg-1。盆栽苗木在露地常规管理,至4月中旬左右,将盆栽苗木移到防雨棚下。
1.2 试验设计2009年5月上旬,试验苗进入快速生长期时,选取生长势一致的植株进行NaCl处理。依据预试验的筛选结果,试验共设置5个盐分梯度:土壤NaCl含量分别为对照(含盐量为0.042%),0.1%,0.2%,0.3%和0.4%。加入NaCl使处理达到设定含量,定期测定土壤含盐量,并及时补盐,保持盆内土壤盐分含量维持在设定梯度,土壤田间持水量维持在60% ~ 80%。每处理设3次重复,每重复6盆,共18盆,随机排列。于处理0,5,10,15,20,25天进行指标测定:早晨取样,从植株不同方向取新梢中上部功能叶2 ~ 3片。采后用冰壶立即带回实验室测定色素含量和可溶性糖含量; 并用色差计在田间测定叶片色泽参数L*,a*,b*,C*,h,每个处理测定10片叶,每片叶测定不同部位3次。
1.3 生理指标测定方法叶色色度的测定:采用日本产Minolta CR-400型全自动色差计测定叶色(Voss,1992; Wang et al., 2004)。C光源,测色光斑直径为8 mm,以标准白板和黑板为标准样校正。其中L*表示明度或亮度,L*值越大,亮度越高; 色相a*值表示红/绿,a*值越大,红色越深,a*值越小,绿色越深; b*值表示黄/蓝,b*值越大,黄色越深,b*值越小,蓝色越深。彩度C*和色相角h根据公式计算: C* = (a*2+b*2)1/2,h = arctan (b*/a*)。C*值表示到L*轴的垂直距离,距离越大,彩度越大。叶绿素、类胡萝卜素和可溶性糖的测定参照李合生等(2003)的方法,花青苷和类黄酮的测定和计算参照李彦慧(2008)的方法。PAL酶活性的测定参照Lister等(1996)的方法,测定290 nm的吸光值,以每分钟每克鲜质量变化0.1个吸光度为1个酶活单位。
1.4 数据处理采用EXCEL2003和SPSS 13.0,采用Duncan法进行多重比较。
2 结果与分析 2.1 NaCl胁迫对紫叶李叶片色泽的影响NaCl处理后,紫叶李叶片的亮度发生变化。随处理时间延长,对照中L*值呈平缓趋势; 各盐处理中的L*值上升,且盐胁迫越重,L*值升高的幅度越大; 处理10天时,各梯度盐处理组亮度L*值显著高于对照(P<0.05),10天后各处理的亮度值逐渐趋于平缓,且始终高于对照(图 1A)。

|
图 1 NaCl胁迫下紫叶李叶色参数的变化 Figure 1 The changes of color parameters under NaCl stress
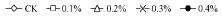 下同。 The same below. 下同。 The same below.
|
随着处理时间的延长,各处理中a*值呈下降趋势; 0.1%处理下a*下降缓慢,与对照差异不大; 0.2%的盐处理20天以后,a*显著低于对照(P<0.05),比对照降低了11.75%; 0.3%,0.4%处理5天后,a*值极显著低于对照(P<0.01)。处理25天时,0.1%,0.2%,0.3%,0.4%的处理下a*值分别比对照降低10.92%,30.08%,28.61%,40.61% (图 1B)。
对照组中b*值随处理时间延长缓慢下降,各盐处理组则先上升后下降; 0.1%,0.2%,0.3%,0.4%中b*值在处理第10天达到高峰值7.15,8.68,8.68,10.73; 10天后,0.1%,0.2%处理中b*快速降低,0.3%的b*值变化趋势比较平缓; 0.4%的b*值在处理10天比对照增加109.70%,之后随时间延长逐渐降低(图 1C)。
彩度C*值随着处理时间的延长而下降,对照的彩度值在处理的前20天一直低于各盐处理。处理第10天时,0.1%,0.2%,0.3%,0.4%的盐处理下彩度C*极显著高于对照(P<0.01),比对照增加7.77%,17.55%,10.54%,15.68% (图 1D)。
如图 1F所示,各盐处理下的色相角h均大于对照。随处理时间延长,对照中色相角h不断减小,由33.78降至21.34; 0.1%的色相角h先下降后上升,并在处理20天后趋于平缓,0.2%处理下的色相角h一直处于平稳状态,到第20天时开始下降,0.3%和0.4%处理下的色相角h则呈不断上升趋势,处理25天时分别比对照增加11.16%,24.49%。
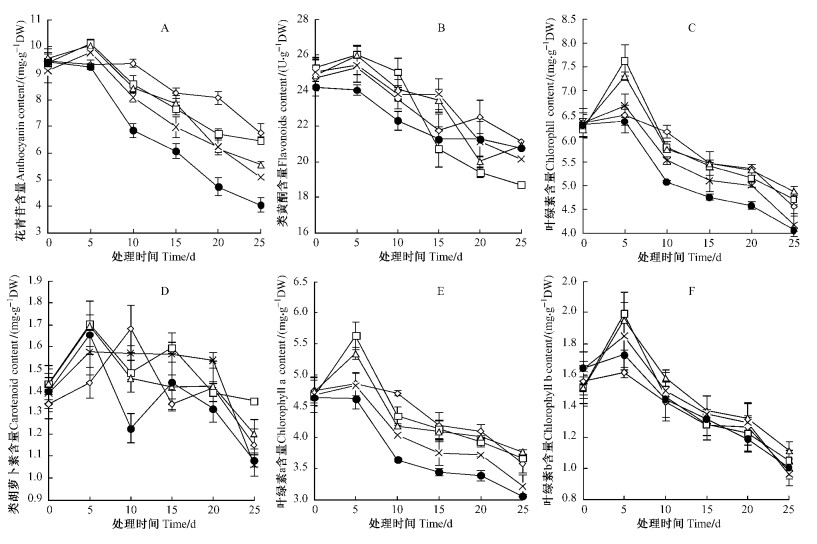
2.2 NaCl胁迫对紫叶李叶片中色素含量的影响紫叶李受盐胁迫后,0.1%,0.2%,0.3%处理下的花青苷含量在处理的第5天升高,显著高于对照(P<0.05),之后各盐处理随盐胁迫时间的延长而下降,且始终低于对照。处理10天后,各盐处理梯度的花青苷含量显著低于对照(P<0.05)。在第25天时,0.1%,0.2%,0.3%,0.4%的NaCl处理下花青苷含量分别比对照降低31.12%,41.63%,43.83%,56.77% (图 2A)。
|
图 2 NaCl胁迫下紫叶李色素含量的变化 Figure 2 The changes of content of pigments under NaCl stress |
NaCl胁迫时间越长紫叶李各处理中的类黄酮含量越低。0.1% NaCl处理在盐胁迫的第15天开始低于对照,0.2%,0.3%的NaCl处理均在第20天开始低于对照,0.4%的NaCl处理始终低于对照。处理第25天时,0.1%,0.2%,0.3%,0.4%的NaCl处理下类黄酮含量分别比对照降低11.56%,1.07%,4.62%,1.78% (图 2B)。
处理第5天时,0.1%,0.2%,0.3%的NaCl处理下紫叶李叶片中的叶绿素含量上升且高于对照,达到显著水平(P<0.05),0.4%的NaCal处理低于对照。从处理的第10天开始,各盐处理中的叶绿素含量低于对照,0.1%和0.2%的NaCl处理与对照差异不显著(P<0.05),0.3%,0.4%的NaCl处理显著低于对照(P<0.05) (图 2C)。
紫叶李叶片中类胡萝卜素随着处理时间的延长先升高后降低(图 2D),除对照在处理的第10天出现高峰值外,其余各处理均在处理的第5天时出现高峰,0.1%,0.2%,0.3%,0.4%的NaCl处理分别比对照增加19.18%,18.61%,13.60%,18.50%。
在处理的第5天,0.1%,0.2%的NaCl处理下紫叶李叶片中的叶绿素a含量上升,显著高于对照(P<0.05),0.3%,0.4%的NaCl处理下,叶绿素a略有升高,与对照差异不显著(P>0.05)。之后各处理随着盐胁迫时间的延长,叶绿素a含量不断下降,且盐处理越重,叶绿素a下降的越明显,各盐处理中的叶绿素a含量低于对照(图 2E)。
紫叶李中的叶绿素b含量随胁迫时间延长先升高后降低(图 2F)。在处理第5天时,紫叶李的0.1%,0.2%,0.3%,0.4%处理比对照增加31.54%,28.79%,13.01%,5.18%,达到显著水平(P<0.05),之后均随处理时间的加长而下降,且各处理之间差异不显著(P>0.05)。
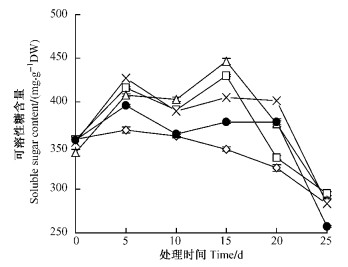
2.3 NaCl胁迫对可溶性糖含量的影响可溶性糖含量随处理时间延长,呈先上升后下降的趋势。在处理第15天可溶性糖含量达到高峰值,0.1%,0.2%,0.3%,0.4%的NaCl胁迫下的可溶性糖分别比对照增加24.73%,30.52%,17.88%,9.82%,显著高于对照(P<0.05);之后又随时间延长,迅速下降,但各处理中可溶性糖含量仍高于对照。在处理的第25天时可溶性糖含量降到最低,且处理低于对照。0.1%的NaCl处理显著(P<0.05)低于对照,其他处理极显著(P<0.01)低于对照(图 3)。
|
图 3 NaCl胁迫下紫叶李可溶性糖含量的变化 Figure 3 The changes of content of soluble sugar under NaCl stress |
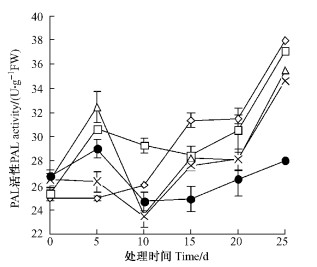
NaCl处理的前5天,对照中PAL酶活性变化不大,0.1%,0.2%,0.3%,0.4%处理下的PAL酶活性均升高,显著高于对照(P<0.05),在处理的第10天,除0.1%处理高于对照外,其余各处理均低于对照,从处理第15天开始,对照和各处理中PAL酶活性都呈急剧上升趋势。对照,0.1%,0.2%,0.3%,0.4%在第25天时的PAL酶活性比处理初时高52.32%,46.47%,34.12%,30.85%,4.98% (图 4)。
|
图 4 NaCl胁迫下紫叶李PAL酶活性的变化 Figure 4 The changes of activity of PAL under NaCl stress |
NaCl胁迫对紫叶李的叶色产生较大的影响。叶片色泽表达的物质基础是色素,紫叶李叶片中的色素种类主要是花青苷、类黄酮、叶绿素和类胡萝卜素,因此不能以单一色素的含量变化来表示紫叶李的叶色变化(王庆菊等,2008)。用叶色参数来表示色泽能够使色泽指标量化,已经成为人们研究色泽的重点内容之一。
李崇晖等(2008)和张圆圆等(2008)都认为,花色随着花青苷总含量的上升而变暗。在本试验中,亮度L*值与花青苷、叶绿素含量都呈负相关,表明花青苷、叶绿素等色素的含量增大时,亮度降低; 反之,花青苷、叶绿素等色素的含量减少时,亮度升高,这与孙卫等(2009)在瓜叶菊中的研究结果一致。随着盐胁迫程度的增大和处理时间的延长,红色调和蓝色调都减退,而明度L*值却不断增大,这与前人的研究结果一致。
色相a*值的大小直接反映叶片的红/绿程度,色相b*值的大小反映黄/蓝程度。本研究中,色相值a*随着盐处理浓度的升高和处理时间的延长而降低,所以,紫叶李在NaCl胁迫后,色泽逐渐转绿。在本研究中,NaCl处理第5天,花青苷、类黄酮、叶绿素和类胡萝卜素含量都出现不同程度的上升,而a*值却降低,b*上升,可能是由于叶绿素升高的幅度比花青苷大,使叶绿素在色泽红绿程度的表达中起主导作用; 呈黄色的色素类黄酮、类胡萝卜素和叶绿素b的增加量,大于呈蓝色的色素叶绿素a的增加量,因此黄/蓝的程度增大,即色相b*值增大; 黄绿类色素含量的大幅度增加使彩度C*增大,色相角h升高,红色变浅(葛雨萱等,2008)。在处理的第10天,花青苷、类黄酮、叶绿素和类胡萝卜素含量都开始降低,a*也降低,0.1%,0.3%处理下b*趋于平稳,0.2%,0.4%处理下b*开始上升,使紫叶李色泽转绿,0.2%,0.4%处理下彩度C*也增加,0.2%,0.3%,0.4%的色相角h增大,使紫叶李红色性状减弱; 从处理的第15天开始,花青苷、类黄酮、叶绿素和类胡萝卜素含量持续下降,使a*不断降低,各处理的b*也出现不同程度的下降,C*受a*和b*下降的影响也不断下降,使紫叶李彩度降低,色相角h不断升高,紫叶李叶片红色逐渐减弱。
关于NaCl胁迫对叶绿素含量的影响,前人研究认为苇状羊茅(Festuca arundinacea) (董晓霞等,1998)、水稻(Oryza sativa) (王仁雷等,2002)等在盐胁迫后叶绿素含量升高,南瓜(Cucurbita moschata) (赵利等,2006)等植物则降低。本研究中,紫叶李受NaCl胁迫后,叶绿素总量在处理5天时升高,之后随处理时间的延长不断下降,主要是由于NaCl胁迫促进叶绿素酶对叶绿素a和b的分解引起的。
NaCl胁迫对类黄酮合成量的影响,主要是通过对其合成过程中的关键酶和类黄酮合成的前体物质的影响决定。在本研究中,花青苷和类黄酮均在处理的第5天升高,之后随盐胁迫时间延长不断下降。花青苷和类黄酮是次生代谢产物,其合成的起始酶是PAL,PAL是苯丙烷代谢的关键酶(高华君等,2006)。花青苷是由花青素和糖组成的糖苷,花青素是在糖代谢的基础上合成,因此,植物细胞内糖分的积累有利于花青苷的合成(张元慧等,2004; Madhur et al., 1999)。NaCl胁迫后,可溶性糖含量增加,在植物组织中起渗透调节作用,维持植物组织正常生理功能。在本研究中,通过对PAL酶活性和可溶性糖含量分析可知:在处理的前5天,可溶性糖含量急速上升,为花青苷的合成提供大量的糖,PAL酶活性增强,因此促进花青苷和类黄酮的合成; 处理的第10天,可溶性糖含量开始降低,PAL活性也降低,因此花青苷和类黄酮合成代谢受影响,其含量开始下降; 处理15天时可溶性糖含量再次回升,PAL活性升高,但始终低于对照,花青苷和类黄酮含量持续下降,这可能是因为再次增加的可溶性糖主要参与植物组织的渗透调节作用(陈淑芳等,2005),并没有为花青苷的合成提供更多的糖,另外,有研究证明PAL在植物的抗逆性研究中起重要作用(Engelsma,1974; Bufler et al., 1982),因此,PAL酶的提高可能参与植物的抗逆生理。从处理的第20天开始,由于紫叶李中叶绿素含量的不断降低,导致光合作用减弱,可溶性糖含量开始下降,花青苷含量也不断下降,使紫叶李叶色红色性状逐渐减弱。
本研究的结果证明: NaCl胁迫后使紫叶李叶色不断转绿。花青苷、类黄酮、叶绿素和类胡萝卜素在处理的第5天时含量上升,之后不断下降。0.1%的NaCl胁迫下,紫叶李的叶片色泽与对照相比,变化不明显; 0.2% NaCl胁迫20天后,叶色明显转绿; 0.3%,0.4%的NaCl处理5天后,叶色开始转绿,且随时间延长转绿程度不断加重。在整个处理过程中a*值持续降低,说明紫叶李叶片由深红色逐渐转绿,b*值上升,说明叶色转黄。因此,NaCl胁迫后,紫叶李叶色由深紫红色向黄绿方向发展,严重降低观赏价值,影响紫叶李在园林中的应用。如何提高盐胁迫条件下紫叶李的观赏价值,有待今后深入探讨。
陈淑芳, 朱月林, 刘友良, 等. 2005. NaCl胁迫对番茄嫁接苗保护酶活性、渗透调节物质含量及光合特性的影响[J]. 园艺学报, 32(4): 609-613. |
董晓霞, 赵树慧, 孔令安, 等. 1998. 苇状羊茅盐胁迫下生理效应的研究[J]. 草业科学, 15(5): 10-13. |
高华君, 王少敏, 王江勇. 2006. 套袋对苹果果皮花青苷合成及着色的影响[J]. 果树学报, 23(5): 750-755. |
葛雨萱, 王亮生, 徐彦军, 等. 2008. 蜡梅的花色和花色素组成及其在开花过程中的变化[J]. 园艺学报, 35(9): 1331-1338. |
李崇晖, 王亮生, 舒庆艳, 等. 2008. 迎红杜鹃花色素组成及花色在开花过程中的变化[J]. 园艺学报, 35(7): 1023-1030. |
李合生. 2003. 植物生理生化实验原理和测定技术[M]. 北京: 高等教育出版.
|
李彦慧. 2008. 李属彩叶植物耐SO2机制研究[J]. 河北农业大学博士学位论文. |
李云飞, 李彦慧, 王中华, 等. 2009. 土壤干旱胁迫对紫叶矮樱(Prunus cistenena cv.Pissardii)叶片呈色的影响[J]. 生态学报, 29(6): 3678-3684. |
庞文龙, 刘富中, 陈钰辉, 等. 2008. 茄子果色性状的遗传研究[J]. 园艺学报, 35(7): 979-986. |
孙卫, 李崇晖, 王亮生, 等. 2009. 花青苷成分对瓜叶菊花色的影响[J]. 园艺学报, 36(12): 1775-1782. DOI:10.3321/j.issn:0513-353X.2009.12.009 |
王庆菊, 李晓磊, 王磊, 等. 2008. 紫叶稠李叶片花色苷及其合成相关酶动态[J]. 林业科学, 44(3): 45-49. DOI:10.11707/j.1001-7488.20080312 |
王仁雷, 华春, 刘友良, 等. 2002. 盐胁迫对水稻光合特性的影响[J]. 南京农业大学学报, 25(4): 11-14. |
张元慧, 关军锋, 杨建民, 等. 2004. 李果实发育过程中果皮色素、糖和总酚含量及多酚氧化酶活性的变化[J]. 果树学报, 21(1): 17-20. |
张圆圆, 齐冬梅, 刘辉, 等. 2008. 观赏向日葵的花色多样性及其与花青苷的关系[J]. 园艺学报, 35(6): 863-868. |
赵利, 陈贵林, 李卫欣, 等. 2006. NaCl、Na2SO4和Na2CO3对南瓜幼苗的生理胁迫效应[J]. 河北农业大学学报, 29(6): 21-24. |
Bufler G, Bangerth F. 1982. UV-induced peroxidase and phenylalanine ammonia-lyase activity and phaseollin accumulation in leaves of Phaseolus vulgaris L.in relation to ethylene[J]. Plant Science Letters, 25(2): 227-237. DOI:10.1016/0304-4211(82)90181-X |
Engelsma G. 1974. On the mechanism of the changes in Phenylalanine Ammonia-lyase activity induced by ultraviolet and blue light in gherkin hypocotyls[J]. Plant Physiology, 54(5): 702-705. DOI:10.1104/pp.54.5.702 |
Lister C E, Lancaster J E, Walker J R L. 1999. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars[J]. Journal of the Science of Food and Agriculture, 71(3): 313-320. |
Madhuri G, Reddy R. 1999. Plant biotechnology of flavonoids[J]. Plant Biotech, 16(3): 179-199. DOI:10.5511/plantbiotechnology.16.179 |
Voss D H. 1992. Relating colourimeter measurement of plant colour to the royal horticultural society colour chart[J]. HortScience, 27(12): 1256-1260. |
Wang L S, Hashimoto F, Shiraishi A, et al. 2004. Chemical taxonomy of the Xibei tree peony from China by floral pigmentation[J]. Journal of Plant Research, 117(1): 47-55. DOI:10.1007/s10265-003-0130-6 |
 2010, Vol. 46
2010, Vol. 46

