文章信息
- 孟鹏, 李玉灵, 张柏习, 张学利, 雷泽勇, 宋晓东
- Meng Peng, Li Yuling, Zhang Baixi, Zhang Xueli, Lei Zeyong, Song Xiaodong
- 沙地彰武松与樟子松苗木抗旱生理特性比较
- A Comparative Study on Physiological Characteristics of Drought Resistanceof Pinus densiflora var. zhangwuensis and P. sylvestris var. mongolica in Sandy Soil
- 林业科学, 2010, 46(12): 56-63.
- Scientia Silvae Sinicae, 2010, 46(12): 56-63.
- DOI: 10.11707/j.1001-7488.20101209
-
文章历史
- 收稿日期:2009-12-05
- 修回日期:2010-01-13
-
作者相关文章
2. 辽宁省固沙造林研究所 阜新 123000;
3. 辽宁工程技术大学 阜新 123000
2. Liaoning Sand-Fixation and Afforestation Research Institute Fuxin 123000;
3. Liaoning Technical University Fuxin 123000
自1991年开始,在最早引种樟子松(Pinus sylvestris var.mongolica)的章古台地区,樟子松人工固沙纯林出现衰退枯死现象,大面积的樟子松纯林陆续感病枯死、生长衰退。鉴于此,辽宁省固沙造林研究所(下文简称固沙所)开始选育新的固沙造林树种。彰武松(Pinus. densiflora var. zhangwuensis)是继樟子松之后由固沙所优选发现的新针叶树良种,由东北林业大学聂绍荃、袁晓颖教授正式定名(黎承湘等,1997; 张树杰等,1995)。在正常年份,其与樟子松连年高生长量之比为121%;在干旱年份,该比值增大至130% ~ 150%。其综合生长指标比樟子松高出20%以上(邢兆凯等,2001),所以是比樟子松抗性更强、生长更快的又一沙地针叶树良种。
苗木期是植物度过干旱环境的关键时期,一些生理指标的变化可以反映苗木期的抗旱能力(吴春芳等,2005; 哈申格日乐等,2006; 孙一荣等,2008)。大量研究表明:当植物受到干旱胁迫时,SOD起到抗氧化保护者系统的作用(McKersie et al., 1996),而SOD的催化反应受到其扩散率的限制,所以提高该酶的活性不是PS Ⅱ唯一的保护机制(Noctor et al., 1996)。樟子松幼苗在土壤轻度干旱胁迫下,针叶SOD活性随胁迫时间延长呈上升趋势,表明樟子松通过明显提高其保护酶SOD活性响应胁迫,提高氧自由基的清除能力,但此时MDA含量仍有上升趋势,证实植物体内仅SOD水平提高无法独立完成保护作用,从而支持上述观点(夏新莉等,2000)。邓斌等(2006)对1年生樟子松苗进行不同水平氮肥的施肥试验,发现氮素供应水平与脯氨酸(Pro)含量存在一定的相关性,表明Pro积累机制在于提高Pro的生物合成或是降低它的氧化,而在干旱条件下,Pro生物合成是其积累主要原因。而对于干旱条件下植物体内Pro累积,对植株抗旱性是否有影响,目前有3种观点: 1)认为植物抗旱性的差异与累积的Pro无关; 2)认为植物在干旱条件下,累积的Pro和田间抗旱性有关; 3)认为植物体内游离酸的相对变率与品种的抗旱性密切相关(刘学师等,2002)。
通过对幼苗阶段彰武松的几个水分生理指标测定可知:彰武松鲜物质量含水率、相对含水率、干物质量含水率均大于樟子松,表明彰武松吸水能力强,叶体内贮藏水分多; 而彰武松蒸腾强度、失水速率、相对饱和亏等指标均小于樟子松,表明彰武松比樟子松更具抗旱性(黎承湘等,1997)。对彰武松在不同土壤的适生性调查,结果显示:彰武松在半湿润草甸土区、半干旱褐土区和风沙土区均适于生长,长势良好(黎承湘等,2003)。对彰武松的形态特征、生物学特征、生态学特征研究发现:彰武松有针叶长短隔年交替的现象,表明彰武松属于春季生长类型的树种(雷泽勇等,2003)。
彰武松发现时间短,所以针对其抗旱性研究较樟子松少。对彰武松在沙地上优良的抗旱机制尚不明确,尤其与樟子松抗旱生理特性的对比研究更不多见。本研究通过幼苗盆栽控水试验,以樟子松为对比树种,对彰武松和樟子松的抗旱生理指标进行比较研究,试图阐释彰武松幼苗阶段的抗旱生理机制,为彰武松在三北地区推广应用提供理论依据。
1 材料与方法 1.1 试验地概况试验在辽宁省彰武县章古台镇固沙所种子园工区进行,该区地处42° 43′ N,122° 22′ E,海拔226.5 m,年降水量300 ~ 600 mm(近5年平均降水量为433 mm),年蒸发量1 570 mm,年平均气温5.7 ℃ (近5年平均温度为7.2 ℃),无霜期154天,≥10 ℃有效积温2 800 ~ 3 200 ℃。
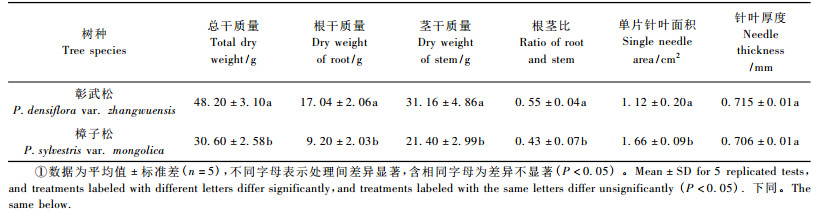
1.2 试验材料对彰武松和樟子松苗木进行不同水分处理的盆栽试验,通过生理指标测定探讨2个树种抗旱性。2008年5月5日,以4年生彰武松和樟子松幼苗为试材,苗木于试验前一年盆栽在5 L塑料容器中,每个树种各100株,盆内基质为草炭:沙壤土:优质3元素复合肥= 1: 1: 0.05,达到田间持水量(FMC)时土壤的含水率为20%。盆栽试验设在固沙所种子园管理处院内,雨天时将盆栽幼苗搬至室内。试验期间最高气温为33.6 ℃、最低气温为9.5 ℃,相对湿度30% ~ 40%。在开展水分胁迫试验的前2天,分别树种随机选取5株苗木,测定如下形态指标:总干质量、根干质量、茎干质量、根茎比、单片针叶面积和针叶厚度,其中生物量测定采用烘干法,叶面积测定采用复印法(董朝霞等,2002),针叶厚度用精度0.02 mm的游标卡尺测量。
1.3 盆栽控水试验设计水分梯度设置采用称重法(朱教君等,2006; 单长卷等,2007)。环刀测定法测土壤的FMC,以FMC的20%为重度干旱区,30%为中度干旱区,40%为轻度干旱区,研究表明樟子松幼苗在40% FMC时已表现出干旱胁迫(朱教君等,2006),因此将轻度干旱区的土壤含水量设为40% FMC,100% FMC为对照区(Yan et al., 2003),每个树种每个处理20株(即在所剩95株盆栽苗木中随机抽取)。在对苗木停止供水后的第2天起,每天16: 00用管型取样器取苗木盆中的土壤,取样时尽量靠近盆的中央区,每盆取样3个,测定土壤含水量并取其平均值。当土壤含水量达到设定值时,用ES10K-1天平称量盆总质量(Wtc),之后每天16: 00称盆总质量(Wtt); 由于苗木蒸腾及土壤蒸发,使土壤含水量降低,因此,每天需对供试苗木盆中补充水分,补充水分量(Wtm)由公式(Wtm = Wtc-Wtt)确定。
1.4 干旱受损程度的生长分级进行以上干旱胁迫处理后,每隔7天对各处理苗木长势和萎蔫情况进行观察记录,共调查5次,干旱受损程度生长分级标准如下: 1级(Ⅰ) :顶梢生长正常未受伤害; 2级(Ⅱ) :少数苗木(<50%)顶梢有轻度下垂,皱缩萎蔫; 3级(Ⅲ) :多数苗木(>50%)顶梢有轻度下垂,皱缩萎蔫,第1轮枝和第2轮枝中间的叶片也有发黄现象; 4级(Ⅳ) :多数苗木(>50%)顶梢出现永久萎蔫,个别出现第2轮枝及以上部位全部枯死的现象。
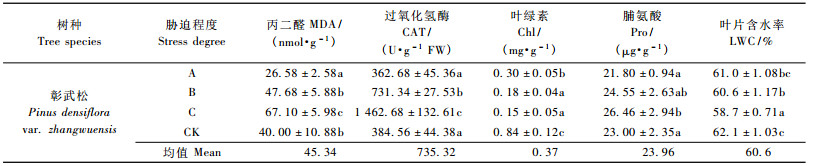
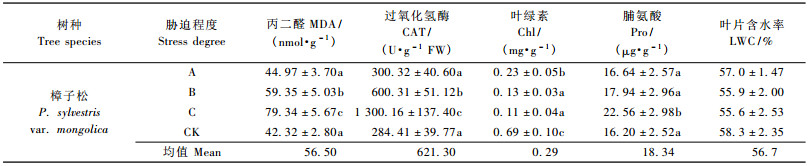
1.5 生理指标测定方法胁迫30天后复水,5天后在各处理中分别随机抽取5株苗木,在顶端向下的第1轮枝与第2轮枝的中部取生长正常叶片,测叶片中的各项生理指标。MDA采用直线回归与双组分分光光度计法相结合的方法测定(赵世杰等,1994); CAT用Na2S2O3滴定法测定(张宪政等,1994); Chl采用80%丙酮提取,比色法测定(李合生等,2000); Pro采用茚三酮比色法测定(汤章城,1999)。LWC采用烘干法,以鲜质量为基数表示。
1.6 数据处理数据采用SPSS软件进行数理统计分析,对组间数据进行单因素方差分析(One-way ANOVA),差异显著的采用LSD法做多重比较分析,图表制作采用EXCEL软件。
2 结果与分析 2.1 生物量与叶片形态指标干旱受损的变化彰武松总干质量、根干质量、茎干质量和根茎比4个指标都显著高于樟子松(P<0.05),分别约为樟子松的157.5%,185.2%,145.6%和127.9%。从叶片形态特征指标看,彰武松单片针叶面积显著小于樟子松(P<0.05),仅为樟子松的67.5%;而针叶厚度却略大(表 1)。
|
|
从胁迫过程中的形态分级看(表 2),在轻度胁迫区2个树种形态都和对照区一样正常。在中度干旱区,樟子松在第21天出现外在形态的变化,表现为2级,在第28天表现为3级,在第35天由于经历胁迫复水,所以形态又恢复到2级; 而该区彰武松形态保持不变。在重度干旱区,樟子松形态在第14天就表现为2级,第21天表现为3级,第28天表现为4级,第35天虽经历复水但形态也没有恢复的迹象; 彰武松形态只在第28天表现为2级,而复水后恢复正常。
|
|
如图 1所示:在同样的供水条件下,供试彰武松的MDA含量小于樟子松,并且除对照区外均呈显著差异(P<0.05)。由表 3和表 4可见:樟子松在40% FMC时MDA含量略大于对照区,而彰武松在同样水分条件下MDA含量反而显著小于对照区(P<0.05)。中度干旱区(30% FMC)彰武松MDA含量与对照区相比增加19.2%,但差异不显著(P<0.05)。樟子松在中度干旱区MDA含量较对照增加40.2%,处理间差异显著(P<0.05)。

|
图 1 在不同水分梯度下彰武松和樟子松叶片内丙二醛含量 Figure 1 Comparison of difference significance of MDA contents of P. densiflora var. zhangwuensis and P. sylvestris var. mongolica under different water gradient 数据为平均值±标准差(n = 5);a,b表示同一处理不同树种间差异显著,含相同字母为差异不显著(P<0. 05)。下同。 The same below. Shown are: Mean ± SD for 5 replicated tests, and a, b mean significent difference between different tree species in the same treatment at 0. 05 level, and treatments labeled with the same letter or no symbol differ unsignificantly (P < 0. 05). The same below. |
|
|
|
|
樟子松和彰武松MDA含量在各处理间的大小排序为:重度干旱区>中度干旱区>轻度干旱区。彰武松在中度干旱区与轻度干旱区相比较,MDA增幅为21.1 nmol·g-1; 重度干旱区与中度干旱区相比,MDA含量增幅为19.42 nmol·g-1; 樟子松的中度干旱区与轻度干旱区相比,MDA增幅为14.38 nmol·g-1; 重度干旱区与中度干旱区相比,增幅为19.99 nmol·g-1 (表 3,4)。
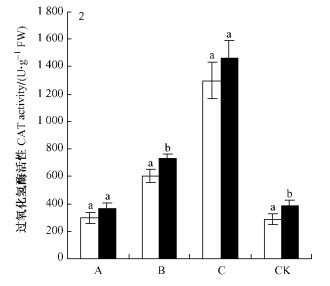
2.2.2 过氧化氢酶如图 2所示:在同样供水条件下,彰武松叶片内的CAT活性均高于樟子松,并且在中度干旱区差异显著(P<0.05)。轻度干旱区中彰武松的CAT活性较对照区反而降低,而轻度干旱区中樟子松的CAT活性已产生微小增幅(15.91 U·g-1 FW),但处理间差异不显著(P<0.05)。中度干旱区中彰武松CAT较对照区产生较大增幅(368.66 U·g-1 FW),各处理间差异显著(P<0.05) (表 3,4)。
|
图 2 在不同水分梯度下彰武松和樟子松叶片内过氧化氢酶活性 Figure 2 Comparison of difference significance of CAT activities of P. densiflora var. zhangwuensis and P. sylvestris var. mongolica under different water gradient |
彰武松和樟子松Chl含量在不同水分梯度下变化规律相同(图 3),大小排序均为:对照区>轻度干旱区>中度干旱区>重度干旱区。每个水分梯度下,彰武松的Chl含量均大于樟子松,是樟子松的121.7% ~ 138.5%。轻度干旱区中2个树种叶片Chl含量较对照区显著降低(P<0.05),降幅分别为0.54 mg·g-1 (彰武松)和0.46 mg·g-1 (樟子松)。在中度干旱区2个树种Chl含量与轻度干旱区相比也显著下降(P<0.05),但降幅减小了许多,分别为0.12 mg·g-1 (彰武松)和0.10 mg·g-1 (樟子松)。重度干旱区中2个树种的Chl含量较中度干旱区小,但差异不显著(P<0.05),降幅分别为0.03 mg·g-1 (彰武松)和0.02 mg·g-1 (樟子松) (表 3,4)。
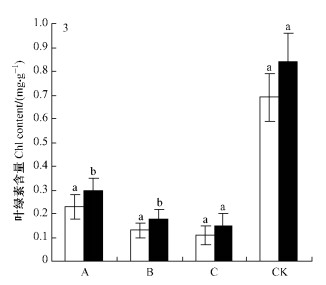
|
图 3 在不同水分梯度下彰武松和樟子松叶片内叶绿素含量 Figure 3 Comparison of difference significance of Chl contents of P. densiflora var. zhangwuensis and P. sylvestris var. mongolica under different water gradient |
在相同水分梯度下,彰武松Pro含量高于樟子松,是樟子松的117.3% ~ 142% (表 3,4),并且在中度干旱区差异显著(P<0.05,图 4)。轻度干旱区中彰武松叶片内的Pro含量较对照差异不显著(P<0.05)。轻度干旱区中樟子松的Pro已较对照产生增幅(0.44 μg·g-1)。中度干旱区中彰武松Pro含量才较对照区产生增幅(1.55 μg·g-1),且升高幅度是樟子松在受到轻度干旱胁迫时所产生增幅的3.52倍。
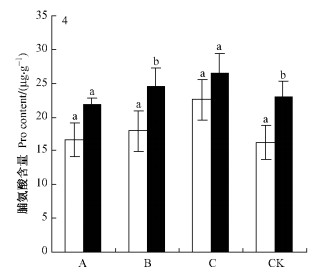
|
图 4 在不同水分梯度下彰武松和樟子松叶片内脯氨酸含量 Figure 4 Comparison of difference significance of Pro contents of P. densiflora var. zhangwuensis and P. sylvestris var. mongolica under different water gradient |
彰武松和樟子松LWC在不同水分梯度下变化规律相同(表 3,4和图 5),大小排序均为:对照区>轻度干旱区>中度干旱区>重度干旱区。每个水分梯度下,彰武松的LWC含量均显著大于樟子松(P<0.05),是樟子松的105.6% ~ 108.4%。2个树种从对照区到重度干旱区的LWC变化幅度不很大,彰武松LWC变幅3.4%,樟子松LWC变幅2.7%。彰武松从轻度干旱区到中度干旱区的含水量仅下降0.4%,而此时樟子松则下降1.1%。
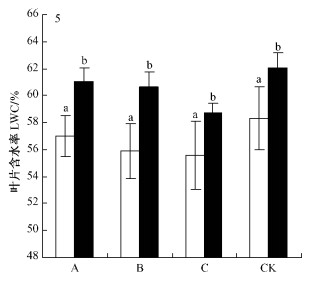
|
图 5 在不同水分梯度下彰武松和樟子松叶片内叶片含水率差异显著性的比较 Figure 5 Comparison of difference significance of LWC contents of P. densiflora var. zhangwuensis and P. sylvestris var. mongolica under different water gradient |
植物形态指标可以反映植物的抗旱性,根系和叶片的生长特征都是重要的抗旱性指标(胡新生等,1998)。从根系生长特征指标看,彰武松根干质量和根茎比都显著高于樟子松(P<0.05),其中根干质量接近樟子松的2倍(表 1),说明彰武松根系发达,具有较高的抗旱潜力。从叶片生长特征指标看,彰武松单片针叶面积显著小于樟子松,而针叶厚度却略大,这种构造的针叶更有利于防止水分丧失。从胁迫过程中的形态分级看,虽然在轻度胁迫区2者形态都和对照区一样正常,但此时樟子松内在的生理指标已经发生变化(表 4),受到轻度胁迫伤害。这表明植物受到干旱胁迫时,生理指标的变化先于形态的变化。在中度干旱区,樟子松在复水前形态表现为3级,复水后恢复到2级,表明此时土壤含水率还没有达到樟子松的永久萎蔫点(PWP); 该区彰武松形态依然保持正常状态,但第35天时所测定生理指标显示受到轻度干旱胁迫(表 3)。在重度干旱区,樟子松形态逐渐升到第4级,复水后形态也没有恢复的迹象,表明已经达到PWP; 该区彰武松形态只在复水前表现为顶梢下垂,而复水后又恢复正常。总之,从形态指标看,彰武松比樟子松抗旱性更强。
MDA,CAT和Pro都是重要的抗旱性生理指标。植物器官在逆境下遭受伤害,往往发生膜脂过氧化作用,MDA是膜脂过氧化的最终分解产物,其含量反映植物遭受逆境伤害的程度,含量越高说明植物细胞膜受到的伤害就越大(罗建平等,1999;
宫长荣等,1999; 孔繁翔等,2004)。CAT普遍存在于植物的所有组织中,其活性与植物的抗性有一定关系,它是生物体内过氧化物酶体中极为重要的保护酶。C3植物在受到干旱胁迫时,会通过以下3种途径导致细胞内H2O2的积累: 1)用于光呼吸的能量随干旱胁迫而增加,光呼吸作用增强,从而产生大量的H2O2 (Noctor et al., 1996); 2)当干旱胁迫导致线粒体结构和功能受到破坏时,H2O2也会显著提高(卫星等,2009); 3) MnSOD清除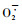
2个树种在同样的水分梯度下所受到干旱胁迫的程度是不同的,彰武松在土壤水分更少的时候才会表现出胁迫伤害和萎蔫,说明其抗旱性要强于樟子松。本试验结果可知: MDA,CAT和Pro含量都是反映彰武松和樟子松受胁迫与否和受害程度的良好指标。干旱胁迫作为一种非生物胁迫,会导致植物体内抗氧化系统各要素的紊乱或表达上调(Smirnoff,1993)。本次试验也发现CAT活性和Pro含量作为其中的2个要素在水分胁迫下含量均升高。虽然CAT活性的变化是否是由干旱引起的还存在质疑(Smirnoff,1993),但通过本次研究的数据看出: CAT活性的变化确实与干旱及干旱胁迫的程度密切相关。本试验也支持Pro通过抗氧化作用保护细胞膜免受破坏或减小了破坏程度的观点(刘宁等,2000),表明植物累积的Pro与田间抗旱性有关,尤其是植物体内游离Pro的相对变率与品种的抗旱性密切相关。
水分胁迫下Chl含量低于对照区的原因可能是干旱胁迫使得叶绿素片层结构中的Chla/b-Pro复合体合成受到抑制,或者与水分胁迫诱导叶绿体发生膜质过氧化而产生的破坏作用有关(喻晓丽等,2007)。LWC和Chl含量能较好反映土壤的含水量,但却不能很好地反映植物的胁迫程度,因为彰武松在轻度干旱区虽然没有受到任何程度的干旱胁迫,其LWC和Chl含量依然明显降低。Chl含量虽然不能很好地指示胁迫与否和胁迫程度,但它作为是植物光合作用的物质基础,其含量也必然影响到光合作用强度和干物质积累程度; 同时Chl含量高也有利于增强植物对损伤胁迫的抗性(姜英淑等,2009)。在每个水分梯度下,彰武松的Chl含量均大于樟子松,这也许是彰武松能更好地适应干旱条件,同时能保持速生性的原因之一。彰武松和樟子松LWC在各水分梯度下变幅不大,说明2个树种在苗期都是抗脱水类型的树种。李雪华等(2003)通过测定樟子松幼苗的叶片水势得出樟子松幼苗的抗旱机制以耐脱水为主,本文所得结论与其一致。
综上所述,通过对2个树种幼苗形态指标和不同水分梯度下叶片生理生化指标对比分析,推测彰武松在幼苗阶段存在以下抗旱机制:在干旱胁迫下,彰武松体内CAT活性和Pro含量较高,清除了过多的H2O2,并且抗氧化能力得以增强; MDA含量较小,膜质过氧化程度较低。彰武松在开始受到干旱胁迫时就迅速启动了抗氧化系统的保护机制,即CAT活性有较大增强,Pro含量也明显增加。总之,由于彰武松超强的抗旱性,在沙区和干旱半干旱区,此树种的确是优于樟子松的理想造林树种,应该加大推广力度。
4 结论通过MDA,CAT和Pro变化综合判断表明:樟子松在40% FMC时MDA含量大于对照区,已经遭受轻度胁迫,此时樟子松CAT活性略有增强,Pro含量也已经开始少量升高。40% FMC时彰武松针叶内MDA,Pro含量和CAT活性较对照区反而减小,说明土壤含水量达到40% FMC时,彰武松并未遭受干旱胁迫,其CAT活性未增强,也未启动Pro的保护机制。
在30% FMC时樟子松MDA显著高于对照区,说明叶片内膜脂过氧化程度加剧,而且表观上苗木顶梢已开始萎蔫,判断此时樟子松幼苗已处于中度胁迫程度。彰武松此时MDA略高于对照,说明才开始进入干旱胁迫状态,应属轻度胁迫程度,幼苗依然正常生长。虽然此时彰武松刚受到轻度干旱胁迫,其CAT活性就迅速增强,并且其Pro含量也开始迅速升高。
在20% FMC时,樟子松大部分苗木叶片枯黄、萎蔫,针叶内膜脂过氧化程度十分严重(MDA含量达到79.34 nmol·g-1),对植物造成不可逆损伤,所以复水后几乎不能恢复,说明已处于重度胁迫,而此时彰武松复水后萎蔫现象消失,说明此时仅处于中度胁迫。
彰武松的Chl含量和LWC均大于樟子松,并且2个指标在各水分梯度下的变化趋势也相同,大小排序均为:对照区>轻度干旱区>中度干旱区>重度干旱区,这表明LWC和Chl对环境水分极为敏感,水分不足会影响到二者的含量,同时表明二者可以较为真实地反映土壤的含水量。
邓斌, 曾德慧. 2006. 添加氮肥对沙地樟子松幼苗生物量分配与叶片生理特性的影响[J]. 生态学杂志, 25(11): 1312-1317. DOI:10.3321/j.issn:1000-4890.2006.11.003 |
董朝霞, 沈益新. 2002. 苇状羊茅控水处理后的补偿性生长[J]. 南京农业大学学报, 25(1): 15-18. |
宫长荣, 陈江华, 汪耀富. 1999. 烘烤中的膜脂过氧化作用及其对烟叶内在质量的影响[J]. 中国烟草学报, (3): 11-15. |
哈申格日乐, 宋云民, 李吉跃, 等. 2006. 水分胁迫对毛乌素地区4树种幼苗生理特性的影响[J]. 林业科学研究, 19(3): 358-363. |
胡新生, 王世绩. 1998. 树木水分胁迫生理与耐旱性研究进展及展望[J]. 林业科学, 34(2): 77-89. |
姜英淑, 陈书明, 王秋玉, 等. 2009. 干旱胁迫对2个欧李种源生理特征的影响[J]. 林业科学, 45(6): 6-10. DOI:10.11707/j.1001-7488.20090602 |
孔繁翔, 桑伟莲. 2004. 小麦铝抗性和敏感品系对铝胁迫的生理生化反应[J]. 应用与环境生物学报, 10(5): 559-562. |
雷泽勇, 孟鹏, 周凤艳. 2003. 彰武松主要特性的研究[J]. 沈阳农业大学学报, 34(4): 267-271. |
黎承湘, 张学利. 1997. 彰武松生长量及其生理指标分析[J]. 辽宁林业科技, (1): 58-59. |
黎承湘, 张学利, 刘淑玲, 等. 2003. 彰武松生长及适应性初步研究[J]. 中国生态农业学报, 11(1): 122-123. |
李合生, 孙群, 赵世杰, 等. 2000. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社: 134-200.
|
李雪华, 蒋德明, 骆永明, 等. 2003. 不同施水量处理下樟子松幼苗叶片水分生理生态特性的研究[J]. 生态学杂志, 22(6): 17-20. |
刘宁, 高玉葆, 贾彩霞, 等. 2000. 渗透胁迫下多花黑麦草叶内过氧化物酶活性和脯氨酸含量以及质膜相对透性的变化[J]. 植物生理学通讯, 36(1): 11-14. |
刘学师, 任小林, 苗卫东, 等. 2002. 游离脯氨酸与植物抗旱性[J]. 河南职业技术师范学院学报, 30(3): 35-37. |
罗建平, 顾月华, 王圣兵, 等. 1999. 抗坏血酸对沙打旺原生质体分离和培养中膜损伤及相关酶活性的影响[J]. 植物生理学报, 25(4): 343-349. |
单长卷, 徐新娟, 王光远, 等. 2007. 冬小麦幼苗根系适应土壤干旱的生理学变化[J]. 植物研究, 27(1): 55-58. |
孙一荣, 朱教君, 康宏樟. 2008. 水分处理对沙地樟子松幼苗膜脂过氧化作用及保护酶活性影响[J]. 生态学杂志, 27(5): 729-734. |
汤章城. 1999. 现代植物生理学实验指南[M]. 北京: 科学出版社: 302-306.
|
卫星, 王政权, 张国珍, 等. 2009. 水曲柳苗木不同根序对干旱胁迫的生理生化反应[J]. 林业科学, 45(6): 16-21. DOI:10.11707/j.1001-7488.20090604 |
吴春芳, 贾小明, 许晓英. 2005. 磷营养对侧柏、樟子松、油松抗旱性的影响[J]. 西北林学院学报, 20(1): 53-56. |
夏新莉, 郑彩霞, 尹伟伦. 2000. 土壤干旱胁迫对樟子松针叶膜脂过氧化、膜脂成分和乙烯释放的影响[J]. 林业科学, 36(3): 8-12. DOI:10.11707/j.1001-7488.20000302 |
邢兆凯, 焦树仁, 吴祥云. 2000. 辽西北沙漠化土地恢复治理技术研究[M]. 沈阳: 辽宁大学出版社: 173-182.
|
喻晓丽, 邸雪梅, 宋丽萍. 2007. 水分胁迫对火炬树幼苗生长和生理特性的影响[J]. 林业科学, 43(11): 57-61. DOI:10.3321/j.issn:1001-7488.2007.11.010 |
张树杰, 黎承湘, 袁晓颖. 1995. 赤松一新变种[J]. 植物研究, 15(3): 338-341. |
张宪政, 陈凤玉, 王荣富, 等. 1994. 植物生物学实验技术[M]. 沈阳: 辽宁科技出版社: 100-101.
|
赵世杰, 许长成. 1994. 植物组织中丙二醛测定方法的改进[J]. 植物生理学通讯, 30(3): 207-210. |
赵银河, 祝钰, 孙明高, 等. 2007. 干旱和盐分交互胁迫对紫荆、皂角幼苗保护酶活性的影响[J]. 山东农业大学学报:自然科学版, 38(2): 173-177. |
朱教君, 康宏樟, 李智辉. 2006. 不同水分胁迫方式对沙地樟子松幼苗光合特性的影响[J]. 北京林业大学学报, 28(2): 57-63. |
McKersie B D, Bowley S R, Harjanto E, et al. 1996. Water-deficit tolerance and field performance of transgenic alfalfa overexpressing superoxide dismutase[J]. Plant Physiol, 111: 1177-1181. DOI:10.1104/pp.111.4.1177 |
Noctor G, Veljovic-Jovanovic S, Driscoll S, et al. 2002. Drought and oxidative load in the leaves of C3 plants: a predominant role for photorespiration[J]. Annals of Botany, 89(7): 841-850. DOI:10.1093/aob/mcf096 |
Smirnoff N. 1993. The role of active oxygen in the response of plants to water deficit and desiccation[J]. New Phytologist, 125: 27-58. DOI:10.1111/nph.1993.125.issue-1 |
Yan J Q, Wang J, Tissue D, et al. 2003. Photosynthesis and seed production under water-deficit conditions in transgenic tobacco plants that overexpress an arabidopsis ascorbate peroxidase gene[J]. Crop Sci, 43(4): 1477-1483. DOI:10.2135/cropsci2003.1477 |
 2010, Vol. 46
2010, Vol. 46