文章信息
- 张超, 刘国彬, 薛萐, 宋籽霖, 樊良新
- Zhang Chao, Liu Guobin, Xue Sha, Song Zilin, Fan Liangxin
- 黄土丘陵区不同林龄人工刺槐林土壤酶演变特征
- Evolution of Soil Enzyme Activities of Robinia pseudoacacia Plantation at Different Ages in Loess Hilly Region
- 林业科学, 2010, 46(12): 23-29.
- Scientia Silvae Sinicae, 2010, 46(12): 23-29.
- DOI: 10.11707/j.1001-7488.20101204
-
文章历史
- 收稿日期:2009-09-18
- 修回日期:2010-09-22
-
作者相关文章
2. 中国科学院研究生院 北京 100049
2. Graduate School of Chinese Academy of Sciences Beijing 100049
土壤酶是高分子有机物催化分解的一类具有蛋白质性质的生物催化剂,主要来源于土壤微生物的活动、植物根系分泌物和腐解的动植物残体(关松荫,1986),参与土壤中各种有机质的分解、合成与转化以及无机物质的氧化与还原等过程,其活性与土壤物理特征(水分、温度、空气、团聚体)、有机质、pH值、土壤微生物及土壤类型等关系密切(周礼恺,1987; Gehrke et al., 1995),是评价土壤肥力的一个重要指标(关松荫,1986)。近年来,国内外学者对于生态恢复中土壤中酶活性的动态变化以及与土壤质量之间关系已有大量研究(Floch et al., 2009; Ranjith et al., 2009; 姜华等,2008)。An等(2008)研究表明土壤脲酶、转化酶以及磷酸酶与土壤有效氮、有效磷含量相关性显著,且随着草地恢复年限的延长而增加。Floch等(2009)从土壤质量与土壤酶之间的机制方面讨论了土壤酶活性随土壤质量变化的演变特征。何跃军等(2005)通过对石灰岩退化生态系统不同恢复阶段土壤酶活性长期观测指出,不同植被恢复方式对土壤酶改善作用不同,且土壤全氮与土壤酶活性呈显著或极显著相关。可以看出,土壤酶在恢复过程中起着至关重要的作用,通过对酶活性的研究,可以清楚地认识该生态过程中土壤质量变化规律以及物质转化过程。
黄土高原丘陵区地形破碎,自然植被遭到破坏,土壤结构疏松,是我国水土流失严重的地区之一,该区也是国家退耕还林还草及生态建设的重点区域。近年来开展的生态建设和退耕还林生态工程极大改善该区的生态环境,使得该区的水分、土壤养分都产生一些变化。研究表明人工林可通过次生演替恢复土壤特性和维持土壤肥力(Lamb,1998; Campbell et al., 1994),从而达到恢复生态系统健康的目的。而刺槐作为黄土高原植被恢复与重建的主要人工树种之一,对改善这一地区的生态环境、防止水土流失、调节水文状况以及改善土壤质量发挥着非常重要的作用。目前对于刺槐的研究大多集中在生理机能和土壤水分方面(李军等,2008; 于占辉等,2009; 郑淑霞等,2007; 杨建伟等,2004),对于土壤酶活性变化的研究相对较少。本文以不同林龄的人工刺槐(Robinia pseudoacacia)林为研究对象,分析生态恢复过程中土壤质量及酶活性的演变过程,探讨土壤酶活性在评价刺槐造林过程的生态意义,从而为黄土高原土壤质量评价和生态恢复的持续健康发展提供科学依据。
1 材料与方法 1.1 研究区概况研究区位于陕西省安塞县纸坊沟流域(109°13′46″-109°16′03″ E,36°46′42″-36°46′28″ N),海拔1 010 ~ 1 400 m,年均气温8.8 ℃,年均降水量505.3 mm,年际变化大且年内分配不均,属暖温带半干旱季风气候。该区地形破碎,沟壑纵横,属黄土高原丘陵沟壑地貌,植被类型处于暖温带落叶阔叶林向干草原过渡的森林草原带。土壤类型以黄土母质上发育而成的黄绵土为主,抗冲抗蚀能力差,其中砂粒(2.0 ~ 0.05 mm)含量占19.0%,粉粒(0.05 ~ 0.02 mm)含量占65.2%,粘粒(<0.02 mm)含量占15.8 %。纸坊沟流域是中国科学院安塞水土保持试验站生态恢复定位试验研究小流域,该流域生态系统先后经历严重破坏期(1938-1958年)、继续破坏期(1959-1973年)、不稳定期(1974- 1983年)、稳定恢复改善期(1983-1990年)和良性生态初步形成期(1991年至今)。经过30多年的水土保持综合治理,通过林草植被和工程等措施建设,有效遏制了该流域的土壤侵蚀,成功地恢复了退化生态系统,林地面积从1980年的不足5%增加到40%以上,流域生态经济系统进入良性循环阶段(Liu,1999)。
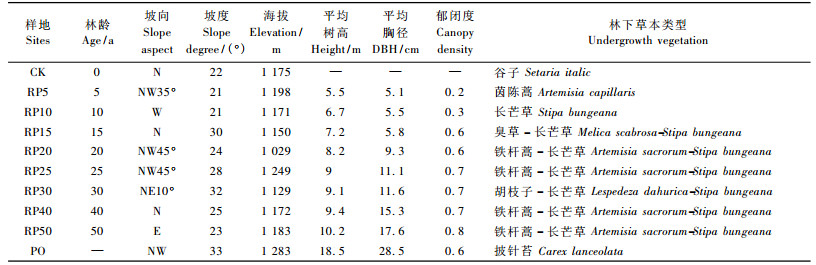
根据流域地貌特征、植被以及不同年龄人工刺槐林地状况,以典型性和代表性为原则,采用时空互代法在流域内选择营造和管理方法一致,土壤与成土母质类型相同,种植刺槐前均为坡耕地的5年(RP5)、10年(RP10)、15年(RP15)、20年(RP20)、25年(RP25)、30年(RP30)、40年(RP40)和50年(RP50)人工刺槐林为样地,选取坡耕地(sloping cropland,CK)和该地区植被破坏前顶级群落天然侧柏(Platycladus orientalis,PO)林为对照样地,其基本特征及林下植被如表 1。
|
|
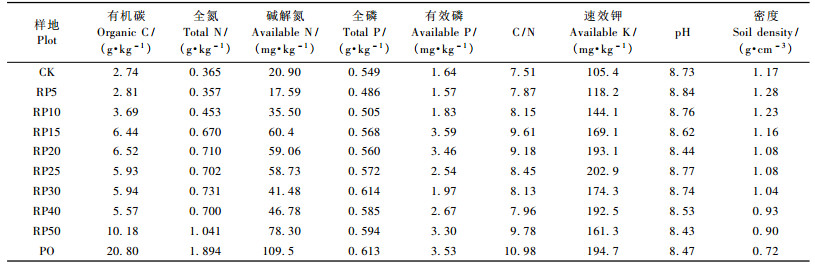
在试验地20 m × 20 m样方内按S型选取6点,每点采集0 ~ 20 cm混合土样,重复3次。土壤pH值、全氮、全磷、有机质、碱解氮、有效磷及速效钾含量采用常规方法测定,具体结果见表 2。蔗糖酶测定: 3,5-二硝基水杨酸比色法,以1 h后1 g土壤中含有的葡萄糖量(mg)表示; 淀粉酶测定: 3,5 -二硝基水杨酸比色法,以1 h后1 g土壤中含有的麦芽糖量(mg)表示; 纤维素酶测定:硝基水杨酸比色法,活性以1 h后1 g土壤生成的葡萄糖量(mg)表示; 脲酶测定:靛酚比色法,活性以1 h后1 g土壤中的NH3-N量(mg)表示; 碱性磷酸酶测定:磷酸苯二钠比色法,以1 g土壤中1 h后的苯酚量(mg)表示; 过氧化氢酶测定:滴定法(0.1 N的标准KMnO4液滴定),活性以1 g土壤20 min后消耗0.1 N的KMnO4量(mL)表示; 多酚氧化酶测定:碘量滴定法,酶活性用滴定相当于1 g土壤滤液的0.01 N I2量(mL)表示。
|
|
土壤酶种类繁多,每一种酶在土壤中起着不同的作用,有的酶相互之间信息重叠,而单一酶类在反映土壤酶的变化上存在很大的片面性,土壤酶指数(soil enzymes index; SEI)能够客观、全面地揭示不同林龄人工刺槐林土壤酶活性的变化规律,因此本文在各酶类的基础上,采用加权和法计算出土壤酶指数,其计算过程分为因子的选择、权重的确定和综合指标的获得3个步骤(许明祥等,2005)。由于土壤因子变化具有连续性质,各酶活性指标采用连续性质的隶属度函数,并从主成分因子负荷量值的正负性确定隶属度函数分布的升降性。对于多酚氧化酶采用降型分布函数,而对于其他酶采用升型分布函数。
土壤酶评价指数计算公式如下:
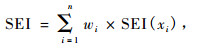
|
(1) |
式中: SEI(xi)表示土壤酶隶属度值,Wi表示土壤酶(i)的权重。
升型分布函数和降型分布函数的计算公式如下:

|
(2) |
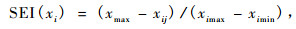
|
(3) |
式中: xij表示土壤酶活性值,ximax和ximin分别表示土壤酶(i)活性的最大值和最小值。通过以上转换计算出评价指标的隶属度,将评价指标的实测值转换为介于0 ~ 1之间的数值,实现指标量纲归一化,消除评价指标量纲的不同对因子荷载的影响。
由于土壤质量的各个因子的状况与重要性通常不同,所以通常用权重系数来表示各个因子的重要性程度。本研究中利用利用主成分分析因子负荷量计算各因子作用的大小,确定它们的权重。利用下式来计算:
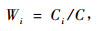
|
(4) |
式中: Ci为公因子方差,C为公因子方差之和。
1.4 数据统计分析数据分析采用SPSS 15.0统计软件,显著水平为P<0.05和P<0.01。
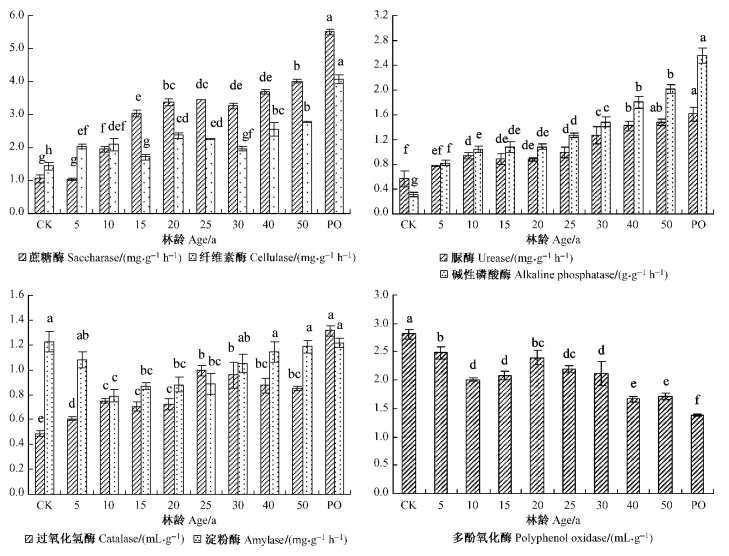
2 结果与分析 2.1 人工刺槐林土壤酶活性变化趋势 2.1.1 蔗糖酶、纤维素酶蔗糖酶是一种可以把土壤中高分子量蔗糖分子分解成能够被植物和土壤微生物吸收利用的葡萄糖和果糖的水解酶,为土壤提供充分能源,其活性反映土壤有机碳积累与分解转化的规律。An等(2009)、胡斌(2002)研究表明生态恢复可以增加土壤蔗糖酶活性,本研究也表明(图 1) :种植刺槐10年后,蔗糖酶活性较坡耕地增加85.9%,达到显著水平,10 ~ 25年趋于稳定,25年后继续上升,50年后达到最大值,较坡耕地增加281.8%,但仅为天然侧柏林的69.9%。纤维素酶与土壤有机质的分解、腐殖质的形成和碳素的营养释放密切相关,可将纤维素分解生成葡萄糖。研究表明,栽植刺槐林5年后,纤维素酶活性显著增加,随后呈波状缓慢增加,50年后达到最大值,较坡耕地增加92.6%,但仅为天然侧柏林的67.8%。
|
图 1 不同林龄人工刺槐林土壤酶活性变化 Figure 1 Dynamic of soil enzymes activities in R.pseudoacacia |
土壤脲酶能够将土壤中的有机化合物尿素水解为氨态氮,使植物所需的养分转化为有效态,提高氮素的利用率,促进土壤氮素循环(李冬坡,2003)。从图 1可看出,坡耕地退耕栽植刺槐林后,随着林龄的增加,土壤脲酶含量变化显著,栽植刺槐林10年后较坡耕地显著增大(P<0.05),增幅达65.9%,10 ~ 25年逐渐趋于平稳,25年后继续上升,50年时达到最大值,较坡耕地增加160.2%,是天然侧柏林的91.5%。土壤磷酸酶活性高低直接影响土壤有机磷的分解转化速率,常用来反映土壤有效磷水平。结果表明,坡耕地栽植刺槐前10年,碱性磷酸酶含量较坡耕地显著增加,增幅达232.3%,10 ~ 25年趋于稳定,25年后又缓慢上升,50年后达到最大值,较坡耕地增加541.6%,但仅为天然侧柏林的79.1%。
2.1.3 过氧化氢酶、淀粉酶过氧化氢酶能酶促水解过氧化氢为水和氧,解除过氧化氢对植物的毒害作用,在一定程度上可以表征土壤生物氧化过程的强弱(杨万勤,2002; 和文祥,1997)。研究表明(图 2),在栽植刺槐5年时过氧化氢酶较坡耕地显著增加,10 ~ 20年趋于稳定,随后显著升高,在25年达到最高峰,30 ~ 50年略微下降,但并未达到显著水平,50年时较坡耕地增加73.8%,为天然侧柏林的64.5%。土壤淀粉酶可将土壤中淀粉水解生成糊精和麦芽糖,其活性大小与有机碳的代谢速率密切相关(Debosz et al., 1999)。由图 1可知,栽植刺槐林后淀粉酶活性先降低后升高,10年时达到最低值,随后逐渐增高,30年时和坡耕地没有显著差异,并逐渐趋于稳定,与天然侧柏林无显著差异。
|
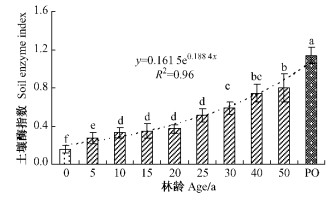
图 2 不同林龄人工刺槐林土壤酶指数变化 Figure 2 Dynamic of soil enzyme index in R. pseudoacacia |
多酚氧化酶参与土壤腐殖质组分中芳香族化合物的转化作用,酚促氧化产物醌与土壤中的氨基酸缩合形成胡敏酸分子,完成土壤芳香族化合物循环(Durin et al., 2000; Toseano et al.,2002),常用来反映土壤腐殖质状况。图 1表明,多酚氧化酶活性随刺槐林龄逐渐降低,5年时达到显著水平,10 ~ 30年趋于稳定,随后继续降低,到50年达到最低值,较坡耕地降低39.1%,但仍显著高于天然侧柏林。
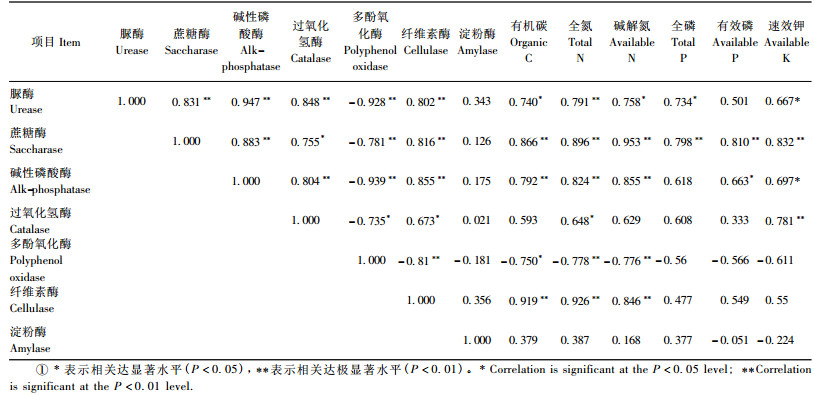
2.2 土壤酶活性与养分因子的相关性分析相关性分析表明(表 3),除淀粉酶外,脲酶、蔗糖酶、磷酸酶、过氧化氢酶、多酚氧化酶、纤维素酶相互之间呈显著或极显著相关(P<0.05,P<0.01)。此外,脲酶与土壤有机质、碱解氮、全磷、速效钾呈显著正相关(P<0.05),与全氮呈极显著正相关(P<0.01);蔗糖酶与土壤有机质、全氮、碱解氮、全磷、有效磷、速效钾呈极显著正相关。
|
|
磷酸酶除与全磷相关性较弱外,与土壤有机质、全氮、碱解氮呈极显著正相关,与有效磷、速效钾呈显著正相关; 过氧化氢酶与全氮、速效钾呈显著正相关,与其他养分因子相关性较弱; 多酚氧化酶与有机碳呈显著负相关,与全氮、碱解氮呈极显著负相关(P<0.01),纤维素酶与有机碳、全氮、碱解氮呈极显著正相关,与全磷、有效磷、速效钾相关性较弱; 淀粉酶与主要肥力因子相关性较弱,未达到显著水平。
2.3 土壤酶指数土壤酶指数(SEI)作为各酶因子综合作用的反映,克服单一指标片面反映土壤性质变化的缺点,能够客观、全面地反映土壤酶活性的变化过程。由图 2可知,土壤酶指数与刺槐林龄总体上呈指数增长趋势,表现为在前10年显著升高,10 ~ 25年保持相对稳定,25年后又开始稳定升高,50年时达到最大值,但仅为天然侧柏林的69.2%。坡耕地营造刺槐林后,耕种过程中对土壤机械破坏消失,土壤结构渐趋稳定,有效积累土壤养分,为根系的生长提供营养来源。植被恢复的同时,林下物种日益增多,增加植物根系生物量,而枯枝落叶的增加也为土壤微生物提供充足的营养来源,从而提高土壤酶活性。
3 结论与讨论1) 黄土丘陵区坡耕地种植刺槐林后,土壤脲酶、蔗糖酶、磷酸酶、过氧化氢酶、纤维素酶活性显著增加,但仍低于天然侧柏林,多酚氧化酶活性较坡耕地显著降低,淀粉酶则随林龄的增加先降低后升高。侵蚀环境下的坡耕地由于长期人为活动的干扰,土壤结构遭到破坏,水土流失严重,土壤酶活性低下,坡耕地种植刺槐林后大量的枯枝落叶和营养元素等物质返回到生态系统中,土壤中的有机物含量增多,为微生物提供充足的碳源,同时刺槐可以形成固氮菌(Pastor et al., 1998),固定更多的空气中氮素,为土壤系统提供更多氮素供给,促进微生物生理代谢活动,因此坡耕地种植刺槐后,脲酶、蔗糖酶、磷酸酶、纤维素酶以及过氧化氢酶活性较坡耕地显著增加。多酚氧化酶与其他酶变化不同,随刺槐林龄呈降低趋势,刘福德(2005)、谭芳林等(2003)研究也发现类似现象,而李传荣等(2004)、Cao等(2008)却得出相反的结论。由此可知,植物残体腐殖化过程中土壤多酚氧化酶的变化可以分成2类,一类是随分解过程而降低,另一类则是随着分解过程而升高,究其原因与不同环境下植物残体的化学组成以及林木根系分泌特征有关。淀粉酶活性呈先降低后升高趋势,与他人研究结果不同(张学利等,2005; 周玮等,2008)。影响土壤酶的原因多种多样,水热条件、养分丰缺、植被组成以及地形地貌均与其紧密相关,对于淀粉酶的变化原因可以推测出多种因素,因此对于不同植被类型下土壤淀粉酶的变化规律还有待进一步研究。
此外,在植被恢复过程中,除土壤水热条件、结构组成、养分丰缺等外界条件外,林木的生长特性也影响土壤酶的变化,并呈现出一定的规律性:在生长前期,随着林龄增加,植物生物量较坡耕地迅速积累,枯枝落叶和营养物质急剧增加,土壤酶活性增强; 到了中龄或成熟林期,刺槐生长旺盛,林分郁闭度增加(Pastor,1998),林下光照强度显著降低,土壤水分剧烈消耗,形成土壤干层(薛萐等,2007),高密度林分下的植被生长受到强烈抑制,其种类、生物量显著降低,土壤养分积累下降,根系微生物活性减慢,所以在此时期土壤酶活性基本保持稳定。成熟林后期,在自然稀疏等因素的作用下,林冠逐渐疏透,林下光照增强,林下植物群落的盖度、生物量和植物种类增加,群落形成乔木-灌木-草本的复层结构,特别在低等植物的出现后,代谢途径更加多样化,土壤酶活性增强。
2) 本文中土壤脲酶、磷酸酶、蔗糖酶、过氧化氢酶和多酚氧化酶不仅相互之间关系密切,而且与主要土壤养分因子相关性显著,从而说明土壤酶在植被恢复过程中对于改善土壤质量具有相当重要的作用,它们直接影响着土壤养分的循环和能量的转化,因此可以作为评价土壤肥力的指标。邱莉萍等(2004)研究发现土壤脲酶和碱性磷酸酶活性与土壤养分之间呈显著或极显著相关关系,认为脲酶和碱性磷酸酶可以作为衡量土壤肥力水平的指标,而See等(1998)认为土壤酶活性与土壤肥力无显著相关关系,这是由于同一种类的酶在不同植被以及不同质地土壤中,所起的作用不同,进而与土壤养分因子之间的相关性也会存在一定差异。
3) 在土壤肥力评价中,土壤酶已经被用来评价土壤肥力状况,但单一酶类在反映土壤酶的变化时存在很大的片面性和局限性,土壤酶指数则克服这一缺点,能够客观、全面地反映土壤酶活性的变化过程。研究显示,种植刺槐50年后,土壤酶指数较坡耕地显著增加,但与天然侧柏林相比,仅为其69.2%,这表明坡耕地种植刺槐林后土壤酶活性显著增强,但要恢复到该区演替顶级群落时的水平,还需要很长的时间。
关松荫. 1986. 土壤酶及其研究法[M]. 北京: 农业出版社: 271-319.
|
和文祥, 朱铭莪. 1997. 陕西土壤脲酶活性与土壤肥力关系分析[J]. 土壤学报, 34(4): 392-398. |
何跃军, 钟章成, 刘济明, 等. 2005. 石灰岩退化生态系统不同恢复阶段土壤酶活性研究[J]. 应用生态学报, 16(6): 1077-1081. |
胡斌, 段昌群. 2002. 植被恢复措施对退化生态系统土壤酶活性及肥力的影响[J]. 土壤学报, 39(4): 604-608. DOI:10.11766/trxb200009190422 |
姜华, 毕玉芬, 朱栋斌, 等. 2008. 恢复措施对云南退化山地草甸土壤微生物和酶活性的影响[J]. 草地学报, 16(3): 256-261. DOI:10.11733/j.issn.1007-0435.2008.03.009 |
李冬坡, 武志杰. 2003. 长期培肥黑土脲酶活性动态变化及其影响因素[J]. 应用生态学报, 14(12): 2208-2212. DOI:10.3321/j.issn:1001-9332.2003.12.026 |
李军, 王学春, 邵明安. 2008. 黄土高原不同密度刺槐林地水分生产力与土壤干燥化效应模拟[J]. 生态学报, 28(7): 3125-3141. |
刘福德, 姜岳忠, 王华田, 等. 2005. 杨树人工林连作效应的研究[J]. 水土保持学报, 19(2): 102-105. |
邱莉萍, 刘军, 王益权, 等. 2004. 土壤酶活性与土壤肥力的关系研究[J]. 植物营养与肥料学报, 10(3): 277-280. DOI:10.11674/zwyf.2004.0311 |
谭芳林, 林捷, 张水松. 2003. 沿海沙地湿地松林地土壤养分含量及酶活性研究[J]. 林业科学, 39(1): 170-173. |
许明祥, 刘国彬, 赵允格. 2005. 黄土丘陵区土壤质量评价指标研究[J]. 应用生态学报, 16(10): 1843-1848. DOI:10.3321/j.issn:1001-9332.2005.10.009 |
薛萐, 刘国彬, 戴全厚. 2007. 侵蚀环境生态恢复过程中人工刺槐林土壤微生物量演变特征[J]. 生态学报, 27(3): 909-917. |
杨建伟, 梁宗锁, 韩蕊莲. 2004. 不同土壤水分状况对刺槐的生长及水分利用特征的影响[J]. 林业科学, 40(5): 93-98. DOI:10.11707/j.1001-7488.20040515 |
杨万勤, 王开运. 2002. 土壤酶研究动态与展望[J]. 应用与环境生物学报, 8(5): 564-570. |
于占辉, 陈云明, 杜盛. 2009. 黄土高原半干旱区人工林刺槐展叶期树干液流动态分析[J]. 林业科学, 45(4): 53-59. DOI:10.11707/j.1001-7488.20090409 |
张学利, 杨树军. 2005. 不同林龄樟子松根际与非根际土壤的对比[J]. 福建林学院学报, 25(1): 1-4. |
周玮, 周运超, 田春. 2008. 花江喀斯特地区花椒人工林的土壤酶演变[J]. 中国岩溶, 27(3): 240-245. |
周礼恺. 1987. 土壤酶学[M]. 北京: 科学出版社: 118-159.
|
郑淑霞, 上官周平. 2007. 黄土高原油松和刺槐叶片光合生理适应性比较[J]. 应用生态学报, 18(1): 16-22. |
An S S, Zheng F L, Zhang F. 2008. Soil quality degradation processes along a deforestation chronosequence in the Ziwuling area, China[J]. Catena, 75(3): 248-256. DOI:10.1016/j.catena.2008.07.003 |
An S S, Huang Y M, Zheng F L. 2009. Evaluation of soil microbial indices along a revegetation chronosequence in grassland soils on the Loess Plateau, Northwest China[J]. Applied Soil Ecology, 41(3): 286-292. DOI:10.1016/j.apsoil.2008.12.001 |
Carine F, Yvan C, Steven C. 2009. Enzyme activities in apple orchard agroecosystems: How are they affected by management strategy and soil properties[J]. Soil Biology & Biochemistry, 41(1): 61-68. |
Campbell B M, Frost P, King J A, et al. 1994. The influence of trees on soil fertility on two contrasting semi-arid types at Matopos, Zimbabwe[J]. Agroforestry Systemst, 28(2): 159-172. DOI:10.1007/BF00704827 |
Cao CY, Jiang D M, Teng X H, et al. 2008. Soil chemical and microbiological properties along a chronosequence of Caragana microphylla Lam[J]. plantations in the Horqin sandy land of Northeast China. Applied Soil Ecology, 40(1): 78-85. |
Debosz K, Rasmussen P H, Pedersen A R. 1999. Temporal variations inmicrobial biomass C and cellulolytic enzyme activity in arable soils: Effect of organic matter input[J]. Applied Soil Ecology, 13(3): 209-218. DOI:10.1016/S0929-1393(99)00034-7 |
Durin N, Esposito E. 2000. Potential applications of oxidative enzymes and phenol-oxidase-like compounds in wastewater and soil treatment: a review[J]. Applied Catalysis B: Environmental, 28(2): 83-99. DOI:10.1016/S0926-3373(00)00168-5 |
Floch C, Capowiez Y, Criquet S. 2009. Enzyme activities in apple orchard agroecosystems: How are they affected by management strategy and soil properties[J]. Soil Biology & Biochemistry, 41(1): 61-68. |
Gehrke C, Johanson U, Callaghan T V, et al. 1995. The impact of enhanced ultraviolet-B radiation on litter quality and decomposition processes in Vaccinium leaves from the Subarctic[J]. Oikos, 72(2): 213-222. DOI:10.2307/3546223 |
Lamb D. 1998. Large-scale ecological restoration of degraded tropical forest lands: The potential role of timber plantations[J]. Restoration Ecology, 6(3): 271-279. DOI:10.1046/j.1526-100X.1998.00632.x |
Liu G B. 1999. Soil conservation and sustainable agriculture on the Loess Plateau: challenge and prospective[J]. AMBIO, 28(8): 663-668. DOI:10.1046/j.1526-100X.1998.00632.x |
Pastor J, Binkley D. 1998. Nitrogen fixation and the mass balances of carbon and nitrogen in ecosystems[J]. Biogeochemistry, 43(1): 63-78. DOI:10.1023/A:1006057428096 |
Ranjith P, Udawatta, Robert J, et al. 2009. Soil enzyme activities and physical properties in a watershed managed under agroforestry and row-crop systems[J]. Agriculture, Ecosystems and Environment, 131(1/2): 98-104. |
See M H, Laitamm H, Pikk J. 1998. The influence of nutritional conditions on forest soil microflora[J]. Baltic Forestry, 4(1): 2-7. |
Toseano G, Maria L, Greco G. 2003. Oxidative polymerisation of phenols by a phenol oxidase from green olives[J]. Enzyme and Microbial Technology, 33(1): 47-54. DOI:10.1016/S0141-0229(03)00080-2 |
 2010, Vol. 46
2010, Vol. 46