文章信息
- 杨阳, 王华田, 王延平, 姜岳忠, 王宗芹
- Yang Yang, Wang Huatian, Wang Yanping, Jiang Yuezhong, Wang Zongqin
- 外源酚酸对杨树幼苗根系生理和形态发育的影响
- Effects of Exogenous Phenolic Acids on Root Physiologic Characteristics and Morphologic Development of Poplar Hydroponic Cuttings
- 林业科学, 2010, 46(11): 73-80.
- Scientia Silvae Sinicae, 2010, 46(11): 73-80.
-
文章历史
- 收稿日期:2010-10-09
- 修回日期:2010-08-24
-
作者相关文章
2. 山东省淄博市鲁山林场 淄博 255205;
3. 山东省林业科学研究院 济南 250014
2. Forest Park of Lushan Zibo 255205;
3. Shandong Academy of Forestry Jinan 250014
杨树(Populus)是我国华北地区和江淮流域广泛栽培的速生用材树种。受林地资源的限制,我国杨树速生丰产林培育多实行多代连作经营模式,由此引发的地力衰退现象非常严重(刘福德等,2005)。研究表明:人工林多代连作地力衰退与林地土壤有毒物质的累积存在密切关系(Blum,1996)。酚酸作为一类化感活性较强的物质,在植物化感效应研究中受到广泛重视(Tang et al., 1982; Rice,1984)。化感物质的作用强度及持续时间依赖物种的敏感度以及根际周围活性酚酸的持续浓度(Einhellig et al., 1971; Glass et al., 1974; Blum et al., 1985; Blum et al., 1989; Lehman et al., 1999)。化感作用在植物竞争活动中虽不优于光照、温度、水分、养分等因素,但在一定条件下,也具备成为一种限制因子的可能性,从而在植物的竞争中成为决定性因素(Waller,1987; Einhellig,1996; 孔垂华等,2000; 林思祖等,2002)。研究表明:杨树人工林根际土壤中酚酸物质的含量呈现逐代累积的趋势(谭秀梅等,2008)。植物根系是土壤酚酸直接作用的对象,是化感作用的重要受体,且根系生长比枝叶生长更易受到化感物质的影响(Inderjit et al., 1995)。酚酸物质可以通过影响根系的形态和生理特征,影响植株对水分和矿质元素的吸收,进而影响植株整体的营养代谢和生长发育(Holappa et al., 1991; Einhellig,1995; Blum et al., 2005)。酚酸物质可通过改变植物体内保护酶活性,导致体内活性氧含量增多,启动膜质过氧化,破坏膜结构,对细胞膜造成伤害,而酚酸物质对膜的破坏可能是化感作用所有效应的起点(Baziramakenga et al., 1995; Rama et al., 1996; Roshchina et al., 1993; Romagni et al., 2000; 吴凤芝等,2001; Yu et al., 1997)。
Ⅰ-69杨(P.deltoides ‘Lux ’)是20世纪90年代鲁中地区的主栽杨树品种之一,存在连作二代林,但由于杨树品种更新很快,目前Ⅰ-69已经为Ⅰ-107(Populus × euramericana ‘Neva’)所取代。连作衰退问题从Ⅰ-69连作二代林地即表现出来。研究发现: Ⅰ-69连作二代林地土壤中有5种酚酸物质存在明显的累积,而不同品种更替连作三代林存在更明显的累积(谭秀梅等,2008)。本研究组以往对连作二代(同一品种)、连作三代(不同品种)、连作四代(不同品种)土壤中酚酸累积规律的研究发现:杨树连作人工林土壤中5种酚酸在各代杨树人工林土壤中是普遍存在的,其浓度变化趋势总体上随着连作代数的增加而升高。多代连作杨树人工林土壤中酚酸类物质逐代累积,可能影响杨树根系的生理功能和生长发育,但相关研究尚未见报道。
综合产区杨树栽培历史及林地酚酸累积规律,本研究以Ⅰ-69连作二代林地土壤酚酸含量为基础设置酚酸浓度水平,以目前广泛栽培的Ⅰ-107为试验材料构建模拟试验,研究酚酸作用下杨树幼苗根系生理特性和根系形态的变化规律,探讨酚酸对杨树根系生长发育的影响,以期揭示酚酸累积与杨树人工林连作地力衰退的内在联系,为揭示连作杨树人工林地力衰退机理提供科学依据。
1 材料与方法 1.1 试验材料杨树种源来自山东宁阳高桥林场国家黑杨种质资源基因库。从健康、粗度均一的1年生黑杨派欧美杨Ⅰ-107中部,采集直径1 cm,长度15 cm的插穗,采用随机区组试验设计,在改良Hoagland营养液(吴晓辉,2005)中于自然光照下培养(采用塑料培养容器,其容积为2 L,每个容器可容纳10株幼苗; 为防止光照对杨树幼苗根系发育造成影响,培养容器均进行遮光处理),每个处理布置50株幼苗,每个小区10株,重复5次,其中4株用于形态测定,6株用于采集根系样品进行生理试验。参照连作二代杨树连作人工林土壤酚酸含量X(谭秀梅等,2008),培养液中预先外源混合引入对羟基苯甲酸(p-hydroxybenzoic acid)、香草醛(vanillin)、阿魏酸(ferulic acid)、苯甲酸(benzoic acid)、肉桂酸(cinnamic acid)5种酚酸,并将混合酚酸浓度分别设置为0.5X,1.0X,1.5X,2.0X 4个梯度作为4个酚酸浓度处理,以不加酚酸的营养液作为对照。各区组培养液每3天更换1次。
1.2 测定方法分别在外源酚酸处理后第1,5,10,20,30,40天从用于生理测定的幼苗中随机抽取幼苗采集根系样品,剪碎混匀作待测样品,利用UNICO UV-2102紫外可见分光光度计和雷磁DDSJ-308A电导率仪等进行根系生理特性测定:根系超氧化物歧化酶(SOD)和过氧化物酶(POD)活性参照郝再彬等(2004)的方法测定; 根系丙二醛(MDA)含量和根系活力参照孔祥生等(2008)的方法测定; 根系伤害度参照赵世杰等(2004)的方法测定。生理测定每个处理3次重复。
在外源酚酸处理后第40天进行根系形态测定:使用EPSON Flatbed Scanner根系扫描系统结合EPSON Expression根系分析软件采集根系形态数据(由测定系统根据根系特征自行运算并输出最终结果,其中根系直径数据为平均值,其他形态指标均为累加值); 采用Fractal Box Count of Image J图像分形维数分析软件处理根系扫描图片,获取根系分形维数(fractal dimension,F.D.)。形态测定每个处理统计分析20株幼苗。
1.3 数据分析采用SAS 8.0统计分析软件进行数据差异显著性检验、Duncan多重极差检验及多元线性回归分析,使用Microsoft Excel进行模型拟合和图表绘制。
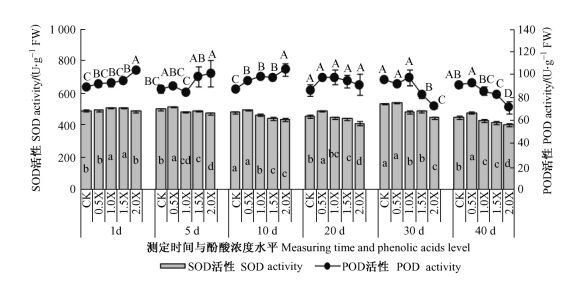
2 结果与分析 2.1 外源酚酸对杨树水培幼苗根系SOD和POD活性的影响酚酸处理后第1天,杨树水培幼苗根系SOD活性即受较低浓度酚酸处理0.5X,1.0X和1.5X的刺激而分别提高0.36%,3.10%和3.65%,而最高浓度酚酸处理2.0X的SOD活性下降1.11%,较高浓度酚酸处理1.0X和1.5X与对照表现出显著差异(P<0.05) (图 1)。酚酸处理后的第5 ~ 40天,低浓度处理0.5X提高根系SOD活性,而高浓度酚酸则逐渐抑制SOD活性。其中,处理后第40天,低浓度处理0.5X的SOD活性比对照提高6.34%,较高浓度处理1.0X,1.5X和2.0X的SOD活性则分别比对照降低4.29%,7.09%和10.63%。全部酚酸处理的根系SOD活性在第40天与对照均表现出显著差异(P<0.05) (图 1)。试验结果说明:低浓度酚酸提高杨树水培幼苗根系SOD活性,促进根系内
|
图 1 外源酚酸影响下杨树水培幼苗SOD和POD活性动态变化 Figure 1 Dynamic changes of SOD and POD activity of poplar hydroponic cuttings under exogenous phenolic acids 按照Duncan多重极差检验,标记有不同字母的均值存在显著差异(P<0.05)。Means marked with different letters are significantly different according to Duncan's multiple range test (P < 0.05).下同.The same below. |
酚酸处理后第1 ~ 10天,杨树水培幼苗根系POD活性随酚酸浓度的增大表现出逐渐提高的趋势。处理后第1天,0.5X,1.0X,1.5X和2.0X浓度处理的根系POD活性分别比对照提高2.79%,3.91%,6.15%和16.20%,高浓度处理1.5X和2.0X与对照的数值表现出显著差异(P<0.05);处理后第10天,0.5X,1.0X,1.5X和2.0X浓度处理的根系POD活性则分别比对照提高8.00%,12.57%,11.43%和19.43%,全部酚酸处理与对照均出现显著差异(P<0.05) (图 1)。处理后第20 ~ 40天,根系POD活性逐渐表现出随酚酸浓度的增大而逐渐下降的趋势。处理后第40天,低浓度处理0.5X的POD活性比对照提高2.20%,而较高浓度处理1.0X、1.5X和2.0X则分别比对照降低5.49%,8.79%和21.43%,高浓度处理1.5X和2.0X与对照表现出显著差异(P<0.05) (图 1)。试验结果说明:酚酸作用前期,所有酚酸处理均提高根系POD活性,利于幼苗根系体内H2O2的清除,阻止脂性自由基产生,有利于根系抗氧化功能的发挥; 酚酸作用后期,低浓度酚酸处理的POD活性保持较高水平,根系仍可维持较强的抗氧化能力,而高浓度酚酸处理的POD活性则发生显著的降低,不利于幼苗根系体内H2O2的清除,还可能导致脂性自由基产生,加剧根系伤害。
2.2 外源酚酸对杨树水培幼苗根系活力、丙二醛含量与根系伤害度的影响酚酸处理后第5 ~ 40天,杨树幼苗根系活力随酚酸浓度的提高而逐渐受到抑制。处理后第40天,0.5X,1.0X,1.5X和2.0X酚酸处理的根系活力分别比对照降低18.66%,35.08%,45.04%和54.58%,全部酚酸处理的根系活力与对照均表现出显著差异(P<0.05) (图 2)。酚酸处理引起杨树水培幼苗根系活力下降,说明根系脱氢酶活性受到酚酸物质的抑制,导致根系代谢功能下降,影响幼苗根系的吸收和转化功能的正常发挥。

|
图 2 外源酚酸影响下杨树水培幼苗根系活力与根系丙二醛含量动态变化 Figure 2 Dynamic changes of root activity and MDA content of poplar hydroponic cuttings under exogenous phenolic acids |
以处理时间X1和酚酸浓度水平X2为自变量(其中X1取值分别为1,5,10,20,30,40,X2取值分别为0,0.5,1.0,1.5,2.0),根系活力为依变量Y,进行方差分析与多元线性回归。方差分析结果表明:回归关系检验P<0.000 1,即Y与X1,X2的线性回归关系极显著。根系活力Y与处理时间X1和酚酸浓度水平X2的回归方程为

|
处理时间(X1)和酚酸浓度水平(X2)均对根系活力(Y)产生极显著影响(P<0.000 1)。在对根系活力的影响方面,酚酸处理时间持续22.3天的累积效果与酚酸浓度提高1倍的强度效果一致。
酚酸处理后第1天,低浓度酚酸处理0.5X的根系MDA含量比对照提高1.38%,而较高浓度的酚酸处理1.0X,1.5X和2.0X则分别比对照降低0.19%,3.29%和2.74%,各酚酸处理的根系MDA含量与对照未达到显著差异水平(P<0.05) (图 2)。酚酸处理后第5 ~ 40天,根系MDA含量随酚酸浓度的提高而逐渐增大。处理后第40天,处理0.5X,1.0X,1.5X和2.0X的根系MDA含量分别比对照数值提高12.83%,9.43%,20.82%和20.74%,全部酚酸处理的根系MDA含量与对照之间均表现出显著差异(P<0.05) (图 2)。酚酸处理导致杨树水培幼苗根系MDA含量提高,说明酚酸物质刺激根系细胞膜脂过氧化的发生,细胞膜结构受到破坏,同时产生的MDA对根系细胞正常的生理代谢功能存在潜在的伤害。
以处理时间X1和酚酸浓度水平X2为自变量(其中X1取值分别为1,5,10,20,30,40,X2取值分别为0,0.5,1.0,1.5,2.0),根系MDA含量为依变量Y,进行方差分析与多元线性回归。方差分析结果表明:回归关系检验P<0.000 1,即Y与X1,X2的线性回归关系极显著。根系MDA含量Y与处理时间X1和酚酸浓度水平X2的回归方程为

|
处理时间(X1)和酚酸浓度水平(X2)均对根系MDA含量(Y)产生极显著影响(P<0.000 1)。在对根系MDA含量的影响方面,酚酸处理时间持续27.6天的累积效果与酚酸浓度提高1倍的强度效果一致。
杨树水培幼苗根系伤害度随酚酸浓度水平的提高而逐渐增大。较低浓度酚酸处理0.5X和1.0X的根系伤害度相对较小,在整个生长过程中分别维持在1.25% ~ 3.98%和1.45% ~ 8.62%;高浓度酚酸处理1.5X和2.0X的根系伤害度相对较大,在整个生长过程中分别维持在12.94% ~ 18.76%和16.97% ~ 22.70%。处理后第40天,全部酚酸处理的根系伤害度之间均表现出显著差异(P<0.05) (图 3)。酚酸处理导致根系伤害度增大,这说明杨树水培幼苗总体抗逆能力的下降,可能与前述的SOD,POD活性下降以及根系活力下降存在密切关系。

|
图 3 外源酚酸影响下杨树水培幼苗根系伤害度动态变化 Figure 3 Dynamic changes of root injury degree of poplar hydroponic cuttings under exogenous phenolic acids |
以处理时间X1和酚酸浓度水平X2为自变量(其中X1取值分别为1,5,10,20,30,40,X2取值分别为0.5,1.0,1.5,2.0),根系伤害度为依变量Y,进行方差分析与多元线性回归。方差分析结果表明:回归关系检验P<0.000 1,即Y与X1、X2的线性回归关系极显著。根系伤害度Y与处理时间X1和酚酸浓度水平X2的回归方程为:

|
模型检验表明此回归方程关系极显著(P<0.000 1)。在对根系伤害度的影响方面,酚酸处理时间持续40.4天的累积效果与酚酸浓度提高1倍的强度效果一致。
2.3 外源酚酸影响下杨树水培幼苗根系形态的变化随酚酸浓度的提高,杨树水培幼苗平均根尖数逐渐减小。酚酸处理0.5X,1.0X,1.5X和2.0X的平均根尖数分别比对照下降25.95%,35.48%,84.48%和92.50%,全部酚酸处理的平均根尖数与对照均表现出显著差异(P<0.05) (表 1)。根尖数的显著下降,说明酚酸物质降低根系的生长发育潜力,不利于根系在土壤空间的延伸以及对矿质养分和水分的获取,对植株的生长具有不利影响。
随酚酸浓度的提高,杨树水培幼苗平均根系直径逐渐增大。酚酸处理0.5X,1.0X,1.5X和2.0X的平均根系直径分别比对照提高9.76%,36.97%,32.98%和47.56%,高浓度酚酸处理1.5X和2.0X与对照表现出显著差异(P<0.05) (表 1)。根系直径的增大,说明酚酸物质对根系造成的伤害,杨树水培幼苗通过增大根系直径的方式减轻酚酸物质的伤害。
|
|
杨树水培幼苗的平均根长随外源酚酸浓度水平的提高而逐渐减小。酚酸处理0.5X,1.0X,1.5X和2.0X的平均根长分别比对照降低37.85%,53.71%,82.06%和87.26%,全部酚酸处理的平均根长与对照均表现出显著差异(P<0.05)(表 1)。根系长度的减小,说明酚酸物质降低根系的延伸能力,不利于根系对土壤中矿质养分和水分的吸收利用。
杨树水培幼苗平均根表面积随酚酸浓度的提高而逐渐减小。酚酸处理0.5X,1.0X,1.5X和2.0X的平均根表面积分别比对照降低33.04%,37.00%,75.96%和81.74%,全部酚酸处理的平均根表面积与对照均表现出显著差异(P<0.05) (表 1)。根系表面积的显著降低,说明酚酸物质对杨树水培幼苗根系与土壤物质交换过程十分不利,而根系对土壤物质的交换吸收能力下降会对植株的整体生长发育造成影响。
杨树水培幼苗平均根系分枝数随酚酸浓度的提高而逐渐减小。酚酸处理0.5X,1.0X,1.5X和2.0X的平均根尖数分别比对照下降41.69%,54.06%,87.46%和92.62%,全部酚酸处理的平均根系分枝数与对照均表现出显著差异(P<0.05)(表 1)。根系分枝数的显著降低,说明酚酸物质抑制根系的生长发育,从而形成结构简单但生物量较小的根系,这种形态变化不利于杨树水培幼苗对矿质养分和水分的吸收利用,影响幼苗整体的生长发育。
杨树水培幼苗平均根系分形维数随酚酸浓度的提高而逐渐减小。酚酸处理0.5X,1.0X,1.5X和2.0X的平均根系分形维数分别比对照下降3.56%,4.00%,3.47%和6.97%,高浓度处理2.0X与对照存在显著差异(P<0.05) (表 1)。根系分形维数的降低,说明酚酸物质影响杨树水培幼苗根系的整体发育,导致根系分枝数减少,同时根系分布表现出不均匀、无序的特点,这些对于根系功能的发挥乃至幼苗的生长存在不利影响。
通过对比不同酚酸处理下根系形态扫描图(图 4,图示内容为各处理具有代表性的单条根系的整体形态)可发现:随着酚酸浓度的提高,杨树水培幼苗根系长度和侧根数量逐渐减小; 在根系顶端(主根根尖)附近由于侧根发育受到抑制而逐渐形成无侧根区域; 根系总体形状逐渐由柱形(CK)向倒金字塔形(0.5X和1.0X)和伞形过渡(1.5X和2.0X); 在较高浓度酚酸处理下,主根根尖出现坏死(1.5X和2.0X),这可能是导致根长生长受到抑制的重要原因。以上结果表明:酚酸物质对杨树水培幼苗根系的形态特征具有明显的作用,而形态特征的变化可能会对根系功能以及植株整体生长发育造成影响。

|
图 4 外源酚酸影响下杨树水培幼苗根系形态特征变化 Figure 4 Root morphologic characteristics of poplar hydroponic cuttings under exogenous phenolic acids |
本试验研究结果表明:低浓度酚酸提高杨树根系超氧化物歧化酶和过氧化物酶的活性,而高浓度酚酸则显著抑制2种酶的活性; 根系活力随酚酸浓度的提高而显著降低; 根系丙二醛含量以及根系伤害度随酚酸浓度的提高而显著升高; 酚酸能显著抑制杨树幼苗根系发育,导致平均根尖数、平均根长、平均根系表面积、平均根系分枝数以及平均根系分形维数显著降低; 高浓度酚酸导致根尖坏死。其他学者的研究结果与本试验研究基本一致:低浓度酚酸能够刺激植株保护酶系统功能的发挥,对超氧化物歧化酶和过氧化物酶的活性产生促进作用(Rama et al., 1996),而随着酚酸浓度的提高,酚酸诱发的伤害超出植株自我保护能力从而对上述保护酶产生抑制作用(Roshchina et al., 1993; Baziramakenga et al., 1995; Romagni et al., 2000; 何华勤等,2001; 吕卫光等,2002),并导致丙二醛等有害物质的积累(Politycka,1996); 根系生长对化感物质十分敏感,酚酸物质能明显抑制根系的纵向生长和细胞分裂,从而在根系形态上表现出明显的变化(Inderjit et al., 1995; Sang et al., 2002)。但是,对于酚酸浓度和处理时间对受体植物的效应权重的问题鲜见报道,笔者通过动态数据比较和多元线性回归分析发现:在试验浓度下,对于根系活力、根系丙二醛含量和根系伤害度等生理指标,酚酸处理时间持续20 ~40天所产生的累积效应与酚酸浓度提高1倍的强度效应基本一致。可见,较低浓度酚酸如果长时间持续胁迫也能够对植株生理特性产生类似高浓度酚酸胁迫的明显影响。
3.2 酚酸物质对受体植物造成伤害的原因探讨有研究指出:在过渡金属离子存在时,酚酸物质的自氧化可能是其产生化感作用的主要机制(Satoshi et al., 2001)。酚酸自氧化诱导细胞产生H2O2和醌,其中H2O2能够进一步造成细胞脂质过氧化,导致丙二醛等有害物质的产生(Ayako et al., 2003); 而醌作为潜在的过氧化物,通过氧化还原循环能够促进活性氧等有害物质的产生(Bors et al., 2000)。酚酸物质进入细胞后能够与细胞中某些特定的位点结合,导致细胞保护酶系统功能受到抑制(Rama et al., 1996; Romagni et al., 2000; 何华勤等,2001),从而促进细胞中活性氧和丙二醛等有害物质的积累(Politycka,1996; 1997),而这些有害物质能够导致细胞结构蛋白和功能蛋白受损,导致膜流动性下降,膜透性增大,同时能够破坏线粒体等细胞器,影响氧化磷酸化过程,抑制呼吸,干扰正常的生理生化代谢,导致细胞受损或死亡(陈少裕,1991),最终抑制植物组织器官正常功能的发挥,对植物生长发育产生不利影响(Holappa et al., 1991; Baziramakenga et al., 1995; Einhellig,1995)。由此可见,酚酸自氧化作用和酚酸对细胞保护酶系统功能的抑制引发的一系列细胞生理生化伤害是其对受体植物造成伤害的重要原因。另外,笔者认为酚酸持续胁迫的累积效应也是其导致植株生理特性出现明显变化并最终影响植株正常生长发育的重要原因。
陈少裕. 1991. 膜脂过氧化对植物细胞的伤害[J]. 植物生理学通讯, 27(2): 84-90. |
郝再彬, 苍晶, 徐仲. 2004. 植物生理实验[M]. 哈尔滨: 哈尔滨工业大学出版社: 110-116.
|
何华勤, 林文雄. 2001. 水稻化感作用生理生化特性研究[J]. 中国生态农业学报, 9(3): 56-57. |
孔垂华, 徐涛, 胡飞, 等. 2000. 环境胁迫下植物的化感作用及其诱导机制[J]. 生态学报, 20(5): 849-854. |
孔祥生, 易现峰. 2008. 植物生理学实验技术[M]. 北京: 中国农业大学出版社.
|
林思祖, 杜玲, 曹光球. 2002. 化感作用在林业中的研究进展及应用前景[J]. 福建林学院学报, 22(2): 184-188. |
刘福德, 姜岳忠, 王华田, 等. 2005. 杨树人工林连作效应的研究[J]. 水土保持学报: 102-105. DOI:10.3321/j.issn:1009-2242.2005.02.027 |
吕卫光, 张春兰, 袁飞, 等. 2002. 化感物质抑制黄瓜生长的作用机理[J]. 中国农业科学, 35(1): 106-109. |
谭秀梅, 王华田, 孔令刚, 等. 2008. 杨树人工林连作土壤中酚酸积累规律及对土壤微生物的影响[J]. 山东大学学报理学版, 43(1): 14-19. |
吴凤芝, 赵凤艳, 马凤鸣. 2001. 酚酸物质及其化感作用[J]. 东北农业大学学报, 32(4): 313-319. |
吴晓辉. 2005. 常见眼子菜科沉水植物对浮游藻类的化感作用研究. 中国科学院博士学位论文, 24-25.
|
张淑香, 高子勤. 2000. 连作障碍与根际微生态研究Ⅱ根系分泌物与酚酸物质[J]. 应用生态学报, 11(1): 152-156. |
赵世杰, 邹琦, 高辉远, 等. 2004. 植物生理学实验技术. 泰安: 山东农业大学植物科学系, 98-101.
|
Ayako F, Shinkji O, Mariko M, et al. 2003. (-)-Epigallocatechin gallate causes oxidative damage to isolated and cellular DNA[J]. Biochemical Phamacology, 66(9): 1769-1778. DOI:10.1016/S0006-2952(03)00541-0 |
Baziramakenga R, Leroux G D, Simard R R. 1995. Effects of benzoic and cinnamic acids on membrane permeability of soybean roots[J]. Journal of Chemical Ecology, 21(9): 1271-1285. DOI:10.1007/BF02027561 |
Blum U, Dalton B R. 1985. Effects of ferulic acid, an allelopathic compound, on leaf expansion of cucumber seedlings grown in nutrient culture[J]. J Chem Ecol, 11: 279-301. DOI:10.1007/BF01411415 |
Blum U, Gerig T M. 2005. Relationships between phenolic acid concentrations, transpiration, water utilization, leaf area expansion, and uptake of phenolic acids: nutrient culture studies[J]. J Chem Ecol, 31(8): 1907-1932. DOI:10.1007/s10886-005-5934-5 |
Blum U, Rebbeck J. 1989. Inhibition and recovery of cucumber roots given multiple treatments of ferulic acid in nutrient culture[J]. J Chem Ecol, 15: 917-928. DOI:10.1007/BF01015187 |
Booker F L, Blum U, Fiscus E L. 1992. Short term of ferulic acids on ion uptake and water relations on cucumber seedlings[J]. Journal of Experimental Botany, 43(250): 649-655. |
Bors W, Michel C, Stettmaier K. 2000. Electron paramagnetic resonance studies of radical species of proanthocyanidins and gallate esters[J]. Arch Biochem Biophys, 374(2): 347-355. DOI:10.1006/abbi.1999.1606 |
Einhellig F A, Kuan L. 1971. Effects of scopoletin and chlorogenic acid on stomatal aperture in tobacco and sunflower[J]. Bull Torrey Bot Club, 98: 155-162. DOI:10.2307/2484031 |
Einhellig F A. 1985. Effects of allelopathic chemicals on crop productivity[J]. American Chemical Society, Washington D C, 276: 109-130. |
Einhellig F A. 1995. Mechanism of action of allelochemicals in allelopathy[J]. American Chemical Society, Washington D C, 582: 96-116. |
Einhellig F A. 1996. Interactions involving allelopathy in cropping systems[J]. Agronomy Journal, 88: 886-893. DOI:10.2134/agronj1996.00021962003600060007x |
Glass A D M, Dunlop J. 1974. Influence of phenolic acids on ion uptake Ⅳ epolarization of membrane potentials[J]. Plant Physiol, 54: 855-858. DOI:10.1104/pp.54.6.855 |
Holappa L D, Blum U. 1991. Effects of exogenously applied ferulic acid, a potential allelopathic compound, on leaf growth, water utlization, and endogenous abscissic acid levels of tomato, cucumber, and bean[J]. Journal of Chemical Ecology, 17: 865-886. DOI:10.1007/BF01395596 |
Inderjit, Dakshini K M M. 1995. On laboratory bioassays in allelopathy[J]. Bot Rev, 61: 28-44. DOI:10.1007/BF02897150 |
Lehman M E, Blum U. 1999. Evaluation of ferulic acid uptake as a measurement of allelochemical dose: effective concentration[J]. J Chem Ecol, 25(11): 2585-2600. DOI:10.1023/A:1020838611441 |
Politycka B. 1996. Peroxidase activity and lidid peroxidation in roots of cucumber seedlings influenced by derivatives of cinnamic and benzoic acids[J]. Acta Physiologiae Plantarum, 18(4): 365-370. |
Politycka B. 1997. Free and glucosylated phenolics, phenol β-glucosyltransferase activity and membrane permeability in cucumber roots affected by derivatives of cinnamic and benzoic acids[J]. Acta Physiologiae Plantarum, 19(3): 311-317. DOI:10.1007/s11738-997-0007-8 |
Rama Devi S, Prasad M N V. 1996. Ferulic acid mediated changes in oxidative enzymes of maize seedlings: implications in growth[J]. Biologia Plantarum, 38(3): 387-395. DOI:10.1007/BF02896668 |
Rice E L. 1984. Allelopathy, 2nd ed[M]. New York: Academic Press Inc.: 267-290.
|
Romagni J G, Allen S N, Dayan F E. 2000. Allelopathic effects of volatile cineoles on two weedy plant species[J]. Journal of Chemical Ecology, 26(1): 303-314. DOI:10.1023/A:1005414216848 |
Roshchina V V, Roshchina V D. 1993. The excretory function of higher plant[M]. New York: Spinger Verlag: 213-215.
|
Sang U C, Seong K C, Sunyo J, et al. 2002. Effects of alfalfa leaf extracts and phenolic allelochemicals on early seedling growth and root morphology of alfalfa and barnyard grass[J]. Crop Prot, 21(10): 1077-1082. DOI:10.1016/S0261-2194(02)00092-3 |
Satoshi N, Yutaka I, Masaaki H. 2001. Algal growth inhibition effects and inducement modes by plant-producing phenols[J]. Wat Res, 35(7): 1855-1859. DOI:10.1016/S0043-1354(00)00444-9 |
Tang C S, Young C C. 1982. Collection and identification of allelopathic compounds from the undisturbed root system of bigalta limpograss (Hemarthria altissima)[J]. Plant Physoil, 69: 155-160. DOI:10.1104/pp.69.1.155 |
Waller G R. 1987. Allelochemicals: Role in agriculture and forestry. American Chemical Society, Washington D C.
|
Yu J Q, Matsui Y. 1997. Effects of root exudates of cucumber (Cucumis sativus) and allelochemicals onion uptake by cucumber seedlings[J]. Journal of Chemical Ecology, 23(3): 817-827. DOI:10.1023/B:JOEC.0000006413.98507.55 |
 2010, Vol. 46
2010, Vol. 46


