文章信息
- 文樵夫, 沈红香, 姚允聪, 田佶, 宋婷婷
- Wen Qiaofu, Shen Hongxiang, Yao Yuncong, Tian Ji, Song Tingting
- 苹果属观赏海棠McDFR的克隆及不同叶色品种间的表达差异
- Cloning and Expression of McDFR gene in the Different Foliar Color of Malus crabapple
- 林业科学, 2010, 46(11): 16-24.
- Scientia Silvae Sinicae, 2010, 46(11): 16-24.
-
文章历史
- 收稿日期:2009-08-31
- 修回日期:2009-10-03
-
作者相关文章
大量研究表明,植物的色泽发育和植物类黄酮代谢紧密有关。花色苷是广泛存在于被子植物中的一类重要的类黄酮化合物。它是植物花朵、叶片和果实中几乎所有色泽形成的物质基础(Joseph et al., 1998; Gillian,2001)。植物中基本的花色苷有3种,即花葵素、花青素、花翠素,以及这些花色素的甲基化衍生物等(徐纪尊等,2006)。二氢黄酮醇-4-还原酶(DFR)是花色素苷合成途径中后期表达的第1个关键酶,它以二氢黄酮醇类(DHK,DHQ,DHM)为底物,在辅因子NADPH的作用下将4位的羰基还原为羟基,产生上述3种无色原花色素(Holton et al., 1995)。DFR是1个短链还原酶,属于二氢黄酮醇-4-还原酶超家族(Martens et al., 2002)。O’Reilly等(1985)采用转座子标签技术第1次从玉米(Zea mays)分离克隆出DFR基因,随后从金鱼草(Antirrhinum majus)(O’Reilly et al., 1985)和矮牵牛(Petunia hybrida)(Beld et al., 1989)中克隆到了DFR基因。随着深入研究,人们发现DFR对于花色的改变具有重要的作用。Aida等(2000)将反义DFR基因导入蝴蝶草(Torenia concolor),发现转化株的花色素苷合成减少,黄酮和黄酮醇(此二者为助色素)含量显著提高,获得了开蓝色花的蝴蝶草,表明调控花色素苷的助色素含量是花色改变的途径之一; 还分别将正义的DFR和CHS转入蓝猪耳(Torenia fournier)中,转基因株系的花冠花色素苷含量均呈不同程度的减少。
苹果属(Malus)观赏海棠是苹果属植物中最具观赏价值的类型,树形优美,花色丰富多彩,其叶色有绿色叶类、新叶有色类和常色紫叶类,是园林景观中不可缺少的彩叶树种资源。然而,在这一多色型植物资源中,叶片色泽形成的遗传机制、DFR基因结构和功能及其品种间差异至今还未见报道。本文在克隆获得苹果属观赏海棠叶片查尔酮合成酶(McCHS)、查尔酮异构酶(McCHI)和黄烷酮3-羟化酶(McF3H)基因(GenBank登陆号分别为:FJ599763,FJ817485和FJ817486),并对不同叶色品种基因表达差异分析的基础上,拟从常色紫叶品种中克隆DFR基因,并对基因及其编码蛋白序列进行分析,采用实时荧光定量PCR技术检测不同叶色品种中DFR表达量,并与花色苷含量进行对比分析,为观赏海棠不同品种间叶色差异的分子机制研究提供理论基础与试验证据。
1 材料与方法 1.1 试验材料选取苹果属观赏海棠中具有典型叶色的4个品种叶片为试材,即:绿色叶类品种‘火焰’(M.‘Flame’)、新叶有色类(幼叶红色、功能叶为绿色)品种‘绚丽’(M.‘Radiant’)和‘高原之火’(M.‘Prairifire’)、常色紫叶类品种‘王族’(M.‘Royalty’)。2008年春季,在北京农学院海棠种质资源圃采集4个品种相同自然条件下4年生树体萌芽后7天的幼叶和萌芽后50天的功能叶,液氮速冻后-80 ℃保存备用。
1.2 总RNA的提取及cDNA第1链的合成用改良热硼酸法(陆旺金等,2003)提取‘王族’幼叶总RNA。以提取的总RNA为模板,利用Clontech SMARTTM Library试剂盒(购自Clontech生物有限公司)合成3’-RACE和5’-RACE cDNA第1链。采用CTAB法提取‘王族’叶片总DNA(Williamson et al., 1994)。
1.3 观赏海棠McDFR序列的克隆以上述提取得到的‘王族’叶片cDNA为模板,根据GenBank上登录的近缘植物二氢黄酮醇-4 -还原酶基因保守区段序列,设计3’端引物DFRP1:CACATCCTCAGCAGGAACTG,扩增McDFR基因的3’端序列; 设计5 ’端引物DFRP2: GCTTGATGATGCCATAATGTG,DFRP3: CATTTCTTAAGATCGGCGAAAGTC,扩增McDFR基因的5 ’端序列。UPM通用引物由RACE试剂盒提供,根据试剂盒说明,转录产物的3’末端和5’末端分别用DFRP1和DFRP2及UPM引物扩增,其PCR反应条件为94 ℃预变性5 min; 94 ℃变性1 min,64 ℃和68 ℃退火30 s,72 ℃延伸2 min,30个循环; 72 ℃延伸5 min。将第1轮PCR产物稀释1 000倍,取1 μL作为模板,以DFRP3和UPM为引物,进行巢式PCR反应,PCR反应条件与第1轮相同。经回收、纯化,与pMD19-TVector(购自宝生物工程有限公司)连接,转化DH5α感受态细胞,蓝白斑筛选后测序(上海生工生物工程技术服务有限公司)。用DNAMAN5.2.2软件拼接以上序列得到观赏海棠叶片二氢黄酮醇-4-还原酶基因全长cDNA序列。
1.4 观赏海棠McDFR基因cDNA和DNA全长序列的获得以上述提取得到的‘王族’叶片cDNA和DNA为模板,设计全长引物DFRF: ATGGGATCCGAGTCCGAATC和DFRR: ACCTACTTTGACATCAACGAGG,扩增二氢黄酮醇-4-还原酶基因的全长序列。PCR反应条件: 94 ℃预变性5 min; 94 ℃变性1min,57 ℃退火30 s,72 ℃延伸3 min,30个循环; 72℃延伸5 min。PCR产物经回收、纯化,与pMD19-TVector(购自宝生物工程公司)连接,转化DH5α感受态细胞,蓝白斑筛选后测序(上海生工生物工程技术服务有限公司)。
1.5 实时荧光定量PCR分析分别提取‘绚丽’、‘火焰’、‘高原之火’、‘王族’4个品种的幼叶和功能叶RNA (陆旺金等,2003),使用M-MuLV First cDNA Synthesis Kit(购自Promega公司)合成第1链cDNA备用。按照RealMaster Mix (SYBR Green) PCR试剂盒(购自天根生化科技有限公司)操作指南,采用实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)的方法,检测基因的相对表达量。扩增目标基因McDFR的引物设计为DFR-F: GGTTGGATGTACTTCGTCTC和DFR-R: TGATGAGGCTTGGTGGCAT,预测产物长度是145 bp,适用于荧光定量PCR; 以苹果属的杂交种(Malus × domestica) 18S ribosomal RNA基因(GenBank序列号: DQ341382)作为内参基因,其引物18SR-F: ACACGGGGAGGTAGTGACAA和18SRR: CCTCCAATGGATCCTCGTTA,预测产物长度是80 bp,适用于荧光定量PCR。
对反转录所得的cDNA按体积分别进行5倍梯度稀释(1,1 /10,1 /100,1 /1 000,1 /10 000),实施荧光定量反应,然后绘制相对标准曲线。反应程序为:94 ℃预变性2 min; 94 ℃变性20 s,57 ℃退火30 s,72 ℃延伸30 s,40次循环,每次循环第3步进行荧光采集; 最后95 ℃变性1 min,退火至55 ℃ (每隔10 s上升0.15 ℃)后保温1 min,接着检测其荧光值,绘制熔点曲线。内参基因反应程序同McDFR的反应程序基本相同,退火温度为55 ℃。标准品cDNA和待测样品均设置3次重复。
1.6 花色苷和类黄酮含量测定花色苷和类黄酮相对含量的提取根据何亦昆等(1995)的方法略有改动。称取1.0 g叶片剪碎(2 ~3 mm),置于50 mL离心管中,加入10 mL 1%的盐酸甲醇,常温下浸泡20 h。取上清液,以提取液作空白,采用UNICO UV-2100型紫外可见分光光度计在530 nm处和325 nm处测定吸光度。以每克鲜质量叶片的提取液的光密度变化值OD530 = 0.1作为1个花色苷单位。类黄酮含量以每克鲜质量叶片的提取液的光密度变化值OD325 = 1作为1个类黄酮单位。
2 结果与分析 2.1 McDFR的克隆与序列比较依据得到的保守片断设计5 ’和3 ’末端的RACE引物。用引物对UPM /DFRP2、DFRP3进行McDFR的5’末端的扩增反应,在琼脂糖凝胶电泳中显现出700 bp左右2条目的条带(图 1A,左),将700 bp左右的条带回收、测序,获得到1条DFR的5’cDNA末端。用引物UPM /DFRP1进行McDFR的3’末端扩增,获得1条约850 bp的带(图 1B,右),克隆入T-载体,挑选6个长度有代表性的单克隆测序,获得1条DFR的3’cDNA末端。以上述片断进行Blast分析,确认其与其他植物DFR基因同源。根据3’RACE和5’RACE测序结果拼读出苹果属观赏海棠DFR基因,全长序列为1 247 bp,命名该基因为McDFR (登陆号: FJ817487)。基因组扩增得到约2 400 bp的条带,拼接后得到全长序列2 396 bp(图 1C)。分析发现,McDFR存在5个内含子,将起始密码子ATG定义为+ 1位,则5个内含子分别位于+ 119 ~ + 238 bp,+ 409 ~ + 1 167 bp,+ 1 363 ~ + 1 620 bp,+ 1 785 ~ + 1 887 bp,+ 2 081 ~+ 2 200 bp。结果与大多数物种一致,且内含子-外图 2苹果属观赏海棠McDFR全长cDNA的核苷酸序列及推测的氨基酸序列Fig.2 The full-length cDNA sequence and the deduced amino acid sequence of McDFR起始密码子和终止密码子用下划线表示,阴影处是功能结构域,黑框表示保守域。The start codon and the stop codon are underlined,the functional domains are shaded,and the conserved domains are boxed.显子边界均符合“GT-AG”规则。第1个内含子有多个直接重复序列,如+ 124,+ 128 bp处分别存在1个8 bp的直接重复序列(TCCCTCCC),+ 140,+ 142 bp处分别存在1个9 bp的直接重复序列(TTTTTTTTT)等; 只存在1个8 bp的镜像重复序列,为+ 177,+ 222 bp处的TAAGTATT; 不存在反向重复序列。第2个内含子则散布着多个重复序列,如+ 668,+ 693 bp处分别存在1个10 bp的直接重复序列(AGGAAGATTT),+ 477,+ 951 bp处分别存在1个9 bp镜像重复序列(ATTATAAAT),+ 894,+ 1 029 bp处的14 bp反向重复序列(AATTAAAAAATTGT)等。第3个内含子也同样散布着多个重复序列,如+ 1 415,+ 1 417 bp处分别存在1个11 bp的直接重复序列(ATATATATATA),+ 1 384,+ 1 480 bp处分别存在1个9 bp镜像重复序列(ATTAAAAAA),+ 1 386,+ 1 549 bp处的8 bp反向重复序列(TAAAAAAA)等。第4个内含子存在2个镜像重复序列,为+ 1 810,+ 1 844 bp处的AATAATTATT和+ 1 831,+ 1 875 bp处的TTGTTAATT,还存在2个反向重复序列,为+ 1 801,+ 1 825 bp处的AATAAAAT和+ 1 832,+ 1 857 bp处的TGTTAATTA。第5个内含子只存在1个反向重复序列,为+ 2 117,+ 2 128 bp处的AATTGATTA。
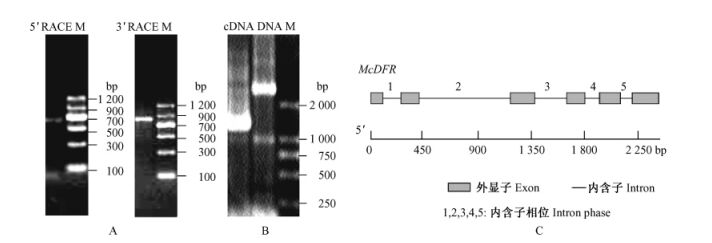
|
图 1 McDFR基因的克隆及结构分析 Figure 1 Cloning and DNA sequence structure of McDFR M.1 kb DNA ladder. A.McDFR基因的RACE末端扩增结果; B.McDFR基因的cDNA和对应基因组DNA扩增; C.McDFR基因DNA序列的结构。 A.RACE ends amplification of McDFR; B.The full-length amplification of cDNA and genomic DNA; C.The DNA sequence structure of McDFR. |
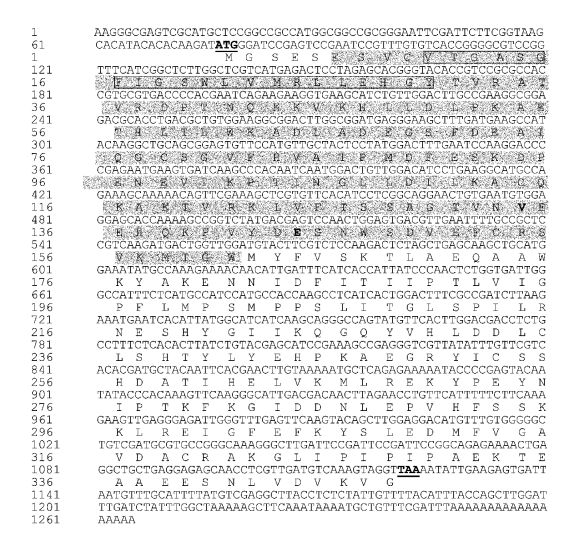
|
图 2 苹果属观赏海棠McDFR全长cDNA的核苷酸序列及推测的氨基酸序列 Figure 2 The full-length cDNA sequence and the deduced amino acid sequence of McDFR 起始密码子和终止密码子用下划线表示,阴影处是功能结构域,黑框表示保守域。 The start codon and the stop codon are underlined, the functional domains are shaded, and the conserved domains are boxed. |
对该基因的序列进行分析表明,其含有1个编码348个氨基酸的完整阅读框架,包括起始密码子和终止密码子。利用DNAMAN5.2.2软件,对McDFR编码的氨基酸序列分析,认为该基因具有起始密码子(ATG)和终止密码子(TAA),是苹果属观赏海棠DFR基因的ORF序列(图 2)。
根据InterProScan和SMART在线软件对编码氨基酸分子质量、编码蛋白的结构域和功能位点进行分析表明,McDFR main ORF编码348个氨基酸(pI5.93)的分子质量约为41.973 ku,其编码的蛋白具有典型的DFR蛋白功能结构域:短链的脱氢酶和还原酶(SDR)家族(从E6到W161),大多数已知是NAD-或者NADP-依赖的还原酶。其中大多数脱氢酶具有至少2个结构域,第1个结构域通常结合NAD-的辅酶,第2个结构域决定底物的特异性并且决定氨基酸是否具有催化作用。还包括NmrA区域,这是1个反式作用调控区域,参与转录因子AreA转录后的修饰。该结构域还包括差向酶和霍霍巴酰基辅酶A还原酶等。
用SOPMA对蛋白的二级结构预测表明,McDFR蛋白与草莓(Fragaria × ananassa)和葡萄(Vitis vinifera) (SOPMA预测)之间的二级结构十分相似。它们主要由α-螺旋(α-helix)、随机卷曲(random coil)、β-转角(β-turn)和延伸链(extendedstrand)组成。在二级结构中,α-螺旋均匀分布在整个蛋白中。McDFR蛋白由42.82%的α-螺旋、14.08%的延伸链、7.47%的β-转角和35.63%的随机卷曲组成(图 3A)。
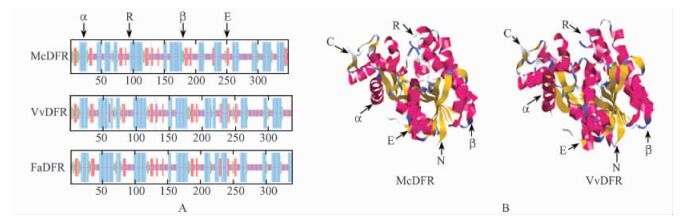
|
图 3 McDFR蛋白结构 Figure 3 The protein structure of McDFR R.随机卷曲Random coil; C.C端C-terminal; α.α-螺旋α-helix; E.延伸链Extended strand; N.N端N-terminal; β.β-折叠β-turn.A.McDFR与VvDFR(Y11749)和FaDFR(AF029685)二级结构预测,α-螺旋、延伸链、β-折叠和随机卷曲分别用蓝色、红色、绿色和紫色表示; B.预测的McDFR蛋白三级结构和VvDFR蛋白结构,α-螺旋、β-折叠、随机卷曲、延伸链分别用红色、蓝色、白色和黄色表示。 A.Secondary structures of McDFR, FaDFR (AF029685) and VvDFR (Y11749) predicted by SOPMA.The two-dimensional models of McDFR, FaDFR(AF029685) and VvDFR(Y11749).α-helix is indicated in blue, β-turn in green, random coil in purple and extended strand in red; B.The three-dimensionalmodels of VvDFR(2c29F) and the deduced McDFR.α-helix is indicated in red, β-turn in blue, random coil in white and extended strand in yellow. |
以VvDFR (2c29F)为模型,用Swiss-Model对McDFR蛋白进行三级结构的同源建模,所得到结果都与已知结构和功能的葡萄DFR蛋白的三级结构很类似(图 3B),水桶状,上端表面有一个缺口,与底物特异结合催化的部位正好位于水桶底部裂口所对位置,而与NADPH结合的部位位于水桶外表面。由于VvDFR的结构和功能是已知的,故而推断McDFR与其有类似的功能。
2.2 苹果属观赏海棠McDFR的同源性及进化分析利用DNAMAN5.2.2软件进行多重序列比对(图 4)发现,McDFR含有与其他同源基因相似的中央编码区,显示了二氢黄酮醇-4-还原酶进化的保守性。同时还发现不同物种的DFR氨基酸序列在很多区域有较高的相似性。在不同的物种中“VTGAAGFIGSWLIMRLLERGY”是高度保守区,是DFR与NADP结合位点(Johnson et al., 1999),McDFR具有该结合位点(从V10到Y30)。

|
图 4 苹果属观赏海棠McDFR基因中央编码区推导的氨基酸序列的多重比对分析 Figure 4 Alignment of the predicted amino acid sequences of McDFR main ORF in Malus crabapples and other plants 1.观赏海棠Malus crabapple; 2.西洋梨Pyrus communis; 3.月季Rosa hybrida; 4.大豆Glycine max; 5.蒺藜苜蓿Medicago truncatula; 6.甜橙Citrus sinensis; 7.毛果杨Populus trichocarpa; 8.菠菜Spinacia oleracea; 9.金荞麦Fagopyrum cymosum; 10.杜鹃Rhododendron simsii; 11.烟草Nicotiana tabacum; 12.蓝灰石竹Dianthus gratianopolitanus; 13.缕丝花Gypsophila elegans; 14.斑点矢车菊Centaurea maculosa; 15.桃Prunus persica. |
为了进一步了解DFR的进化关系,选择部分植物的DFR蛋白利用MEGA 4.0软件,对McDFR与已知植物DFR结构域蛋白进行进化树分析,可以看出McDFR编码的氨基酸序列与其他物种来源的DFR具有较高相似性。其与西洋梨(Pyrus communis) (AY227731)和月季(Rosa hybrida)(AB490072)的相似性最高,分别为98.57%,82.81%。基于氨基酸序列的系统进化树可以看出其氨基酸的进化与植物的进化基本一致,同科植物在进化树上处于同一分支(图 5)。
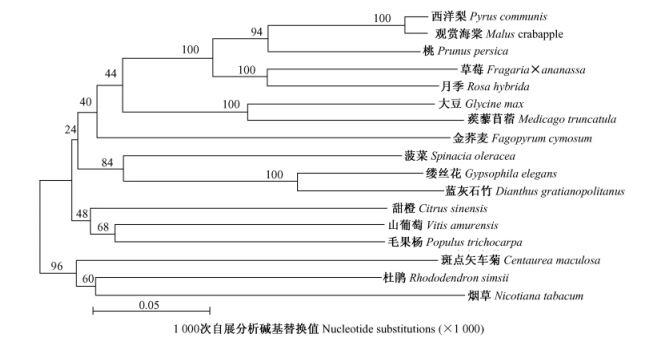
|
图 5 苹果属观赏海棠McDFR与其他物种DFRs的分子进化树聚类分析 Figure 5 A phylogenetic tree of McDFR and other species DFRs |
由iCycleriQTM自动测出的苹果属内参基因18S rRNA的回归方程、PCR扩增效率和相关系数分别为: Y =-3.409X + 35.857,96.5%和0.997*; 测出的苹果属McDFR的回归方程、PCR扩增效率和相关系数分别为: Y =-3.322 2 X + 29.61,100.0%和0.997 6*。说明该试验具有良好的重复性和较高扩增效率。熔点曲线分析出的18S rRNA和McDFR均只有1个Tm值,分别为88 ℃和85 ℃,表明18S rRNA和McDFR所用引物具有高度特异性,其PCR扩增产物均为目的片段,不含引物二聚体。
McDFR在4个苹果属观赏海棠品种叶片中的表达模式如图 6。以表达量最高的‘高原之火’幼叶的表达量为“1”,按照相对定量公式2-△△Ct作图。由图 6可以看出,McDFR在4个观赏海棠品种的幼叶和功能叶中均有表达。就叶龄而言,供试品种除绿色叶品种‘火焰’外,幼叶中的花色苷含量均高于功能叶,并且幼叶中McDFR表达量也大于功能叶。就不同叶色品种而言,新叶有色类品种‘高原之火’在幼叶中花色苷含量最高,McDFR的表达量也最大; 在功能叶中McDFR的表达量最高,花色苷含量仅次于‘王族’。新叶有色类品种‘绚丽’花色苷含量与McDFR的表达量在各个时期都居中。常色紫叶品种‘王族’在幼叶期花色苷含量与McDFR的表达量无明显的对应关系; 而在功能叶中花色苷含量最高,McDFR的表达量仅次于‘绚丽’。绿色叶类品种‘火焰’幼叶和功能叶中的McDFR表达量最低,花色苷积累量最低,在功能叶中几乎没有表达。对不同品种中类黄酮含量进行分析可以看出,幼叶中的类黄酮含量高于功能叶,并且幼叶中McDFR表达量也大于功能叶。在幼叶中,类黄酮含量与McDFR的表达量无明显相关性; 在功能叶中,除绿色叶品种‘火焰’外,类黄酮含量越高,McDFR的表达量越大。
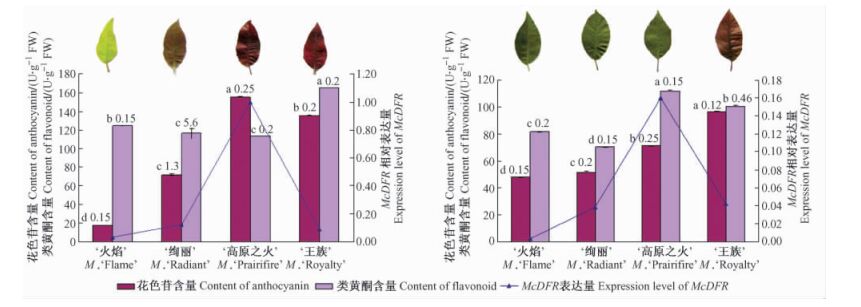
|
图 6 苹果属观赏海棠叶片中McDFR基因相对表达量与花色苷、类黄酮含量的关系 Figure 6 The relationship between relative expression levels of McDFR and the content of anthocyanin and flavonoid in the leaves of different Malus crabapple cultivars A.不同品种幼叶中McDFR基因相对表达量与花色苷、类黄酮含量的关系; B.不同品种功能叶中McDFR基因相对表达量与花色苷、类黄酮含量的关系。差异显著水平分析数据采用Duncan新复极差法进行方差分析,不同小写字母表示在0.05水平上差异显著。 A.The relationship between relative expression levels of McDFR and the content of anthocyanin and flavonoid in the young leaves of different cultivars; B.The relationship between relative expression levels of McDFR and the content of anthocyanin and flavonoid in the mature leaves of different cultivars.The significance was by value of Duncan's new multiple range method.Letters in lower case indicate significant difference level(P < 0.05). |
对花色苷和类黄酮含量的多重比较分析还表明:花色苷含量在不同时期由于品种的不同表现出显著差异。类黄酮含量在功能叶时期随着品种的不同表现出显著差异; 而在幼叶时期常色紫叶品种‘王族’与绿色叶品种‘火焰’和新叶有色类品种存在显著差异,绿色叶品种‘火焰’与新叶有色类存在显著差异,而新叶有色类的2个品种间不存在显著差异。
3 结论与讨论DFR是花色素苷合成途径中后期表达的第1个关键酶,对于植物器官色泽形成具有十分重要的意义(刘娟等,2005)。O’Reilly等(1985)采用转座子标签技术首次从玉米分离、克隆出DFR基因,其后研究人员相继从金鱼草、矮牵牛、拟南芥(Arabidopsis thaliana)、大麦(Hordeum vulgare)、非洲菊(Gerbera jamesonii)、香石竹(Dianthus caryophyllus)、野百合(Lilium brownii)等多种植物中克隆到了DFR基因(刘娟等,2005)。对DFR基因结构分析表明,大多数植物DFR都由6个外显子和5个内含子组成,如裂叶牵牛(Ipomoea hederacea)、圆叶牵牛(I.purpurea)、金鱼草、矮牵牛、拟南芥(Inagaki et al., 1999; Winkel-Shirley et al., 1992)等的DFR,并且它们内含子剪切位点相同。但在玉米、大麦和高粱(Sorghum bicolor) (Schwartz-Sommer et al., 1987; Kristiansen et al., 1991; Chen et al., 1998)中,DFR基因结构则由4个外显子和3个内含子组成,玉米和大麦的内含子剪切位点相同,与金鱼草和矮牵牛的DFR基因的前3个内含子相对应。本研究从‘王族’中克隆得到了McDFR的cDNA和DNA全长序列,含有6个外显子和5个内含子。McDFR具有植物DFR典型的结构特点,其编码的蛋白具有典型DFR蛋白的功能结构域:短链的脱氢酶和还原酶(SDR)家族(从E6到W161),大多数已知是NAD-或者NADP-依赖的还原酶,大多数脱氢酶具有至少2个结构域,第1个结构域通常结合NAD-的辅酶,第2个结构域决定底物的特异性并且决定氨基酸是否具有催化作用。通过多重序列比对,发现McDFR具有与NADP的结合位点(从V10到Y30)。Johnson等(2001)发现,结合区中的134位与145位的氨基酸可直接影响酶的底物特异性,大多数物种在134位含有D(天冬氨酸)或N (天冬酞胺),而McDFR在此位点则是V(缬氨酸),因而其DFR酶作用底物仅限于DHQ。仅与DHQ结合将会生成花青素-3-葡萄糖苷,表现为红色,这与观赏海棠的叶片紫红色相对应。对McDFR进行二级结构预测发现,α-螺旋均匀分布在蛋白内部,与草莓和葡萄的二级结构类似。对McDFR基因编码蛋白的三级结构进行建模后发现,McDFR与已知结构和功能的葡萄VvDFR(2c29F)蛋白的高级结构非常相似,故而推断McDFR蛋白功能与VvDFR功能类似。与已知其他植物DFR蛋白相比,McDFR编码的氨基酸序列与其他物种来源的DFR具有较高相似性。其与西洋梨和月季的相似性最高,分别为98.57%和82.81%。所以推断McDFR具有典型的DFR的生物学功能。这为进一步研究McDFR的遗传转化和揭示观赏海棠器官色泽形成的分子机制提供了基础。
结合实时定量PCR和花色苷含量测定的数据对不同时期不同叶色品种进行分析发现,McDFR均有表达,而且与叶色密切相关。叶色越红的品种,其花色苷含量越高,而McDFR表达量也相应比较高。供试品种中除绿色叶品种‘火焰’外,幼叶中的花色苷含量均高于功能叶,并且幼叶中McDFR表达量也大于功能叶。随着新叶有色类品种在功能叶时期变为绿色,常色紫叶品种‘王族’叶片红色变浅,花色苷含量与McDFR表达量在功能叶中也明显降低; 绿色叶品种‘火焰’幼叶和功能叶中的McDFR表达量最低,花色苷积累量也最低,在功能叶中几乎没有表达; 这些结果都说明叶片的红着色与McDFR的表达量存在一定的相关性。而就不同叶色品种而言,新叶有色类品种‘高原之火’在幼叶中花色苷含量最高,McDFR的表达量也最大; 在功能叶中McDFR的表达量最高,而花色苷含量次于‘王族’。McDFR的表达量又不是完全与花色苷的含量相对应。对DFR基因表达的大量研究表明,不同物种的DFR基因在不同发育期与不同部位的时空表达特性也有所不同,调控方式十分复杂。金鱼草和拟南芥的DFR基因的表达受多个转录调控因子的调控(Holton et al., 1995; Nesi et al., 2001)。作者曾应用同样的方法研究过观赏海棠McCHS基因在叶片发育过程中的变化及与花色苷积累的关系,发现McCHS的表达量与花色苷的积累在叶片发育早期密切相关,而功能叶期的这一变化特点不明显,由此看来,在观赏海棠叶片类黄酮代谢过程中叶片McCHS和McDFR各自的表达阶段不同,也可能存在着某种程度的协同表达作用(宋婷婷等,2010)。
在各个品种中,对不同品种中类黄酮含量进行分析可以看出,幼叶中的类黄酮含量高于功能叶,并且幼叶中McDFR表达量也大于功能叶。这个结果与花色苷的含量与McDFR表达量关系相一致。花色苷的含量与类黄酮的含量却没有明显的相关性。在幼叶中,类黄酮含量与McDFR的表达量无明显相关性; 在功能叶中,除绿色叶品种‘火焰’外,类黄酮含量越高,McDFR的表达量越大。由此推测类黄酮含量与McDFR的表达量有一定的相关性。通过对类黄酮含量进行多重比较统计分析,不同叶色品种的类黄酮含量在不同时期的差异性不同,因此类黄酮的含量受不同时期和不同品种的影响,与McDFR的表达量不是表现为简单的对应关系。作者用相同的方法研究McANS发现其与类黄酮也无明显的相关性。类黄酮的生物合成途径很复杂,受到发育和多种外界环境因素的调控,有待于进一步的研究。
作者期望找到苹果属观赏海棠不同叶色类型的品种和不同发育时期的叶片中McDFR及花色苷生物合成途径中的相关酶基因的表达与花色苷和类黄酮积累的对应关系,用于解释花色苷积累对叶色形成的作用,进而了解花色苷积累的调控机制。在本试验中,新叶有色类品种‘高原之火’在各个时期中的McDFR表达量都是最高的,而在功能叶中花色苷含量却不是最高的。这可能是由于花色苷的生物合成受多种诱导因子影响,例如光诱导,各种花色苷的相对含量受光敏素的调控(Mol et al., 1996); 低温也可以诱导一些植物体内花色苷的合成,如拟南芥(Graham,1998)、玉米(Christie et al., 1994)、高粱幼苗(Shichijo et al., 1993)等。诱导因子除上述因子外,其他一些内在的和外界环境因子也与植物花色素苷的诱导、积累和抑制有关(Mol et al., 1996)。从二氢黄酮醇转变成花色素苷的反应非常复杂,需要几个不同酶的作用。其中一些已被证实。由于这个过程的复杂性和中间产物的不稳定,精确的反应过程还没有完全搞清楚,有待于进一步研究。葡萄DFR基因启动子与GUS融合后,在葡萄幼苗中的表达分析表明,VvDFR基因在幼苗的根、茎和叶中都有表达,受光、盐和糖的诱导,其启动子区具有多个调控元件(Gollop et al., 2002),所以花色苷含量与McDFR的表达量不仅仅表现出简单的对应关系。今后的工作中,对于叶色相关的DFR基因来讲,其转基因研究不仅能了解其功能,而且有助于用各种方法(启动子的克隆及功能验证、反义RNA、共抑制或RNAi等)实现叶色的修饰,继续深入研究具有重要意义。
何亦昆, 代庆阳, 苏学辉. 1995. 雁来红叶色转变与超微结构及色素含量的关系[J]. 四川师范学院学报:自然科学版, 16(3): 195-197. |
刘娟, 冯群芳, 张杰. 2005. 二氢黄酮醇4-还原酶基因(DFR)与花色的修饰[J]. 植物生理学通讯, 41(6): 715-716. |
陆旺金, 蒋跃明. 2003. 荔枝果实两个膨大素基因的克隆与序列分析[J]. 中国农业科学, 36(12): 1525-1529. DOI:10.3321/j.issn:0578-1752.2003.12.017 |
宋婷婷, 沈红香, 姚允聪, 等. 2010. 苹果属观赏海棠McCHS基因的克隆及实时定量表达研究[J]. 园艺学报, 37(2): 269-276. |
徐纪尊, 王丽辉, 潘庆玉. 2006. 观赏植物花色基因转化的研究进展[J]. 中国农业科技导报, 8(5): 56-60. |
Aida R, Kishimoto S, Tanaka Y, et al. 2000. Modification of flower color in torenia (Torenia fournieri Lind.) by genetic transformation[J]. Plant Sci, 153(14): 33-42. |
Beld M, Martin C, Huits H, et al. 1989. Flavonoid synthesis in Petunia hybrida: Partial characterization of dihydroflavonol 4-reductase genes[J]. Plant Mot Biol, 13(5): 491-502. DOI:10.1007/BF00027309 |
Chen M, SanMiguel P, Bennetzen J L. 1998. Sequence organization and conservation in sh2 / a1 homologous regions of sorghum and rice[J]. Genetics, 148(1): 435-443. |
Christie P J, Alfenito M R, Walbot V. 1994. Impact of low-temperature stress on general phenylpropanoid and anthocyanin pathways: enhancement of transcript abundance and anthocyanin pigmentatio in maize seedlings[J]. Planta, 194(2): 541-549. |
Gillian A. 2001. Contributions of jeffrey harbome and co-workers to the study of anthocyanins[J]. Phytochemistry, 56(3): 229-236. DOI:10.1016/S0031-9422(00)00455-6 |
Gollop R, Even S, Colova-Tsolova V, et al. 2002. Expression of the grape dihydroflavonol reductase gene and analysis of its promoter region[J]. J Exp Bot, 53(373): 1397-1409. |
Graham T L. 1998. Flavonoid and flavonol glycoside metabolism in Arabidopsis[J]. Plant Biochem, 36(2): 135-144. |
Holton T A, Cornish E C. 1995. Genetics and biochemistry of anthocyanin biosynthesis[J]. Plant Cell, 7(7): 1071-1083. DOI:10.1105/tpc.7.7.1071 |
Inagaki Y, Johzuka-Hisatomi Y, Mori T, et al. 1999. Genomic organization of the genes encoding dihydroflavonol 4-reductase for flower pigmentation in the Japanese and common morning glories[J]. Gene, 226(2): 181-188. DOI:10.1016/S0378-1119(98)00571-X |
Johnson E T, Ryu S, Yi H, et al. 2001. Alteration in a single amino acid changes the substrate specificity of dihydroflavonol 4-reductase[J]. Plant J, 25(3): 325-333. DOI:10.1046/j.1365-313x.2001.00962.x |
Johnson E T, Yi H, Shin B, et al. 1999. Cymbidium hybrida dihydroflavonol 4-reductase does not efficiently reduce dihydrokae mpferol to produce pelargonidin-type anthocyanins[J]. Plant J, 19(3): 81-85. |
Joseph M, Erich G, Ronald K. 1998. How genes paint flowers and seeds[J]. Trends Plant Science, 3(6): 212-218. DOI:10.1016/S1360-1385(98)01242-4 |
Kristiansen K N, Rohde W. 1991. Structure of the Hordeum vulgare gene encoding dihydroflavonol 4-reductase and molecular analysis of ant18 mutants blocked in flavonoid synthesis[J]. Mol Gene, 230(2): 49-59. |
Martens S, Teeri T, Forkmann G. 2002. Heterologous expression of dihydroflavonol 4-reductases from various plants[J]. FEBS Lett, 531(3): 453-458. DOI:10.1016/S0014-5793(02)03583-4 |
Mol J, Jenkins G J, Schafer E, et al. 1996. Signal perception, transduction, and gene expression involved in anthocyanin biosynthesis[J]. Crit Rev Plant Sci, 15(5): 525-557. DOI:10.1080/713608141 |
Nesi N, Jond C, Debeaujon I, et al. 2001. The Arabidopsis TT2 gene encodes an R2R3 MYB domain protein that acts as a key determinant for proanthocyanidin accumulation in developing seed[J]. Plant Cell, 13(3): 2099-2114. |
O'Reilly C, Shepherd N S, Pereira A. 1985. Molecular cloning of the allocus in Zea mays using the transposable elements En and Mul[J]. EMBO J, 4(3): 877-882. |
Schwartz-Sommer Z, Shepherd N, Tacke E, et al. 1987. Influence of transposable elements on the structure and function of the A1 genes of Zea mays[J]. EMBO J, 6(2): 287-294. |
Shichijo C, Hamada T, Hiraoka M, et al. 1993. Enhancement of redlight-induced anthocyanin synthesis in sorghum first internodes by moderate low temperature given in the irradiation culture period[J]. Planta, 191(2): 238-245. |
Williamson V M, Ho J Y, Wu F F, et al. 1994. A PCR based marker tightly linked to the nematode resistance gene, Mi, in tomato[J]. Theoretical and App lied Genetics, 87(7): 757-763. |
Winkel-Shirley B, Hanley S, Goodman H M. 1992. Effects of ioning radition on a plant: genome analysis of two Arabidopsis transparent testa mutations[J]. Plant Cell, 4(3): 333-347. DOI:10.1105/tpc.4.3.333 |
 2010, Vol. 46
2010, Vol. 46

