文章信息
- 洪亚平, 张亚冰
- Hong Yaping, Zhang Yabing
- 一种新的非酶法分离毛白杨珠心的方法
- A New Method to Isolate Non-Enzymatically the Nucellus of Populus tomentosa
- 林业科学, 2010, 46(10): 183-185.
- Scientia Silvae Sinicae, 2010, 46(10): 183-185.
-
文章历史
- 收稿日期:2009-03-31
- 修回日期:2010-01-06
-
作者相关文章
被子植物的胚珠微小,手工分离胚珠内的珠心比较困难(胡适宜,1994)。目前,人们多是借助于纤维素酶和果胶酶等的酶解技术,完成珠心、胚囊、卵细胞和合子等微小结构的人工分离(周嫦等,1982; Huang et al., 1990; Kovács et al., 1994; Tian et al., 1997; 杨弘远等,1998; 2001; Uchiumi et al., 2006)。由于胚囊和合子经酶处理后,可能对其存活、发育及人工培养等产生不良的影响,有学者提出应在卵细胞等的分离过程中减少酶的影响(杨弘远等,1998; 何玉池等,2004)。因此,研究操作简单的非酶法分离珠心等微小结构的新方法仍具有比较重要的意义。笔者曾提出一种利用口香糖胶块和普通解剖镜观察花的形态与结构的方法(洪亚平等,2008),在此基础上,本研究总结出利用胶块的黏性辅助操作,将毛白杨(Populus tomentosa)胚珠的珠心和珠被进行非酶法手工分离的方法。
1 材料与方法 1.1 试验材料试验所用的毛白杨雌花于2009年2月下旬至3月上旬的开花季节,分多次在河南省洛阳市市内栽植的毛白杨(雌株)大树上采集,并将部分枝条在室内进行水培,以观察珠柄上绒毛的生长情况。
1.2 试验方法1) 胶块的制备 取一至数块口香糖放入温水中揉搓、浸洗多次,以充分洗去口香糖中的糖分等物质,将洗好的胶块揉成团,粘放在解剖镜的视野中央,备用。试验中,如果胶块黏性过大影响操作,可将手指蘸水后重新揉挤胶块,使胶块内渗入一些水分以降低其黏性。
2) 胚珠的分离 取1个毛白杨的雌花序,用镊子从其中下部将其一分为二,从折断的花序轴上摘下小花,放在胶块上,利用胶块的黏性将其粘住。在解剖镜下,用解剖针和尖头镊子将雌花的苞片、花盘分别除去,将剩下的雌蕊粘在胶块上。毛白杨的雌蕊由2个心皮构成,在其子房的左、右侧壁上各有1条纵向的凹沟,此即背缝线。在分离毛白杨胚珠时,用解剖针(或镊子的一个尖头)沿着子房侧壁上的1条背缝线将子房纵向剖开,把剖开的子房壁掀开,并将其外壁粘在胶块上,以便暴露出子房室内胚珠的着生情况。若分别沿着子房左、右侧壁上的2条背缝线将子房纵向剖开,并将剖开的2片子房壁由上至下掀开(或进一步将其外壁粘在胶块上),可暴露出胚珠与心皮之间的位置和着生的关系。
3) 珠心的分离 将毛白杨的珠柄与胚珠从胎座上分离下来,侧放在胶块上,并使珠柄粘在胶块上。然后,在胚珠与珠柄的交界处,用解剖针向上将胚珠的珠被轻轻地纵向划开,再在其附近按照同样的方法选择一至数处由下至上将胚珠的珠被轻轻划开,用解剖针将2个割缝之间的珠被由下至上轻轻挑开、掀起,将掀起的珠被外壁粘在胶块上,就可以逐步暴露出胚珠内的珠心。最后,在珠心下部用解剖针将珠心与珠被的连接处(即合点处)割断,就可以将珠心从珠被上完全分离下来。
4) 染色与透明 为便于观察胚珠和珠心等的内部结构,可对分离出的胚珠和珠心进行染色。染色后,将其转移到凹玻片上,经过透明后进行制片观察。染色液采用稀释的代氏苏木精(Delarfield’s haematoxylin),透明液为1/2纯乙醇+ 1/2二甲苯或1/2纯乙醇+ 1/2香柏油,利用香柏油封片。对胚珠和珠心的染色与透明,也可采用杨弘远(1986; 1988)提出的整体染色与透明技术。
2 结果与分析 2.1 毛白杨胚珠的分离将毛白杨的雌花(图版Ⅰ-1)从雌花序上摘下,粘放在胶块上,在解剖镜下将其苞片和斜杯状的花盘除去,沿着1条背缝线将子房壁纵向剖开,然后掀开并将其外壁粘在胶块上,可见子房室内一般有2个胚珠着生,胚珠下的珠柄长而粗壮(图版Ⅰ-2)。若沿着2条背缝线将子房剖开,并将2片子房壁掀开(或粘在胶块上),便观察到每个胚珠下的珠柄分别着生于2个心皮的基部,每个珠柄的一侧游离,一侧与心皮贴生(图版Ⅰ-3)。偶而在子房室内会出现3个胚珠,3个胚珠等大,与正常的胚珠无形态上的差异(图版Ⅰ-4); 或其中1个胚珠体积很小,而珠柄细长,可能是退化的不育胚珠(图版Ⅰ-5)。
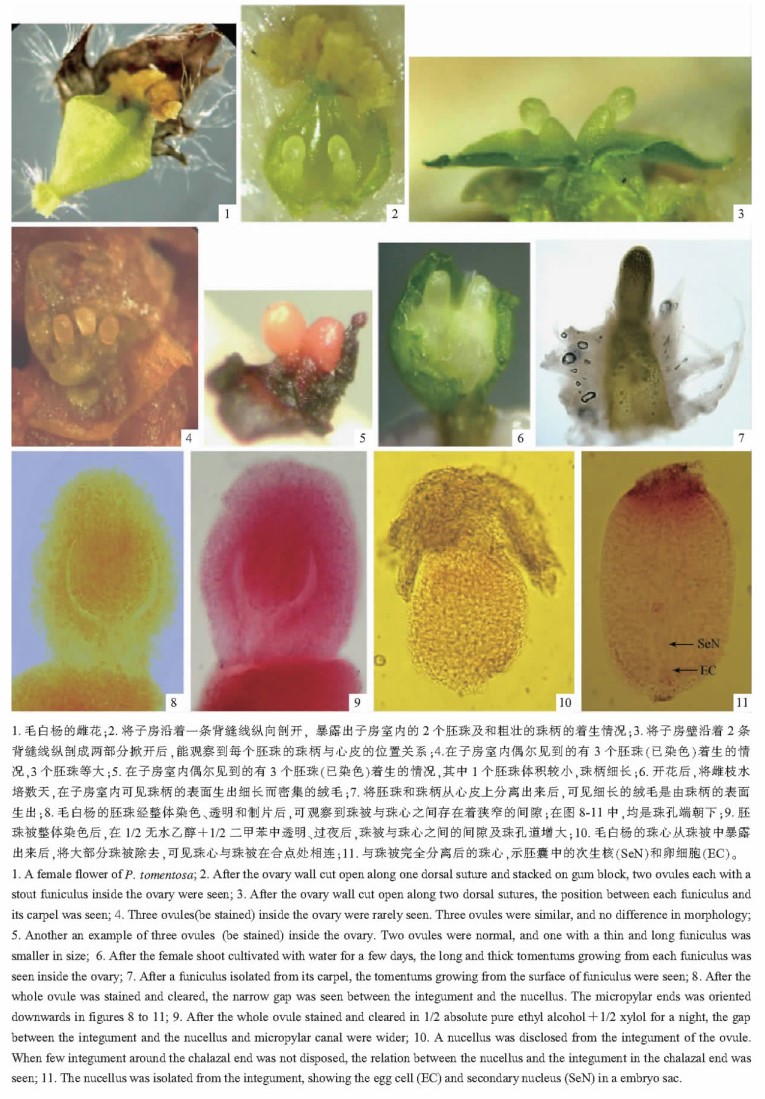
|
图版Ⅰ Plate Ⅰ |
对室内水培数天的毛白杨雌枝上的雌花进行解剖,可见珠柄在开花后的发育过程中,其表面逐渐生长出很多细长而密集的绒毛,它们是果实成熟后的种毛(图版Ⅰ-6,7)。而在胚珠表面即珠被(或幼嫩的种皮)上,未见到表皮毛生出。
对毛白杨胚珠染色、透明和制片后,在显微镜下可见毛白杨的胚珠为倒生胚珠、单层珠被、厚珠心,珠被与珠心之间有狭窄的间隙(图版Ⅰ-8)。将染色后的胚珠浸泡于1/2无水乙醇+ 1/2二甲苯混合液中透明并过夜后,珠心收缩强烈,与珠被之间的间隙以及珠孔道均显著增大(图版Ⅰ-9),倒生胚珠的特征十分明显。这为珠心的手工分离提供依据。
2.2 毛白杨珠心的分离将珠柄用胶块粘着、固定后,再用解剖针在珠被表面选择一至数处由下至上(即由珠孔附近向合点处)将珠被纵向划破、掀开,使珠心逐步暴露出来,可观察到珠心的下半部与珠被在合点处愈合在一起,珠心的顶端有1个小凸尖(图版Ⅰ-10)。用解剖针将珠心与珠被的连接处割断,就可将珠心完全分离出来,将其染色后转移到凹玻片上,经过透明后制片观察,在显微镜下可进一步观察珠心内胚囊的结构特征(图版Ⅰ-11)。
3 讨论目前,植物胚胎学微观结构主要通过石蜡切片法获得。石蜡切片的制片过程繁琐,制片效果偶然性大,难以控制(杨弘远,1986)。这使得植物胚胎学研究不仅难度大,而且工作繁重,耗费研究人员的大量时间和精力,影响着植物胚胎学研究的广泛开展(董源,1984; 张志毅等,2000; Li et al., 2006)。如果在做胚胎学研究之前,先对胚珠、珠心和胚等结构进行人工分离与观察,便能建立起有关胚珠和珠心等结构的立体观念。这样在观察切片时,就可以很容易地判读出各个切片所反映出的结构信息。若将人工分离出来的胚珠、珠心等微小结构在解剖镜下进行微型包埋、切片和制片,就可以极大地改善植物胚胎学的制片效果和工作效率。如果采用杨弘远(1986; 1988)提出的整体染色与透明技术,对分离出的胚珠和珠心等结构进行整体染色与透明,还可以进一步简化植物胚胎学的研究过程。
由于技术条件所限,采用非酶解技术使分离出的珠心维持原有形态几乎是不可能的。传统的非酶法手工分离操作是在双筒解剖镜下,左手用镊子夹住胚珠,右手拿解剖针将胚珠轻轻划破来分离胚珠内的微小结构(胡适宜,1994),此方法用力不易控制,需要极其熟练的操作技术才能完成,而且所分离出来的珠心等微小结构极难保持原有形态。利用胶块辅助分离,可替代手的部分操作,能缓冲用力、灵巧施力,减轻手和脑的操作压力,因此能比较容易地分离出损伤小、保持原有形态的胚珠和珠心。此工作无需使用倒置显微镜等特殊仪器,即使是试验设施较差的实验室内也能完成,而且能够对珠心内胚囊的结构进行观察。
董源. 1984. 毛白杨胚胎学观察Ⅱ:胚珠、胚囊的构造、受精作用和胚的发育[J]. 北京林学院学报, 6(1): 83-94. |
何玉池, 孙蒙祥, 杨弘远. 2004. 烟草合子离体培养再生可育植株[J]. 科学通报, 49(5): 457-461. |
洪亚平, 朱喜荣, 胡亚琼. 2008. 在解剖镜下利用胶块观察植物花形态的方法[J]. 安徽农业科学, 36(22): 9482-9483, 9539. DOI:10.3969/j.issn.0517-6611.2008.22.017 |
胡适宜. 1994. 植物胚胎学实验方法(六):胚和胚乳的解剖和整体制片法[J]. 植物学通报, 11(3): 55-57. |
杨弘远. 1986. 用整体染色与透明技术观察胚囊、胚、胚乳和胚状体[J]. 植物学报, 28(6): 572-581. |
杨弘远. 1988. 植物胚胎学中的整体透明技术[J]. 植物学报, 30(2): 114-116. |
杨弘远, 周嫦. 1998. 被子植物离体受精与合子培养研究进展[J]. 植物学报, 40(2): 95-101. |
杨弘远, 周嫦. 2001. 植物有性生殖实验研究四十年[M]. 武汉: 武汉大学出版社: 195-336.
|
张志毅, 于雪松. 2000. 杨树生殖生物学研究进展[J]. 北京林业大学学报, 22(6): 69-74. |
周嫦, 杨弘远. 1982. 被子植物胚囊酶法分离的研究:固定材料的分离技术与显微观察[J]. 植物学报, 24(5): 403-407. |
Huang B Q, Russell S D, Strout G W, et al. 1990. Organization of isolated embryo sacs and eggs of Plumbago zeylanica (Plumbaginaceae) before and after fertilization[J]. Amer J Bot, 77(11): 1401-1410. DOI:10.2307/2444750 |
Kovács M, Barnabas B, Kránz E. 1994. The isolation of viable egg cells of wheat(Triticum aestivum L.)[J]. Sex Plant Reprod, 7(5): 311-312. |
Li W D, Ma F S. 2006. Reproductive biology of sexual hybridization in woody plants: an atlas[M]. Beijing: Science Press: 65-78.
|
Tian H Q, Russell S D. 1997. Micromanipulation of male and female gametes of Nicotiana tabacum: I[J]. Isolation of gametes. Plant Cell Reports, 16(8): 555-560. |
Uchiumi T, Komatsu S, Koshiba T, et al. 2006. Isolation of gametes and central cells from Oryza sativa L[J]. Sex Plant Reprod, 19(1): 37-45. DOI:10.1007/s00497-006-0020-x |
 2010, Vol. 46
2010, Vol. 46
