文章信息
- 陈介南, 王琼, 卢孟柱, 章怀云, 刘伯斌
- Chen Jienan, Wang Qiong, Lu Mengzhu, Zhang Huaiyun, Liu Bobin
- 量子点在植物分子荧光标记中的应用
- Application of Quantum Dots in Plant Molecule Fluorescent Labeling
- 林业科学, 2010, 46(10): 153-161.
- Scientia Silvae Sinicae, 2010, 46(10): 153-161.
-
文章历史
- 收稿日期:2009-08-14
- 修回日期:2010-02-25
-
作者相关文章
2. 中国林业科学研究院林业研究所 北京 100091
2. Research Institute of Forestry, Chinese Academy of Forestry Beijing 100091
量子点(quantum dot)又可称为半导体纳米微晶体,是由Ⅱ-Ⅵ族或Ⅲ-Ⅴ族元素组成的纳米颗粒。从20世纪70年代末起,量子点就引起了物理学家、材料学家、化学家和电子工程学家的广泛关注。近20年来,对量子点的研究,逐渐从电子材料科学领域渗透到生物医学应用领域(刘爱平,2007)。1998年,Alivisatos和Nie等分别攻克了量子点作为生物探针的生物相容性难关,使量子点作为荧光探针标记生物大分子的分析成为可能(Bruchez et al., 1998; Chan et al., 1998),这在国内外学者当中引起了强烈的反响。Michalet等(2005)在《Science》上叙述了目前量子点的合成、溶解和功能实现的机制以及量子点在细胞生物学和动物学中的应用,标志着量子点在生物分析中的研究已取得了重要的进展。目前不断有关于量子点用于动物学分析的研究和综述文章,但量子点用于植物分子标记的报道却不多。本文在前人的基础上,评述了量子点的主要特性、制备方法、修饰方法等,综述了近年来量子点在植物分子标记中的应用,特别是展望了其在植物细胞和分子生物学领域的应用趋势和前景。
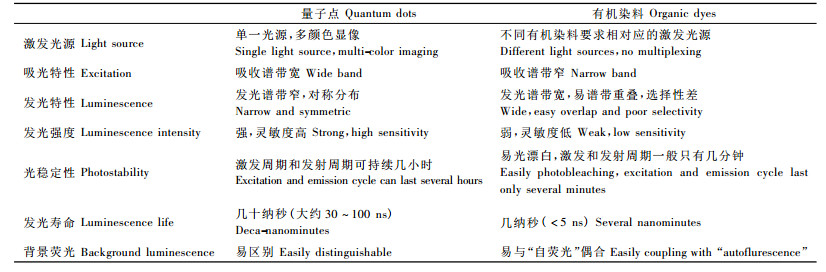
1 量子点的概述 1.1 量子点的特性目前对量子点的研究较多的主要有Ⅱ-Ⅵ族(如CdS,CdSe,CdTe)和Ⅲ-Ⅴ族(如InAs,InP,GaAs)元素组成的纳米颗粒,其半径通常小于或接近于激子玻尔半径(一般小于10 nm)。由于电子和空穴被量子限域,连续的能带结构变成具有分子特性的分立能级结构,接受激发光后能产生荧光。与传统的有机荧光染料相比(表 1),量子点表现出以下独特的光学特性和应用前景(王彦广等,2007) :不同大小的颗粒发出的不同颜色荧光,可用于分辨或标记不同的目标物,从而做到单分子、多目标检测(Murcia et al., 2006); 光化学稳定性高,不易发生荧光漂白,适合作为长时间连续跟踪成像的荧光材料; 荧光量子点的发光寿命长,很适合谱带多元化和时间序列化的生物检测(Gao et al., 2005)。
|
|
对用于生物荧光探针的量子点来说,目前合成方法主要有2种,有机相合成主要是基于有机物与无机/有机金属化合物之间的反应(Murray et al., 1993; Qu et al., 2002; Sapra et al., 2006)。但有机溶剂一般有毒,如果以(CH3)2 Cd作为原料,毒性还很大。另外有机溶剂易燃、昂贵、室温下还不稳定,水溶性太差,因此不能直接用于生物体系。水相合成是目前量子点制备方法研究的热点。该方法采用巯基乙醇(Li et al., 2004)、3-巯基丙酸(徐海娥等,2007)、柠檬酸(邓大伟等,2008)、硫代甘油(Unni et al., 2008)、L-半胱氨酸(王琼等,2009)等为稳定剂控制反应速度,在水溶液中化学合成。虽然水相中合成的量子点粒径不均匀,容易沉聚,但由于在水溶液中合成,具有无毒、稳定、表面电荷和表面性质可控、生物兼容性好等优点,因此引起了许多科研工作者的关注(Xu,2005),今后将逐渐取代有机相合成法成为量子点制备方法新的探索重点和发展趋势。
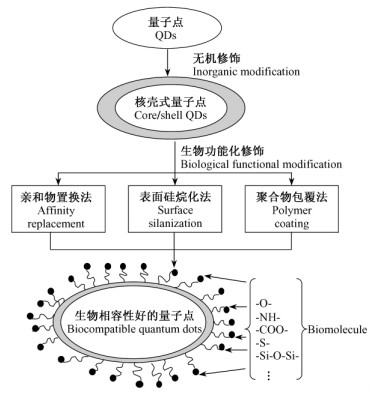
1.3 量子点的修饰量子点用于生物标记其优势首先是要获得高的量子产率和光学稳定性。通过对量子点表面形态研究发现,粒子的表面并不光滑,存在着许多缺陷,这些都会影响发光效率。因此用无机或有机分子对量子点进行包敷,制备成壳层结构,以此来消除由于表面缺陷而引起的表面上大量的无辐射复合中心,可以提高量子点的荧光产率以及增强发光稳定性。近年来已经研究的核壳结构体系,如CdSe/ZnS (Murcia et al., 2006),CdSe/CdS (邓大伟等,2008),CdS/ZnS(周建安等,2004),CdS/HgS(Hasselbarth et al., 1993),InAs/CdS (Cao et al., 2000),CdS/HgS/CdS(Schooss et al., 1994)等均证实了选择合适的无机修饰层能明显提高量子点的发光效率。修饰流程如图 1所示。
|
图 1 量子点修饰流程 Figure 1 Flow chart of modification of quantum dots (QDs) |
在获得高荧光强度、稳定的发光量子点后,针对量子点在生物体系中的应用,需改善其水溶性和生物相容性,如图 1所示。量子点的亲水处理方法包括以下几种:亲和物置换法、表面硅烷化法和聚合物包覆法。亲和物置换法是将带有特殊官能团的小分子如半胱氨酸(Sukhanova et al., 2002)和带巯基的烷酸(Chan et al., 1998)等置换量子点表面的疏水性配体。这些小分子的共同特点是一端带有亲水性基团,另一端是与量子点表面有较强结合作用的基团,大多是巯基(-SH)基团,但巯基易被氧化,与Zn或Cd之间的配位结合不强。表面硅烷化用硅烷取代疏水性配体,能形成稳定的交联结构(Bruchez et al., 1998)。聚合物包覆法是通过包被双亲、类脂性质的高分子共聚物如多聚体壳(polymer shell)、磷脂(phospholipids)以及聚乙二醇(PEG)等,使量子点成为亲水基团向外的囊状体,覆盖层上的亲水氨基、羟基和羧基,还为其提供了功能分子结合位点(Dubertret et al., 2002; Xing et al., 2007; 李德娜等,2008)。经过修饰后的量子点将有望进一步应用于生物检测。
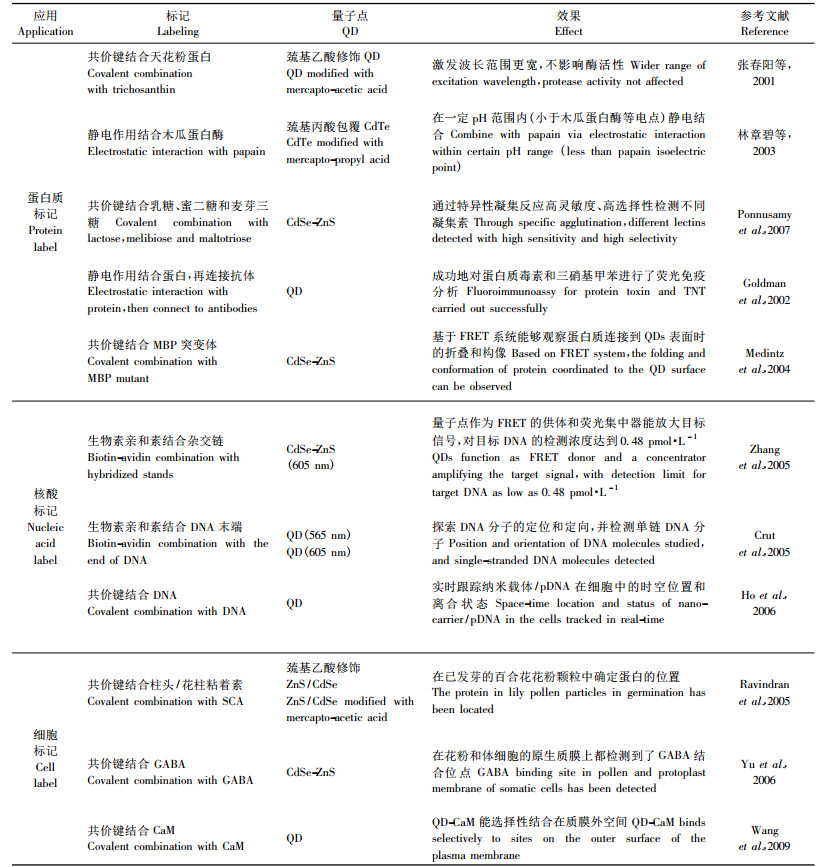
2 量子点在植物分子荧光标记中的应用量子点经过生物功能化修饰后由荧光团和反应基团2部分构成,荧光团决定探针的荧光参数,依靠反应基团使荧光标记与被标记分子结合。虽然目前量子点作为荧光探针用于植物体系的报道还不多,但基于量子点的优势,其在蛋白核酸分子标记(Goldman et al., 2002; Zhang et al., 2005)、生物物理机制(Medintz et al., 2004; Ho et al., 2006)、细胞膜蛋白和全细胞标记(Ravindran et al., 2005; Yu et al., 2006)等植物研究领域都将发挥作用(表 2)。
|
|
量子点与生物大分子(蛋白质、核酸和生物酶等)的链接主要是通过量子点修饰后的反应基团与生物大分子的活性官能团(氨基、巯基、酚羟基、羧基等)共价偶联完成的。张春阳等(2001)用量子点标记天花粉蛋白(TCS),首次将量子点引入中药研究领域,标记后其激发性能大为改善,但未影响蛋白具有的酶活性。在水溶液中量子点和生物分子还可以通过静电作用结合,林章碧等(2003)在一定的pH值条件下,通过静电作用,将CdTe量子点与植物分子木瓜蛋白酶相结合。这种方法简便易行,通过改变体系pH值,还可以使量子点选择性地标记目标分子,有望用于灵敏的检测试剂或细胞内的示踪剂。蛋白质标记方法同样还可以用于抗体荧光标记,但抗体对结构变化很敏感,荧光标记后必须保持抗体抗原结合区域的特异性和活性,过度标记不仅会破坏其免疫性,还会降低荧光效率。针对这一特殊性,Goldman等(2002)先将蛋白与量子点静电结合,再连接抗体,结合抗体的量随反应物浓度而变化,通过色谱将结合与未结合的分子分离,成功地对蛋白质毒素和三硝基甲苯进行了荧光免疫分析。该方法还可适用于其他植物受体-配体对(如亲和素-生物素对、酶-底物对、凝集素和糖蛋白等)的特异性识别和结合,Ponnusamy等(2007)利用Zn、Cd与巯基间的络合力将3种不同颜色的CdSe-ZnS核壳量子点分别与乳糖、蜜二糖、麦芽三糖结合(图 2),通过特异性凝集反应,蜜二糖-QD可以检测大豆凝集素,麦牙三糖-QD检测半刀豆球蛋白,检测限能达到100 nmol·L-1,这一方法为研究糖蛋白凝集素的相互作用提供了有效的途径。

|
图 2 糖轭合物CdSe-ZnS量子点合成示意 Figure 2 Schematic representation of synthesis of neoglycoconjugate CdSe-ZnS QD constructs |
传统荧光标记方法用于核酸杂交检测不仅灵敏度低,还要求将未杂交的DNA子链分离出来,以避免造成很强的背景荧光。量子点的发光寿命长,比背景自荧光的衰变时间慢,通过时间分辨成像技术可以将量子点的荧光从背景荧光中分离出来,能避免有机染料的缺陷。Han等(2001)将不同颜色的量子点组合进内部镂空的高分子球,制备出可标记生物大分子的多色编码微珠,理论表明这种编码微球可以识别大批量不同的DNA并用于DNA杂交检测。
2.2 量子点用于生物物理机制研究生物大分子的结构是分子生物物理学研究的重点之一,分子特定的功能依赖于它所特有的结构。单个分子水平对生物大分子的结构进行探测和操纵是目前生命科学研究的热点之一,分子梳和荧光原位杂交技术相结合为快速对DNA进行分析提供了有效的方法。Crut等(2005)利用分子梳技术将DNA分子拉伸并平铺在玻璃表面,在DNA末端标记不同颜色的量子点,通过量子点荧光信息及量子点之间的距离能探究DNA分子的位置和方向,这种方法为蛋白质- DNA相互作用及核酸检测研究铺平了道路,还有望用于对基因组DNA所有部位的结构和功能进行分析。
以量子点为基础的荧光共振能量转移方法(FRET)作为一种光学尺,避免了有机分子FRET的缺陷,能检测小于纳米的距离变化,因此能有效地用于研究生物分子结构的变化、蛋白质相互作用及生物传感器的开发。Medintz等(2004)将6种不同的麦芽糖结合蛋白(MBP)突变体用罗丹明(RR)标记后,配位结合CdSe-ZnS核壳量子点; 通过研究QDsMBP-RR之间的FRET来确定QDs供体和这6种不同的MBP-RR受体之间的距离以及MBP-RR在QDs表面的位置和取向。这种方法同样可用来检测蛋白质在其他杂交蛋白/球形纳米粒子上位置,并用于观察蛋白质连接到QDs表面时的折叠和构像。Zhang等(2005)采用FRET方法,构造了超灵敏、辨别力强、简单的DNA纳米传感器。量子点作为荧光共振能量转移的供体和纳米颗粒的集中器放大目标信号,对DNA的检测限达到0. 48 pmol·L-1,该方法有望用于植物多基因检测和细胞表面点突变研究。
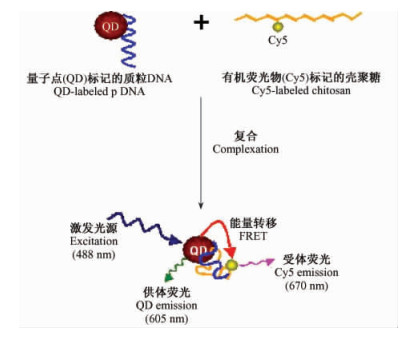
植物纳米基因工程的主要挑战是如何使纳米载体/pDNA突破各种生物物理和生物化学的障碍进入植物细胞核并获得目的基因整合与表达。量子点标记作为FRET的供体已成功用于基因转导过程中膜与细胞生物物理机制研究,并已显示了巨大的应用前景。Ho等(2006)用量子点标记的质粒DNA和阳离子聚合物纳米载体通过静电作用结合,形成荧光共振能量转移(FRET)的供受体,实时跟踪纳米载体/pDNA在细胞中的时空位置和离合状态,并通过激光共聚焦系统进一步表征其转导机制(包括导入、传输、定位、释放等) (图 3)。结果表明在细胞内传输过程中,QD-FRET是一种高灵敏和定量检测纳米复合物的组成及其动态稳定性的方法,并为优化纳米载体,克服细胞传输障碍提供了科学的依据。
|
图 3 QD标记的DNA纳米复合物形成及荧光共振能量转移(Ho et al., 2006) Figure 3 QD-labeled DNA nanocomplex formation and fluorescence resonance energy transfer (FRET) (Ho et al., 2006) |
作为一种新的高效稳定的荧光标记物,量子点目前在活体动物细胞生理学过程中的研究已取得了突破性的进展(Gao et al., 2005; Simberg et al., 2007)。在植物细胞中的标记比哺乳动物细胞的标记要复杂的多,这是因为植物细胞外基质结构和细胞壁天然屏障的影响,外部的信号分子进入细胞要通过细胞壁表面分子感知,再穿过细胞壁被质膜上的受体识别。
美国加州大学Ravindran等(2005)制备了颗粒直径6. 3 nm的ZnS /CdSe核壳量子点,巯基乙酸修饰后作为荧光探针; 与柱头/花柱粘着素(SCA)结合后,加入到已发芽的百合(Lilium)花粉颗粒中并在共聚焦显微镜下观察。利用量子点的荧光特性可以显示这种蛋白的位置,观察到先前传统成像技术无法了解的信息。这项研究第1次将量子点用于植物系统的实时成像,为量子点在植物细胞实时成像领域的利用打开了大门,并且促进了对花粉管和雌性组织在生殖阶段的相互作用机制的了解。
γ-氨基丁酸(GABA)是哺乳动物中枢神经系统中的一种抑制性神经递质,近来研究表明,该物质还调节花粉管生长和植物的生长方向。为了确定GABA受体是否也存在于花粉原生质体上,武汉大学Yu等(2006)构建了一种水溶性CdSe-ZnS量子点荧光探针,用交联剂将GABA与这种量子点进行生物耦合。利用这种探针,研究人员在花粉和体细胞的原生质膜上都检测到了GABA结合位点。质膜表面的荧光信号和利用Ca2+探针Fluo-3 /AM进行的Ca2+振荡分析结果都证实,潜在的GABA受体存在于植物的质膜上。这项研究不仅揭开了这类植物发育的一个谜团,更推动了量子点作为新型荧光探针在植物学中的研究。
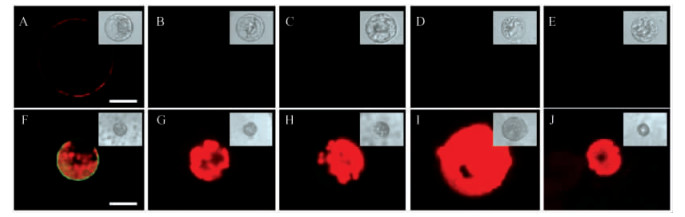
植物钙调蛋白(CaM)是一种高保守性的胞内钙离子传感器,能作为多肽信号调节胞内功能,但是其在细胞质外的结合位点仍存在争议。中国科学院植物研究所Wang等(2009)通过将量子点标记CaM,成功制备了CaM-QD探针。以拟南芥(Arabidopsis thaliana)花粉细胞、烟草(Nicotiana tabacum)悬浮细胞(BY-2)、拟南芥悬浮细胞及其原生质体进行活体标记,鉴定了胞外CaM在植物细胞膜表面的结合位点(图 4),并解析了CaM对细胞生长的调控机制。这是胞外CaM受体首次在活体细胞上标记的成功应用,也为荧光纳米技术在植物细胞上的研究提供了有力的证据。
|
图 4 荧光检测原生质体细胞膜表面CaM的结合位点 Figure 4 Fluorescence detection of CaM binding sites on the plasma membrane of protoplasts A-E: QD-CaM,QD-CmPP16,QD-BSA,QD-CaMTR1 C和QD-CaMTR2 C培育的BY-2细胞原生质体; F-J: QD-CaM,QD-CmPP16,QD-BSA,QD-CaMTR1 C和QD-CaMTR2 C培育的拟南芥细胞原生质体(Wang et al., 2009)。 A-E: BY-2 cell protoplasts incubated with QD-CaM, QD-CmPP16, QD-BSA, QD-CaMTR1 C and QD-CaMTR2 C; F-J: Arabidopsis thaliana protoplasts incubated with QD-CaM, QD-CmPP16, QD-BSA, QD-CaMTR1 C and QD-CaMTR2 C. |
将量子点用于植物分子标记是近年来发展起来的新兴领域,正得到许多研究人员的重视。而如何合成无毒稳定、植物相容性强的量子点; 如何高效将量子点与识别分子相结合,实现细胞定位及长时间跟踪; 如何突破细胞壁的屏障进入细胞,研究细胞内发生的变化,这些都是研究中的关键技术和待解决的问题。
目前量子点用于植物的报道还不多,但它在植物中,包括树木研究方面,有着重要的应用前景:
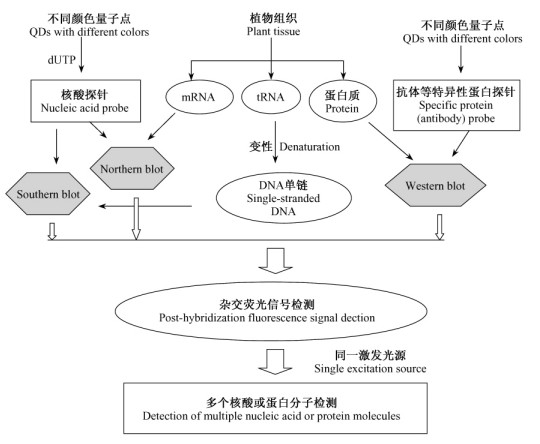
1) 鉴于量子点优越的荧光特性,以后有可能取代传统荧光染料进行核酸探针标记(图 5),通过杂交实现基因的筛选、克隆及序列分析和基因突变检测,并用于植物分子遗传材料的筛选和对植物病理的诊断等研究。
|
图 5 量子点探针用于杂交的应用结构 Figure 5 Frame chart of application of quantum dots probe for hybridization |
2) 在对植物细胞的标记上,传统荧光染料毒性高、易猝灭、光线穿透能力差,量子点克服了这一缺陷,通过靶向偶联对植物细胞进行动态标记,追踪其动力学过程,为阐明细胞生长发育的调控规律提供直观依据。如果将某一生物过程中有关生物分子标记不同颜色的量子点,还可以多组分地同时监测,实现对细胞内部多分子的监测。
3) 目前植物基因转化方法主要有农杆菌介导、基因枪转化和纳米载体介导等方法,量子点可以作为基因荧光标记的辅助手段,用现代物理显像方法和分子生物学技术,实时定位跟踪农杆菌细胞膜、质粒DNA或纳米载体在植物体内的运转,揭示植物转基因的生物物理过程及其机制。
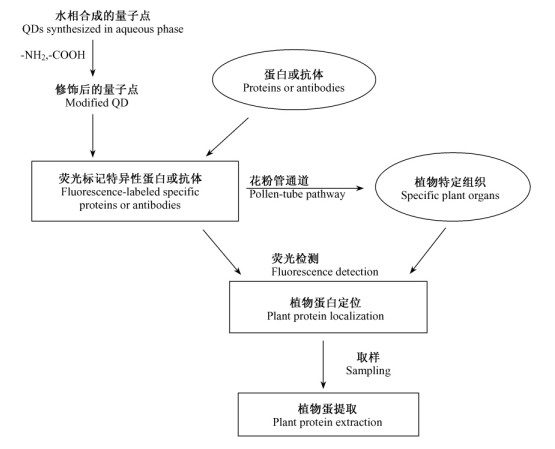
4) 植物提取蛋白是从天然植物中提取某些具有特殊效果的蛋白质,目前存在提取效率低、提取部位不准等问题。量子点对光漂白的耐受性比传统的荧光标记物更强,如果标记植物蛋白,还可以对植物体内特定蛋白定位并提取其有效成分,同样标记植物病变组织,就能检测到植物病害的发生发展以及定位病害的部位(图 6)。
|
图 6 量子点用于植物特定蛋白提取及检测流程 Figure 6 Flow chart of quantum dots for extraction and detection of specific plant proteins |
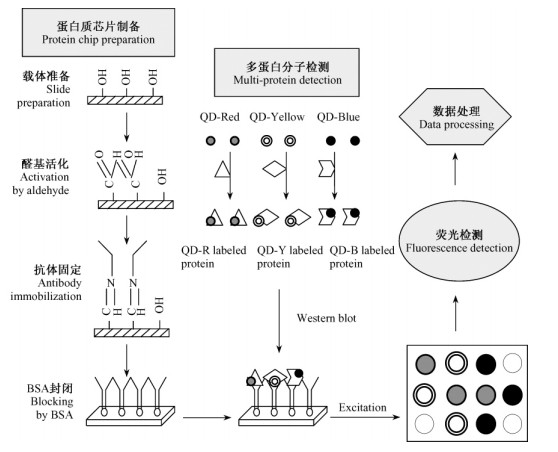
5) 在现有的生物芯片技术中,常用的样品标记方法有荧光标记(可用于核酸及蛋白质芯片)和酶标记(主要用于蛋白质芯片)。在荧光标记方法中,普通染料荧光寿命短、背景荧光干扰大,因此检测的灵敏度不高,而且一次还只能标记一种生物分子(蛋白质或DNA)与芯片作用。酶标法的原理来源于传统的酶联免疫吸附方法(ELISA),当抗体芯片捕获目标蛋白后,通过酶标记的二级抗体进行检测,虽然检测的灵敏度和特异性比较高,但和荧光标记相比需要更多抗体捕获分子,限制了目标蛋白的数量,而且过程复杂,很难用于多蛋白检测。而量子点发光寿命长、无背景干扰、单一激发波长、发光颜色多样性等特性,能满足对生物分子中所蕴藏的海量信息进行分析的要求。如用一系列大小不同、不同材料、光谱特性各不同的量子点标记蛋白质分子,可以同时检测所有标记蛋白质与芯片上的蛋白质之间的相互作用(图 7)。与现有方法相比,检测效率大大提高。
|
图 7 量子点用于蛋白质芯片上的多分子检测 Figure 7 Quantum dots used for detection of multiple molecules in protein chip |
鉴于量子点独特的光学性质,基于量子点的分子荧光标记技术会给植物学领域一些难点的解决带来契机。随着量子点技术的进一步发展,特别是针对植物分子荧光标记的改进,其在植物(包括树木)研究中的应用价值将得到越来越多的体现。
邓大伟, 于俊生. 2008. 柠檬酸稳定的水溶性CdSe和CdSe/CdS量子点的荧光特性[J]. 无机化学学报, 24(5): 5701-5707. |
刘爱平. 2007. 细胞生物学荧光技术原理与应用[M]. 北京: 中国科学技术大学出版社: 64-70.
|
李德娜, 张兵波, 马贵平, 等. 2008. 水溶性量子点纳米微球的制备、表征及其在生物检测中的应用[J]. 高等学校化学学报, 29(1): 46-49. |
林章碧, 张皓, 陈奇丹, 等. 2003. 利用水相合成的量子点标记木瓜蛋白酶的研究[J]. 高等学校化学学报, 24(4): 609-611. |
王琼, 陈介南, 章怀云, 等. 2009. 水溶性量子点制备条件的优化与表面修饰[J]. 材料导报, 23(5): 83-86. |
王彦广, 刘洋. 2007. 化学标记与探针技术在分子生物学中的应用[M]. 北京: 化学工业出版社: 94-106.
|
徐海娥, 闫翠娥. 2007. 水溶性量子点的制备及其与壳聚糖衍生物的自组装[J]. 高等学校化学学报, 28(1): 169-172. |
张春阳, 马辉, 丁尧, 等. 2001. 量子点标记天花粉蛋白的研究[J]. 高等学校化学学报, 22(1): 34-37. |
周建安, 李冬梅, 桑文斌, 等. 2004. ZnS-CdS核壳纳米微晶的制备与光学特性[J]. 人工晶体学报, 33(1): 43-47. |
Bruchez M J, Moronne M, Gin P, et al. 1998. Semiconductor nanocrystals as fluorescent bio-logical labels[J]. Science, 281(5385): 2013-2016. DOI:10.1126/science.281.5385.2013 |
Cao Y W, Banin U. 2000. Growth and properties of semiconductor core/shell nanocrystals with InAs cores[J]. J Am Chem Soc, 122(40): 9692-9702. DOI:10.1021/ja001386g |
Chan W C W, Nie S. 1998. Quantum dot bioconjugates for ul-trasensitive nonisotopic detection[J]. Science, 281(5385): 2016-2018. DOI:10.1126/science.281.5385.2016 |
Crut A, Geron-landre B, Bonnet I, et al. 2005. Dectection of single DNA molecules by multicolor quantum dot end-labeling[J]. Nucleic Acids Res, 33(11): 98. DOI:10.1093/nar/gni097 |
Dubertret B, Skourides P, Norris D J, et al. 2002. In vivo imaging of quantum dots encapsulated in phospholipid micelles[J]. Science, 298(5599): 1759-1762. DOI:10.1126/science.1077194 |
Gao X, Yang L, Petros J A, et al. 2005. In vivo molecular and cellular imaging with quantum dots[J]. Curr Opin Biotechol, 16(1): 63-72. DOI:10.1016/j.copbio.2004.11.003 |
Goldman E R, Anderson G P, Tran P T. 2002. Conjugation of luminescent quantum dots with antibodies using an engineered adaptor protein to provide newreagents for fluoroimmunoassays[J]. Anal Chem, 74(4): 841-847. DOI:10.1021/ac010662m |
Han M, Gao X, Su J Z, et al. 2001. Quantum-dot-tagged microbeads for multiplexed optical coding of biomolecules[J]. Nat Biotechnol, 19(7): 631-635. DOI:10.1038/90228 |
Hasselbarth A, Eychmuller A, Eichberger R, et al. 1993. Chemistry and photophysics of mixed cadmium sulfide/mercury sulfide colloids[J]. J Phys Chem, 97(20): 5333-5340. DOI:10.1021/j100122a026 |
Ho Y P, Chen H H, Wang T H, et al. 2006. Evaluating the intracellular stability and unpacking of DNA nanocomplexes by quantum dotsFRET[J]. Journal of Controlled Release, 116(1): 83-89. DOI:10.1016/j.jconrel.2006.09.005 |
Li Jun, Hong Xia, Li Di, et al. 2004. Mixed ligands of cysteine and thioglycolic acid assisted synthesis of highly luminescent watersoluble CdTe nanorods[J]. Chem Com, (15): 1740-1741. DOI:10.1039/b405623j |
Medintz I L, Konnert J H, Mattoussi H, et al. 2004. A fluorescence resonance energy transfer-derived structure of a quantum dot-protein bioconjugate nanoassembly[J]. PNAS, 101(26): 9612-9617. DOI:10.1073/pnas.0403343101 |
Michalet X, Pinaud F F, Bentolila L A, et al. 2005. Quantum dots for live cells, in vivo imaging, and diagnostics[J]. Science, 307(5709): 538-544. DOI:10.1126/science.1104274 |
Murray C B, Norris D J, Bawendi M G. 1993. Synthesis and characterization of nearly monodisperse CdE(E = sulfur, selenium, tellurium) semiconductor nanocrystallites[J]. J Am Chem Soc, 115(19): 8706-8715. DOI:10.1021/ja00072a025 |
Murcia M J, Shaw D L, Woodruff H, et al. 2006. Facile sonochemical synthesis of highly luminescent ZnS-shelled CdSe quantum dots[J]. Chem Mater, 18(9): 2219-2225. DOI:10.1021/cm0505547 |
Ponnusamy B, Sharmistha S, Avadhesha S. 2007. Sugar-quantum dot conjugates for a selective and sensitive detection of lectins[J]. Bioconjugate Chem, 18(1): 146-151. DOI:10.1021/bc060204q |
Qu L, Peng X. 2002. Control of photoluminescence properties of CdSe nanocrystals in growth[J]. J Am Chem Soc, 124(9): 2049-2055. DOI:10.1021/ja017002j |
Ravindran S, Kim S, Martin R, et al. 2005. Quantum dots as bio-labels for the localization of a small plant adhesion protein[J]. Nanotechnology, 16(1): 1-4. DOI:10.1088/0957-4484/16/1/001 |
Sapra S, Rogach A L, Feldmann J. 2006. Phosphine-free synthesis of monodisperse CdSe nanocrystals in olive oil[J]. J Mater Chem, 16(33): 3391-3395. DOI:10.1039/b607022a |
Schooss D, Mews A, Eychmuller A, et al. 1994. Quantum-dot quantum well CdS/HgS/CdS: theory and experiment[J]. Phys Rev B, 49(24): 17072-17078. DOI:10.1103/PhysRevB.49.17072 |
Simberg D, Duza T, Park J H, et al. 2007. Biomimetic amplification of nanoparticle homing to tumors[J]. Proc Natl Acad Sci USA, 104(3): 932-936. DOI:10.1073/pnas.0610298104 |
Sukhanova A, Venteo L, Devy J, et al. 2002. Highly stable fluorescent nanocrystals as a novel class of labels for immunohistochemical analysis of paraffin-embedded tissue sections[J]. Lab Invest, 82(9): 1259-1261. DOI:10.1097/01.LAB.0000027837.13582.E8 |
Unni C, Philip D, Gopchandran K G. 2008. Studies on optical absorption and photoluminescence of thioglycerol-stabilized CdS quantum dots[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 71(4): 1402-1407. DOI:10.1016/j.saa.2008.04.023 |
Wang Qinli, Chen Bo, Liu Peng, et al. 2009. Calmodulin binds to extracellular sites on the plasma membrane of plant cells and elicits a rise in intracellular calcium concentration[J]. J Biol Chem, 284(18): 12000-12007. DOI:10.1074/jbc.M808028200 |
Xing Y, Chaudry Q, Shen C, et al. 2007. Bioconjugated quantum dots for multiplexed and quantitative immunohistochemistry[J]. Nature Protocols, 2(5): 1152-1165. DOI:10.1038/nprot.2007.107 |
Xu Y. 2005. Synthesis and characterization of silica coated CdSe/CdS core/shell quantum dots. Ph. D. Dissertation, Virginia Polytechnic Institute and State University.
|
Yu Guanghui, Liang Jianggong, He Zhike, et al. 2006. Quantum dotmediated detection of g-aminobutyric acid binding sites on the surface of living pollen protoplasts in tobacco[J]. Chemistry & Biology, 13(3): 723-731. |
Zhang C Y, Yeh H C, Kuroki M T, et al. 2005. Single-quantum-dot-based DNA nanosensor[J]. Nature Materia, 4(11): 826-831. DOI:10.1038/nmat1508 |
 2010, Vol. 46
2010, Vol. 46