文章信息
- 王有年, 李青, 李照会, 师光禄
- Wang Younian, Li Qing, Li Zhaohui, Shi Guanglu
- 萹蓄提取物对朱砂叶螨的触杀活性及相关酶活性的影响
- Acaricidal Activities of Polygonum aviculare Extracts against Tetranychus cinnabarinus and Their Effects on Enzyme Activities in the Mite
- 林业科学, 2010, 46(10): 103-107.
- Scientia Silvae Sinicae, 2010, 46(10): 103-107.
-
文章历史
- 收稿日期:2009-10-11
- 修回日期:2009-12-04
-
作者相关文章
2. 山东农业大学植保学院 泰安 271018
2. College of Plant Protection, Shandong Agricultural University Tai'an 271018
朱砂叶螨(Tetranychus cinnabarinus)是一种世界范围的重要经济害虫(Hazan et al., 1974; Ho et al., 1997),具有个体小、繁殖快、种群密度高、危害重等特点(师光禄等,1994; 李连昌等,1992),比其他害螨更易对常规化学杀螨剂产生抗性,防治费用也随着抗药性的逐年增加而加大,因此,寻找更加安全的高效杀螨剂势在必行。植物源杀螨剂具有选择性好、低毒、易降解、害螨不易产生抗性,对目标害螨的天敌昆虫伤害较小等优点。近年来,从植物提取物中筛选出高活性的物质,直接开发新的生物源杀螨剂,或以其为先导化合物合成新的更安全高效的农药,已成为国内外农药研究开发领域的一个热点。
萹蓄(Polygonum aviculare)又名多茎萹蓄,为蓼科(Polygonaceae)1年生或多年生草本植物,分布于全国各地,以河南、四川、浙江、山东、吉林、河北等地产量较大,生于田野、路旁、水边和湿地。有关萹蓄应用于医学方面的研究较多,但有关杀螨活性成分的研究却鲜见报道。本文紧密结合当前生产实践,系统研究了萹蓄植物杀螨活性成分及作用机制,为开发植物源农药提供科学的理论依据。
1 材料与方法 1.1 材料试材萹蓄(叶)购于北京某药店,经高速粉碎机(型号6202,北京环亚天元机械技术有限公司)粉碎后过40目筛,放入冰箱(BCD-278WNN,青岛海尔股份有限公司)备用。朱砂叶螨源于室内饲养的敏感品系,温度(25 ± 1) ℃,相对湿度RH = (50 ± 10) %,光照L: D = 18 h: 6 h。所用试剂均为分析纯(北京化工厂)。
1.2 方法提取:称取一定量的试材干粉,装入广口瓶内,加入干粉5倍量的有机溶剂(石油醚、氯仿、甲醇),室温下(25 ± 2) ℃分别浸提3次,每次3~5天,分别合并3种提取液并减压浓缩至膏状后,称质量。萃取:称取萹蓄氯仿提取物15 g,用10倍量石油醚溶解,装入分液漏斗中,用甲醇萃取3次,合并萃取液并减压浓缩至稠膏状,称量。柱层析:称取萃取物100倍量的硅胶(100~200目),与适量的洗脱液混匀,迅速注入层析柱中,并用橡胶锤轻敲柱壁,同时,打开底端的旋塞,使溶液缓慢下移,硅胶颗粒紧密沉集在柱底。取萃取物7 g用少量初始洗脱液溶解,待柱内溶液表面距硅胶表面1 cm左右时,将待分离物质沿柱内壁注入,待需分离物质移动到硅胶表面以下时,覆盖一层石英砂,然后分别用石油醚、氯仿、甲醇溶剂系统进行洗脱; 流速为10 mL·min-1,每流分收集50 mL,经薄层层析(TLC)后,置于碘蒸气中进行检测,做好标记。将相同成分者合并,最终得到19个流分,分别减压浓缩后进行生物活性测定。
生测采用玻片浸渍法(FAO,1980),用双面胶条将健康活泼、大小一致的30头雌成螨粘于载玻片的一端,于药液中浸5 s后取出,并用滤纸吸掉螨体周围多余药液,处理后置于室温(25 ± 1) ℃下,48 h后观察其死亡情况,接触动者为活,不动者为死,按Abbott公式计算校正死亡率(Abbort,1987)。症状观察采用叶碟浸渍法(朱丽梅等,2002) :将洗净的平展的大豆叶片于水培养台上,每一叶片挑入成螨30头以上,待成螨稳定后,夹取叶片浸入药液(2 mg·mL-1)中5 s,以清水处理为对照。叶片边缘用湿棉条围住,以防螨体逃逸。每12 h观察1次成螨的活动及反应状况,共观察4次。
酶液制备:将试螨用触杀方法处理,分别取处理后的8,16,24,32,40,48 h的雌成螨150头,加0.25 mL生理盐水在冰浴中匀浆后,10 000 r·min-1,4 ℃下离心15 min,取上清液备用; 蛋白质含量测定采用考马斯亮蓝G-250法(慕立义,1991)。加酶液0.1 mL于5 mL考马斯亮蓝G-250试剂中混匀,25 ℃水浴中恒温加热2 min,于595 nm波长处比色测定OD值,然后根据标准曲线得出蛋白质含量。乙酰胆碱酯酶(AchE),Na+, K+-ATPase及GSH-S -转移酶均参照慕立义(1991)的有关方法进行酶活性测定。
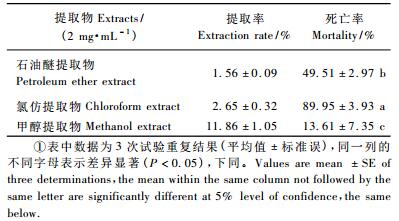
2 结果与分析 2.1 萹蓄提取物对朱砂叶螨的触杀作用萹蓄3种溶剂的提取率分别为甲醇(11.86 ± 0.56)% >氯仿(2.65 ± 0.38)% >石油醚(1.56 ± 0.08)%。将石油醚、氯仿和甲醇提取物分别配制成浓度为2 mg·mL-1药液,对害螨进行毒力测定(表 1),结果表明: 48 h后,萹蓄氯仿提取物的触杀活性明显大于其余2种有机溶剂提取物(P < 0.05),对朱砂叶螨的触杀效果达到89.95%。为此选择萹蓄的氯仿提取物作进一步的萃取与纯化。
|
|
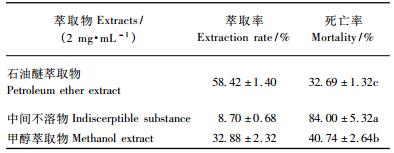
将触杀效果较好的氯仿提取物用甲醇和石油醚进行萃取分离(表 2)。其萃取率为:石油醚(58.42 ± 1.40) % >甲醇(32.88 ± 2.32) % >中间不溶物(8.70 ± 0.68) %; 萃取物生物测定结果表明:中间不溶物杀螨率为(84.00 ± 5.32) %,明显高于甲醇萃取物(40.74 ± 2.64) %和石油醚萃取物(32.69 ± 1.32) % (P < 0.05),由此可确定萹蓄的杀螨活性物质主要存在于中间不溶物中。
|
|
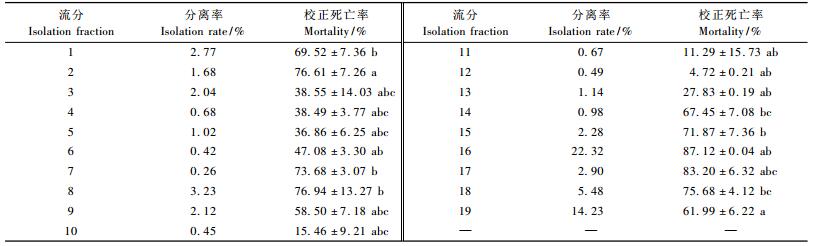
对柱层析分离及TLC检测后得到的19个流分(表 3)进行生物测定,结果表明:流分2,7,8,15,16,17,18对朱砂叶螨的触杀效果较好,均达到70%以上,其中在2 mg·mL-1时,流分16的杀螨效果最好,达到了87.12%;且由于其得率较高,因此选择该物质进行后续研究。
|
|
将所得流分16配制成5个不同浓度的药液(0.5,1,2,4,8 mg·mL-1)进行生物活性测定,分别求出毒力回归方程(y = 5.270 2 + 1.003 8x)及致死中量LC50 (0.988 mg·mL-1),可见其有较好的生物活性。药液浓度为2 mg·mL-1时,48 h后害螨死亡率达到87.12%,适于后续酶活性的进一步研究。因此选择2 mg·mL-1这一药剂浓度进行症状观察及酶的活性测定。
2.4 症状观察用流分16 (2 mg·mL-1)及清水处理雌成螨进行症状观察,发现0~12 h间,处理组害螨表现十分兴奋,四处爬动,并急剧产卵,而对照组则缓慢爬动,正常取食叶片; 12~24 h间,处理组试螨背部体液开始外渗,四处窜动,产卵量有所下降,而对照组行为正常,并开始产卵; 24~36 h间,处理组试螨体液仍保持外渗状态,身体开始收缩,对照组则正常爬动,未见异常; 36~48 h间,处理组试螨身体逐渐收缩至死亡,对照组则身体饱满,活动正常。经流分16处理后,表现的症状与神经毒剂有相似之处,如兴奋、抽搐等,由此推测,该活性物质可能对神经系统有一定的作用。
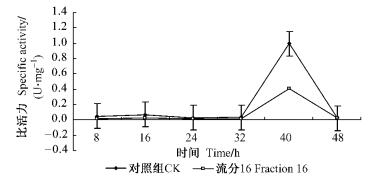
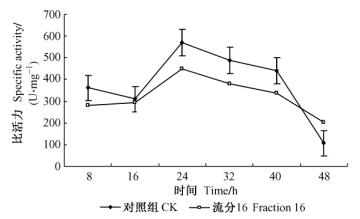
2.5 乙酰胆碱酯酶的活力测定将流分16 (2 mg·mL-1)和清水分别喷施于朱砂叶螨体表,作为处理组和对照组,经测定两者乙酰胆碱酯比活力变化如图 1所示: 8 h时,处理组比活力为0.009 8 U·mg-1,是对照组的0.21倍,低于对照(P < 0.01); 16~48 h间,对照组比活力分别是处理组的2.83,1.75,1.94,2.47,0.707倍。16~40 h间,处理组比活力均低于对照组。可见,流分16对朱砂叶螨的乙酰胆碱酯酶具有一定的抑制作用。
|
图 1 萹蓄活性物质对朱砂叶螨乙酰胆碱酯酶活性的影响 Figure 1 Effect of the extracts of P. aviculare on the activity of AchE of T. cinnabarinus |
从图 2可以看出:害螨经流分16处理后,Na+,K+-ATPase比活力变化趋势与对照(清水)基本相同,8,16,32,40 h变化不大; 24 h和48 h时,对照组的比活力分别为处理组的3.18倍和18倍,抑制效果显著。

|
图 2 萹蓄活性物质对朱砂叶螨Na+,K+-ATPase活性的影响 Figure 2 Effect of the extracts of P. aviculare on the Na+, K+-ATPase activity of T. cinnabarinus |
谷胱甘肽-S-转移酶是螨类体内最活跃的解毒酶系之一,它能催化有毒的亲电化合物与内源性的还原型谷胱甘肽发生共轭反应,进行解毒代谢。由图 3可知,8,24,32,40 h时,组分16对谷胱甘肽-S-转移酶活性具有一定的抑制作用,对照组比活力分别是处理组的1.29,1.26,1.29,1.32倍; 48 h时,对照组是处理组的0.52。从整体情况来看,谷胱甘肽-S-转移酶是受抑制的。
|
图 3 萹蓄活性物质对朱砂叶螨GSTs酶活性的影响 Figure 3 Effect of the extracts of P. aviculare on the GSTs activity of T. cinnabarinus |
通过提取、萃取,柱层析以及色、光谱技术,对扁蓄的杀螨活性成分进行了初步分离提纯,发现此成分对朱砂叶螨乙酰胆碱酯酶(AchE),Na+, K+-ATPase,GSH-S -转移酶的活性均产生了不同程度的影响。大多数杀螨剂是通过干扰神经系统来发挥致死作用的,而且其中毒特征多表现为颤栗、痉挛、麻痹或是其他行为发生改变。神经细胞间的化学信息传递主要依靠神经传递素的合成与分解,已经报道了许多被公认的神经传递素,如乙酰胆碱、伽马氨基丁酸、真硝胺等,其中已有一些被证明为杀螨剂的靶标(Dekeyser et al., 1994)。笔者所观察到害螨施药后的症状与上述神经毒剂的症状有相似之处,因此选择神经系统中2个重要酶系,即乙酰胆碱酯酶与Na+,K+-ATPase 2种酶的活性进行测定。乙酰胆碱存在于突触间隙中并可被乙酰胆碱酯酶分解,从而终止神经兴奋的传导,一旦该酶被一定程度的抑制,会促使昆虫过度兴奋后死亡(林忠莲等,2001)。本研究结果表明:萹蓄提取物流分16对乙酰胆碱酯酶的活性具有明显的抑制作用,16,40,48 h后均可见到明显的抑制效果(图 1)。神经细胞的离子组成不同于周围介质,它取决于细胞膜对不同离子的渗透性、周围介质中这些离子的浓度以及在细胞膜上离子泵的的活性(林忠莲等,2001)。Na+,K+-ATPase广泛分布于细胞膜及内质网等膜成分之中,与Na+,K+的传递有关,该酶受抑制时,膜对离子的通透性降低,Na+流受抑制,引起膜内Na+浓度升高,造成神经膜处于持续的兴奋状态,继而引发神经系统功能紊乱,最终导致昆虫死亡(张宗炳,1982)。试验结果表明,药剂处理后的害螨Na+,K+-ATPase活性在40~48 h时间段内变化明显,与乙酰胆碱酯酶出现的时间段相同,且与观察到的与之相应症状出现的时间段也基本相符,由此可推断,活性物质可能通过对这2种酶活性的影响,引起神经传递的阻断从而导致螨体死亡; 谷胱甘肽-S-转移酶能催化生物体内的还原型谷胱甘肽(GSH)与外源化合物的亲电子基团发生轭合,最终形成硫醚氨酸排出体外,其活性的升高可作为动物组织损伤的敏感指标(沈同等,1990; 深见顺一,1994)。这种高效的解毒代谢体系在生物体与外界不良环境因子的适应过程中很可能发挥重要作用。从本研究结果来看,处理组酶活性受到抑制可能会影响朱砂叶螨的正常解毒代谢,从而导致有毒物质在螨体内积累,引起死亡。
近年来,有关萹蓄的报道多局限于临床医学方面,例如Kim等(1994)从萹蓄中分得黄芪甙、萹蓄甙、槲皮甙、杨梅树皮甙。郑旭东等(1999b)从萹蓄(乌蓼)中分离得到5个黄酮类物质。Vysochina (1998)从萹蓄的地上部分分得Uglanin (山萘酚-3-O-阿拉伯糖昔)、山萘酚、杨梅素、杨梅素-3-O-(半乳糖)2及2个未知黄酮类化合物。于兆海等(2002)从中分离得到8种物质。赵爱华等(2002)从萹蓄丙酮提取物中分离到10个化合物。陈晓虎等(2004)从乙酸乙酯部位分离到13个化合物。郑旭东等(1999a)从萹蓄的挥发油分离到α -莰酮、芳樟醇、匙叶桉油烯醇、莰烯。Al-Hazimi等(2002)从萹蓄丙酮提取物中分离到6-methoxyplumbagin。也有文献报道萹蓄具有对棉铃虫(Helicoverpa armigera)、小菜蛾(Plutella xylostella)、菜青虫(Pieris rapae)的杀虫活性,但有关萹蓄对朱砂叶螨的杀螨活性尚未见报道。本研究利用相似相容原理,从萹蓄中分离出了杀螨活性物质,并对朱砂叶螨的生物活性及几个重要酶的影响进行了初步测定,为该活性物质的结构鉴定、作用机制的深入研究及新型植物源农药的开发等工作奠定了良好的基础。
陈晓虎, 陈道峰. 2004. 萹蓄的化学成分研究[J]. 中国中药杂志, 29(9): 918-919. |
李连昌, 李利贞, 范永亮, 等. 1992. 中国枣树害虫[M]. 北京: 中国农业出版社.
|
林忠莲, 张立力. 2001. 磷化氢对谷蠢和玉米象成虫体内乙酰胆碱酯酶的影响[J]. 郑州工程学院学报, 22(4): 35-41. |
慕立义. 1991. 植物化学保护方法[M]. 北京: 中国农业出版社.
|
深见顺一, 上杉康彦, 石皓造富, 等. 1991. 农药实验法---杀菌剂篇. 李树正, 程天恩, 译. 北京: 农业出版社.
|
沈同, 王镜岩. 1990. 生物化学[M]. 北京: 高等教育出版社.
|
师光禄, 郑王义, 党泽普, 等. 1994. 果树害虫[M]. 北京: 中国农业出版社.
|
于兆海, 孙结. 2002. 萹蓄的化学成分研究[J]. 中草药, 33(6): 495-499. |
张宗炳. 1982. 昆虫毒理学的新进展[M]. 北京: 北京大学出版社.
|
赵爱华, 赵勤实, 林中文, 等. 2002. 萹蓄的化学成分研究[J]. 天然产物研究与开发, 14(5): 29-32. |
郑旭东, 胡浩斌, 郑尚珍, 等. 1999a. 庆阳乌蓼挥发油成分的研究[J]. 西北师范大学学报:自然科学版, 35(3): 68-70. |
郑旭东, 苏跃增. 1999b. 庆阳乌蓼中黄酮类化合物的研究[J]. 西北师范大学学报:自然科学版, 35(2): 47-49. |
朱丽梅, 倪钰萍, 黄春霞, 等. 2002. 螨的综合测试方法的研究[J]. 南京农专学报, 17(1): 13-17. |
Abbort W S. 1987. A method of computing the effectiveness of an insecticide[J]. J Am Mosq Control Assoc, 3(2): 302-303. |
Al-Hazimi H M A, Haque S N. 2002. A new naphthoquinone from Polygonum aviculare[J]. Natural Product Research, 16(2): 115-118. |
F AO. 1980. Revised method for spider mites and their eggs (eg Tetranychus spp. and Panonychus ulmi Koch)[J]. FAO Plant Production, 21: 49-54. |
Hazan A, Gerson U, Tahori A S. 1974. Spider mite webbing Ι. the production of webbing under various environmental conditions[J]. Acarologia, 16: 68-84. |
Ho C C, Lo K C, Chen W H. 1997. Spider mite (Acari: Tetranychidae) on various crops in Taiwan[J]. J Agr Res China, 46: 333-346. |
Kim H J, Woo E R, Park H. 1994. A novel lignan and flavonoids from Polygonum aviculare[J]. J Nat Prod, 57(5): 581-586. DOI:10.1021/np50107a003 |
Dekeyser M A, Downer K G H. 1994. Biochemical and physiological targets for miticides[J]. Pestic Sci, 40(2): 85-101. DOI:10.1002/ps.v40:2 |
Vysochina G I. 1998. Total and individual contents of several of the principal flavonoids found in aerial parts of Polygonum aviculare grown in Siberia[J]. Rastitel Resursy, 34(4): 47-55. |
 2010, Vol. 46
2010, Vol. 46