文章信息
- 王曦茁, 朴春根, 李虹, 汪来发, 郭民伟, 李永, 刘晓莉
- Wang Xizhuo, Piao Chungen, Li Hong, Wang Laifa, Guo Minwei, Li Yong, Lui Xiaoli
- 根癌农杆菌介导的淡紫拟青霉遗传转化体系的建立
- Establishment of Agrobacterium tumefaciens-Mediated Transformation System of Paecilomyces lilacinus
- 林业科学, 2010, 46(10): 95-102.
- Scientia Silvae Sinicae, 2010, 46(10): 95-102.
-
文章历史
- 收稿日期:2010-05-04
- 修回日期:2010-07-23
-
作者相关文章
2. 中国林业科学研究院林业研究所 北京 100091;
3. 安徽农业大学林学与园林学院 合肥 230036
2. Research Institute of Forestry, CAF Beijing 100091;
3. School of Forestry and Landscape Architecture, Anhui Agricultural University Hefei 230036
淡紫拟青霉(Paecilomyces lilacinus)是一种典型的土壤习居菌,是一些植物病原线虫的重要天敌(李芳等,1998)。淡紫拟青霉能够有效防治南方根结线虫(Meloidogyne incognita)和马铃薯白线虫(Globodera pallida)等植物寄生线虫,对南方根结线虫的卵寄生率高达60%~70% (Jatala et al., 1979; Jatala,1986),许多试验表明淡紫拟青霉杀线活性与化学杀线剂相比较无明显差别甚至超过化学杀线剂(Vijaya Kuman et al., 2002; 高学彪等,1998),而且还能促进植物的生长(李芳等,1998),达到增产的目的(Khan et al., 2002)。国内外在淡紫拟青霉的生物学特性、生防应用和代谢物生理功效等方面的研究已取得了很大的进展,但在分子水平,特别是致病功能基因及其机制等方面的研究甚少。
构建插入突变体库,是获得突变体并进一步克隆相关基因的有效方法之一。根癌农杆菌介导的转化(Agrobacterium tumefaciens-mediated transformation,ATMT)技术是获得真菌插入突变的有效手段之一,它在一定程度上克服了其他插入突变技术的缺点,具有操作方法简便、受体材料多样、转化效率较高(de Groot et al., 1998; Chen et al., 2000)、单拷贝插入的比例高(de Groot et al., 1998)、转化子稳定(Campoy et al., 2003; Michielse et al., 2004)等优点,已经成为真菌功能基因组学研究的有力工具(方卫国等,2002)。目前应用根癌农杆菌介导的转化技术,已成功实现了昆虫病原真菌绿僵菌(Metarhizium anisopliae) (Fang et al., 2006)和白僵菌(Beauveria bassiana) (dos Reis et al., 2004)的遗传转化。虽然丝状真菌的基本过程相同,但不同真菌转化所需要的转化参数存在差异,需要针对不同真菌的转化条件进行摸索。本研究成功地利用根癌农杆菌介导的遗传转化方法对淡紫拟青霉进行了遗传转化,并对可能影响淡紫拟青霉遗传转化的因子进行研究,建立根癌农杆菌介导的淡紫拟青霉遗传转化体系,为淡紫拟青霉突变体库的构建、相关侵染基因的克隆等研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌种、质粒及其来源淡紫拟青霉20-7菌株和根癌农杆菌菌株EHA105及AGL-1由中国林业微生物菌种保藏管理中心(CFCC)提供,分别放置于4 ℃和-80 ℃冰箱中保存备用。
构建质粒pBI-G3C-aphⅠ的原始质粒pBI-G3C是日本京都府立大学Yasuyuki Kubo教授构建(经Yasuyuki Kubo教授同意,由中国农业大学彭友良教授惠赠)。质粒pBI-G3C-aphⅠ由本实验室构建。
质粒pETF28A,带有G-418的抗性基因aphⅠ,该基因被克隆后用来置换pBI-G3C中的hph(ClaⅠ/XhoⅠ)基因。
1.1.2 主要培养基和抗生素培养基: LB培养基、基本培养基(minimal medium,PDA)和诱导培养基(induction medium,IM)分别用于农杆菌划线培养、振荡培养,共培养前诱导。农杆菌和淡紫拟青霉孢子混和后,铺在共培养培养基上进行转化,用PDA培养基进行转化子的第1次和第2次筛选。转化子的保存用PDA培养基。LB培养基:胰蛋白胨(Tryptone)10 g,酵母提取物(yeast extract)5 g,NaCl 10 g,加蒸馏水定容至1 L; PDA培养基: 10 mL Kbuffer (pH 7.0),20 mL M-N,1 mL 10 mg·L-1 CaCl2·2H2O、10 mL 200 mg·L-1葡萄糖(glucose),10 mL 0.1 mg·L-1 FeSO4,5 mL Spore Elements,2.5 mL 200 mg·L-1 NH4NO3,加蒸馏水定容至1 L; IM培养基: 0.8 mL 1.25 mol·L-1 K-buffer (pH 4.9),20 mL M-N,1 mL 10 mg·L-1 CaCl2·2H2O,5 mL Spore Elements,2.5 mL 200 mg·L-1 NH4NO3,10 mL 500 mg·L-1甘油(glycerol),40 mL 1 mol·L-1 MES(pH 5.5用NaOH调节pH值),10 mL 200 mg·L-1葡萄糖(glucose),2 mL 100 μg·mL-1 AS,加蒸馏水定容至1 L。
抗生素:振荡培养农杆菌时所用抗生素为链霉素(50 μg·mL-1)和卡那霉素(10 μg·mL-1),对得到的转化子进行筛选时所用抗生素为头孢噻肟钠(200 μg·mL-1)和G-418(800 μg·mL-1)。
其他试剂:乙酰丁香酮(AS) (200 μg·mL-1)。
1.2 表达载体的构建 1.2.1 选择标记基因的克隆潮霉素B作为选择标记虽然可以用于某些真菌的遗传转化,但本试验中淡紫拟青霉对潮霉素不敏感,高浓度的潮霉素仍不能抑制拟青霉的生长,故选择G-418基因aphⅠ基因为筛选标记。aphⅠ基因是根据设计的保守引物通过PCR方法从pETF28A载体中扩增获得。回收PCR产物并进行T载体连接,连接产物转化大肠杆菌DH5α感受态细胞,涂在附加50 μg·mL-1氨苄青霉素(AMP)的LB固体平板上筛选重组菌株。重组菌株质粒DNA碱法小量提取的步骤参照王关林等(1998)。
1.2.2 选择标记基因的改造利用在aphⅠ引物端设计加入的ClaⅠ和XhoⅠ酶切位点进行双酶切,同时将pBI-G3C质粒也用ClaⅠ和XhoⅠ双酶切; 将酶切后回收的DNA片段,用T4 DNALigase进行连接。连接产物转化大肠杆菌DH5α感受态细胞,构成表达载体pBI-G3C-aphⅠ。转化后得到的重组子进行PCR检测,重组菌株质粒DNA碱法小量提取的步骤参照王关林等(1998)。
1.3 淡紫拟青霉遗传转化体系的建立 1.3.1 根癌农杆菌菌株的筛选使用2种已经成功用于丝状真菌遗传转化上,并证明转化效率很高的农杆菌菌株EHA105和AGL-1 (Park et al., 2004; Michielse et al., 2005)进行转化效率对比,重复3次,取平均值。
1.3.2 抑制淡紫拟青霉20-7菌株的G-418最佳浓度的筛选取大小相同(直径为5 mm)、培养条件一致(5天、25 ℃)的边缘菌丝块,移到含G-418浓度分别为0,100,200,300,400,500,800和1 000 μg·mL-1的PDA平板上; 然后置于25 ℃恒温箱中进行培养,分别于培养后48,72,96和108 h观察记录,测定其对菌落生长情况。
1.3.3 最佳转化条件的筛选1) 不同生长时期的淡紫拟青霉孢子悬浮液的准备 淡紫拟青霉20-7菌株在PDA平板上25 ℃培养5天后,刮取培养基上的分生孢子到适量的吐温80中,振荡后用4层灭菌擦镜纸过滤孢子悬液以除去菌丝,装于试管中,调节孢子含量至1 × 106个·mL-1,制成新鲜孢子悬浮液备用。另取4 ℃保存1个月的平板,直接刮取培养基上的分生孢子,经过同样方法处理,制成孢子悬浮液备用。
2) 不同浓度农杆菌的准备 取出-80 ℃保存的农杆菌,LB培养基(SM 50 μg·mL-1,Kan+ 10 μg· mL-1)上划线培养1天。挑取单菌落PDA培养液(SM 50 μg·mL-1,Kan+ 10 μg·mL-1)中振荡培养1~2天(28 ℃,200 r·min-1)。在IM液体培养基(AS 200 μg·mL-1)中振荡培养6 h,调节OD660值为0.1,0.2,0.3,0.4,0.5,0.6和0.7,分别置于10 mL无菌管中备用。重复3次,取平均值。
3) 不同浓度乙酰丁香酮的准备 在IM液体培养基和共培养培养基中加入100,200,500,1 000 μg·mL-1的乙酰丁香酮,设不加AS的为空白对照。重复3次,取平均值。
4) 最佳共培养条件的筛选 ①不同共培养时间、温度、pH的准备选择3个共培养pH: 5.0,5.5和6.0; 4个共培养时间: 24,48,72和96 h; 4个共培养温度: 22,25,28和31 ℃。重复3次,取平均值。②不同共培养方式的选择2种共培养方式: A.将EHA105菌液和20-7孢子悬浮液等体积混合,28 ℃,140 r·min-1于摇床共培养14 h。将共培养液均匀涂布在含G-418 (800 μg·mL-1)和头孢噻肟钠(200 μg·mL-1)的PDA培养基上,25 ℃培养3~5天。B.混合100 μL EHA105菌液和100 μL 20-7孢子悬浮液(106个·mL-1),混合液均匀涂布在共培养平板上的滤纸片上(预先将滤纸片剪成宽度5 mm左右的条形),25 ℃下避光共培养72 h。将滤纸条揭下,反铺到含G-418(800 μg·mL-1)和头孢噻肟钠(200 μg·mL-1)的PDA培养基上,25 ℃培养48 h。揭下滤纸条,在25 ℃下培养1~2天。
1.4 抗性菌株的筛选 1.4.1 筛选培养及抗性稳定测定挑取选择培养基(PDA)上培养的抗性单菌落,至含有G-418 (800 μg·mL-1)和头孢噻肟钠(200 μg·mL-1)的PDA平板上,于25 ℃恒温培养,进一步筛选。7天后,有孢子产生的转化子进行单孢分离。分离的单孢转接到PDA (G-418 800 μg· mL-1和头孢噻肟钠200 μg·mL-1)上进行3次筛选; 没有孢子产生的转化子,在菌落边缘挑取单根菌丝末端进行分离培养,3天后再次筛选培养。以上步骤中经5次筛选的抗性菌株,转接到含有G-418 (800 μg·mL-1)的PDA斜面培养基上保存。
1.4.2 转化子的PCR检测转化子总DNA提取及农杆菌Ti质粒DNA的碱法小量提取的步骤参照王关林等(1998)。
随机挑选10个转化子(T1-T10)进行PCR验证。引物由上海生工生物工程技术服务有限公司合成,扩增AphⅠ基因所用引物如下,下划线表示ahoⅠ和ClaⅠ酶切位点。
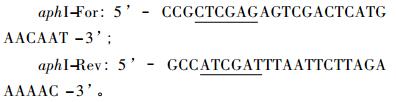
|
PCR扩增体系如下: 10 × buffer (Mg2+) 5 μL,dNTP(2.5 mmol·L-1) 4 μL,Genome DNA 1.5 μL,AphI-For (20 p mol·μL-1) 1 μL,AphI-Rev (20 pmol·μL-1)1 μL,Taq酶(5 U·μL-1)1.5 μL,ddH2O 36 μL。
扩增反应程序: 94 ℃预变性4 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1.5 min,进行30个循环; 最后72 ℃延伸10 min,4 ℃结束; 电泳检查扩增结果,以鉴定T-DNA是否插入到淡紫拟青霉基因组内。
1.5 20-7转化子的生物学特性比较将野生型20-7菌株和分离培养的转化子,用打孔器打成大小相同的菌块接到PDA培养基上,25 ℃培养,菌丝长满培养皿后观察记录。
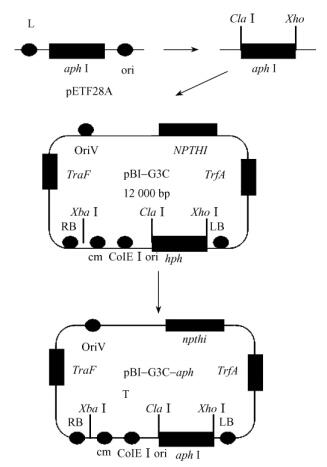
2 结果与分析 2.1 质粒pBI-G3C-aphⅠ的构建质粒pBI-G3C-aphⅠ的构建示意图见图 1,将原有质粒pBI-G3C中的hph基因置换为aphⅠ基因,以用于淡紫拟青霉的遗传转化,G418基因从质粒pETF28A上扩增获得。
|
图 1 载体构建示意 Figure 1 Construction of vectors |
20-7在含不同浓度G-418的PDA培养基上的菌落生长情况见表 1。当G-418浓度达到800 μg·mL-1以上时,已经可以完全抑制淡紫拟青霉20-7菌株的生长。
|
|
分别使用保存了1个月的淡紫拟青霉20-7菌株制成的孢子悬浮液和新鲜菌株制成的孢子悬浮液,同EHA105进行共培养,IM作共培养培养基(pH 5.5),PDA作筛选培养基,AS浓度200 μg·mL-1,G-418的筛选浓度为800 μg·mL-1,在相同的试验条件下进行遗传转化试验,结果表明:新鲜孢子的转化率远远高于保存1个月后的孢子转化率(表 2)。
|
|
用IM作共培养培养基(pH 5.5),PDA作筛选培养基,AS浓度200 μg·mL-1,G-418的筛选浓度为800 μg·mL-1,在相同的试验条件下进行遗传转化试验,试验选用农杆菌菌株EHA105和AGL-1对淡紫拟青霉20-7菌株进行转化。结果表明:不同农杆菌对淡紫拟青霉转化率有明显的影响(表 3)。
|
|
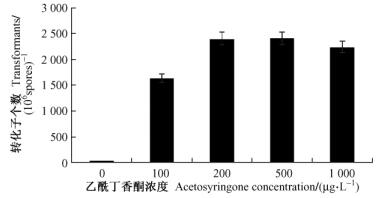
用IM作共培养培养基(pH 5.5),PDA作筛选培养基,G-418的筛选浓度为800 μg·mL-1,没有加AS的处理几乎没有抗G-418的菌落出现,而当AS浓度为200~500 μg·mL-1时,转化效率最高,当AS浓度为1 000 μg·mL-1时,转化效率降低(图 2)。
|
图 2 乙酰丁香酮浓度不同对淡紫拟青霉20-7转化效率的影响 Figure 2 The effect of acetosyringone concentration on transformation frequency of P. lilacinus 20-7 |
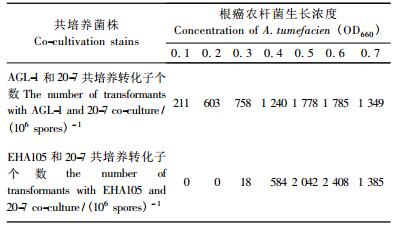
使用不同浓度的根癌农杆菌同淡紫拟青霉20-7菌株共培养得到的转化效率明显不同。2个农杆菌的菌株浓度OD660 = 0.6时转化效率最高,OD660 = 0.5时其次,OD660 < 0.3时转化率明显下降(图 3)。
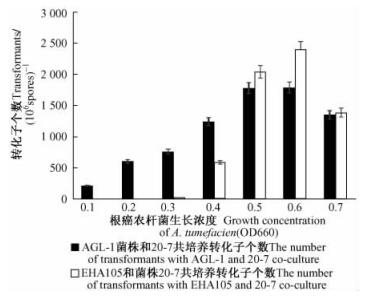
|
图 3 不同农杆菌菌株对淡紫拟青霉转化率的影响 Figure 3 The effect of co-cultivation stains on transformation frequency |
1) 共培养的酸碱度、温度、时间不同对转化效率的影响在相同的试验条件下,共培养条件为使用20-7新鲜菌株孢子悬浮液同EHA105进行共培养,IM作共培养培养基,PDA作筛选培养基,AS浓度200 μg·mL-1,G-418的筛选浓度为800 μg·mL-1,结果显示,共培养培养基的酸碱度、共培养时间和温度都对转化效率有影响。将EHA105菌液和20-7孢子悬浮液涂于滤纸上进行共培养时,酸碱度、共培养时间和温度分别为pH 5.5、25 ℃和72 h时转化效率最高。将EHA105菌液和20-7孢子悬浮液混合振荡共培养时,共培养时间为16 h,酸碱度和温度分别为pH 5.5和25 ℃时转化效率最高(图 4,5)。
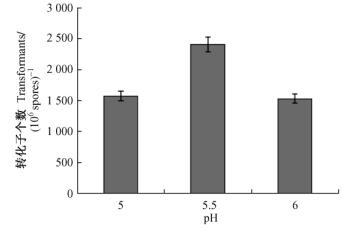
|
图 4 pH值对淡紫拟青霉20-7转化效率的影响 Figure 4 The effect of pH value on transformation frequency of P. lilacinus strain 20-7 |
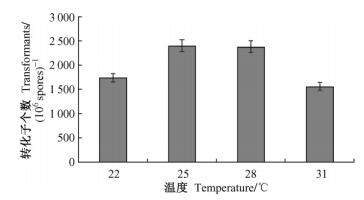
|
图 5 温度对淡紫拟青霉20-7菌株转化效率的影响 Figure 5 The effect of temperature on transformation frequency of P. lilacinus strain 20-7 |
2) 共培养方式对转化效率的影响共培养条件为使用20-7新鲜菌株孢子悬浮液同EHA105进行共培养,IM作共培养培养基(pH 5.5),PDA作筛选培养基,AS浓度200 μmol·L-1,G-418的筛选浓度为800 μg·mL-1。结果显示:共培养方式对转化效率有影响,将EHA105菌液和20-7孢子悬浮液混合振荡培养比将混合液直接涂在滤纸上转化效率高(表 4)。
|
|
含G-418 800 μg·mL-1的PDA上,接种72 h后20-7与T20-7的菌落生长情况: T20-7在筛选培养基上扩展2 cm左右,20-7被G-418抑制。G-418浓度保持不变继续在PDA筛选培养基上继代培养共5代。结果显示: T20-7对G-418的抗性稳定遗传。
2.3.2 PCR检测随机选取100个T20-7菌落,提取其DNA,采用PCR对转化子进行T-DNA插入验证,结果显示从79个抗性菌株中可以扩增出与从质粒pBI-G3C-aphⅠ中扩增条带大小相同的片段,证明G-418基因已整合到20-7转化子的基因组中; 21个没有条带,可能为假阳性,图 6为随机选取的10个T20-7菌落PCR结果。
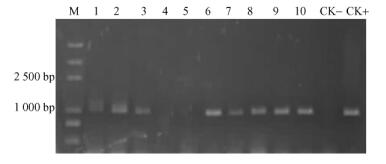
|
图 6 淡紫拟青霉20-7转化子的PCR检测 Figure 6 PCR identification of transformants of P. lilaciuns 泳道从左到右编号1-10分别为转化子T20-7-1,T20-7-2,T20-7-3,T20-7-4,T20-7-5,T20-7-6,T20-7-7,T20-7-8,T20-7-9,T20-7-10; CK + :质粒pBI-G3C-aphⅠ; CK-:野生型20-7; M: 2 kb DNA Marker。 Line 1 to 10 is Transformants T20-7-1, T20-7-2, T20-7-3, T20-7-4, T20-7-5, T20-7-6, T20-7-7, T20-7-8, T20-7-9 and T20-7-10; CK + : plasmid pBI-G3C-aphⅠ as positive control: CK -: P. lilacinus 20-7 as negative control; M: 2kb DNA Marker. |
按照优化后的操作程序,对淡紫拟青霉20-7菌株进行大量遗传转化,转化效率为1 000~2 400个·10-6个分生孢子,从所得的突变体中,随机选出100个经单孢分离并继代筛选表明抗性稳定的突变体,又经PCR检测,证明在基因组中已经插入了G-418抗性基因。
挑选出PCR检测为阳性的菌株,进行培养和观察、记录各种表型特征(表 5)。产孢能力改变:有些突变体产孢量明显降低,如T20-7-1,T20-7-2,T20-7-3;菌落形态改变:部分菌落出现扇变,如T20-7-4,T20-7-5(表 5)。
|
|
影响转化效率的因素主要包括:筛选标记与双元表达载体(Hanif et al., 2002; Godio et al., 2004)、根癌农杆菌菌株(Michieles et al., 2005)、乙酰丁香酮浓度(Michielse et al., 2004)、农杆菌生长浓度、共培养酸碱度(Takahara et al., 2004; Tsuji et al., 2003)、共培养温度(Campoy et al., 2003)、共培养时间(Takahara et al., 2004)、共培养方式。本试验对以上变量都进行了研究,并得到最适合淡紫拟青霉20-7遗传转化的条件。
本研究通过农杆菌介导转化淡紫拟青霉的条件探索,获得淡紫拟青霉20-7菌株遗传转化最佳的参数,包括筛选标记、双元表达载体、根癌农杆菌菌株、根癌农杆菌浓度、淡紫拟青霉分生孢子的新鲜程度、AS浓度、共培养条件等。采用这种遗传转化体系,20-7菌株的转化效率达到1 000~2 400个转化子· 10-6分生孢子,比以前报道的对其他真菌的转化效率更高(dos Reis et al., 2004; Lima et al., 2006; Fang et al., 2006; 赵培静等,2007)。该转化体系的建立,为淡紫拟青霉功能基因组学,尤其是对线虫的致病机制研究奠定了良好的基础。
虽然农杆菌介导的遗传转化已经成功应用于一些真菌(Michieles et al., 2005),但转化效率在不同真菌中差距很大(De Groot et al., 1998)。即使对同一种真菌,筛选标记对抗性菌株的比例也有很大的影响。赵培静等(2007)建立的淡紫拟青霉的遗传转化体系是以膦丝菌素乙酸转移酶(bar)基因作为选择标记,57%的抗性转化子PCR检测为阳性; 而本研究是以大肠杆菌转座子Tn903编码的氨基糖苷磷酸转移酶(G-418)基因作为筛选标记,随机选取100个转化子进行PCR验证,79 %抗性转化子的PCR为阳性,这可能是由于真菌对抗生素的耐药性不同,真菌在培养几代后,就会出现不同的耐药性,因而会出现不同数量的假阳性菌株。试验证明,G-418作为选择标记适合淡紫拟青霉的遗传转化。Hanif等(2002)在转化Suillus bovines时,也出现了类似的结果,当以潮霉素磷酸转移酶(hygromycin B phosphotransferase hph)基因作为筛选标记,全部抗性转化子的PCR均为阳性,而以腐草霉素为选择标记进行转化,抗性克隆中只有73%为PCR阳性,这也许也是由于Suillus bovines对潮霉素和腐草霉素的耐药性存在差异造成的。
表达载体的不同会对转化效率造成很大的影响,据分析这可能是由于质粒的结构和启动子的差异造成的,质粒的结构会影响到农杆菌介导质粒进入真菌细胞的过程(Campoy et al., 2003),而启动子的不同对外源基因的调控可能会出现不同的效果,抗性基因的表达是影响其转化效果的重要因素。据研究试验目的不同选择合适的启动子是成功进行基因表达的关键因素之一。以淡紫拟青霉为例,赵培静等(2007)以pCAMBIA1301为基本骨架构建的双元表达载体pTBAR对淡紫拟青霉的转化效率仅为80~200个·10-6孢子。pCAMBIA1301质粒多用于植物的遗传转化,真菌跟植物的结构存在很大的差异; 而本试验使用的表达载体来源于曾成功用于炭疽菌和稻瘟菌的遗传转化(Sakaguchi et al., 2008)的双元表达载体pBI-G3C,这个载体在转化稻瘟菌时获得了700~1 200个转化子·10-6个孢子的转化效率,这样的转化效率在世界上是比较高的。本研究通过置换pBI-G3C中的抗性基因,构建了适合淡紫拟青霉遗传转化的双元表达载体pBI-G3C-APH,载体的转化效率为1 000~2 400个·10-6孢子。试验证明,以pBI-G3C为基本骨架构建的表达载体更适合淡紫拟青霉的遗传转化。Hanif等(2002)年在转化S.bovines时,也出现过类似的试验结果:利用双元载体pUR5750比利用pBGgHg转化效率高出2倍,用pBG7-1却没有得到转化子。
各种不同的农杆菌菌株都被用于真菌的遗传转化,每一种农杆菌菌株对真菌的转化效率都是不同的; 另外,每一种农杆菌对同一种真菌的不同株系的转化效率也是不同的(Covert et al., 2001; Fitzgerald et al., 2004; Sullivan et al., 2002)。作者通过试验比较,选取了对20-7侵染能力最强的EHA105菌株进行淡紫拟青霉的遗传转化。
表面上看,菌液浓度越大,转化的机会应该越大,所以转化率应该高些,但笔者通过试验证实,事实并非如此。其原因可能是因为菌液浓度过大造成共培养后杀除农杆菌比较困难、农杆菌与淡紫拟青霉抢占营养而造成淡紫拟青霉形成菌落受到阻碍的缘故。通过试验比较,认为OD660值在0.5~0.6范围内为农杆菌的最佳侵染浓度。
采用4天以内的新鲜淡紫拟青霉孢子有助于转化效率的提高。另外,曾有试验证明,使用老的皮炎芽生菌(Blastomyces dermatitidis)菌株进行转化,会降低转化效率(Sullivan et al., 2002)。
试验表明添加AS对淡紫拟青霉20-7的遗传转化是必须的(图 2)。当AS浓度达到200 μg·mL-1时,会得到很高的转化效率。Michielse等(2004)在研究时发现,Aspergillus awamori的遗传转化过程依赖VIR区的表达,VIR区基因表达的蛋白质VirA和VirG在识别像乙酰丁香酮类的酚类信号物质后表现出活性,然后激活整个T-DNA转化机制。
共培养条件是否合适,对ATMT转化的成功与否有着举足轻重的影响,在一定程度上决定着转化效率的高低,共培养的条件主要包括:共培养酸碱度、共培养温度、共培养时间、共培养方式等。本试验表明:共培养最适酸碱度为pH 5.5,其原因可能是微酸性条件有利于激活农杆菌的侵染毒性、促进淡紫拟青霉菌丝生长; 最适温度是25 ℃; 最适时间是72 h,时间过长可能会增加多拷贝插入的机会。
利用上述转化体系进行大规模的淡紫拟青霉转化操作。在所得的突变体中,随机选出100个进行系统分析,获得了5个菌落形态改变的突变体,其中3个为产孢量减少突变体,2个为菌落形态的突变体。这些突变体的获得,有助于克隆淡紫拟青霉致病关键阶段的相关基因和开展分子调控机制的研究,为揭示淡紫拟青霉与植物寄生线虫相互作用的分子机制、培育高效的生物防治品种策略奠定基础。
方卫国, 张永军, 杨星勇, 等. 2002. 根癌农杆菌介导真菌遗传转化的研究进展[J]. 中国生物工程杂志, 22(5): 40-44. |
高学彪, 邓穗儿, 周慧娟, 等. 1998. 淡紫拟青霉MCWAI8菌株对南方根结线虫的奇生和防治作用[J]. 中国生物防治, 4(4): 163-166. |
李芳, 张绍升, 陈家骅. 1998. 淡紫拟青霉对烟草根结线虫的防治效果[J]. 福建农业大学学报, 27(2): 196-199. |
王关林, 方宏筠. 1998. 植物基因工程原理与技术[M]. 北京: 科学出版社.
|
赵培静, 任文彬, 缪承杜, 等. 2007. 根癌农杆菌介导的淡紫拟青霉遗传转化. 中国植物病理学会2007年学术年会论文集.
|
Chen X, Stone M, Schlagnhaufer C, et al. 2000. A fruiting body tissue method for efficient Agrobacterium-mediated transformation of Agaricus bisporus[J]. Appl Environ Microbiol, 66(10): 4510-4513. DOI:10.1128/AEM.66.10.4510-4513.2000 |
Covert S F, Kapoor P, Lee M, et al. 2001. Agrobacterium-mediated transformation of Fusarium circinatum[J]. Mycol Res, 105(3): 259-264. DOI:10.1017/S0953756201003872 |
de Groot M J A, Bundock P, Hooykaas P J J, et al. 1998. Agrobacterium tumefaciens-mediated transformation of filamentous fungi[J]. Nat Biotechnal, 16: 839-842. DOI:10.1038/nbt0998-839 |
dos Reis M C, Pelegrinelli Fungaro M H, Delgado Duarte R T, et al. 2004. Agrobacterium tumefaciens-mediated genetic transformation of the entomopathogenic fungus Beauveria bassiana[J]. J Microbiol Methods, 58(2): 197-202. DOI:10.1016/j.mimet.2004.03.012 |
Fang W, Pei Y, Bidochka M J. 2006. Transformation of Metarhizium anisopliae mediated by Agrobacterium tumefaciens[J]. Can J Microbiol, 52(7): 623-626. DOI:10.1139/w06-014 |
Fitzgerald A, van Kan J A L, Plummer K M. 2004. Simultaneous silencing of multiple genes in the apple scab fungus Venturia inaequalis, by expression of RNA with chimeric inverted repeats[J]. Fungal Genet Biol, 41(10): 963-971. DOI:10.1016/j.fgb.2004.06.006 |
Godio R P, Fouces R, Gudina E J, et al. 2004. Agrobacterium tumefaciens-mediated transformation of the antitumor clavaric acidproducing basidiomycete Hypholoma sublateritium[J]. Curr Genet, 46(5): 287-294. DOI:10.1007/s00294-004-0533-5 |
Hanif M, Pardo A, Gorfer M, et al. 2002. T-DNA transfer and integration in the ectomycorrhizal fungus Suillus bovinus using hygromycin B as a selectable marker[J]. Curr Genet, 41(3): 183-188. DOI:10.1007/s00294-002-0297-8 |
Lima I G P, Duarte R T D, Furlaneto L, et al. 2006. Transformation of the entomopathogenic fungus Paecilomyces fumosoroseus with Agrobacterium tumefaciens[J]. Letters in Applied Microbiology, 42(6): 631-636. |
Jatala P, Kaltenbach R, Bocangel M. 1979. Biological control of Meloidogyne incognita acrita and Globodera pallida on potatoes[J]. Journal of Nematology, 11: 303. |
Jatala P. 1986. Biological control of plant-parasitic nematodes[J]. Annual Review of Phytopathology, 24: 453-489. DOI:10.1146/annurev.py.24.090186.002321 |
Khan M R, Goswarni B K. 2002. Evaluation of Paecilomyces lilacinus isolated against Meloidogyne incognita infecting tomato[J]. International Journal of Nematology, 12(1): 111-114. |
Michielse C B, Hooykaas P J J, van den Hondel C A, et al. 2005. Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J]. Curr Genet, 48(1): 1-17. DOI:10.1007/s00294-005-0578-0 |
Michielse C B, Ram A F J, Hoogkaas P J J, et al. 2004. Role of bacterial virulence proteins in Agrobacterium-mediated transformation of Aspergillus awamori[J]. Fungal Genet Biol, 41(5): 571-578. DOI:10.1016/j.fgb.2004.01.004 |
Park S M, Kim D K. 2004. Transformation of a filamentous fungus Cryphonectria parasitica using Agrobacterium tumefaciens[J]. Biotechnol Bioprocess Eng, 9(3): 217-222. DOI:10.1007/BF02942296 |
Sakaguchi A, Miyaji T, Tsuji G, et al. 2008. Kelch repeat protein clakel2p and calcium signaling control appressorium development in Colletotrichum lagenarium[J]. Eukaryotic Cell, 7(1): 102-111. DOI:10.1128/EC.00227-07 |
Sullivan T D, Rooney P J, Klein B S. 2002. Agrobacterium tumefaciens integrates transfer DNA into single chromosomal sites of dimorphic fungi and yields homokaryotic progeny from multinucleate yeast[J]. Eukaryot Cell, 1(6): 895-905. DOI:10.1128/EC.1.6.895-905.2002 |
Takahara H, Tsuji G, Kubo Y, et al. 2004. Agrobacterium tumefaciens mediated transformation as a tool for random mutagenesis of Colletotrichum trifolii[J]. J Gen Plant Pathol, 70(2): 93-96. DOI:10.1007/s10327-003-0099-y |
Tsuji G, Fujii S, Fujihara N, et al. 2003. Agrobacterium tumefaciens mediated transformation for random insertional mutagenesis in Colletotrichum lagenarium[J]. J Gen Plant Pathol, 69(4): 230-239. DOI:10.1007/s10327-003-0040-4 |
Vijaya Kumari N, Sujathamma P, Savithti G, et al. 2002. Effect of biocontrol agents and Furadon 3G on the juvenile mortality of root knot nematode Meloidogyne incognita[J]. Acta Agricalturae Zhejiangensis, 14(3): 159-162. |
 2010, Vol. 46
2010, Vol. 46