文章信息
- 周玲莉, 姚斌, 向仰州, 尚鹤, 韦秀文, 刘方
- Zhou Lingli, Yao Bin, Xiang Yangzhou, Shang He, Wei Xiuwen, Liu Fang
- 五氯酚胁迫对杨树生长及根际微生物群落的响应特征
- Growth and Microbial Community Characteristics in the Rhizosphere of Poplar in Respond to Pentachlorophenol Stress
- 林业科学, 2011, 46(10): 62-68.
- Scientia Silvae Sinicae, 2011, 46(10): 62-68.
-
文章历史
- 收稿日期:2009-08-12
- 修回日期:2009-11-09
-
作者相关文章
2. 贵州大学资源与环境工程学院 贵阳 550003;
3. 中国林业科学研究院热带林业研究所 广州 510520
2. College of Resource and Environment Engineering, Guizhou University Guiyang 550003;
3. Research Institute of Tropic Forestry, CAF Guangzhou 510520
五氯酚(pentachlorophenol, PCP)是一种高氯有机化合物, 曾在世界范围内广泛应用, 主要用于木材防腐、除草、消毒杀菌和杀灭钉螺(Scelza et al., 2008; Orser et al., 1994)。因其具有稳定的芳香环状结构, 五氯酚在环境介质和生物体内具有难分解、停留时间长及“三致效应”等特点, 被许多国家列为环境优先监测的持久性有机污染物(Middaugh et al., 1994), 是土壤、水体中常见的有毒污染物之一(Wang et al., 1998; 张兵等, 2001)。目前全球已普遍停止使用五氯酚, 但在许多国家和地区的土壤、沉积物、地表水、地下水等环境中仍然检测到五氯酚( U.S.Department of Health and Human Services, 1999), 它可通过食物链放大危害(Ferro et al., 1994), 对人类健康造成严重威胁。通过物理、化学、生物及联合方式修复五氯酚污染备受关注(孙磊等, 2004; Nakamura et al., 2004; 何艳, 2006; 马兆辉等, 2007)。利用植物修复技术清除污染环境中的五氯酚因成本低、易大面积实施、环境风险小等优点而受到广泛关注(熊珺等, 2006; 李振高等, 2008)。
目前关于五氯酚污染的植物修复研究已经取得一定的进展, 国内部分学者利用禾本科和水生植物对五氯酚污染土壤进行模拟修复, 其目标主要集中于根际五氯酚的降解效果, 对根际环境土壤微生物特征的影响研究较少(何艳, 2006; 熊珺等, 2006; 马兆辉等, 2007; 李振高等, 2008)。而利用杨树(Populus)等具有生物量大、生长迅速及根系发达的树木修复材料对有机污染土壤的修复研究鲜见报道。
本文以4个杨树品种作为供试植物材料, 研究不同五氯酚污染浓度对杨树生长及根际微生物特征的影响, 探索五氯酚污染胁迫条件下杨树株高、地径及土壤微生物群落状态与功能变化特征, 以期从多角度为筛选用于五氯酚污染土壤修复的抗性杨树品种提供有益参考。
1 材料与方法 1.1 试验材料供试土壤采自北京昌平区表层0 ~ 15 cm土壤。新鲜土样采集后捡去植物残体分成2部分:一部分直接过2 mm筛, 混合均匀, 供盆栽试验用; 另一部分土样风干后, 研磨过60目筛, 用于土样基本性质的测定及污染母土的制备。供试土壤的基本理化性质:砂粒26.0%, 粉粒24.3%, 粘粒49.7%, 有机碳10.96 g·kg-1, 阳离子交换量(CEC)8.5 cmol·kg-1, pH(H2O)8.46, 水土比为1: 2.5, 全氮4.03 g·kg-1, 全磷(P2O5)4.28 g·kg-1, 全钾15.07 g·kg-1。
五氯酚标准品购于北京迪马公司, 纯度≥98.5%。
用于试验研究的杨树品系共4个, 其中LA08-N26和TN04-N53由中国林业科学研究院苏晓华研究员提供; 黑林1号(HL)由铁岭市林业局刘成志教授级高工提供; 杨树(Populus deltoides × P.nigra, DN34)由美国密苏里-罗拉大学Joel Gerard Burken博士提供。将杨树插条扦插育苗, 选取长势均匀的当年扦插苗用于盆栽试验。
1.2 试验方法将经准确计算称量的五氯酚标准品与甲醇混合均匀后, 参照姚斌等(2005)的方法配制0, 50和100 mg·kg-1共3个浓度系列的五氯酚人工污染土壤。制备好的污染土壤装入规格为16 cm × 30 cm的塑料盆中, 放置于中国林业科学研究院温室。平衡1周后选取健康、个体大小均匀的供试杨树扦插苗植于盆中, 每个处理每次皆重复3盆, 每盆1株。定量浇水至田间持水量75%, 满足植物正常生长需水。以后视土壤干湿度适时定量浇水, 杨树生长期内定期松土, 保水透气。
杨树生长至第60天时测量株高、地径; 同期采集根际土壤。采集方法:去除表面可见的土壤动物和植物残体, 用小铲沿树干基部开始挖去上层覆土, 沿侧根生长方向剪下须根部分, 将其带土取出, 用小刀将距根2 mm以上的土壤轻轻剥离, 抖落其余土壤作为根际土并用小毛刷将不能抖落的沾附在根上的土轻轻刷下迅速过2 mm尼龙网筛, 混合均匀(周文君等, 2005)。将取好的土壤样品置于冰块上运至实验室, 置于4 ℃的冰箱内保存, 取样后48 h内进行Biolog分析和土壤微生物量碳的测定(郑华等, 2007; 李振高等, 2008)。
1.2.1 株高和地径测量杨树株高和地径分别采用卷尺和数显千分尺测量。
1.2.2 土壤微生物生物量碳的测定采用氯仿熏蒸-仪器分析法(李振高等, 2008)。称取新鲜土样(相当于干质量10 g)氯仿熏蒸, 以0.5 mol·L-1 K2SO4提取, 德国Elementar公司Liquic Toc分析仪测定提取液中的有机碳含量。
计算公式:
Bc = Ec/kEc。
式中:Bc单位(mg·kg-1); Ec为熏蒸和未熏蒸土壤的差值; kEc为转换系数, 取值为0.45(Wu et al., 1990)。
1.2.3 Biolog分析Biolog微平板分析法是测定土壤微生物对不同碳源利用能力及其代谢差异, 进而用以表征土壤微生物功能多样性或结构多样性的一种方法(徐华勤等, 2007)。本研究采用Biolog ECO板(Hayward, CA, USA)测试土壤微生物功能多样性。准确称取相当于10.0 g干质量(按含水量换算)的新鲜土样, 加入到装有90 mL无菌水三角瓶中, 封口后在摇床上震荡(200 r·min-1)30 min, 按照10倍稀释法稀释到10-3后, 接种悬浮液于Biolog ECO微孔板中, 每孔150 μL, 每样1板即每样重复3次, 置于25 ℃暗箱连续培养168 h, 期间每隔24 h在Biolog ELX808(Hayward, CA, USA)自动读盘机上利用Microlog3.4.2软件在590 nm波长下读取吸光值(杨永华等, 2000; Garland, 1996)。计算每24 h的平均每孔颜色变化率(average well color develop-ment, AWCD), 选取96 h的数据进行多样性指数的计算和主成分分析。
多样性指数计算方法如下(杨永华等, 2000; Zak et al., 1994):
1) 平均每孔颜色变化率(AWCD), 计算公式为:
AWCD = [Σ(C-R) ]/31。
式中:C为测得31个反应孔的吸光值; R为对照孔的吸光值。
2) Shannon指数(H), 可以表征土壤中微生物群落丰富度, 计算公式为:
H =-Σ PilnPi。
式中:Pi为第i孔相对吸光值(C-R)与所有31孔的吸光值总和的比率。
3) Simpson指数(D), 用于评估土壤中微生物群落优势度, 计算公式为
D = 1-Σ(Pi)2。
式中:Pi为第i孔的相对吸光值与整个平板相对吸光值总和的比率。
4) McIntosh指数(U), 是基于群落物种多维空间距离的多样性指数, 反映土壤中微生物群落均一性,
U =(Σ ni2),
式中:ni是第i孔的相对吸光值。
数据结果分析利用SPSS(V16.0)及DPS统计软件分析。
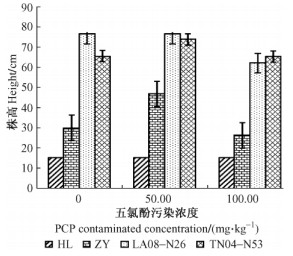
2 结果与分析 2.1 五氯酚胁迫对杨树生长的影响 2.1.1 五氯酚胁迫下杨树株高的变化分析污染胁迫会对植物的生长造成一定程度的影响, 株高是对污染胁迫响应的一个特征指标。如图 1所示:随着PCP浓度的增加, HL和LA08-N26 2种杨树的株高都呈现降低的趋势, 而ZY与TN04-N53在50 mg·kg-1污染处理下的株高与对照相比反而有增加, 100 mg·kg-1处理下略有降低, 这表明PCP 50 mg·kg-1污染浓度对ZY和TN04-N53这2个杨树品种株高有促进作用。4种杨树株高在100 mg·kg-1污染处理下与对照之间差异显著(P < 0.05), 株高下降幅度范围为0.3% ~ 18.8%, 表明五氯酚胁迫对不同的杨树品种的株高生长造成显著的影响。
|
图 1 五氯酚胁迫下杨树株高的变化 Figure 1 The variety of poplars' height under pentachlorophenol excess |
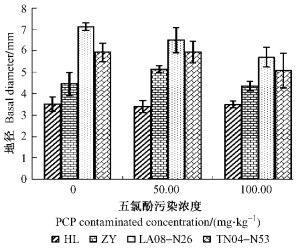
植物地径是表征植物生长性状的重要指标之一。如图 2所示:不同的PCP污染条件下, 4种供试杨树的地径存在明显的差异。随着PCP浓度的增加, 4种杨树的地径值出现不同程度的变化。在3个处理下HL地径的变化微乎其微; 在50 mg·kg-1处理下, ZY和TN04-N53的地径大于对照, 而100 mg·kg-1处理下小于对照。方差分析显示:各杨树品种地径在100 mg·kg-1处理下与对照差异显著(P < 0.05), 与对照相比, 4种杨树地径降幅范围为0.6% ~ 19.9%, 其中降幅LA08-N26 > TN04-N53 > ZY > HL。由此可见:低浓度的PCP污染对某些品种的杨树地径有促进作用, 而高浓度的PCP污染导致杨树地径生长受到明显抑制, 因此五氯酚胁迫对杨树的地径生长产生显著影响。
|
图 2 五氯酚胁迫下杨树地径的变化 Figure 2 The variety of poplars' basal diameter under pentachlorophenol excess |
相同污染条件下, 不同杨树品种间会存在生长差异, 其原因是多方面的, 如自身对养分的吸收能力、对污染物的迁移转化能力、不同的根系环境等。本试验中不同PCP污染浓度导致的试验结果差异, 可能是五氯酚污染导致不同杨树品种间根际环境特征产生变化, 从而导致杨树株高、地径等生长性状产生表观差异。因而, 进一步研究杨树根际微生物特征的变化成为必然。
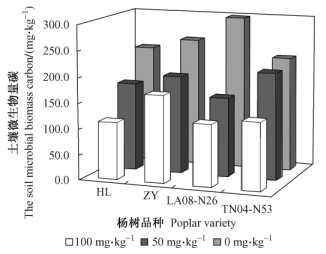
2.2 根际微生物特性 2.2.1 五氯酚胁迫对杨树根际微生物量碳的影响土壤微生物量碳是指土壤中所有活微生物体中碳的总量, 是反映土壤微生物量和土壤微生物整体活性的重要微生物学指标(徐秋芳等, 2007; 李振高等, 2008)。不同PCP污染浓度胁迫下, 4个杨树品系根际土壤微生物量碳的测定结果见图 3, 随着土壤中PCP浓度的增加, 土壤微生物生物量碳总体呈明显的下降趋势。方差分析显示:50与100 mg·kg-1污染处理与对照的土壤微生物量碳均存在显著差异(P < 0.05)。
|
图 3 五氯酚胁迫下杨树根际微生物量碳的变化 Figure 3 The variety of poplars' rhizosphere microbial biomass carbon under pentachlorophenol excess |
在相同PCP污染浓度下, 各杨树根际土壤的微生物量碳也存在明显的差异。PCP污染浓度为50 mg·kg-1时, 杨树根际土壤微生物量碳的平均下降比率排序为:LA08-N26 > HL > ZY > TN04-N53, 降幅分别为48.24%, 25.75%, 23.58%和6.26%;而当PCP污染浓度为100 mg·kg-1时, 杨树根际土壤微生物量碳的平均下降排序为:LA08-N26 > HL > TN04-N53 > ZY, 降幅分别为59.56%, 51.54%, 40.83%和32.02%, 且均差异显著(P < 0.05)。
目前已有研究表明:土壤微生物生物量随着除草剂施用量的增加而降低, 尤其是高浓度的除草剂会显著抑制微生物的活性, 但也有一些除草剂并不影响或增加土壤微生物的生物量(Wardle et al., 1992; 张超兰等, 2001)。黄耀蓉等(1999)和吴坤等(2004)的研究表明:五氯酚的施入对土壤细菌和好气性自生固氮菌表现出较强的刺激作用, 而放线菌和霉菌却受到强烈抑制。据此推断, 导致本试验中4种供试杨树品种根际微生物量碳产生不同变化的原因可能是PCP进入土壤后, 对根际土壤微生物数量和种群造成一定程度的影响, 降低微生物的总体活性, 从而导致微生物量碳的测定结果出现明显差异, 这与高创新(2008)的研究结果相似。
2.2.2 Biolog结果分析1) 平均每孔颜色变化率(AWCD) Biolog 法能快速简便分析微生物对碳源的利用能力(Preston-Mafham et al., 2002; 姚斌等, 2004), AWCD的变化是反映土壤微生物群落功能多样性的一个重要指标(杨永华等, 2000)。
不同杨树品系在PCP污染胁迫下, 根际土壤微生物的 AWCD 值见图 4。AWCD 值随培养时间的延长而提高, 方差分析显示:100 mg·kg-1污染处理与对照的 AWCD 值差异显著(P < 0.05)。在整个培养期间内, PCP污染浓度为50和100 mg·kg-1时的 AWCD 值始终大于对照处理, 表明一定浓度范围内的PCP污染处理对杨树根际土壤微生物某些菌种产生一定的刺激作用, 这与黄耀蓉等(1999)、吴坤等(2004)的试验结果相似。另有研究表明:在一种类的有机污染土壤上种植植物, 如烟草(Nicotiana)和龙葵(Solanum nigrum)会显著增加土壤细菌总数(Hartmann et al., 2005)。
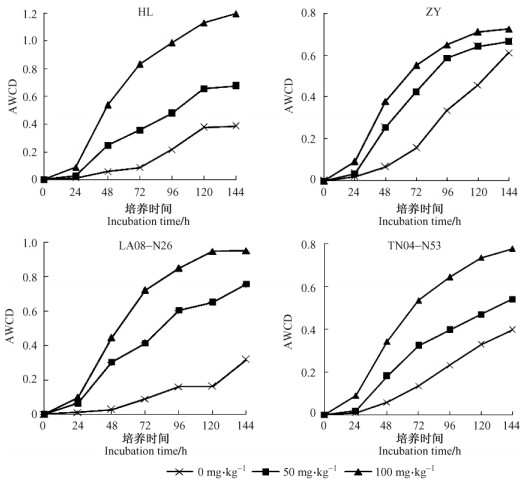
|
图 4 五氯酚胁迫下杨树根际微生物的AWCD值变化 Figure 4 The variety of AWCD for poplars' rhizosphere microbial under pentachlorophenol excess |
4个品系的杨树根际土壤微生物的 AWCD 值都呈现从24 h开始急剧上升、96 h以后增长速度变缓的趋势。这可能是在五氯酚污染影响下, 培养前期能够利用 Biolog ECO 盘内碳源的微生物数量增加, 微生物的活性较强, 其碳源利用程度增加, 从而导致 AWCD 值上升较快; 培养后期由于能利用的碳源逐渐消耗殆尽, AWCD 值增长速度变缓, 其值也就逐渐达到平衡。
相同污染水平下不同品系杨树之间根际土壤微生物群落碳源利用代谢存在差异。100 mg·kg-1浓度胁迫下, AWCD值总体呈现HL > LA08-N26 > TN04-N53 > ZY, 其原因可能是由于不同杨树品种根系分泌物不同, 使得根际土壤的碳源有效性产生差异, 影响微生物特定群落的生长繁殖, 造成树种之间根际环境微生物群落结构上的差异; 当然还可能与微生物群落随时间的变化有关系。相关研究表明:根系分泌物是植物根系影响土壤微生物种群的主要因素(信欣等, 2003; 腾应等, 2004; 罗虹等, 2005)。植物通过根系向周围环境释放有机分泌物如糖类、磷酸和蛋白质等(Shanks et al., 1999), 这些分泌物是土壤微生物的重要碳源和能源, 因此从理论上讲植物根系的一些变化会引起土壤微生物尤其是根际微生物发生变化。目前已有研究表明具有发达根系的植物能够促进根系微生物菌群对除草剂、杀虫剂等有机污染物的吸附和降解(Anderson et al., 1993)。
2) 杨树根际土壤微生物群落碳源利用的主成分分析利用主成分分析(principal component analysis, PCA) 研究土壤微生物对不同碳源利用能力的差异, 有助于更全面地了解微生物群落代谢功能特性。本研究采用3个处理下96 h吸光值进行主成分分析。
如图 5所示, 从31种因子中提取2个主成分因子, PC1和PC2分别解释了所有变量方差的41.6%和11.3%。PC1轴上, 100和50 mg·kg-1 PCP污染处理与对照处理的得分值可以完全区分开来, 这表明PCP污染处理对杨树根际微生物的碳源利用有明显差异, 说明PCP进入土壤, 影响杨树根际碳源, 增强根际土壤微域内特定微生物群落的生理代谢活性, 从而与对照形成鲜明对比。

|
图 5 五氯酚胁迫下杨树根际微生物碳源利用的主成分分析 Figure 5 Principal components analysis of carbon utilization profiles for poplars' rhizosphere microbial under pentachlorophenol excess |
3) 五氯酚胁迫下杨树根际微生物多样性指数比较分析 本文计算样品96 h时4种杨树土壤微生物群落的 Shannon, Simpson 和 McIntosh 指数, 计算结果见表 1。杨树品系HL对照与污染处理的 Shannon 指数差异显著, 表明PCP污染胁迫对HL根际微生物群落的丰富度有明显影响, 污染处理的群落丰富度大于对照。杨树品系HL对照处理的 Simpson 指数与2个污染处理的 Simpson 指数之间差异显著, 可能的原因是PCP刺激了该品种杨树根际土壤微生物群落中某些优势种群的生长, 随着浓度的增加, PCP对这些优势种群的刺激作用增强, Simpson 指数逐渐增大。其他3个杨树品系各PCP浓度处理的 Simpson 指数均大于对照, 但与对照没有明显差异, 表明PCP对其根际土壤微生物的群落的刺激作用不明显。计算结果表明:在3个处理下, 4种杨树根际微生物的 McIntosh 指数均没有显著差异, 表明PCP对杨树根际土壤微生物物种均一性没有太大影响。
|
|
有研究结果表明:在重金属和有机物污染条件下上述3个指数会随着污染物浓度增高而逐渐降低(腾应等, 2003; 申卫收等, 2008; 向月琴等, 2008), 这与本试验的结果相反。由此可知:在污染土壤中, 微生物种群的变化并非遵循统一规律, 这可能与供试的土壤类型以及污染物种类不同等因素有关, 具体原因还需要进一步细化研究。另外方差分析结果表明:同污染浓度下, 杨树品种间指数差异不显著, 这说明不同的杨树品种对微生物的多样性和均匀度没有显著影响。
3 结论1) 植物株高和地径是表征植株响应污染胁迫的重要指标, 本研究表明五氯酚污染胁迫对杨树的株高和地径生长都造成显著影响, 在100 mg·kg-1处理下与对照相比, 杨树株高和地径都出现不同程度的降低, 但是杨树品种之间并没有出现规律性的变化, 因此, 就生物性状而言, 要筛选出耐受性的杨树品种是需要进一步的观测和深入研究。
2) 五氯酚进入土壤, 对根际土壤微生物数量和种群造成一定程度的影响, 降低了土壤微生物的总体活性, 从而导致土壤微生物量碳随五氯酚污染浓度的上升出现明显下降的趋势。
3) Biolog测定结果显示:五氯酚污染土壤处理的AWCD值始终大于对照土壤, 而且主成分分析结果也显示五氯酚污染处理对杨树根微生物的碳源利用造成显著影响, 初步判断一定浓度范围的五氯酚污染可能有利于增强根际土壤微域内特定微生物群落的生理代谢活性, 从而增加微生物的碳源利用程度。
4) 杨树根际土壤微生物群落的Shannon指数, Simpson指数和McIntosh指数均高于对照, 微生物的群落的丰富度、均匀度和优势度得到增强, 并且PCP对土壤微生物的刺激作用随浓度的增加而增强。
高创新. 2008. 五氯酚污染土壤的水生植物修复研究. 华中师范大学硕士学位论文, 38-42. http://cdmd.cnki.com.cn/Article/CDMD-10511-2008114880.htm
|
何艳. 2006. 五氯酚的水土界面行为及其在毫米级根际微域中的消减作用[J]. 浙江大学博士学位论文: 85-95. |
黄耀蓉, 李登煜, 张小平. 1999. 五氯酚钠污染土壤的微生物活性及优势菌群研究[J]. 西南农业学报, (12): 39-44. |
李振高, 骆永明, 腾应. 2008. 土壤与环境微生物研究法[M]. 北京: 科学出版社: 325-326.
|
罗虹, 刘鹏, 李丽仙. 2005. 铝胁迫对大豆根际土壤微生物区系的影响[J]. 土壤通报, 36(5): 735-738. |
马兆辉, 何艳, 徐建民. 2007. 根际修复中五氯酚耐性草种的筛选及其应用效果研究[J]. 土壤通报, 38(2): 365-368. |
申卫收, 林先贵, 张华勇. 2008. 不同施肥处理下蔬菜塑料大棚土壤微生物活性及功能多样性[J]. 生态学报, 28(6): 2682-2689. |
孙磊, 蒋新, 周健民, 等. 2004. 五氯酚污染土壤的热修复初探[J]. 土壤学报, 41(3): 462-465. DOI:10.11766/trxb200305120321 |
腾应, 黄昌勇, 龙建. 2003. 复垦红壤中牧草根际微生物群落功能多样性[J]. 中国环境科学, 23(3): 295-299. |
滕应, 黄昌勇, 骆永明. 2004. 铅锌银尾矿区土壤微生物活性及其群落功能多样性研究[J]. 土壤学报, 41(1): 113-119. DOI:10.11766/trxb200209100119 |
吴坤, 刘娜, 贾新成. 2004. 五氯酚对土壤微生物数量及酶活性的影响[J]. 河南农业大学学报, 38(2): 207-210. |
信欣, 蔡鹤生. 2003. 农药污染土壤的植物修复研究[J]. 植物保护, 30(1): 8-11. |
向月琴, 高春明, 庞国辉, 等. 2008. 土壤中多菌灵的降解动态及其对土壤微生物群落多样性的影响[J]. 土壤学报, 45(4): 699-704. |
熊珺, 高创新, 袁恒, 等. 2006. 水葱对五氯酚污染土壤植物修复的初步研究[J]. 农业环境科学学报, 25(6): 1493-1497. |
徐秋芳, 姜培坤, 邬奇峰, 等. 2007. 集约经营板栗林土壤微生物量碳与微生物多样性研究[J]. 林业科学, 43(3): 15-19. |
徐华勤, 肖润林, 邹冬生, 等. 2007. 长期施肥对茶园土壤微生物群落功能多样性的影响[J]. 生态学报, 27(8): 3355-3362. |
杨永华, 姚健, 华晓梅. 2000. 农药污染对土壤微生物群落功能多样性的影响[J]. 微生物学杂志, 20(3): 23-47. |
姚斌, 徐建民, 尚鹤. 2005. 阿特拉津污染土壤的微生物特征研究[J]. 水土保持学报, 19(3): 46-49. |
姚斌, 徐建民, 张超兰. 2004. 甲磺隆对土壤微生物多样性的影响[J]. 土壤学报, 42(1): 320-322. |
张兵, 邦明辉, 刘艽岩, 等. 2001. 五氯酚在洞庭湖环境介质中的分布[J]. 中国环境科学, 21(2): 165-167. |
张超兰, 徐建民, 姚斌. 2001. 阿特拉津污染胁迫下土壤微生物生物量对外源有机物质的响应[J]. 土壤学报, 41(2): 40-43. |
郑华, 陈法霖, 欧阳志云. 2007. 不同森林土壤微生物群落对BiologGN板碳源的利用[J]. 环境科学, 28(5): 1126-1131. |
周文君, 沈有信, 刘文耀. 2005. 滇中云南松根际土与非根际土磷的有效性[J]. 中南林学院学报, 25(3): 25-29. |
Anderson T A, Guthrie E A, Walton B T. 1993. Bioremediation in the rhizosphere[J]. Environ Sci Technol, 27(13): 2630-2636. DOI:10.1021/es00049a001 |
Ferro A M, Sims R C, Bugbee B. 1994. Hycrest crested wheatgrass accelerates the degradation of pentachlorophenol in soil[J]. J Environ Qual, 23(2): 272-279. |
Garland J L. 1996. Patterns of potential C source utilization by rhizosphere communities[J]. Soil Biology and Biochemistry, 28(2): 223-230. DOI:10.1016/0038-0717(95)00113-1 |
Hartmann A, Schmid M, Wenzel W, et al.2005.Rhizosphere 2004-perspectives and challenges─ a tribute to Lorenz Hiltner.Munich, Germany:GSF-National Research Center for Environment and Health. https://link.springer.com/article/10.1007/s11104-009-0063-5
|
Middaugh D P, Thomas R L, Lantz S E, et al. 1994. Field-scale testing of a hyperfiltration unit for removal of creosote and pentachlorophenol from ground water:chemical and biological assessment[J]. Arch Environ Contam Toxicol, 26(3): 309-319. |
Nakamura T, Motoyama T, Suznki Y, et al. 2004. Biotransformation of pentachlorophenol by Chinese chive and a recombinant derivative of its rhizosphere-competent microorganism, Pseudomonas gladioli M-2196[J]. Soil Biology and Biochemistry, 36(5): 787-795. DOI:10.1016/j.soilbio.2004.01.006 |
Orser C S, Lange C C. 1994. Molecular analysis of pentachlorophenol degradation[J]. Biodegradation, 5(3-4): 277-288. DOI:10.1007/BF00696465 |
Preston-Mafham J, Boddy L, Randerson P F. 2002. Analysis of microbial community functional diversity using sole-carbon-source utilization profile—a critique[J]. FEMS Microbiology Ecology, 42(1): 1-14. |
Scelza R, Rao M A, Gianfreda L. 2008. Response of an agricultural soil to pentachlorophenol(PCP) contamination and the addition of compost or dissolved organic matter[J]. Soil Biology and Biochemistry, 40(9): 2162-2169. DOI:10.1016/j.soilbio.2008.05.005 |
Shanks V, Morgan J. 1999. Plant 'hairy root'culture[J]. Current Opinion in Biotechnology, 10(2): 151-155. DOI:10.1016/S0958-1669(99)80026-3 |
U.S.Department of Health and Human Services. 1999. Pubilc health service, agency for toxics substance and disease registry.toxicological profile for pentachlorophenol.[J]. Atlanta, Georgia, 8. |
Wang P, Woodward C A, Kaufman E N. 1998. Poly(ethylene glycol)-modified ligninase enhances pentachlorophenol biodegradation in water-solvent mixtures[J]. Biotechnology and Bioengineering, 64(3): 290-297. |
Wardle D A, Parkinson D. 1992. Influence of the herbicides 2, 4-D and glyphosate on soil microbial biomass and activity:a field experiment[J]. Soil Biology and Biochemistry, 24(2): 185-186. DOI:10.1016/0038-0717(92)90277-5 |
Wu J, Joergensen R G, Pommerening B, et al. 1990. Measurement of soil microbial biomass C by fumigation-extraction-an automated procedure[J]. Soil Biology and Biochemistry, 22(8): 1167-1169. DOI:10.1016/0038-0717(90)90046-3 |
Zak J C, Willig M R, Moorhead D L, et al. 1994. Functional diversity of microbial communities:a quantitive approach[J]. Soil Biology and Biochemistry, 26(9): 1101-1108. DOI:10.1016/0038-0717(94)90131-7 |
 2011, Vol. 46
2011, Vol. 46