文章信息
- 耿慧, 沈红香, 姚允聪, 田佶, 宋婷婷
- Geng Hui, Shen Hongxiang, Yao Yuncong, Tian Ji, Song Tingting
- 苹果属观赏海棠McCHI基因的克隆及不同叶色品种间表达差异分析
- Cloning of McCHI Gene of Malus Crabapple and Its Expression Analysis in the Cultivars with Different Type Foliar Color
- 林业科学, 2010, 46(10): 42-49.
- Scientia Silvae Sinicae, 2010, 46(10): 42-49.
-
文章历史
- 收稿日期:2009-08-24
- 修回日期:2009-09-24
-
作者相关文章
蔷薇科(Rosaceae)苹果属(Malus)观赏海棠(Malus crabapple), 是由起源于中国的山荆子(M. baccata)、多花海棠(M.floribunda)、海棠花(M. spectabilis)等和起源于北美的奥涅海棠(M.fusca)、草原海棠(M.ioensis)、野香海棠(M.coronaria)等为亲本选育而成。其树形紧凑、叶花果色彩多样、部分品种冬果宿存, 抗逆性强, 是一类极具观赏价值的园林植物资源, 其叶色有绿色类、新叶有色类和常色紫叶类3大类品种资源。研究表明, 植物的色泽发育和植物类黄酮代谢及花青素合成紧密相关(韩科厅等, 2008)。查尔酮异构酶(chalcone isomerase, CHI)是类黄酮代谢途径中继查尔酮合成酶(chalcone sythase, CHS)后的第2个关键酶, 它催化黄色的苯基苯乙烯酮(benzylideneacetophenone)转变成无色的黄烷酮(flavanone), 进而衍生出该途径中所有的类黄酮化合物。Mehdy等(1987)采用抗体技术从法国豌豆(Vicia narbonensis)中分离出CHI基因。van Tunen等(1988)以相同的方法在矮牵牛(Petunia hybrida)中得到CHI。后来, 研究者用同源克隆的方法相继在拟南芥(Arabidopsis thaliana)、菜豆(Phaseolus vulgaris)(Wood et al., 1994)、苜蓿(Medicago sativa)、翠菊(Callistephus chinensis)、橙(Citrus sinensis)、烟草(Nicotiana tabacum)和玉米(Zea mays)等多种植物中克隆得到该基因的全长序列, 并对其结构特征和表达特性进行了研究(吴冰等, 2008)。然而, 在多色型观赏海棠植物中还未见到该基因的相关报道。本文在克隆获得苹果属观赏海棠叶片查尔酮合成酶(McCHS)、黄烷酮3 –羟化酶(McF3H)和花色素合成酶(McANS)基因的基础上(GenBank登陆号分别为:FJ817485, FJ817486和FJ817488), 拟从常色紫叶类品种‘王族’(M. ‘Royalty’)中克隆获得查尔酮异构酶基因, 并对该基因及其编码蛋白序列进行分析, 同时, 采用实时荧光定量PCR技术和分光光度计技术分别对不同叶色类型品种叶片中查尔酮异构酶基因表达量和花色苷含量进行检测和分析, 以期为苹果属观赏海棠叶色形成的分子机制研究提供理论基础。
1 材料与方法 1.1 试验材料以苹果属观赏海棠品种中具有典型叶色的4个品种为试验材料, 叶片为绿色类的‘火焰’(M. ‘Flame’); 幼叶红色、功能叶为绿色的新叶有色类‘绚丽’(M.‘Radiant ’)和‘高原之火’(M. ‘Prairifire’); 叶片为紫色的常色叶类‘王族’。这4个品种均是从美国直接引进的品种, 其亲本不详。于2008年春季, 选取树势和生长势相似的植株, 采枝条顶端萌芽后7天的幼叶和枝条5—6节处萌芽50天的功能叶, 液氮速冻后, -80 ℃条件下保存备用。
1.2 总RNA的提取及cDNA第1链的合成用改良热硼酸法(陆旺金等, 2003)提取‘王族’幼叶总RNA, 以提取的总RNA为模板, 利用Clontech SMARTTM Library试剂盒(购自Clontech生物有限公司)合成3’RACE和5’RACE cDNA第1链。采用CTAB法(Williamson et al., 1994)提取‘王族’叶片总DNA。
1.3 观赏海棠McCHI基因序列的克隆以上述提取得到的‘王族’叶片cDNA为模板, 根据Genbank上登录的近缘植物查尔酮异构酶基因保守区段序列, 设计3’端引物CHIP1:CACCGGG YGCCTCTATTCT, 扩增McCHI基因的3’端序列; 设计5 ’端引物CHIP2:CATTTACACCCGTTCAATA GTTG, 扩增McCHI基因的5’端序列。UPM通用引物由RACE试剂盒提供, 根据试剂盒说明, 转录产物的3’末端用CHIF3和UPM引物扩增, 其PCR反应条件为:94 ℃预变性5 min; 94 ℃变性1 min, 55 ℃退火30 s, 72 ℃延伸2 min, 30个循环; 72 ℃延伸5 min。转录产物的5’末端使用CHIR3和UPM引物扩增, 其PCR反应条件为:94 ℃预变性5 min; 94 ℃变性1 min, 55 ℃退火30 s, 72 ℃延伸1 min, 30个循环; 72 ℃延伸5 min。PCR产物经回收、纯化, 与pMD19-T Vector(购自宝生物工程公司)连接, 转化DH5α感受态细胞, 蓝白斑筛选后测序(上海生工生物工程技术服务有限公司)。用DNAMAN5.2.2软件拼接以上序列得到苹果属观赏海棠查尔酮异构酶基因全长cDNA序列。
1.4 观赏海棠McCHI基因cDNA和DNA全长序列的获得设计全长引物CHIF:ATGGCTCCACCACCAT CGCT和CHIR:TCATTTACACCCGTTCAATAGTTG GG, 以上述提取得到的‘王族’叶片cDNA和DNA为模板, 扩增查尔酮异构酶基因的全长序列(McKhann et al., 1994)。PCR反应条件为:94 ℃预变性5 min; 94 ℃变性1 min, 61 ℃退火30 s, 72 ℃延伸2 min, 30个循环; 72 ℃延伸5 min。PCR产物经回收、纯化, 与pMD19-T Vector(购自宝生物工程公司)连接, 转化DH5α感受态细胞, 蓝白斑筛选后测序(上海生工生物工程技术服务有限公司)。
1.5 实时荧光定量PCR分析分别提取‘绚丽’、‘火焰’、‘高原之火’、‘王族’4个品种的幼叶和功能叶RNA(陆旺金等, 2003), 使用M-MuLV First cDNA Synthesis Kit(购自Promega公司)合成第1链cDNA备用。
按照Real Master Mix(SYBR Green) PCR试剂盒(购自天根生化科技有限公司)操作指南, 采用实时荧光定量PCR(real-time quantitative PCR, RTqPCR)的方法, 检测基因的相对表达量。扩增目标基因McCHI引物为CHI-F:CCGTTCAATAGTTG GGATAA和CHI-R:TCCTAAAGGATCACTCACG, 预测产物长度是181 bp; 以Malus domestica 18S ribosomal RNA基因(GenBank序列号:DQ341382)作为内参基因, 其引物18SR-F:ACACGGGGAGG TAGTGACAA和18SR-R:CCTCCAATGGATCCTC GTTA, 预测产物长度是80 bp。
对反转录所得的cDNA按体积分别进行5个梯度稀释(1, 1/10, 1/100, 1/1 000, 1/10 000), 实施荧光定量反应, 然后绘制相对标准曲线。McCHI基因RT-qPCR扩增的反应体系为20 μL, 包括:9 μL Real Master Mix混合液, 2 μL cDNA, 1 μL F3H-F(10 μmol·L-1), 1 μL F3H-R(10 μmol·L-1), 7 μL ddH 2 O。反应程序为:94 ℃预变性2 min; 94 ℃变性20 s, 50 ℃退火30 s, 72 ℃延伸30 s, 40次循环, 每次循环第3步进行荧光采集; 最后95 ℃变性1 min, 退火至55 ℃(每隔10 s上升0.15 ℃)后保温1 min。接着检测其荧光值, 绘制熔点曲线。内参基因的18S rRNA PCR扩增的反应体系为20 μL, 包括:9 μL Real Master Mix混合液, 2 μL cDNA, 1 μL 18SR-F(10 μmol·L-1), 1 μL 18SR-R(10 μmol· L-1), 7 μL ddH2O。其反应程序同McCHI基因的反应程序相同。标准品cDNA和待测样品均设置3次重复。
1.6 花色苷含量测定花色苷相对含量的提取根据何亦昆等(1995)的方法略有改动。称取1.0 g叶片剪碎(2 ~ 3 mm), 置于50 mL离心管中, 加入10 mL 1 ℅的盐酸甲醇, 常温下浸泡20 h。取上清液, 以提取液作空白, 采用UNICO UV-2100型紫外可见分光光度计在530 nm处测定吸光度。以每克鲜质量叶片的提取液的光密度变化值OD530 = 0.1作为1个花色苷单位。
2 结果与分析 2.1 McCHI基因的克隆与序列比较依据得到的保守片断设计5 ’和3 ’末端的RACE引物。用引物对UPM/CHIP2进行McCHI的5’末端的扩增反应, 在琼脂糖凝胶电泳中显现出300 bp和550 bp左右2条目的条带(图 1A, 右), 将550 bp左右的条带回收、测序, 获得1条CHI的5’ cDNA末端。5′端RACE出现长度多态性现象主要是由于转录起始位点多态性造成的。用引物UPM/ CHIP1进行McCHI的3 ’末端扩增, 获得1条约300 bp的带(图 1A, 左), 克隆入T-载体, 挑选6个长度有代表性单克隆测序, 获得到1条CHI的3’ cDNA末端。以上述片断进行Blast分析, 确认其与其他植物CHI基因同源。根据3’RACE和5’RACE测序结果拼读出苹果属观赏海棠查尔酮异构酶基因, 全长序列为660 bp, 命名该基因为McCHI (登陆号FJ817485)。

|
图 1 McCHI基因的扩增结果及结构分析 Figure 1 The PCR results and structure analysis of McCHI A. McCHI基因的3’RACE和5’RACE PCR扩增结果; B. McCHI基因cDNA和DNA全长PCR扩增结果; C. McCHI基因DNA序列的结构。 A.The PCR results of 3'RACE and 5'RACE for McCHI; B.The PCR results of cDNA and DNA full length for McCHI; C.The DNA sequence structure of McCHI. |
基因组扩增得到约1 200 bp的条带, 拼接后得到全长序列1 180 bp(图 1B)。分析发现, McCHI存在3个内含子, 结果与大多数物种一致(图 1C)。将起始密码子ATG定义为+ 1位, 分别位于+ 107 bp ~ + 210 bp(内含子1), + 376 ~ + 704 bp (内含子2), + 929 ~ + 1 009 bp(内含子3)。内含子-外显子边界均符合“GT-AG”规则。第1个内含子中没有任何重复序列; 第2个内含子中存在4个直接重复序列和1个镜像重复序列; 第3个内含子同样没有任何重复序列, 但是第3个内含子与大豆(Glycine max)的内含子有较高的同源性, 而其他内含子却保持了较高的物种特异性。
对该基因的序列进行分析表明, 其含有1个编码219个氨基酸的完整阅读框架, 包括起始密码子和终止密码子。利用DNAMAN5.2.2软件, 对McCHI编码的氨基酸序列分析, 认为该基因具有起始密码子(ATG)和终止密码子(TGA), 是苹果属观赏海棠查尔酮异构酶基因的ORF序列(图 2)。

|
图 2 苹果属观赏海棠McCHI基因cDNA的核苷酸序列及推测的氨基酸序列 Figure 2 The complete cDNA sequence of McCHI and its predicted amino acid sequence 起始密码子和终止密码子用下划线表示, 阴影和黑框表示保守域。 The translation start codon and the stop codon are indicated in underline; The shadow and black box are functional domain. |
根据InterProScan和SMART在线软件对编码氨基酸分子量、编码蛋白的结构域和功能位点进行分析表明, McCHI ORF编码的219个氨基酸(pI5.55)的分子量约为23.4 ku, 其编码的蛋白具有典型的CHI蛋白保守结构域:第1个是生物素和维生素B1合成相关结构域(从Ser79到Pro148)。生物素合成酶是一种同型二聚体, 能促进生物素生物合成途径中的最后一步反应, 而硫胺素合成同样是一个复杂的过程, 涉及ThiFSGH、ThiI和ThiJ等6个基因产物。推测这2种反应可能由共同因素制约, 在CHI的这一相关结构域可能参与共同影响因子结合或二聚作用。第2个是染色体结合区域(从Asn182到Leu215), 发现这一区域是不同的核蛋白质参与染色体组织活动的DNA结合结构域。第3个是螺旋-发夹-螺旋DNA结合区域(从Glu191到Arg210), 该区域是原核和真核非序列特异性DNA结合蛋白中的1个约20个氨基酸结构域, 尽管氨基酸序列相似, 但其螺旋结构是不同。螺旋-发夹-螺旋结构之间的差异也反映在这一结构域的功能级别上, 其不同点可能主要表现在基因调控蛋白与DNA序列结合的具体方式上。
用SOPMA对McCHI蛋白的二级结构预测表明, McCHI蛋白也主要由α-螺旋(α-helix)、随机卷曲(random coil)、β-转角(β-turn)和延伸链(extended strand)组成(图 3)。在二级结构中, α-螺旋均匀分布于蛋白的中部和C-端。McCHI蛋白由43.38%的α-螺旋、20.55%的延伸链、6.85%的β-转角和29.22%的随机卷曲组成。而已知结构和功能的葡萄(Vitis vinifera) CHI蛋白VvCHI的二级结构(SOPMA显示)由44.87%的α-螺旋、20.51%的延伸链、6.84%的β-转角和27.78%的随机卷曲组成。由此可见, McCHI与VvCHI蛋白的二级结构十分类似。
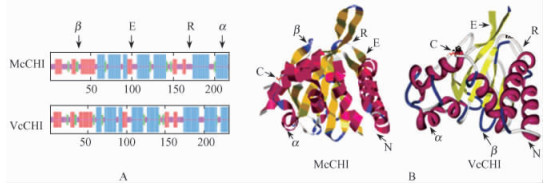
|
图 3 McCHI蛋白结构 Figure 3 The protein structure of McCHI α:α-螺旋α-helix; β:β-转角β-turn; E:延伸链Extended strand; R:随机卷曲Random coil; , C:碳终端C-termination; N:氮终端Ntermination.A.预测的McCHI和VvCHI二级结构:α-螺旋、延伸链、β-转角和随机卷曲在图中分别用长、中长、短和最短竖线表示。B.预测的McCHI蛋白三级结构和VvCHI蛋白结构:α-螺旋、β-转角、随机卷曲、延伸链分别用红色、蓝色、灰色、黄色表示。 A.Secondary structure of McCHI and VvCHI predicted:Four kinds of the bars in descending order in length represent α-helix, extended strand, β-turn and random coil respectively.B.The three-dimensional models of VvCHI and the deduced McCHI :α-helix is indicated in red, β-turn in blue, random coil in gray, and extended strand in yellow. |
以VvCHI(XP _ 002282108)为模型, 用SwissModel对McCHI蛋白进行三级结构的同源建模, 所得到的结果都与已知结构和功能的葡萄CHI蛋白的三级结构很类似(图 4)。McCHI蛋白的结构符合2OG-FeII_Oxy氧化酶的特征结构。二级结构预测的结果支持三级结构的预测, N-末端及其中部的多个α-螺旋组成“果冻”结构的重要骨架, 而延伸链则主要位于内部, 组成缺口的表面。由结构的相似性可以推知McCHI可能具有与VvCHI相似的生物学功能。

|
图 4 苹果属观赏海棠McCHI基因中央编码区的氨基酸序列的多重比对分析 Figure 4 Alignment of the predicted amino acid sequences of McCHI main ORF in Malus crabapples and those of several other plants 1.矮牵牛 Petunia × hybrida; 2.草莓 Fragaria × ananassa; 3.茶 Camellia sinensis; 4.月季 Rosa hybrida; 5.番薯 Ipomoea batatas; 6.观赏海棠 Malus crabapple; 7.毛果杨 Populus trichocarpa; 8.杜鹃 Rhododendron simsii; 9.菊花 Dendranthema morifolium; 10.萝卜 Raphanus sativus; 11.棉花 Gossypium hirsutum; 12.拟南芥 Arabidopsis thaliana; 13.茄子 Solanum melongena; 14.水母雪莲 Saussurea medusa; 15.甜橙 Citrus sinensis; 16.向日葵 Helianthus annuus. |
分析利用DNAMAN5.2.2软件进行多重序列比对(图 4)发现, CHI基因的ORF有一定的特异性, 但功能结构域也高度保守, 显示了查尔酮异构酶进化的保守性。利用MEGA4.0软件, 对McCHI编码蛋白与已知植物CHI结构域蛋白进行进化树(图 5)分析, 可以看出McCHI编码的氨基酸序列与其他物种具有较高相似性。其与茶(Camellia sinensis, DQ120521)、番薯(Ipomoea batatas, AB080768)、甜橙(Itrus sinensis, AB011794)和矮牵牛(Petunia xhybrida, AF233637)的CHI的相似性分别为69.13%, 61.73%, 70.40%和60.58%。

|
图 5 苹果属观赏海棠McCHI氨基酸序列与不同来源CHI氨基酸序列的系统进化树 Figure 5 Phylogenetic tree of CHI from various species including McCHI |
由iCycleriQTM自动测出的苹果属内参基因18S rRNA的回归方程、PCR扩增效率和相关系数分别为:Y =-3.409X + 35.857, 96.5%和0.997*; 测出的苹果属McCHI的回归方程、PCR扩增效率和相关系数分别为:Y =-0.295X + 1.592, 99.9%和0.996*。说明该试验具有良好的重复性和较高扩增效率。熔点曲线分析出的18S rRNA和McCHI均有1个Tm值, 分别为88 ℃和86 ℃, 表明18S rRNA和McCHI所用引物具有高度特异性, 其PCR扩增产物均为目的片段, 不含引物二聚体。
McCHI基因在4个苹果属观赏海棠品种叶片中表达模式如图 6。以表达量最高的‘火焰’幼叶的表达量定为“1”。按照相对定量公式2-ΔΔCt作图。由图 6可以看出, McCHI基因在4个观赏海棠品种的幼叶和功能叶中均有表达。就不同叶色类型品种而言, 绿色叶类品种‘火焰’幼叶的McCHI表达量最高, 而花色苷积累量最低; 常色叶类紫色叶品种的花色苷含量始终较高, 而McCHI的表达量却始终处于中间状态; 新叶有色类品种‘高原之火’幼叶花色苷含量最高, 而McCHI的表达量虽然高于常色叶类紫色叶品种‘王族’, 但却低于绿色叶类品种‘火焰’。就不同发育时期的叶片而言, 在绿色叶类品种‘火焰’的幼叶中McCHI表达量高于功能叶; 在常色叶类紫色叶品种‘王族’幼叶中其表达量相对高于功能叶, 而花色苷积累则低于功能叶; 在新叶有色类‘绚丽’的幼叶中McCHI表达量相对低于功能叶, 花色苷积累无差别; 而‘高原之火’幼叶基因说明McCHI表达量与花色苷积累随品种不同和叶龄不同表现出较大差异, 同时其基因表达量与花色苷积累无明显对应关系。

|
图 6 苹果属观赏海棠叶片中McCHI相对表达量及对应花色苷的含量 Figure 6 Relative copy numbers of McCHI expression levels and change of anthocyanin in the leaves of different M.crabapple cultivars 1.‘火焰’幼叶 Young leaf of M.‘Flame’; 2.‘绚丽’幼叶 Young leaf of M.‘Radiant’; 3.‘高原之火’幼叶 Young leaf of M. ‘Prairifire’; 4.‘王族’幼叶 Young leaf of M.‘Royalty’; 5.‘火焰’功能叶 Mature leaf of M.‘Flame’; 6.‘绚丽’功能叶 Mature leaf of M.‘Radiant’; 7.‘高原之火’功能叶 Mature leaf of M. ‘Prairifire’; 8.‘王族’功能叶 Mature leaf of M.‘Royalty’. |
在类黄酮代谢途径中, 查尔酮合成酶CHS催化合成反应的第1步; 查尔酮异构酶CHI催化第2步反应, 即由1个香豆酰辅酶A和3个丙二酰辅酶A在CHS的作用下生成查尔酮。查尔酮再经过CHI的作用形成二氢黄酮。二氢黄酮在F3H等酶的催化下转化为其他各种颜色类型的黄烷酮化合物。CHI在植物中表达与否及表达量的高低都会影响黄酮代谢的量, 进而影响到植物器官色泽的形成(Mckhann et al., 1994)。如缺乏CHI的玉米突变体, 查尔酮会出现积累, 玉米粒呈古铜色(Herles et al., 2004)。黄酮化合物的产量也受各种环境因子的影响, 如温度与金属离子会影响植物花色苷的积累; 增施镁盐可以预防温度提升和CHI活性下降, 使植物花色增强(Lee et al., 2002; 李雪梅等, 2004; 丛浦珠等, 2002; Masade, 1976)。这说明CHI在植物色泽形成中具有关键的作用。
利用同源扩增和RACE方法, 本研究克隆获得了苹果属观赏海棠查尔酮异构酶基因McCHI。图 6表明McCHI基因在4个观赏海棠品种的幼叶和功能叶中均有表达。但对不同品种花色苷数据和McCHI表达量进行分析发现, 叶色越红的品种, 其花色苷含量越高, 而McCHI表达量却不一定高。绿色叶类品种‘火焰’幼叶的McCHI表达量最高, 而花色苷积累量最低; 新叶有色类品种‘高原之火’幼叶花色苷含量最高, 而其McCHI表达量却低于‘火焰’。这表明McCHI表达量与花色苷积累随品种着色类型不同表现出较大差异。就不同发育时期的叶片而言, 在绿色叶类品种‘火焰’的幼叶中McCHI表达量高于功能叶; 而在新叶有色类品种‘绚丽’和‘高原之火’中, 其幼叶中McCHI表达量相对低于功能叶。这说明品种着色类型不同、叶片发育时期不同, McCHI表达量与花色苷积累量的对应关系各异。这与苹果上的结果类似, 虽然CHI基因在花色苷代谢中有着较为重要的作用(于晓南等, 2002), 但是其与花色苷代谢的对应关系不明显。
纵观近几年来对CHI的研究可以发现, 对酶催化机制方面的研究比较深入, 而对CHI基因的研究主要集中在草本植物的花色代谢调控这一领域。将矮牵牛CHI基因转入番茄并获得了转基因番茄, 表达分析显示在其果皮中黄酮类含量比对照增加了78倍、果肉中黄烷醇增加了21倍, 而在其表现型上和对照相比没有什么差别(Muir et al., 2001)。由Ri质粒介导将水母雪莲(Saussurea medusa) CHI基因转入雪莲花(Saussurea involucrata), 诱导雪莲花发根, 在转CHI基因雪莲花发根中芹菜素含量比对照组提高了12倍, 总黄酮量提高4倍(Li et al., 2006; Shimada et al., 2003)。这些结果表明, 应用基因工程技术将CHI基因导入到植物中, 其表达产物可以促进有益于人体健康的黄酮类化合物的生物合成。运用植物组织培养、分子生物学等技术将CHI等目标酶基因在植物中过量表达来提高植物中黄酮含量, 已成为目前植物学及药学领域中重点研究内容之一。将CHS和CHI基因导入矮牵牛并获得了超表达, 转基因植株花的颜色发生了改变(祝钦泷, 2004)。应用直接导入外源基因CHI或者利用共抑制和反义抑制的技术来改变植物花色, 可以大大提高花卉的观赏性。CHI基因的应用前景已经被逐渐认识, 将会得到越来越广泛的应用。
由于目前对CHI基因表达调控机制、CHI的活性基团、稳定性、环境影响因子以及合成途径中各种酶之间相互协同或抑制等方面还缺乏全面的认识, 所以, CHI基因的相对表达量在整个叶片的发育过程中对花色苷积累的作用及其机制以及对叶色形成的作用有待于大量的研究去证实。
丛浦珠, 李笋玉. 2002. 天然有机质谱学[M]. 北京: 中国医药科技出版社: 783-900.
|
韩科厅, 胡可, 戴思兰. 2008. 观赏植物花色的分子设计[J]. 分子植物育种, 6(1): 16-24. |
何亦昆, 代庆阳, 苏学辉. 1995. 雁来红叶色转变与超微结构及色素含量的关系[J]. 四川师范学院学报:自然科学版, 16(3): 195-197. |
李雪梅, 周谨, 张晓龙. 2004. 超临界CO2流体萃取与常规提取方法制备芹菜籽油的比较[J]. 精细化工, 21(8): 581-585. |
陆旺金, 蒋跃明. 2003. 荔枝果实两个膨大素基因的克隆与序列分析[J]. 中国农业科学, 36(12): 1525-1529. DOI:10.3321/j.issn:0578-1752.2003.12.017 |
吴冰, 祝钦泷, 郭余龙, 等. 2008. 查尔酮异构酶基因的分子特征及其在基因工程中的应用[J]. 植物生理学通讯, 40(1): 175-181. |
于晓南, 张启翔. 2002. 观赏植物的花色素苷与花色[J]. 林业科学, 38(3): 147-153. DOI:10.11707/j.1001-7488.20020326 |
祝钦泷. 2004. 转查尔酮异构酶(CHI)基因矮牵牛花色改变及其花器官变异的研究. 西南农业大学硕士学位论文. http://d.wanfangdata.com.cn/Thesis/Y608318
|
Herles C, Braune A, Blaut M. 2004. First bacterial chalcone isomerase isolated from Eubacterium ramulus[J]. Arch Microbiol, 181(6): 428-434. DOI:10.1007/s00203-004-0676-2 |
Lee D W, Gould K S. 2002. Anthocyanins in leaves and other vegetative organs:an introduction[J]. Advances in Botanical Research, 37: 1-16. DOI:10.1016/S0065-2296(02)37040-X |
Li Fengxia, Jin Zhiping, Zhao Dexiu, et al. 2006. Overexpression of the Saussurea medusa chalcone isomerase gene in S.involucrata hairy root cultures enhances their biosynthesis of apigenin.[J]. Phytochemistry, 67(6): 553-560. DOI:10.1016/j.phytochem.2005.12.004 |
Masade Y. 1976. Analysis of essential oil by gas chromatography and mass spectrometry[M]. New York: John Wiley and Sons Inc.: 43-286.
|
McKhann H I, Hirsch A M. 1994. Isolation of chalcone synthase and chalcone isomerase cDNAs from alfalfa(Medicago sativa L.):highest transcript levels occur in young roots and root tips[J]. Plant Mol Biol, 24(5): 767-777. DOI:10.1007/BF00029858 |
Mehdy M C, Lamb C J. 1987. Chalcone isomerase cDNA cloning and mRNA indiction by fungal elicitor, wounding and infection[J]. EMBO J, 6(6): 1527-1533. |
Muir S R, Collins G J, Robinson S, et al. 2001. Overexpression of petunia chalcone isomerase in tomato results in fruit containing increased levels of flavonols[J]. Nature Biotechnology, 19: 470-474. DOI:10.1038/88150 |
Shimada N, Aoki T, Sato S, et al. 2003. A cluster of genes encodes the two types of chalcone isomerase involved in the biosynthesis of general flavonoidsand legume specific 5-deoxy(iso) flavonoids in Lotus japnicus[J]. Plant Physiol, 131: 941-951. DOI:10.1104/pp.004820 |
van Tunen A J, Koes R E, Spelt C E, et al. 1988. Cloning of the two chalcone flavanone isomerase genes from Petunia hybrida:coordinate, light-regulated and differential expression of flavonoid genes[J]. EMBO J, 7(5): 1257-1263. |
Williamson V M, Ho J Y, Wu F F, et al. 1994. A PCR-based marker tightly linked to the nematode resistance gene, Mi, in tomato[J]. TAG Theoretical and Applied Genetics, 87(7): 757-763. |
Wood A J, Davies E. 1994. A cDNA encoding chalcone isomerase from aged pea epicotyls[J]. Plant Physiol, 104(4): 1465-1466. DOI:10.1104/pp.104.4.1465 |
 2010, Vol. 46
2010, Vol. 46

