文章信息
- 焦如珍, 彭玉红
- Jiao Ruzhen, Peng Yuhong
- 海南岛热带木本豆科植物根瘤菌的溶磷作用
- Phosphate Solubilization by Rhizobia Isolated from Woody Legume Plants in Hainan Island
- 林业科学, 2010, 46(10): 1-5.
- Scientia Silvae Sinicae, 2010, 46(10): 1-5.
-
文章历史
- 收稿日期:2009-12-01
- 修回日期:2010-05-05
-
作者相关文章
磷是植物必需的主要营养元素之一。我国土壤中的总磷含量相当可观, 但95%以上以稳定的铝硅酸盐和磷灰石等无效形式存在(陈延伟等, 1960), 植物很难直接利用。因此绝大多数农作物及林木都要追施磷肥。目前主要施用的速效磷肥生产成本高、能耗大, 还会出现大量的环境污染物, 且施肥当年的利用率仅为10% ~ 25%(张宝贵等, 1998)。追施磷肥后, 一部分磷肥随雨水流入江河湖泊, 造成水体的富营养化, 引起水质污染(李法云等, 1997), 还有一部分磷与土壤中的Ca2+, Fe2+, Fe3+和Al3+等结合, 形成难溶性磷酸盐(赵小蓉等, 2001), 植物无法吸收利用。提高磷的利用率一直是土壤学家关注的问题。
微生物对土壤磷的转化和有效性影响很大(Illmer et al., 1992; 范丙全等, 2004; Goldstein et al., 1994)。大量研究证明:土壤中存在大量的微生物, 能够将植物难以吸收利用的磷转化为可吸收利用的形态, 具有这种能力的微生物称为解磷菌或溶磷菌(phosphate-solublizing microorganisms, PSM)(张毅民等, 2006; Sahu et al., 2002; 金术超等, 2006; 陆俊锟等, 2009; 范丙全等, 2002)。解磷微生物制剂施入土壤后与土著菌株进行竞争时往往处于劣势, 降低了解磷效果。根瘤菌与共生植物形成特定的结构—根瘤, 从而使根瘤菌与其他解磷菌或溶磷菌相比在生存能力、竞争能力上具有得天独厚的优势。目前研究主要集中在根瘤菌与豆科植物共生固氮关系方面, 而对根瘤菌解磷能力的研究较少。木本豆科植物大部分生活在我国的热带和亚热带地区, 该地区有效磷缺乏, 是制约林木生长的关键因子之一(陈竑竣等, 1996; 孙启武等, 2003)。本研究对根瘤菌进行溶磷圈定性试验和溶磷定量试验, 筛选出具有较强溶磷能力的根瘤菌菌株。
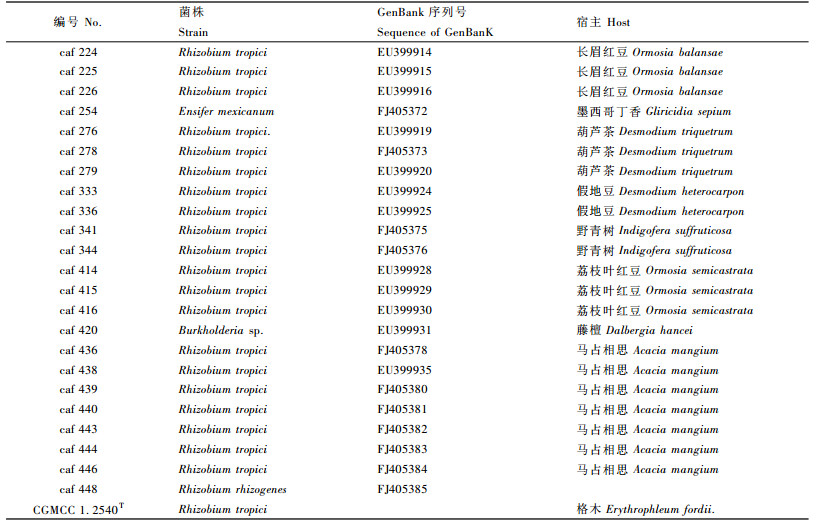
1 材料与方法 1.1 菌株来源本研究所用23株菌都是从海南岛热带尖峰岭自然保护区木本豆科植物根瘤中分离, 菌株编号、学名、共生宿主植物等信息参见表 1。热带根瘤菌(Rhizobium tropici)标准菌株CGMCC 1.2540T 从中国科学院微生物菌种保藏管理中心购买。
|
|
1) 斜面培养基根瘤菌琼脂-1的制作方法参见周宇光(2007)。用于根瘤菌的培养、活化及保藏。
2) 无机磷细菌筛选培养基(PKO无机磷培养基)的制作方法参见李阜棣等(1996)。用于根瘤菌溶解无机磷-Ca3(PO4)2定性试验, 筛选溶解无机磷的菌株。
3) 有机磷细菌筛选培养基的制作方法参见李阜棣等(1996)。该培养基以蛋黄卵磷脂为唯一磷源, 用于根瘤菌溶解有机磷-卵磷脂的定性试验, 筛选出溶解有机磷的菌株。
4) 摇瓶培养基的制作方法参见郑传进等(2002)。该培养基以Ca3(PO4)2为唯一磷源, 测定培养液中有效磷含量, 定量推断试验菌株的溶磷能力。
1.3 溶磷根瘤菌菌株筛选首先将所有试验菌株在根瘤菌琼脂-1培养基上活化3次, 然后分别接种在无机、有机磷细菌筛选培养基上, 每个培养基平板用十字法分为4个区域, 每个区域中心位置分布1个接种点, 每个菌株1个平板4个接种点, 培养4天后, 检查菌落及溶磷圈的大小, 计算出菌落溶磷透明圈直径与菌落直径的比值。比值越大, 溶磷能力越强, 比值越小, 溶磷能力越弱, 比值范围为1 ~ ∞, 比值为l表示菌落无溶磷能力(田宏等, 2004)。
1.4 溶磷根瘤菌溶磷能力测定将形成溶磷圈的菌株接种在灭菌的摇瓶培养基中, 每个菌株接种3瓶, 28 ℃ 160 r·min-1.摇床培养7天, 10 000 r·min-1.离心18 min, 取0.1 mL上清液定容至50 mL容量瓶, 适当稀释后, 利用钼锑抗比色法测定并计算出培养液中有效磷含量(李阜棣等, 1996; 焦如珍等, 2005)。
1.5 数据处理采用Excel和Spss16.0统计软件进行统计分析。
2 结果与分析 2.1 溶磷菌株筛选在PKO无机磷培养基上, 24株供试根瘤菌菌株中, 除caf 254和CGMCC1.2540T不能形成溶磷圈外, 其余22株均能形成溶磷圈, 说明他们具有溶解无效磷Ca3(PO4)2的作用。在有机磷-卵磷脂为唯一磷源的培养基上, 24株试验菌株均不能形成溶磷的透明圈, 说明24株供试菌株均不能溶解卵磷脂。
表 2是溶磷圈与菌落直径的比值(表内数据为3个重复的平均值)。由表 2可以看出22个供试根瘤菌株能溶解Ca3(PO4)2, 但不能溶解有机磷-卵磷脂; caf 254和CGMCC 1.2540T 既不能溶解无机磷Ca3(PO4)2, 也不能溶解有机磷-卵磷脂。除了2个不能溶解无机磷Ca3(PO4)2的菌株caf254和CGMCC 1.2540T 外, 其余22个菌株溶磷圈直径与菌落直径比值由小到大排列为caf 448, caf 279, caf 225, caf 416, caf 336, caf 443, caf 438, caf 333, caf 439, caf 444, caf224, caf 440, caf 226, caf 420, caf 344, caf 278, caf 414, caf 341, caf 436, caf 415, caf 276和caf 446。
|
|
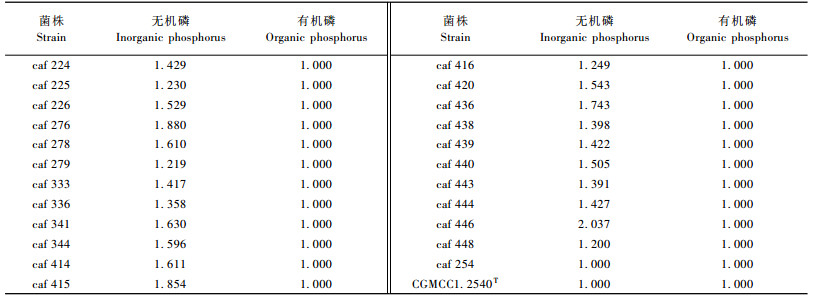
对菌株溶磷圈直径与菌落直径比值大于1.000的菌株做溶磷能力测定。由于有机磷培养基溶磷圈直径与菌落直径比值均为1.000, 24株供试菌株均未出现溶磷圈, 因此未做溶解有机磷能力测定。利用分光光度计测定以无机磷Ca3(PO4)2为唯一磷源的根瘤菌培养液有效磷含量, 数据为同一菌株的3个摇瓶的平均值。表 3为供试菌株有效磷含量。
|
|
从表 3可以看出:22个菌株培养液中有效磷含量均高于CK, 这22个菌株培养液有效磷含量均值为219.13 mg·L-1, 其中高于平均值的菌株有caf 333, caf 443, caf 336, caf 278, caf 344, caf 444, caf 276, caf 436和caf 341;溶磷能力最弱的caf 438和最强的caf 341培养液有效磷含量与对照相比分别增加0.80和628.57 mg·L-1, 后者是前者的786倍。24株供试菌株中除了菌株caf 254, caf 448和caf 420外, 其他21株供试菌株均为热带根瘤菌的不同菌株, 但它们在以无机磷Ca3(PO4)2为唯一磷源的摇瓶培养液中有效磷含量却差异很大, 其中热带根瘤菌标准菌株CGMCC 1.2540T 不溶解无机磷Ca3(PO4)2, 溶解Ca3(PO4)2能力最强的菌株caf 341其培养液有效磷含量可达到629.63 mg·L-1, 溶解Ca3(PO4)2能力较强的菌株caf 438其培养液有效磷含量仅为1.86 mg·L-1, 这说明同种不同株之间溶磷能力差异显著。
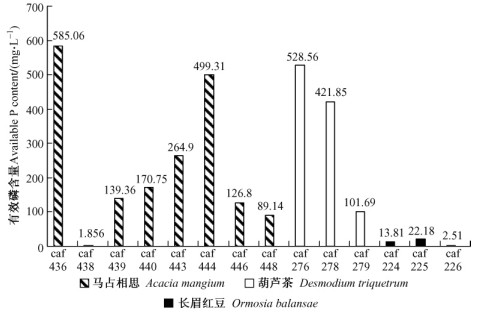
从图 1可以看出:不论宿主是长眉红豆(Ormosia balansae)、葫芦茶(Desmodium triquetrum)还是马占相思(Acacia mangium), 同一共生宿主不同菌株之间溶磷能力相差巨大, 其中来自马占相思的caf436和caf438其培养液中的有效磷含量与对照相比, 分别增加了584和0.80 mg·L-1, 说明相同寄主、相同种的不同根瘤菌菌株间溶磷能力差异显著。
|
图 1 3种宿主不同菌株培养液有效磷含量 Figure 1 Content of available P of the different strains culture from 3 hosts |
表 2中不同根瘤菌溶磷圈直径与菌落直径比值与表 3中不同菌株根瘤菌培养液有效磷含量的变化规律并不完全一致, 为此进行了相关性分析, 结果如表 4。从表 4可以看出, 根瘤菌溶磷圈直径与菌落直径比值与相应菌株培养液的有效磷含量密切相关。从而验证了溶磷圈直径与菌落直径比值可作为根瘤菌是否溶磷以及溶磷能力强弱的定性指标。
|
|
从海南尖峰岭自然保护区9种木本豆科植物根瘤上分离的23株根瘤菌中有22株可以分解无机磷Ca3(PO4)2。
24株供试菌株均不能转化有机磷-卵磷脂, 但土壤有机磷包括植酸、核酸、磷脂、磷蛋白、糖脂和磷酸盐等多种化合物(黄宇等, 2008), 在土壤中是否能溶解其他有机磷成分有待进一步研究。
筛选出的溶解无机磷Ca3(PO4)2能力较强的菌株有caf 333, caf 443, caf 336, caf 278, caf 344, caf 444, caf 276, caf 436和caf 341。溶磷微生物溶解难溶性磷酸盐的能力主要受菌株自身特性的影响, 也与培养条件有关。培养基中碳源(赵小蓉等, 2002); Narsian et al., 2000; 王光华等, 2003)、氮源(赵小蓉等, 2002); Illmer et al., 1992; 王光华等, 2004)、无机盐(Beever et al., 1980)等都是影响溶磷菌溶解难溶性磷酸盐能力的因素, 本研究得到的仅为实验室特定培养基条件下的测定结果, 是否具有较好的田间溶磷效果, 需进一步试验验证。
根瘤菌菌株溶磷能力与共生宿主无关, 菌株caf 436, caf 438, caf 439, caf 440, caf 443, caf 444和caf 446的共生宿主均为马占相思, 但其培养液中有效磷含量分别为585.06, 1.856, 139.36, 170.75, 264.9, 499.31和126.8 mg·L-1, 不同菌株之间差异显著。
同一属种不同菌株的根瘤菌, 其菌株溶磷能力差异巨大。caf 224, caf 225, caf 226, caf 276, caf 278, caf 279, caf 333, caf 334, caf 336, caf 341, caf 344, caf 414, caf 415, caf 416, caf 436, caf 438, caf 439, caf 440, caf 443, caf 444, caf 446和CGMCC 1.2540T 均为热带根瘤菌, 但它们的培养液中有效磷含量差异显著。
陈竑竣, 李贻铨, 陈道东, 等. 1996. 杉木人工林土壤磷素形态及其有效性研究[J]. 林业科学研究, 9(2): 121-126. |
陆俊锟, 陈俊, 康丽华, 等. 2009. 华南红树林溶磷菌16S rDNA PCR.RFLP分析及其溶磷能力[J]. 林业科学, 45(5): 137-142. DOI:10.11707/j.1001-7488.20090521 |
陈延伟, 陈华葵. 1960. 钾细菌的形态生理及其对磷钾矿物的分解能力[J]. 微生物, (2): 104-112. |
范丙全, 金继运, 葛诚. 2002. 溶磷草酸青霉菌筛选及其溶磷效果的初步研究[J]. 中国农业科学, 35(5): 525-530. |
范丙全, 金继运, 葛诚. 2004. 32P示踪法研究溶磷真菌对磷肥转化固定和有效性的影响[J]. 应用生态学报, 15(11): 2142-2146. DOI:10.3321/j.issn:1001-9332.2004.11.031 |
黄宇, 张海伟, 范业宽, 等. 2008. 土壤有机磷组分及其生物有效性[J]. 磷肥与复肥, 23(4): 46-48. |
焦如珍, 杨承栋, 孙启武. 2005. 细菌肥料菌株对无效磷的转化利用[J]. 林业科学, 41(4): 194-198. DOI:10.11707/j.1001-7488.20050433 |
金术超, 杜春梅, 平文祥, 等. 2006. 解磷微生物的研究进展[J]. 微生物学杂志, 26(2): 73-78. |
李法云, 高子勤. 1997. 土壤一植物根际磷的生物有效性研究[J]. 生态学杂志, 16(5): 57-60. |
李阜棣, 喻子牛, 何绍江. 1996. 农业微生物学实验技术[M]. 北京: 中国农业出版社: 90-91.
|
孙启武, 杨承栋, 焦如珍. 2003. 连栽杉木人工林土壤肥力变化的主分量分析[J]. 林业科学研究, 16(6): 689-693. |
田宏, 姚拓. 2004. 兰州地区草坪草根际溶磷菌分离及溶磷能力初步测定[J]. 草原与草坪, (4): 35-40. |
王光华, 周克琴, 金剑, 等. 2004. 不同碳源对三种溶磷真菌溶解磷矿粉能力的影响[J]. 生态学杂志, 23(2): 32-36. |
王光华, 周克琴, 金剑, 等. 2003. 不同碳源对三种溶磷真菌溶解磷矿粉能力的影响[J]. 农业系统科学与综合研究, 19(4): 260-263. |
赵小蓉, 林启美. 2001. 微生物解磷的研究进展[J]. 土壤肥料, (3): 7-11. |
赵小蓉, 林启美, 李保国. 2002. C、N源及C/N比对微生物溶磷的影响[J]. 植物营养与肥料学报, 8(2): 197-204. DOI:10.11674/zwyf.2002.0213 |
张宝贵, 李贵桐. 1998. 土壤生物在土壤磷有效化中的作用[J]. 土壤学报, 35(1): 104-111. DOI:10.11766/trxb199508270115 |
张毅民, 孙亚凯, 吕学斌, 等. 2006. 高效溶磷菌株Bmp5筛选及活力和培养条件的研究[J]. 华南农业大学学报, 27(3): 61-65. DOI:10.7671/j.issn.1001-411X.2006.03.017 |
郑传进, 黄林, 龚明. 2002. 巨大芽孢杆菌解磷能力的研究[J]. 江西农业大学学报, 24(2): 190-192. |
周宇光. 2007. 中国菌种目录[M]. 北京: 化学工业出版社: 648-649.
|
Beever R E, Burns D J W. 1980. Phosphorus uptake storage and utilization by fungi[J]. Advances in Botanical Research, 8: 127-219. |
Goldstein A H, Liu S T. 1994. Molecular cloning and regulation of a mineral phosphat solubilizing(MPS) gene from Erwinia herbicola[J]. Nature Biotechnology, 5: 72-74. |
Illmer P, Schinner F. 1992. Solubilization of inorganic phosphates by microorganisms isolated from forest soils[J]. Soil Biology & Biochemistry, 24(4): 389-395. |
Narsian V, Patel H H. 2000. Aspergillus aculeateus as a rock phosphate solubilizer[J]. Soil Biology & Biochemistry, 32(4): 559-565. |
Sahu S, Natarajan N, Har I K. 2002. Influence of phosphorus solubilizing bacteria on the changes in soil available phosphorus and sugarcane and sugar yields[J]. Field Crops Research, 77: 43-49. DOI:10.1016/S0378-4290(02)00048-5 |
 2010, Vol. 46
2010, Vol. 46