文章信息
- 陈莉, 辛海波, 李晓艳, 李晓昕, 义鸣放
- Chen Li, Xin Haibo, Li Xiaoyan, Li Xiaoxin, Yi Mingfang
- 百合MDHAR基因的克隆与表达分析
- Cloning and Expression Analysis of MDHAR from Lilium longiflorum
- 林业科学, 2010, 46(9): 178-181.
- Scientia Silvae Sinicae, 2010, 46(9): 178-181.
-
文章历史
- 收稿日期:2009-08-10
- 修回日期:2009-10-13
-
作者相关文章
抗坏血酸(ascorbic acid,AsA)作为植物细胞内重要的自由基清除剂,是通过参与一系列的氧化还原反应而发挥抗氧化剂的功能。单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDHAR)在抗坏血酸-谷胱甘肽循环中,可以将氧化型抗坏血酸(MDHA)还原为还原型抗坏血酸(AsA),在维持植物体内抗坏血酸的正常代谢和植物体氧化还原平衡方面起着重要作用(Chen et al., 2003; 2005)。
百合(Lilium)作为主要的切花和盆花材料,在国内外花卉市场上占有重要地位。百合性喜冷凉湿润气候,越夏的百合经常出现生长停滞、植株低矮、花朵败育等现象,严重影响了切花质量,并造成百合种球退化。夏季高温已成为限制国内百合周年生产的重要因素。本研究采用RACE技术从铁炮百合‘白天堂’(L. longiflorum ‘White Heaven’)叶片中克隆得到MDHAR的cDNA全长,并对其在不同组织器官及氧化胁迫下时空表达特征进行了研究,为通过基因工程的方法提高植物活性氧清除酶活性,从而提高植物的抗氧化胁迫能力,增强抗氧化代谢的水平,提高植物的抗逆性提供理论依据。
1 材料与方法 1.1 材料铁炮百合杂种系品种‘白天堂’组培苗。温度(25±2) ℃; 光照时间为14 h·d-1。
1.2 RNA的提取及逆转录反应取百合组培苗直径5 mm的小鳞茎及生长30天的根、叶片,总RNA的提取采用Trizol法。所提取的RNA进行1%琼脂糖凝胶电泳,然后进行逆转录。
1.3 保守片段的克隆根据GenBank核酸数据库中报道的拟南芥(Arabidopsis thaliana)(NM-12044)、白菜(Brassica rapa subsp. pekinensis)(AY039786)、水稻(Oryza sativa)(D85764)、冰叶日中花(Mesembryanthemum crystallinum)(AJ301553)MDHAR的mRNA序列,通过DNAMAN设计保守区兼并引物PF1 (GCNCCWTATGARMGHCCNGC)和PR1(GAGTAGAARTATGGNAGRTARTC)。25 μL反应体系: 10×buffer 2.5 μL,cDNA 1.0 μL,2.5 mmol·L-1 dNTP 2.0 μL,10 mmol·L-1引物PF1 1.0 μL,PR1 1.0 μL,Taq酶0.2 μL,ddH2O 17.3 μL。PCR反应程序为: 94 ℃ 5 min; 94 ℃ 45 s,51 ℃ 45 s,72 ℃ 90 s,35个循环; 72 ℃延伸10 min。
1.4 百合MDHAR基因3′端和5′端的克隆根据已克隆的百合MDHAR保守区片段,设计2条3′RACE上游引物PF2(CCTGAACCTTGGTGC ATGCC)和PF3(GCTGTAGGGGATGTCGCCAC),以AP1(CCGGATCCTCTAGAGCGGCCGC(T)17)引物进行逆转录,以AP2(CCGGATCCTCTAG AGCGGCCGC)为下游引物,进行巢式PCR,对3′端进行扩增。反应程序为: 94 ℃ 5 min; 94 ℃ 45 s,52 ℃ 45 s,72 ℃ 1 min,35个循环; 72 ℃延伸10 min。PCR反应体系同上。
根据已克隆的百合MDHAR保守区片段,设计3条5′RACE下游引物PR2(CCAAGCTCAA GACCAATGTATCC)、PR3(CCTTGCTGAGTGCGG GACGTTC)和PR4(CCTTGCTGAGTGCGGGACG TTC),以PR2(CCAAGCTCAAGACCAATGTATCC)特异引物进行逆转录,对cDNA模板进行加尾反应,再以其为模板进行PCR反应。PCR反应程序为: 94 ℃ 5 min; 94 ℃ 45 s,50 ℃ 45 s,72 ℃ 1 min,35个循环; 72 ℃延伸10 min。PCR反应体系同上。
M-MLV Reverse Transcriptase, Taq DNA poly-merase, Ribonuclease Inhibitor, Terminal Deoxy-nucleotidyl Transferase (TdT), T4 DNA Ligase, pMD18-T vector, DNA Fragment Purification Kit, dNTP Mixture, dATP, DNA Marker DL2000, 限制性内切酶均为Takara生物公司产品。大肠杆菌(Escherichia coli)菌株DH5α购自天根生物公司。引物均由上海生工合成。
1.5 序列测定将所有PCR产物凝胶电泳后回收目的片段,与PMD18-T载体连接并转化DH5α,重组质粒鉴定后送北京华大基因公司进行测序。
1.6 RT-PCR的表达分析根据百合MDHAR cDNA序列设计1对基因特异引物MDHAR-F(TTTTGGCGTTCAAGGAGCAG)和MDHAR-R(CACCCACAACAACAATGTCAGC),以Actin基因作为内参,Actin-F(ATGGAACTGGAATGGTTAAG)和Actin-R(ATAGCAACATACATAGCAGG),采用半定量RT-PCR方法研究MDHAR在根、鳞茎、叶不同组织器官的表达模式,以及生长30天的叶片在0, 0.5, 5, 50, 100 mmol·L-1 H2O2溶液中胁迫处理1 h后的表达情况。
2 结果与分析 2.1 百合单脱氢抗坏血酸还原酶基因MDHAR全长cDNA序列的克隆以百合叶片提取的RNA逆转录的cDNA为模板,以PF1和PR1为引物,进行保守区的PCR扩增(图 1)。经测序其核苷酸序列大小为920 bp,同源序列比对结果显示,与水稻相似性达77%,与白菜相似性达74%,与拟南芥相似性达72%。
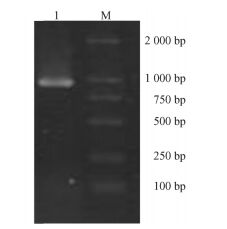
|
图 1 MDHAR基因中间片段电泳图谱 Figure 1 Electrophoresis of MDHAR fragment M: DNA分子量DL2000; 1:扩增产物。下同。M: Marker DL2000; 1: PCR product.The same below. |
根据该保守区片段,利用2条3′RACE上游引物PF2和PF3,进行2轮PCR扩增,测序结果表明该3′RACE产物大小为597 bp(图 2)。结合保守区片段设计3条下游引物,用基因特异引物PR2进行逆转录,PR3和PR4分别进行5′端第1轮和第2轮PCR扩增,经测序该5′端核苷酸序列大小为190 bp(图 3)。
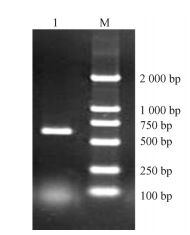
|
图 2 MDHAR基因3′片段巢式PCR扩增电泳图谱 Figure 2 Electrophoresis of nest PCR of MDHAR gene 3′ end |

|
图 3 MDHAR基因5′片段巢式PCR扩增电泳图谱 Figure 3 Electrophoresis of nest PCR of MDHAR gene 5′ end |
将克隆得到的保守区片段,3′端核苷酸序列和5′端核苷酸序列拼接,获得了百合单脱氢抗坏血酸还原酶基因MDHAR 1 502 bp的全长cDNA,其中开放阅读框(ORF)有1 305 bp(图 4),编码434个氨基酸,5′UTR有26 bp,3′UTR有171 bp。从氨基酸序列同源性比较图谱可以看出(图 5),百合与水稻和冰叶日中花的相似性最高,分别达到83%和82%;与白菜和拟南芥的相似性也分别达到76%和74%。系统进化树分析也表明该基因与水稻和冰叶日中花的亲缘关系较近(图 6),将其命名为LlMDHAR。
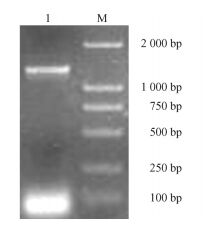
|
图 4 MDHAR基因CDS序列PCR扩增电泳图谱 Figure 4 Electrophoresis of CDS of MDHAR |

|
图 5 百合MDHAR与几种植物蛋白氨基酸序列的同源性比较 Figure 5 Homology comparison of amino acid sequences alignment of Lily MDHAR with other plants Ll:百合Lilium longiflorum; Br:白菜Brassica rapa subsp. pekinensis(AY039786); At:拟南芥Arabidopsis thaliana (NM-12044); Os:水稻Oryza sativa Japonica Group(D85764); Mc:冰叶日中花Mesembryanthemum crystallinum (AJ301553).下同。The same below. |

|
图 6 百合MDHAR与几种植物蛋白氨基酸同源序列的聚类分析 Figure 6 Clustering of the deduced amino acid sequences of MDHAR with homologous amino acid sequences among Lily and other plants |
采用RT-PCR方法对百合的根、鳞茎、叶片进行了相对定量分析,从图 7可以看出,在内参Actin扩增产物比较一致的情况下,MDHAR在根、鳞茎、叶组织里都有表达,但在根和叶中的表达量较高。

|
图 7 百合不同组织MDHAR RT-PCR Figure 7 The RT-PCR expression of MDHAR R:根Root; B:鳞茎Bulb; L:叶Leaf. |
从图 8可以看出,在不同浓度的H2O2处理1 h后,随着H2O2浓度的增加, MDHAR在百合叶片中表达量随之增加。MDHAR表达量在0.5 mmol·L-1 H2O2时,较对照没有明显变化; H2O2浓度达到5 mmol·L-1以上时,MDHAR表达量明显增加; 100 mmol·L-1 H2O2时,MDHAR表达量最大。

|
图 8 不同H2O2浓度处理百合叶片MDHAR RT-PCR Figure 8 The RT-PCR expression of MDHAR in leaf under different concentration of H2O2 |
近年来有关各种环境胁迫因子对植物的伤害,都证明主要是由于逆境条件下大量产生的活性氧所致。高温等逆境条件下,植物细胞内自由基的产生和清除系统的平衡受到破坏,积累的自由基伤害膜系统,进而造成蛋白质变性、核酸降解。在植物中活性氧会引起植物代谢失活、细胞死亡、光合速率下降、同化物的形成减少,甚至造成植物品质下降和产量减低等严重后果(Foyer et al., 2000)。
抗坏血酸在生物体中具有重要的抗氧化作用和代谢功能(Pavet et al., 2005)。抗坏血酸与植物的抗逆性呈正相关,增加细胞内的抗坏血酸含量,能增强植物对炎热、寒冷和盐碱等逆境的耐受能力。一方面,AsA可以直接清除植物体内因氧代谢、光合及环境胁迫等产生的活性氧(ROS),如单线态氧(1O2)、超氧阴离子(
目前已经从黄瓜(Cucumis sativus)、豌豆(Pisum sativum)、番茄(Lycopersicon esculentum)、拟南芥和水稻等植物中克隆到MDHAR的cDNA(Sano et al., 1994; Murthy et al., 1994),然而在众多的抗氧化酶中,之前的大部分研究集中在GR和APX,关于MDHAR的研究,多集中在逆境下酶活性等生理指标的测定(Bilodeau et al., 1998; Cervilla et al., 2007),在分子水平上研究的很少。Grantz等(1995)报道番茄MDHAR基因在创伤下其mRNA表达水平增加; Yoon等(2004)研究表明在H2O2、水杨酸、百草枯、臭氧等氧化胁迫下,油菜(Brassica napus)MDHAR基因的表达量随之增加。本试验中克隆的百合MDHAR基因同样受氧化胁迫诱导而表达,这说明MDHAR在植物活性氧清除系统中的重要性,因此能否通过转基因对其进行过表达,通过提高MDHAR的活性来增加AsA的含量,进而增强植物对氧化胁迫的抗性,有待于进一步的深入研究。
张磊. 2007. 拟南芥维生素C的代谢工程. 上海: 复旦大学博士学位论文.
|
Asada K.1997.The role of ascorbate peroxidase and monodehydroascorbate reductase in H2O2scavenging in plants//Scandalios J G. Oxidative stress and the molecular biology of antioxidant defenses.Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 715-735.
|
Bilodeau C, Chevrier N. 1998. Endogenous ascorbate level modulates ozone tolerance in Euglena gracilis cells[J]. Plant Physiol Biochem, 36(9): 695-702. DOI:10.1016/S0981-9428(98)80019-3 |
Cervilla L M, Blasco B, Rios J J, et al. 2007. Oxidative stress and antioxidants in tomato(Solanum lycopersicum) plants subjecter to boron toxicity[J]. Annals of Botany, 100(4): 747-756. DOI:10.1093/aob/mcm156 |
Chen Z, Gallie D R. 2005. Increasing tolerance to ozone by elevating foliar ascorbic acid confers greater protection against ozone than increasing avoidance[J]. Plant Physiol, 138: 1673-1689. DOI:10.1104/pp.105.062000 |
Chen Z, Yong T E, Ling J, et al. 2003. Increasing vitamin C content of plants through enhanced ascorbate recycling[J]. Proc Natl Acad Sci USA, 100(6): 3525-3530. DOI:10.1073/pnas.0635176100 |
Foyer C H, Noctor G. 2000. Oxygen processing in photosynthesis: regulation and signaling[J]. New Phytol, 146: 359-388. DOI:10.1046/j.1469-8137.2000.00667.x |
Grantz A A, Brummell D A, Bennett A B. 1995. Ascorbate free radical reductase mRNA levels are induces by wounding[J]. Plant Physiol, 108(1): 411-418. DOI:10.1104/pp.108.1.411 |
Murthy S S, Zilinskas B A. 1994. Molecular cloning and characterization of a cDNA encoding pea monodehydroascorbate reductase[J]. J Biol Chem, 269: 31129-31133. |
Pavet V, Olmos E, Kiddle G, et al. 2005. Ascorbic acid deficiency activates cell death and disease resistance in Arabidopsis[J]. Plant Physiology, 139: 1291-1303. DOI:10.1104/pp.105.067686 |
Sano S, Asada K. 1994. cDNA cloning of monodehydroascorbate radical reductase from cucumber: a high degree of homology in terms of amino acid sequence between this enzyme and bacterial flavoenzymes[J]. Plant Cell Physiol, 35(3): 425-437. |
Yoon H S, Lee H, Lee I, et al. 2004. Molecular cloning of the monodehydroascorbate reductase gene from Brassica campestris and analysis of its mRNA level in response to oxidative stress[J]. Biochimica et Biophysica Acta, 1658(3): 181-186. DOI:10.1016/j.bbabio.2004.05.013 |
 2010, Vol. 46
2010, Vol. 46

