文章信息
- 吴鹏飞, 刘世荣
- Wu Pengfei, Liu Shirong
- 汶川地震次生灾害对土壤动物群落的影响
- Impacts of Secondary Geological Disasters Induced by Wenchuan Earthquake on Soil Fauna Community
- 林业科学, 2010, 46(9): 115-123.
- Scientia Silvae Sinicae, 2010, 46(9): 115-123.
-
文章历史
- 收稿日期:2009-08-30
- 修回日期:2009-12-08
-
作者相关文章
2. 中国林业科学研究院森林生态环境与保护研究所 北京 100091
2. Institute of Forest Ecology, Environment and Protection, CAF Beijing 100091
2008年5月12日,四川省汶川县发生里氏8.0级地震,使人民的生命财产遭受巨大损失,同时也给生态环境造成巨大的破坏。据报道,地震造成四川全省9 300多处滑坡、5 500多处崩塌、1 200多处泥石流、2 600多处不稳定斜坡和104处堰塞湖(htttp://www.chinanews.com.cn/gn/news/2009/07-19/1781174.shtml),预计地震灾区发生次生灾害的总面积可达190.86 km2,占灾区总面积的0.19%(徐新良等,2008)。由此可知,地震引发的次生灾害对生态系统具有较强的破坏作用。
土壤动物是土壤生物中的一个庞大群体,是地下生态系统的重要组成部分,在生态系统的物质分解、养分矿化过程中具有非常重要的作用(Wardle,1995;梁文举等,2001),而物质分解及养分矿化过程对生态系统发挥其功能和生产力至关重要(Bardgett et al., 1998)。此外,土壤动物多样性的变化还可影响到陆地生态系统的许多过程(Wolters,2001)。因此,土壤动物是陆地生态系统结构与功能的重要组成部分。目前,已有在宏观尺度上研究汶川地震对生态系统的影响(吴宁等,2008;赵芹等,2008;王学志等,2008;张春敏等,2008),但未见对地下生态系统的土壤动物群落这一重要组成部分影响的报道。
本文以汶川地震引发的泥石流和滑坡2种次生灾害为对象,对次生灾害区的土壤动物群落进行调查研究,查明地震次生灾害对土壤动物群落的影响,揭示地震次生灾害对地下生态系统结构及功能的影响,研究结果可为受损生态系统的恢复重建提供科学依据。
1 研究区概况研究区位于四川省彭州市银厂沟,该区是四川盆地向青藏高原过渡的龙门山中段,属龙门山脉玉垒山支脉。地形属V型峡谷,区域海拔2 000 m左右,地势由北西的高山区向南东的中山区变化。该区属于亚热带湿润气候区;年平均气温为15.6 ℃,年极端最高为36.9 ℃,最低为-6.2 ℃;全年无霜期平均为276天;多年平均降水量为932.5 mm,全年中,平均降水最多的是7月份,最少的是12月份。土壤为三迭系须家河组炭质页岩、砂岩夹薄煤层的风化残积物发育而来的山地黄壤,土层厚度为70~100 cm。区内森林茂密、峡谷幽深、溪流清澈、瀑布成群,植被覆盖面积达96%以上。海拔1 500 m以下的自然植被类型为常绿阔叶林,人工植被以柳杉(Cryptomeria fortunei)林为主。
2 研究方法 2.1 样地选择2008年11月间,在四川省彭州市白水河镇的关木岩至谢家店之间,选取了典型的泥石流和滑坡地段各1个作观测样地,并分别在其附近各选1个柳杉林样地作对照。
2.2 土壤动物调查方法土壤动物的调查及分离方法参照文献(《土壤动物研究方法手册》编写组,1998),具体方法如下。
大型土壤动物:在每个观测样地中各选取6个50 cm×50 cm样方,每个样方的间隔为3 m左右,分0~5 cm、5~10 cm和10~15 cm 3层分别对大型土壤进行调查,手拣法收集大型土壤动物,用5%的福尔马林溶液固定保存。
中小型土壤动物:用特制的300 cm3环刀(Ф88 mm×H50 mm)分0~5 cm、5~10 cm和10~15 cm 3层次取样。每层取土样2份,分别用Tullgren法(干漏斗法)和Baermann法(湿漏斗法)分离土壤动物,分离时间为24 h。Tullgren法分离土壤动物时,如果土壤干燥,则向土样喷洒适量的水分,防止其升温过快而导致土壤动物死亡。每个样地6次重复,共取土样144份。
土壤动物的鉴定:根据《中国土壤动物检索图鉴》(尹文英,1998)在体式显微镜(OLYMPUS SZX16)和光学显微镜(LEICADM 4000B)下对土壤动物进行鉴定。一般鉴定到科,部分种类鉴定到属,并统计个体数量。对于Tullgren法和Baermann法分离到相同物种时,取个体数最大的一个数值进行计算。
2.3 数据分析优势类群划分:个体数量大于捕获总量的10.0%以上者为优势类群(+++),占1.0%~10.0%者为常见类群(++),不足1.0%者为稀有类群(+)(李志伟等,2004)。
多样性分析:采用Shannon-wiener多样性指数(Peet,1974) 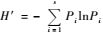
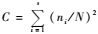
群落相似性分析:利用Sørenson群落相似性系数(Zapfack et al., 2002)S=2C/(A+B)分析不同土壤动物群落的相似性情况。式中:C为2个群落的共有类群数,A和B分别为两个群落中各自的土壤动物类群数,0<S<00.25为极不相似,0.25≤S<0.5为中等不相似,0.5≤S < 0.75为中等相似,0.75≤S<1.0为极为相似。
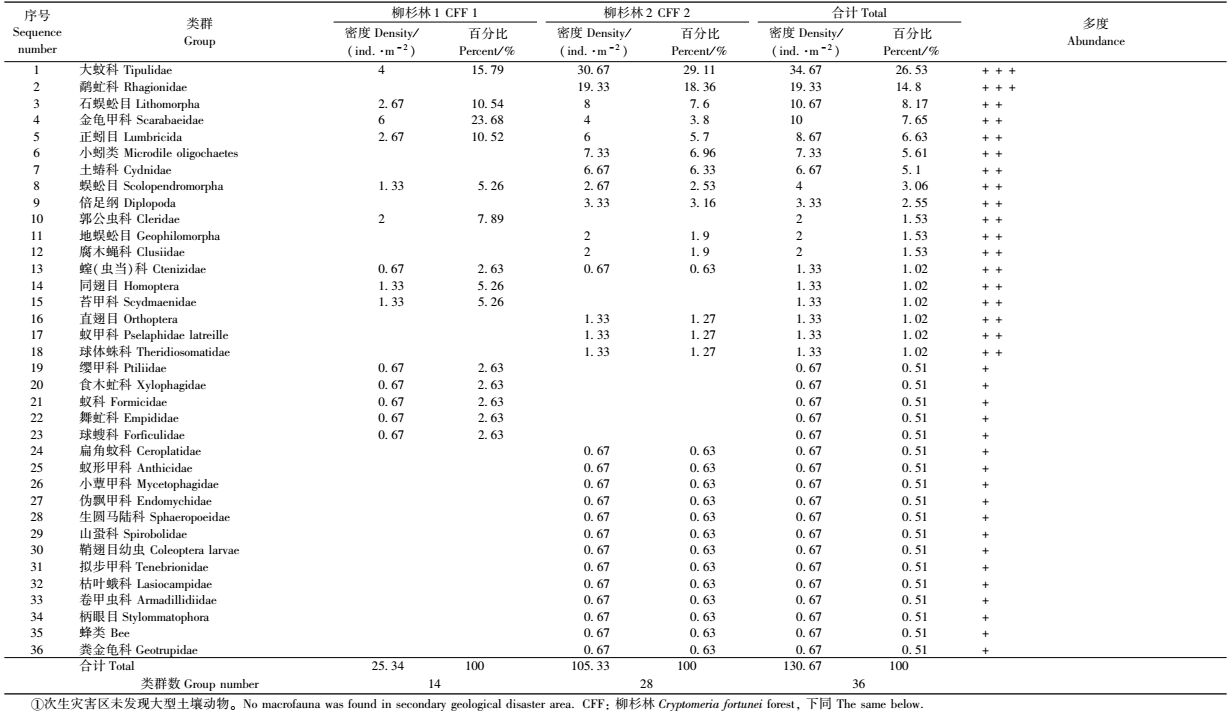
3 结果与分析 3.1 次生灾害对土壤动物群落组成的影响 3.1.1 大型土壤动物群落组成变化本次调查,在次生灾害区未发现有大型土壤动物存在,对照区大型土壤动物群落组成情况如表 1。在对照区共捕获大型土壤动物196只,隶属3门7纲17目36类(科)。优势类群为大蚊科(Tipulidae)和鹬虻科(Rhagionidae),占总体个数的41.33%;常见类群为正蚓目(Lumbricida)、金龟甲科(Scarabaeidae)、同翅目(Homoptera)、石蜈蚣目(Lithomorpha)等16类,占总体个数的49.49%;稀有类群为球体蛛科(Theridiosomatidae)、缨甲科(Ptiliidae)、食木虻科(Xylophagidae)、蚁科(Formicidae)等18类。2个柳杉林样地分别有大型土壤动物14和28个类群,其群落个体密度分别为25.34和105.33个·m-2,平均密度为65.34个·m-2。t检验结果表明: 2样地间的类群数有显著差异(t=2.287,P<0.05),但个体密度无显著差异(t=2.497,P>0.05)。从大型土壤动物群落变化情况来看,地震次生灾害对大型土壤动物群落的影响极其严重,达到全部灭绝的程度。
|
|
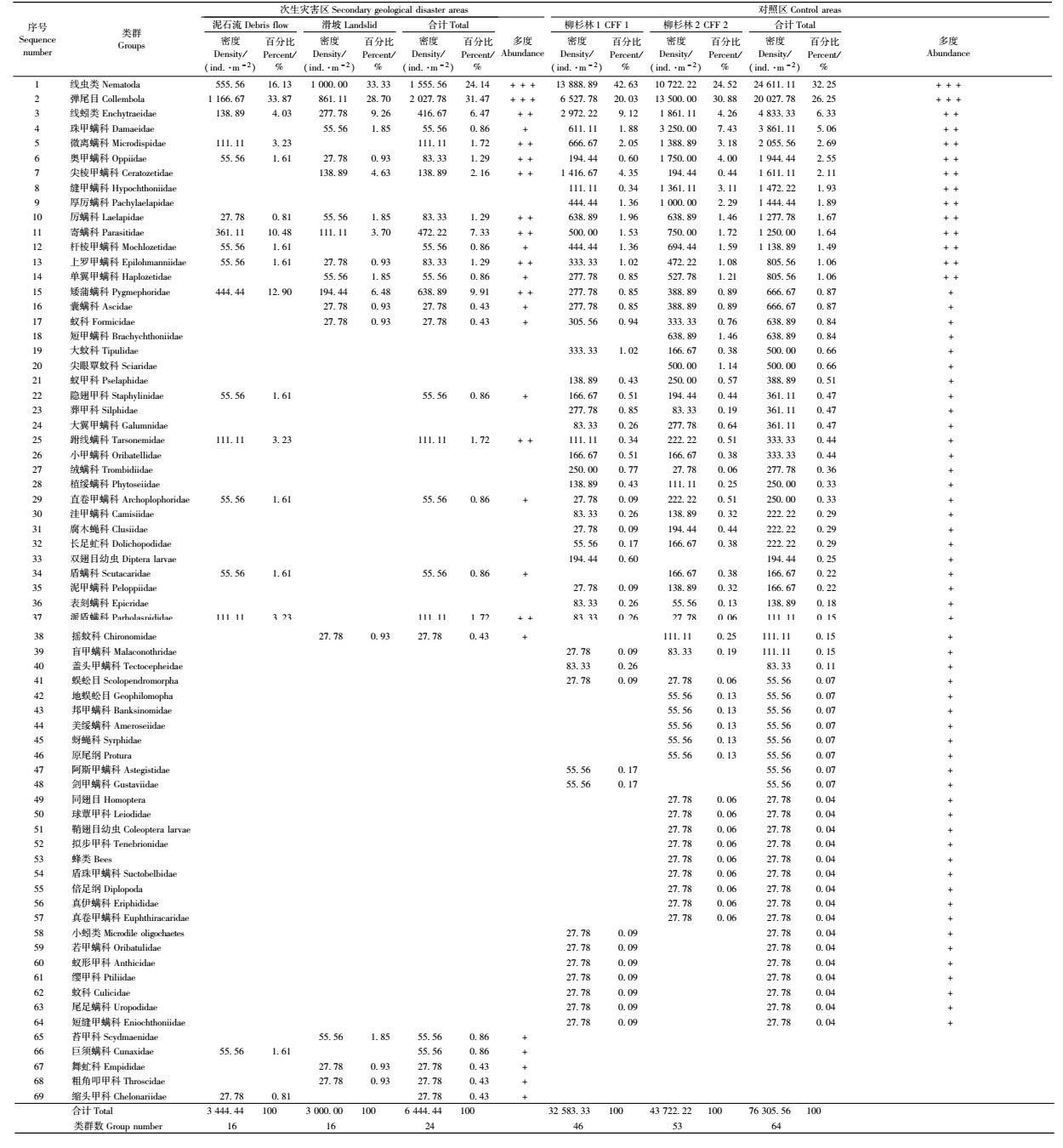
地震次生灾害区与对照区的中小型土壤动物群落组成情况如表 2。次生灾害区共捕获中小型土壤动物232只,隶属3门4纲6目26类(科)。优势类群为弹尾目(Collembola)和线虫类(Nematoda),2者个体总数占群落总个体数的55.60%;常见类群为寄螨科(Parasitidae)、矮蒲螨科(Pygmephoridae)等10类,占总体个数的32.76%;稀有类群为微离螨科(Microdispidae)和直卷甲螨科(Euphthiracaridae)等14类,占总体个数的11.64%。2个样地的中小型土壤动物密度分别为3 444.44和3 000.00个·m-2,平均密度为3 222.22个·m-2。
|
|
对照区共调查到中小型土壤动物2 747只,隶属3门7纲9目64类(科)。优势类群为弹尾目和线虫类,占总体个数的58.50%;常见类群为寄螨科、上罗甲螨科(Epilohmanniidae)和奥甲螨科(Oppiidae)等12类,占总体个数的23.15%;稀有类群为矮蒲螨科、线蚓类(Enchytraeidae)和直卷甲螨科和隐翅甲科(Staphylinidae)等50类,占总体个数18.35%。2个样地的中小型土壤动物密度分别为32 583.33和43 722.22个·m-2,平均密度为38 152.78个·m-2。
与对照区相比,次生灾害区的中小型土壤动类群数显著下降了59.38%(F=43.41,P<0.01),个体密度则显著下降了91.55%(F=41.40,P<0.01)。由表 2知,次生灾害区的中小型土壤动物类群数的减少主要是因稀有类群的消失,而群落密度的下降则主要是因优势类群和常见类群的密度下降。
3.2 多样性变化 3.2.1 大型土壤动物多样性由于次生灾害区未能调查到大型土壤动物,因此无法计算灾害区的大型土壤动物多样性。对照区2个柳杉林样地的大型土壤动物多样性如图 1A。柳杉林1的多样性指数H和丰富度指数D高于柳杉林2,但均匀度指数E和优势度指数C低于柳杉林2。t检验结果表明2个样地间仅有均匀度指数E存在差异显著性(t=2.96,P<0.05)。

|
图 2 土壤动物多样性指数比较 Figure 2 Comparisons of soil fauna diversity indexes in different samples |
次生灾害区与对照区各地样地的中小型土壤动物多样性如图 1B。多样性指数H和富度指数D的大小顺序为:柳杉林2>柳杉林1>泥石流>滑坡;均匀度指数E和优势度指数C的大小顺序为:滑坡>泥石流>柳杉林1>柳杉林2。统计分析结果表明,4个样地间的H,E和D多样性指数有显著差异(P<0.01),多重比较结果表明次生灾害区的H和D多样性指数显著低于对照区(P<0.01),均匀度指数E显著高于对照区(P<0.01),优势度指数C差异不显著(P>0.05)。另外,次生灾害区和对照区内部的2个样地间的多样性均无显著差异(P>0.05)。
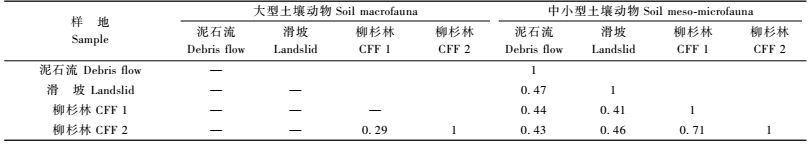
3.3 土壤动物群落的相似性次生灾害区与对照区各样地间土壤动物群落的相似性情况如表 3。大型土壤动物群落中,柳杉林1和柳杉林2间相似性系数为0.29,中等不相似。中小型土壤动物群落间,相似性最高的是对照区的柳杉林1和柳杉林2,相似性系数为0.71,达到中等相似;其次是次生灾害区的泥石流和滑坡两样地间的2个样地,相似性系数为0.47,为中等不相似;其余各样地间的相似性系数均介于0.25~0.47之间,为中等不相似。
|
|
对地震次生灾害区及对照区土壤动物群落的调查结果表明:地震次生灾害区无大型土壤动物分布,并且中小型土壤动物的类群数、个体密度、多样性指数H和丰富度指数D均显著低于对照区域(P<0.01),与对照区土壤动物群落的相似性也低于各区内部样地间的相似性,这表明地震次生灾害对土壤动物有强烈的干扰作用。
地震次生灾害对土壤动物群落结构的影响是多方面的。首先,土壤动物受到来自次生灾害发生时的机械力的直接作用。次生灾害发生时,产生强大的冲击力,流体携带的大石块强烈冲蚀、铲刮地表土壤,而土壤动物一般分布在地表 0~20 cm范围内。因此,土壤动物可被次生灾害所产生的流体所碾压及掩埋,而大型土壤动物则因体型较大,更易受机械力的破坏。因此,本次调查未在次生灾害区发现大型土壤动物。
其次,次生灾害在运动过程中的强大冲击力,可以改变地表土壤的自然发生层结构,从而使原有的土壤理化性质发生改变(Diez et al., 1996;Glade,2003;Restrepo et al., 2006)。在泥石流堆积物组成中,粗大颗粒极多,颗粒普遍较大,漂石含量高,其中砾石含量多在50%以上,沙砾含量也超过30%(陈宁生等,2006)。地表土壤物理环境的变化必然会影响到土壤动物的生存。研究表明土壤动物的类群和数量对地面小气候和非生物条件改变非常敏感(于长福等,1985;Magura et al., 2003),其中湿度和温度是影响土壤动物分布的重要因素(Setälä et al., 1995;Sulkava et al., 2003)。在次生灾害区,湿生性的线虫在群落中所占的比例由对照区的32.25%下降到24.14%,线蚓所占比例变化不大;而旱生及中生性的弹尾目所占比例则由对照区的26.25%增加到31.47%,蜱螨目的比例也由对照区的29.92%增加到34.05%。此外,土壤温度的微小变动还会显著影响碳、氮的矿化比率(Binkley et al., 1994;Stottlemlyer et al., 1999),而土壤有机碳和氮的含量与土壤动物多样性有密切的相关性(林英华等,2004)。
另外,植被是影响土壤动物群落的重要因素,地震次生灾害还可通过破坏地面植被来对土壤动物产生影响。地震作用较轻时,地表植被可能在小范围内被地震造成的次生灾害所破坏(Kitzberger et al., 1995;Allen et al., 1999);当地震作用十分强烈时,可在大范围内将森林完全移除(Veblen et al., 1978;Garwood et al., 1979;Johns,1986)。而土壤动物对植被具有较强的依赖性,不同的植被类型下有着与其相适应的土壤动物群落(林英华等,2005;Loranger-Merciris et al., 2007;de Aquino et al., 2008)。已有研究表明,植被的落叶和部分落叶植物能够改变土壤生物的特性(Mikola et al., 2001),并且植物叶片的数量与特性能影响土壤生物的种群和类群动态(Aubert et al., 2004),而不同植物的凋落物更易对大型土壤动物产生影响(Wardle et al., 2002)。在本文所调查的2个次生灾害区,原有植被已完全被毁,而对照区的2个柳杉林群落的密度和盖度也有较大的差异。在柳杉林1样地,乔木主要是柳杉和少量杉木(Cunninghamia lanceolata),郁闭度达0.8左右,林下植被稀少;而柳杉林2中,乔木只有柳杉1种,且郁闭度仅有0.5左右,林下植被茂盛。因此,对照区2个样地间的大型土壤动物群落组成存在明显差异,相似性较低。相对于大型土壤动物来说,中小型土壤动物对植被变化具有较高的稳定性,因此2个对照样地间的中小型土壤动物群落的相似性较高。
在表征群落多样性的指数中,Shannon-Wiener多样性指数H和丰富度指数D的应用比较广范。由于受到强烈干扰,泥石流和滑坡区的大型土壤动物全部消失,故无法讨论次生灾害对大型土壤动物多样性指数的具体影响。中小型土壤动物群落多样性指数H和丰富度指数D显著下降(P<0.01),而均匀度指数E则显著增加(P<0.01)。造成多样性变化的主要原因是群落稀有类群的消失和个体密度的下降。次生灾害区的优势类群和常见类群共有12个,而对照区为14个,仅相差2个,但稀有类群数(14个)比对照区的稀有类群数(50个)减少了72.00%;另外,次生灾害区的平均密度为3 222.22个·m-2,比对照区的平均密度(38 152.78个·m-2)下降了91.56%。
土壤动物鉴定工作对刚从事土壤动物生态学研究的科研人员是有相当难度的。本文作者对大部分土壤动物鉴定到科,但对少数类群仅鉴定到目或纲,如弹尾目和线虫等,这对土壤动物群落结构的分析会有一定的影响。例如,如以目为统计单元,蜱螨目将是中小型土壤动物群落的优势类群之一,而有些稀有类群则可以成为常见类群。在今后的科研工作中,笔者将会进一步提高有关土壤动物的鉴定方法和技能。
陈宁生, 张飞. 2006. 2003年中国西南山区典型灾害性暴雨泥石流运动堆积特征[J]. 地理科学, 26(6): 701-705. |
李志伟, 童晓立, 张维球, 等. 2004. 广东石门台自然保护区森林土壤无脊椎动物群落多样性[J]. 华南农业大学学报:自然科学版, 25(1): 80-84. |
梁文举, 闻大中. 2001. 土壤生物及其对土壤生态学发展的影响[J]. 应用生态学报, 12(1): 137-140. |
林英华, 张夫道, 杨学云, 等. 2004. 农田土壤动物与土壤理化性质关系的研究[J]. 中国农业科学, 37(6): 871-877. |
林英华, 张夫道, 张俊清. 2005. 鼎湖山不同自然植被土壤动物群落结构时空变化[J]. 生态学报, 25(10): 2616-2622. DOI:10.3321/j.issn:1000-0933.2005.10.023 |
《土壤动物研究方法手册》编写组. 1998. 土壤动物研究方法手册[M]. 北京: 中国林业出版社: 24-34.
|
王学志, 徐卫华, 欧阳志云, 等. 2008. 汶川地震对都江堰地区大熊猫生境的影响[J]. 生态学报, 28(12): 5856-5861. DOI:10.3321/j.issn:1000-0933.2008.12.010 |
吴宁, 卢涛, 罗鹏, 等. 2008. 地震对山地生态系统的影响——以5.12汶川大地震为例[J]. 生态学报, 28(12): 5810-5819. DOI:10.3321/j.issn:1000-0933.2008.12.004 |
徐新良, 江东, 庄大方, 等. 2008. 汶川地震灾害核心区生态环境影响评估[J]. 生态学报, 28(12): 5899-5908. DOI:10.3321/j.issn:1000-0933.2008.12.016 |
殷秀琴, 王海霞, 周道玮. 2003. 松嫩草原区不同农业生态系统土壤动物群落特征[J]. 生态学报, 23(6): 1071-1078. |
尹文英. 1998. 中国土壤动物检索图鉴[M]. 北京: 科学出版社.
|
于长福, 赵克尊. 1985. 老爷岭生态实验站的土壤动物初步调查研究[J]. 东北林业大学学报, 13(3): 128-134. |
张春敏, 王根绪. 2008. 汶川大地震灾害对区域生态系统的影响——以青川、平武和茂县为例[J]. 生态学报, 28(12): 5833-5841. DOI:10.3321/j.issn:1000-0933.2008.12.007 |
赵芹, 卿太明, 曹叔尤. 2009. 汶川特大地震对四川水土流失的影响及其经济损失评估[J]. 中国水土保持, (3): 5-7. |
Allen R B, Belljngham P J, Wiser S K. 1999. Immediate damage by an earthquake to a tempemte montane forest[J]. Ecology, 80(2): 708-7l. DOI:10.1890/0012-9658(1999)080[0708:IDBAET]2.0.CO;2 |
Aubert M, Hedde M, Decaëns T, et al. 2004. Efects of tree can opy composition on earthworms and other macroinvertebrates in beech forests of Upper Normandy (France)[J]. Pedobiologia, 47(5-6): 904-912. |
Bardgett R D, Keiller S, Cook R, et al. 1998. Dynamic interactions between soil animals and microorganisms in upland grassland soils amended with sheep dung: A microcosm experiment[J]. Soil Biology and Biochemistry, 30(4): 531-539. DOI:10.1016/S0038-0717(97)00146-6 |
Binkley D, StottlerrIyer R, Suarez F, et al. 1994. Soil nitrogen availability in some arctic ecosystems in Northwest Alaska: Responses to temperature and moisture[J]. Ecoscience, 1(1): 64-70. DOI:10.1080/11956860.1994.11682229 |
de Aquino A M, da Silva R F, Mercante F M, et al. 2008. Invertebrate soil macrofauna under different ground cover plants in the no-till system in the Cerrado[J]. European Journal of Soil Biology, 44: 191-197. DOI:10.1016/j.ejsobi.2007.05.001 |
Diez A G, Salas L, Teran J R D, et al. 1996. Late quaternary climate changes and mass movement frequency and magnitude in the Cantabrian region, Spain[J]. Geomorphology, 15: 291-309. DOI:10.1016/0169-555X(95)00076-H |
Garwood N C, Janos D P, Brokaw N. 1979. Earthquake-caused landslides: a major disturbance to tropical forests[J]. Science, 205: 997-999. DOI:10.1126/science.205.4410.997 |
Glade T. 2003. Landslide occurrence as a response to land use changes: A review of evidence from New Zealand[J]. Catena, 51: 297-314. DOI:10.1016/S0341-8162(02)00170-4 |
Johns R J. 1986. The instability of the tropical ecosystem in New Guinea[J]. Blumea, 31: 341-371. |
Kitzberger T, Veblen T T, Villalba R. 1995. Tectonic influences on tree growth in northern Patagonia, Argentina: the roles of substrate stabi1ity and climatic variation[J]. Canadian Journal of Forest Research, 25: 1684-1696. DOI:10.1139/x95-182 |
Loranger-Merciris G, Imbert D, Bernhard-Reversat F, et al. 2007. Soil fauna abundance and diversity in a secondary semi-evergreen forest in Guadeloupe (Lesser Antilles): influence of soil type and dominant tree species[J]. Biology and Fertility of Soils, 44: 269-276. DOI:10.1007/s00374-007-0199-5 |
Magura T, Tóthmérész B, Elek Z. 2003. Diversity and composition of carabids during a forestry cycle[J]. Biodiversity and Conservation, 12: 73-85. DOI:10.1023/A:1021289509500 |
Mikola J, Yeates G W, Wardle D A, et al. 2001. Response of soil food—web structure to defoliation of different plant species combinations in an experimental grassland community[J]. Soil Biology and Biochemical, 33: 205-214. DOI:10.1016/S0038-0717(00)00131-0 |
Peet R K. 1974. The measurement of species of diversity[J]. Annual Review of Ecology and Systematics, 5: 285-307. DOI:10.1146/annurev.es.05.110174.001441 |
Pielou E C. 1966. The measurement of diversity in different types of biological collection[J]. Journal of Theoretical Biology, 13: 131-144. DOI:10.1016/0022-5193(66)90013-0 |
Restrepo C, Alvarez N. 2006. Landslides and their contribution to land-cover change in the mountains of Mexico and Central America[J]. Biotropica, 38(4): 446-457. DOI:10.1111/btp.2006.38.issue-4 |
Setälä H, Marshall V G, Trofymow J A. 1995. Influence of micro-and macro-habitat factors on collembolan communities in Douglas-firstumps during forest succession[J]. Applied Soil Ecology, 2(4): 227-242. DOI:10.1016/0929-1393(95)00053-9 |
Simpson E H. 1949. Measurement of diversity[J]. Nature, 163: 688. DOI:10.1038/163688a0 |
Stottlemlyer R, ToczydIowski D. 1999. Seasonal relationships between precipitation, forest floor, and streamwater nitrogen, Isle Royale, Michigan[J]. Soil Science Society of America, 63: 389-398. DOI:10.2136/sssaj1999.03615995006300020018x |
Sulkava P, Huhta V. 2003. Effects of hard frost and freeze-thaw cycles on decomposer communities and N mineralisation in boreal forest soil[J]. Applied Soil Ecology, 22(3): 225-239. DOI:10.1016/S0929-1393(02)00155-5 |
Veblen T T, Ashton D H. 1978. Catastrophic influences on the vegetation of the VaIdivian Andes, Chile[J]. Vegetatio, 36: l49-167. |
Wardle D A, Bonner K I, Barker G M. 2002. Linkages between plant litter decomposition, litter quality, and vegetation responses to herbivores[J]. Functional Ecology, 16: 585-595. DOI:10.1046/j.1365-2435.2002.00659.x |
Wardle D A. 1995. Impact of disturbance on detritus food webs in agroecosystems of contrasting tillage and weed management practice[J]. Advances in Ecological Research, 26: 105-185. DOI:10.1016/S0065-2504(08)60065-3 |
Wolters V. 2001. Biodiversity of soil animals and its function[J]. European Journal of Soil Biology, 37: 221-227. DOI:10.1016/S1164-5563(01)01088-3 |
Zapfack L, Engwald S, Sonke B, et al. 2002. The impact of land conversion on plant biodiversity in the forest zone of Cameroon[J]. Biodiversity and Conservation, 11: 2047-2061. DOI:10.1023/A:1020861925294 |
 2010, Vol. 46
2010, Vol. 46