文章信息
- 田国忠, 李永, 梁文星, 朴春根, 黄钦才, 郭民伟
- Tian Guozhong, Li Yong, Liang Wenxing, Piao Chungen, Huang Qincai, Guo Minwei
- 丛枝病植原体侵染对泡桐组培苗组织内H2O2产生的影响
- Influence of Paulownia Witches'-broom Phytoplasma Infection on Hydrogen Peroxide Produce in Affected Tissues of Tissue-Cultured Paulownia Plantlets
- 林业科学, 2010, 46(9): 96-104.
- Scientia Silvae Sinicae, 2010, 46(9): 96-104.
-
文章历史
- 收稿日期:2009-03-20
- 修回日期:2009-10-01
-
作者相关文章
泡桐(Paulownia)是原产于我国的重要速生用材树种。由植原体引起的泡桐丛枝病是我国泡桐上的严重病害。迄今,植原体病原尚未能人工培养,导致植原体与寄主植物相互作用的研究一直是难点。
此前,已用发病组培苗和相应的健康对照苗测定了病与健康苗在过氧化物酶(POD)、吲哚乙酸氧化酶(IAAO)、苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)等酶活性、激素和酚类物质代谢的差异(田国忠等, 1996; 2001a; 2001b; Tian et al., 1995)。对其他植物的许多研究结果已显示:活性氧爆发,包括过氧化氢(H2O2)、超氧自由基(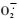
本研究选用已表现典型丛枝病症状的多个无性系泡桐丛枝病组培苗和健康组培苗为研究对象,研究染病泡桐组培苗体内的活性氧代谢变化,了解其在植原体与寄主互作过程中的地位和作用。
1 材料与方法 1.1 试验材料泡桐丛枝病植原体(16SrI-D)株系来自山东兖州。泡桐健康组培苗包括无性系ZH, C020, TY2T, C125, XH, MB33,T35-028等,感染植原体的病组培苗包括ZD(ZH的染病苗), GTY2TD(TY2T的染病苗), C125D(C125H的染病苗), G33D(MB33的嫁接发病苗), C85-028D(健苗T35-028由此染病苗经脱毒获得)等,所采用的基本培养基为普通未添加激素的MS培养基。染病组培苗根据症状划分为3类:重症苗(表现为严重丛枝、小叶、节间缩短、甚至顶芽膨大白化,多无根分化)、轻症苗(有明显的腋芽分化,但叶片较大、节间较长、多有短根或毛细根分化)和无症苗(由病苗具芽茎段培养出现的无明显症状的近似健康组培苗)(Tian et al., 1995, 田国忠等,1999)。
1.2 机械损伤和嫁接接种方法机械损伤包括用止血钳夹伤叶片和针刺叶脉、主茎、叶柄等损伤方式。
植原体接种采用泡桐组培苗嫁接传病试验方法(田国忠等,1999)。本试验用感染植原体的丛枝芽为接穗嫁接到健康组培苗无性系砧木切口上,以健康组培苗接穗嫁接作为对照。
1.3 过氧化氢(H2O2)组织定位H2O2在植物叶片和幼茎中的定位测定按Thordal-Christensen等(1997)报道的3, 3’-二氨基联苯胺(DAB)组织染色法并加以改进。分别取组培带根苗或截根后的地上部茎叶组织插入含1 mg·mL-1的DAB溶液中,或将叶片的叶柄直接插入DAB溶液中,于正常培养条件下吸收DAB 8 h以上,然后用95%乙醇煮沸10 min脱色,观察透明组织中红褐色的H2O2产生部位和强度,并照相记载。另外,也试验了直接将叶片、茎段或整株完全浸泡到DAB溶液中2~4 h,然后再进行脱色处理。
H2O2产生量和组织切片定位测定根据Barcelo等(2002)淀粉/KI显色的方法并加以改进。徒手切取500 μm左右的厚切片100片,浸入1 mmol·L-1抗坏血酸溶液中1 min, 以去除内源H2O2,用淀粉/KI试剂于25 ℃下温浴染色,测定20 h不加抗坏血酸和加入抗坏血酸(1 mg)后的OD572差值来判断切片中产生并溶解到溶液中H2O2的浓度。同时,将反应后的切片取出置于载玻片上,用光学显微镜检查蓝黑色H2O2产生部位。
1.4 过氧化物酶(POD)组织定位过氧化物酶(POD)定位测定按Thordal-Christensen等(1997)报道的DAB吸收法加以改进。包括整株DAB浸泡法、组织切段DAB浸泡法和组织切片染色3种方法。DAB的吸收方法同前,在经吸收后溶液中加400 μL 30%H2O2显色10 min左右,然后用95%乙醇煮沸10 min脱色,观察红褐色的POD产生部位。切片用光学显微镜检查。
1.5 H2O2和抗坏血酸处理病与健组培苗及培养瓶密封在超净工作台的无菌环境下,将病与健组培苗具芽茎段(0.5~1 cm)用不同浓度的H2O2水溶液浸泡处理1 h,然后放入MS培养基上于正常组培条件下培养, 或将茎段直接插入含有不同浓度H2O2的培养基上培养。H2O2浓度为1.5~2 mol·L-1。定期观察外植体生长和病苗症状变化。
将0.1至2 000 μg·L-1的抗坏血酸加入50 ℃左右未凝固的MS培养基中混匀,然后接种病或健康组培苗茎段,进行组织培养和定期观察记载(Tian et al., 1994)。
将接种过的病与健康组培苗茎段的培养瓶加盖密封橡皮塞,并进一步用固体石蜡密封,以常规培养方法为对照,观察记载组培苗变化。
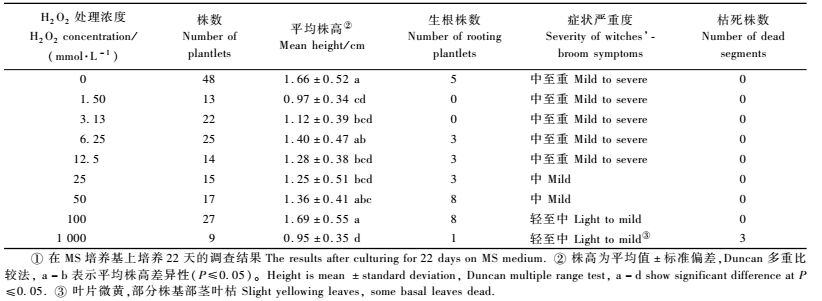
2 结果与分析 2.1 染病泡桐丛枝病组培苗和健康苗H2O2和POD组织定位本试验结果显示(图 1),多数无性系健康苗、已感病并表现典型丛枝症状的病苗, 其培养基以上茎叶在未有任何损伤和环境应力时,H2O2积累不明显, 表明正常生长的健康泡桐茎叶内未发生H2O2过度积累。在组培苗根部能检测到少量H2O2释放, 但例外的是无性系C125H轻症苗G125D体内产生的H2O2却明显强于重症苗、无症苗或健康苗, 这可能与此轻症苗体内仍持续进行的病菌扩展作用及此无性系抗病特性有关(田国忠等, 1999)。
|
图 1 病与健泡桐组培苗H2O2组织定位 Figure 1 Histochemical localization of H2O2 in the tissues of infected and healthy paulownia plantlets in vitro cultures on MS medium a.健苗ZH无性系叶部H2O2积累不明显The healthy clone ZH leaves with little H2O2 accumulation in the intact leaves; b.健苗MB33无性系The healthy clone MB33; c.健苗C125H, 随机夹伤造成局部H2O2积累(箭头所指) The healthy C125H, a certain H2O2 production at the random injury site by the hemostat (Arrows point); d.完整病苗叶片ZD H2O2积累不明显 The intact infected ZH leaves without detectable H2O2 accumulation. |
POD组织定位结果显示(图 2),培养30天以上表现典型丛枝症状的多数无性系染病组培苗,在地上部茎叶内酶活性显著高于相应的健康对照, 其中病苗主茎中部相对伸展病叶主脉和支脉的红褐色POD着色最为明显。健康和染病苗根部POD活性皆强于茎叶部位。在健叶脉间的叶肉组织常出现弱的不规则的POD活性区域。重症苗叶脉着色深、粗或有放射状脉间染色,甚至整叶着色; 在轻症苗上不同部位的叶片间POD活性有差异,有时在同一叶片叶脉上的POD活性也不均匀。在多数无性系无症苗的叶脉中POD活性较弱,接近其相应的健康对照苗, 说明维管束部位的POD活性强弱与症状的严重程度呈明显正相关性。
|
图 2 病与健康泡桐组培苗POD组织定位 Figure 2 Histochemical localization of POD in the tissues of infected and healthy paulownia plantlets a.病苗GTY2TD The infected GTY2TD,a-1.重症苗, 深色叶脉POD活性高The severe symptoms showing high POD activities with deep-coloured leaf vein,a-2.无症苗The asymptomatic plantlets indicating less POD activities with slight-coloured leaf vein; b.健苗TY2T, 叶脉色浅, 但脉间不规则着色The healthy TY2T with slight colour in the leaf vein, but having irregular colourized areas as interveins. |
同时,在不同无性系间微管束部位的POD活性也存在一定差异,其中TY2T和相应病苗GTY2TD活性最强,ZH和ZD,MB33T和G33D中等,而C125H和G125D则较弱。
将主茎切片放入DAB溶液并加H2O2定位POD,发现POD活性主要定位在表皮组织和微管束部位,病苗韧皮部到形成层的区域为活性较强部位。虽然病株梢部组织的皮层细胞膨大明显,但维管束细胞并未有明显增大。纵切片可见韧皮部束状深色细胞呈不规则长线管状和向形成层扩散现象。在健株主茎基部表皮及微管束内POD活性皆强于梢部,但病株则以梢部活性强于基部。
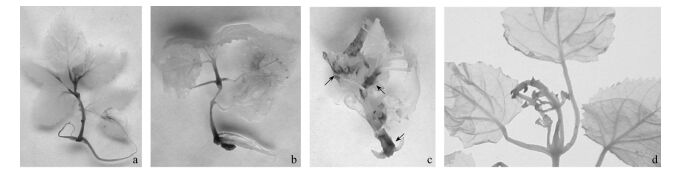
2.2 机械损伤对组培苗H2O2积累的影响泡桐叶片、叶柄或茎部用针刺或用止血钳夹伤12~24 h后,可在损伤部位检测到H2O2积累,其中健康组培苗叶片H2O2的累积量明显高于病苗(图 3); 但无性系TY2T健苗在损伤部位产生H2O2却明显少于ZH。机械损伤可调节活性氧代谢相关酶基因的表达,损伤诱导局部H2O2积累程度的差别可能与品种遗传特性或植株生理状态有关(Cheong et al., 2002; Zhou et al., 1999)。由于已知染病苗POD活性明显高于健苗,这也进一步表明病与健苗体内POD活性不是DAB法测定H2O2的限制因子。
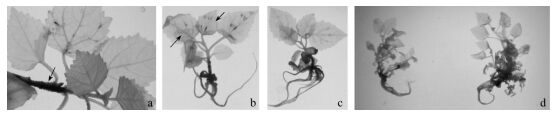
|
图 3 机械损伤对病与健康组培苗H2O2释放的影响 Figure 3 The gerneration of H2O2 in the leaves of infected and healthy paulownia plantlets in vitro cultured in response to wounding a.健康ZH主茎切口损伤, 箭头指H2O2积累部位Stem cut wounding treatment of healthy clone ZH, arrows point to the sites of strong H2O2 generation; b. ZH叶片夹伤ZH leaves was wounded perpendicular to the main vein by crushing with a hemostat; c. ZH未损伤Unwounding; d.病苗损伤处理,病苗ZD未损伤(左), 病苗ZD夹伤(右), 病株损伤诱导H2O2积累少Wounding treatment of infected plantlets ZD, unwounding(left), crushing treatment of leaves(right), less H2O2 generation induced in wounding diseased plantlet. |
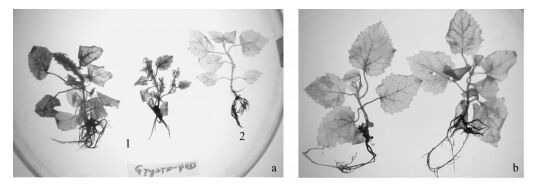
将携带植原体的病组培苗接穗插接在健康泡桐苗砧木上,嫁接3天后,所有组合在接口处(接穗楔形削面和砧木切口)都产生程度不同的H2O2局部积累(局限于伤口表面部位)。个别组合(ZH-ZD)也出现沿砧木接口向茎基和侧枝延伸的红褐色组织,并出现个别远离接口叶片的叶柄和叶脉H2O2释放现象,可能是损伤或病菌诱导了微管束内H2O2的系统性累积。嫁接6~7天后多数组合在砧木接口处的H2O2产生量有减弱趋势,但仍明显高于未损伤部位。此时TY2T接口H2O2释放降低明显,但C125H在砧木接口H2O2积累却仍较明显。
在正常组培条件下,引起健株无性系砧木开始显症的时间一般要在成功嫁接后25天左右(田国忠等, 1999)。本次试验组合MB33-ZD在嫁接21~25天(图 4)其砧木已开始表现丛枝症状。20天后在砧木接口处检测到很明显的H2O2过量积累, 并出现向下延伸,但原病接穗H2O2产生却不明显。相反,在接活但未发病组合和在嫁接后数小时内病接穗从砧木接口脱落的组合,其20天后的砧木接口处H2O2积累已不明显。而用自体健枝作接穗嫁接自体砧木对照(将健枝从主茎中部截断,梢部作接穗再嫁接到原株主茎上),接口处H2O2产生量也微弱。由此判断,嫁接25天左右在接口处H2O2的释放主要应是植原体与泡桐组培苗砧木专化性互作的结果。另外发现,在接口愈伤组织分化能力强的无性系,比如ZH、C020,愈伤组织中一直检测到较强H2O2积累。

|
图 4 泡桐病组培苗接穗嫁接健康砧木接种对相关组织H2O2释放和POD活性的影响 Figure 4 Effects of graft inoculation on healthy stocks with phytoplasma-infected paulownia scions under sterile tissue culture conditions on H2O2 generation and POD activity in affected tissues a-c.为组培苗嫁接25天后砧木开始表现丛枝症状组合(a)、砧木未发病组合MB33-ZD (b)及自体健康接穗嫁接组合MB33-MB33(c)。a to c show the apparence of in MB33-ZD with witches’ broom sympotoms (a), the stock displaying no symptoms (b) as well as self-graft of MB33-MB33(c) 25 d post graft.d-f为H2O2定位结果,d为a处理,e为b处理,f为c处理。d to f show the localization of H2O2, d represents treatment a, e represents treatment b, f represents treatment c。g和h为POD定位结果,g为a处理丛枝砧木叶片,h为c处理叶片和茎段。g and h show the POD localization, g represents treatment a, the leaves of stock, h represents leaves and stem segment of treatment c.箭头示嫁接接口及H2O2积累部位。Arrows point to the graft unions and parts ofH2O2generation. |
用DAB直接浸泡嫁接组合4 h,然后加入H2O2显色反应20 min来定位组织内POD活性。结果显示,嫁接后3~4天砧木切口部位POD活性明显高于其他部位,部分砧木有沿接口向上或向下延伸性POD活性增高区域,延伸长度在上下1 cm范围之内。
在病接穗内,仍维持强的POD活性,其切口处与其他部位相比未有明显增强。嫁接成活株、掉接穗株和未嫁接病接穗而仅做切口损伤的对照处理间所导致的切口POD局部增高似乎无明显的差别。此期间机械损伤对POD的基因的诱导表达可能占主导地位。
在嫁接7天后,某些无性系在接穗脱落的砧木切口长出愈伤组织部位维持强的POD活性。嫁接21~25天已开始表现出发病症状(腋芽萌生,组织切片经DAPI荧光显微镜检查证明植原体的存在)的组合MB33-ZD,接口及近接口主茎部位POD活性最强,在染病砧木中部腋芽萌生的短小茎叶内POD活性更明显,中部较大叶片的叶脉活性也增强。而健康对照嫁接苗的叶片、叶柄POD活性明显低于嫁接发病苗。
2.4 病与健苗主茎切片H2O2释放采用KI/淀粉试剂对切片组织内H2O2定位研究结果显示(图 5), 在放入试剂溶液20 h左右,健株横切片皮层和髓细胞间隙、木质部成熟导管管壁出现的H2O2释放较强,病株的相应部位H2O2产生较少。切片上H2O2的产生可能是切口损伤或溶液渗透势变化诱导作用的结果。

|
图 5 KI/淀粉显色法定位泡桐病与健组织切片中的H2O2释放 Figure 5 H2O2 generation of diseased and healthy tissue sections determined by KI/starch assay a,b.XH健株主茎切片,反应液中加GTY2TD病切片显色19 h后观察结果(a), XH健株切片中加健切片TY2T (b) The healthy XH main stem section, diseased GTY2TD sections were added into reaction solution(a) or healthy TY2T sections were added(b); c.C125H健切片The healthy C125H section; d.G125D病切片The diseased G125D section.箭头示木质部, 深色部位表示H2O2积累明显Arrows point to the xylem parts with deep-browned areas indicating distinct H2O2 accumalation |
不同无性系健康组培苗间在损伤后H2O2产生的强弱有差别,依次为XH≥C020>C125>ZH>TY2T。另外,用DAB溶液浸泡离体损伤叶片4 h以上后,由于叶片产生H2O2释放,浸泡溶液会逐渐变为红色,故溶液颜色在一定程度上可反映H2O2的释放量。其中,G125D的H2O2产生和释放最为明显。
在健康切片测定液中加入病组培苗切片,然后于25 ℃下测定加入病切片19和45 h后切片上和释放到溶液的H2O2量。初步的测定结果发现病苗茎段切片的加入(每80片健康苗切片加20片染病苗切片,对照为20片健康苗切片)具有增加健康切片的H2O2的产生量的趋势。从切片释放到溶液中的H2O2的量也相应增加。
由于植原体存在于泡桐筛管中,从横切片筛管断面会释放出一定量的植原体细胞和破碎细胞内含物,这些病菌组分很可能会与健康切片特定部位发生识别或结合,从而特异性激发健株细胞H2O2代谢作用。在植原体未能人工培养的情况下,此方法可能会成为研究植原体与寄主植物互作关系的一种新的有效手段。
2.5 H2O2对组培苗症状影响用H2O2溶液处理0.5~1 cm发病组培苗泡桐具芽茎段1 h,然后将茎段放在MS培养基上,于光照条件下培养。从表 1中可以看出,低浓度范围的H2O2处理(1.5~12.5 mmol·L-1)可明显抑制病苗的株高生长,丛枝症状与对照处理无显著差别。而较高浓度H2O2(25~100 mmol·L-1)则对病苗症状产生了抑制作用,表现为丛枝症状减轻、生根株增多; 而且,株高生长有恢复的趋势(表 1)。
|
|
在1周内,1 000 mmol·L-1以上的高浓度H2O2会导致健康泡桐茎叶全部枯死,组织褪绿呈漂白状。而感染植原体的9个丛枝外植体茎段在此浓度下仅有3个枯死,3个基部茎叶枯死而上部茎叶仍为黄绿色,且有一株生短根芽。而且较低浓度的H2O2也会引起健株成熟叶片叶柄至主脉出现水浸状褐化坏死。这说明染病外植体对H2O2的耐受浓度明显高于健株。
2.6 低透气环境和抗坏血酸处理对病与健康组培苗生长的影响低浓度抗坏血酸可促进健株组培苗生根,高浓度则抑制根生长。在0.4~100 μg·L-1范围内抗坏血酸具有缓解和抑制G33D,ZD等无性系病苗丛枝症状发展的效应,表现为叶片增大、节间伸长及根芽分化; 但病株需要较高浓度的抗坏血酸才能诱导根芽分化。当培养基内抗坏血酸浓度达到100 μg·L-1时,部分苗开始出现叶片变黄现象。当浓度达到1 mg·L-1时,转接的外植体在20天内枯死,而在2 mg·L-1时转接的外植体在数天内即完全枯死。
在茎段组培时,用不透气的塑料膜代替常规透气棉塞,及在严格的密封条件下,接种病与健组培苗茎段于三角瓶中, 结果显示,低透气环境会促使病苗叶片增大、节间伸长及根分化、存活时间延长等症状减轻的现象。密闭瓶内病株叶片POD活性主要集中在于叶脉组织,而透气瓶内病叶POD除叶脉外脉间叶肉组织内活性也比不透气瓶活性强(图 6)。已知在低氧条件下(0.1%~0.3%),细胞质抗坏血酸POD基因表达受到抑制,活性氧形成下降,HR细胞死亡减弱(Mittler et al., 1996; 1999)。因而可能是氧气交换不足能抑制病原诱导的活性氧爆发,以及进一步诱致POD/IAAO活性下降和内源生长素吲哚乙酸(IAA)水平回升。
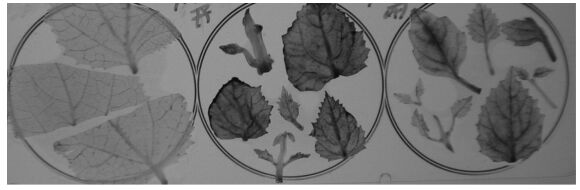
|
图 6 密闭瓶培养对感染植原体组培苗症状和POD活性的影响 Figure 6 Effect of sealed tissue culture flasks on the symptoms and the POD activity in leaves 左为密闭瓶中健叶TY2T POD定位,整叶POD活性低, 中为透气瓶中病叶GTY2TD,POD活性很高, 右为密闭瓶中病叶GTY2TD, POD活性低于透气瓶。Left shows the healthy leaf POD localization from sealed flask plantlets with less POD activity in whole leaf, middle shows the leaf POD localization from diseased plantlet culturing in aerating flask with very strong POD activity, right shows the diseased plantlet culturing in sealed flask with decreasing POD activity compared to the plantlets in aerating flask. |
机械损伤诱导染病泡桐组培苗和健康组培苗H2O2过度积累,其中健苗产生量明显强于病苗。而植原体侵染早期, 即从病菌侵染至症状表达期间可能发生着类似机械损伤诱导H2O2过度积累现象。当病菌成功地侵入砧木组织后(20 h左右)才出现系统性H2O2积累。而一旦病菌在植株体内成功定殖并大量繁殖和引起典型丛枝症状之后,一般感病无性系的H2O2的积累量、及再受损伤时H2O2的产生能力反而下降。
活性氧作为生物体内普遍产生的、对生命活动至关重要的物质,既具有信号传导和调控基因表达与细胞内代谢的功能,也会对生物产生损伤等多重作用(方允中等, 2007); 而在植原体与泡桐寄主互作关系中,活性氧可能既有对病菌膜和DNA的损伤而起到对病菌生长和繁殖产生抑制的作用,也会通过激发植物抗病性反应或代谢途径的改变而产生的抗病或致病反应,这些作用的强弱与活性氧产生的进程和强度密切相关。之前的研究已经发现植原体侵染导致泡桐体内POD和IAAO活性的明显升高,而且这种变化可能与寄主体内生长素IAA的氧化分解和丛枝症状的表达有密切联系。本研究进一步证明感染植原体的组培苗体内POD活性的明显增高发生在病菌定殖的微管束系统内,与植原体侵染引起韧皮部POD活性的增加及植原体寄生部位专化特性相吻合。据此推测,植原体侵染(介体昆虫刺吸传毒)可能首先诱导了寄主受影响部位的H2O2等物质的非正常积累,进一步导致相应组织细胞内POD和IAAO基因的过量表达和氧化游离IAA,进而导致维管束形成层分生组织细胞内IAA浓度降低和丛枝病症状的形成(Tian et al., 1995, 田国忠等, 1996; 2001a; 2001b)。从目前的研究结果看,泡桐体内特别是微管束内POD活性的升高主要应是植原体诱导泡桐POD基因过量表达的结果,但从最近动物菌原体(Mycoplasma gallisepticum)研究结果分析,也不能排除植原体起源的POD的存在和作用(Jenkins et al., 2008)。
本试验也发现,机械损伤、因溶液浓度改变及材料处理不及时而导致的叶片脱水或脱落、病菌侵染都可诱导泡桐组培苗局部组织H2O2释放。除嫁接接种外,H2O2产生部位与病菌直接作用部位似乎无必然联系。因而推断,植原体侵染的(介体昆虫刺吸传毒)早期反应首先是损伤或毒素诱导了H2O2的非特异性积累; 局部高浓度的H2O2既会对植原体的繁殖产生广谱性抑制作用(Peng et al., 1992),同时也会进一步诱导相应部位组织细胞内比如POD等致病或抗病相关基因的表达, 以及过敏性细胞坏死等抗病反应(Levine et al., 1994; Wu et al., 1997)。成功定殖的植原体在侵染初期(20天以内)很可能也发生与寄主专化性作用而诱导产生H2O2的特异性积累过程(Tanaka et al., 2003; Wu et al., 1997)。笔者用间苯三酚/盐酸染色法测定病与健组培苗茎部木质素结果显示,健株初生木质部导管壁有典型的紫红色木质化; 韧皮部筛管及其他细胞壁木质化现象不明显。而病株不仅导管分化少,而且导管的木质化程度也明显低于健株(结果未显示)。因而,植原体诱导的微管束部位POD活性的增高可能与生长素的氧化分解关系最为密切,而与木质素的积累联系较小(田国忠等, 1996; Tian et al., 1995)。
根据本研究结果分析,不同遗传背景的泡桐无性系间对机械损伤和病菌侵染后造成活性氧爆发的程度和方式上的差异,既与泡桐本身的遗传和生长特性有关,也可能与无性系对病菌抵抗能力强弱有密切联系(Parker, 2000; Zhou et al., 1999; Huckelhoren et al., 1998; Alvarez et al., 1998)。根据田间自然抗性表现和嫁接接种抗性鉴定结果来看(部分结果未发表),本研究所采用的泡桐试材中,C125和XH为抗病品系,其他为感病品系(田国忠等, 1992; 1999)。像C125品系在感染植原体后表现出较高H2O2产生能力, 可能发挥着抑制病菌生长和繁殖或起到进一步诱导抗病反应的作用。
已知抗坏血酸过氧化物酶通过作用于抗坏血酸而具有清除过量H2O2作用, 并且抗坏血酸可抑制POD活性, 所以,染病泡桐组培苗补充抗坏血酸后可能是通过清除过量的活性氧或抑制体内POD活动而逆转由病菌侵染引起的IAA的氧化分解和缓解丛枝症状的(Tian et al., 1995; Pekker et al., 2002; Rubinstein et al., 1993; Gebhard, 1982; Tian et al., 2004)。巨关升等(1996)对不同泡桐品种对丛枝病抗性与抗坏血酸含量的关系的研究显示,抗性强的品系抗坏血酸含量高于感病品系,同一品系的健株叶片含量也高于病叶。这一结果与本研究用抗坏血酸处理病组培苗可以减轻丛枝症状和抑制POD活性的结果相吻合。因而推断,泡桐抗氧化能力、活性氧爆发方式与程度以及相关的酶基因的表达水平皆与无性系或品种的抗病、耐病、症状的严重程度等存在密切的联系(Bolwell et al., 1997)。
泡桐丛枝植原体除影响H2O2变化外,笔者的研究结果也显示了
方允中, 郑荣梁. 2007. 自由基生物学的理论与应用[M]. 北京: 科学出版社: 120-159.
|
巨关升, 王蕤, 周银莲, 等. 1996. 泡桐丛枝病的抗性与维生素C关系的研究[J]. 林业科学研究, 9(4): 431-434. |
田国忠, 李永, 梁文星. 2003. 感染植原体的泡桐丛枝病组培苗和健康苗体内H2O2的测定[J]. 云南农业大学学报, 18(4): 160-161. |
田国忠, 李怀方, 裘维蕃. 2001a. 植物过氧化物酶研究进展究[J]. 武汉植物学研, 19(4): 332-344. |
田国忠, 张锡津, 罗飞, 等. 1999. 抗病和感病泡桐无性系组培苗对嫁接传染植原体的不同反应[J]. 林业科学, 35(2): 31-39. |
田国忠, 张锡津, 罗飞. 1996. 抗病与感病泡桐感染MLO后过氧化物酶和IAA氧化酶变化比较[J]. 林业科学研究, 9(MEM): 47-52. |
田国忠, 朱水芳, 罗飞, 等. 2001b. 根癌农杆菌对感染植原体的泡桐组培苗症状的影响[J]. 林业科学研究, 14(3): 258-264. |
Alvarez M E, Pennel R I, Meijer P J, et al. 1998. Reactive oxygen intermediates mediated a systemic signal network in the establishment of plant immunity[J]. Cell, 92: 773-784. DOI:10.1016/S0092-8674(00)81405-1 |
Barcelo A R, Pomar F, Lopez-Serrano M, et al. 2002. Developmental regulation of the H2O2-producing system and of a basic peroxidase isoenzyme in the Zinnia elegans lignifying xylem[J]. Plant Physiol Biochem, 40: 325-332. DOI:10.1016/S0981-9428(02)01376-1 |
Bolwell G P, Wojtaszek P. 1997. Mechanisms for the generation of reactive oxygen species in plant defence-a broad perspective[J]. Physiol Mol Plant Pathol, 51: 347-366. DOI:10.1006/pmpp.1997.0129 |
Cheong Y H, Chang H S, Gupta R, et al. 2002. Transcriptional profiling novel interactions between wounding, pathogens, abiotic stress, and hormonal responses in Arabidopsis[J]. Plant Physiol, 129: 661-677. DOI:10.1104/pp.002857 |
Gebhard K. 1982. Activation of indole-3-acetic acid oxidase from horseradish and prunus by phenols and H2O2[J]. Plant Growth Regul, 1: 73-84. DOI:10.1007/BF00024500 |
Huckelhoven R, Kogel K H. 1998. Tissue-specific superoxide generation at interaction sites in resistant and susceptible near-isogenic barley line attacked by the powdery mildew fungus(Erysiphe graminis f.sp hordei)[J]. Mol Plant Microbe Interact, 11: 292-300. DOI:10.1094/MPMI.1998.11.4.292 |
Jenkins C, Samudrala R, Geary S J, et al. 2008. Structural and functional characterization of an organic hydroperoxide resistance protein from Mycoplasma gallisepticum[J]. Journal of Bacteriology, 190: 2206-2216. DOI:10.1128/JB.01685-07 |
Levine A, Tenhaken R, Dixon R, et al. 1994. H2O2 from the oxidative burst orchestrates the plant hypersensitive disease resistance response[J]. Cell, 79: 583-593. DOI:10.1016/0092-8674(94)90544-4 |
Mittler R, Lam E, Shulaev V, et al. 1999. Signals controlling the expression of cytosolic ascorbate peroxidase during pathogen-induced programmed cell death in tobacco[J]. Plant Mol Biol, 39: 1025-1035. DOI:10.1023/A:1006110223774 |
Mittler R, Shulaev V, Seskar M, et al. 1996. Inhibition of programmed cell death in tobacco plants during a pathogen-induced hypersensitive response at low oxygen pressure[J]. Plant Cell, 8: 1991-2001. DOI:10.1105/tpc.8.11.1991 |
Musetti R, Toppi L S, Martini M, et al. 2005. Hydrogen peroxide localization and antioxidant status in the recovery of apricot plants from European stone fruit yellows[J]. European J of Plant Pathology, 112: 53-61. DOI:10.1007/s10658-004-8233-z |
Orozco-Cardenas M, Ryan C A. 1999. Hydrogen peroxide is generated systemically in plant leaves by wounding and systemin via the octadecanoid pathway[J]. Proc Natl Acad USA, 96: 6553-6557. DOI:10.1073/pnas.96.11.6553 |
Parker J E. 2000. Signaling in plant disease resistance//Dickinson M, Beynon J. Annual Plant Reviews, Vol.4. Molecular Plant Pathology. Hoboken: John wiley & Sons Inc, 144-174.
|
Pekker I, Tel-Or E, Mittler R. 2002. Reactive oxygen intermediates and glutathione regulate the expression of cytosolic ascorbate peroxidase during iron-mediated oxidative stress in bean[J]. Plant Mol Biol, 49: 429-438. DOI:10.1023/A:1015554616358 |
Peng M, Kuc J. 1992. Peroxidase-generated hydrogen peroxide as a source of antifungal activity in vitro and on tobacco leaf disks[J]. Phytopathol, 82: 696-699. DOI:10.1094/Phyto-82-696 |
Rubinstein B, Luster D G. 1993. Plasma membrane redox activity: components and role in plant processes[J]. Annu Rev Plant Phsiol Mol Biol, 44: 131-155. DOI:10.1146/annurev.pp.44.060193.001023 |
Sundaresan M, Yu Z X, Ferrans V J, et al. 1995. Requirement for generation of H2O2 for platelet-derived growth factor signal transduction[J]. Science, 270: 296-299. DOI:10.1126/science.270.5234.296 |
Tanaka N, Che F S, Watanabe N, et al. 2003. Flagellin from incompatible strain of Acidovororax avenae mediates H2O2 generation accompanying hypersensitive cell death and expression of PAL, Cht-1 and PBZ1, but not of LOX in rice[J]. Mol Plant-Microbe Interact, 16: 422-428. DOI:10.1094/MPMI.2003.16.5.422 |
Thordal-Christensen H, Zhang Z, Wei Y, et al. 1997. Subcellullar localization in papillae and hypersensitive response during the barley-powdery mildew interaction[J]. The Plant J, 11(6): 1187-1194. DOI:10.1046/j.1365-313X.1997.11061187.x |
Tian Guozhong, Yuan Qiaoping, Huang Qincai, et al. 1994. Effects of plant growth regulators and phenolic compounds on paulownia culture in vitro infected with mycoplasma-like organisms[J]. Int J Tropical Plant Diseases, 12(2): 43-52. |
Tian Guozhong, Li Yong, Huang Qincai, et al. 2004. Analysis of metabolic changes of in vitro cultured Paulownia sp. in response to paulownia witches' broom-phytoplasma by using long-term maintained and preserved paulownia-phytoplasma co-culture plantlets. Proceedings of the Tenth International Congress for Culture Collections Tsukuba, Japan, 10-15 October, 2004, 623.
|
Tian Guozhong, Huang Qincai, Yuan Qiaoping, et al. 1995. Correlation of metabolic changes of infected paulownia tissue culture with PWB-MLO pathogenic mechanism[J]. Science in China (Series B), 38(8): 954-943. |
Wu G, Shortt B J, Lawrence E B, et al. 1997. Activation of host defense mechanisms by elevated production of H2O2 in transgenic plants[J]. Plant Physiol, 115: 427-435. DOI:10.1104/pp.115.2.427 |
Zhou L, Thornburg R. 1999. Wound-inducible genes in plants//Reynolds P H S. Inducible Gene Expression. Oxford: CAB International, 127-167.
|
 2010, Vol. 46
2010, Vol. 46