文章信息
- 宋瑞清, 孙海珍, 董希文, 邓勋
- Song Ruiqing, Sun Haizhen, Dong Xiwen, Deng Xun
- 黑龙江沙棘干缩病病原菌的研究
- Research on the Pathogen of Dry Shrink on Seabuckthorn (Hippophae rhamnoides) in Heilongjiang Province
- 林业科学, 2010, 46(9): 88-95.
- Scientia Silvae Sinicae, 2010, 46(9): 88-95.
-
文章历史
- 收稿日期:2009-03-23
- 修回日期:2009-11-24
-
作者相关文章
2. 黑龙江省林业科学院 哈尔滨 150081;
3. 黑龙江省森林与环境科学研究院 齐齐哈尔 161005
2. Heilongjiang Forestry Academy of Science Harbin 150081;
3. Forest and Environment Institute of Heilongjiang Province Qiqihaer 161005
沙棘(Hippophae rhamnoides)是多年生的灌木或小乔木,具有极强的生态适应性,对于防风、固沙、防止水土流失、治理生态环境方面具有重要意义(杨芳,2004)。沙棘果性温,味酸涩,入肝、胃、大肠经,有活血散瘀、补脾健胃、化痰宽胸等功效。在沙棘干果肉中的沙棘果肉油含量一般为15%~25%,它含有丰富的维生素、多种微量元素、18种氨基酸、高活力的SOD以及黄酮类化合物,对人畜无毒副作用,已广泛应用于医药、保健、食品、化妆品等领域,是珍贵的药食两用资源(周张章等,2005)。
沙棘干缩病是世界范围内危害沙棘最严重的毁灭性病害,是所有沙棘栽培区都可能出现的危险性病害。沙棘干缩病的发生、蔓延是目前困扰沙棘产业化发展的重要因素。此病造成提前落叶,常常较健康树提早30天以上,树势早衰、有效寿命缩短,连续发病3~4年可致死亡,果实品质下降,产量损失达40%以上,对沙棘危害极大(杜汉君,2001)。自20世纪60年代该病在俄罗斯大面积流行以来,发展至今在世界沙棘主栽区都广泛流行。黑龙江省大量栽培沙棘始于20世纪80年代,栽培品种多为中国沙棘(Hippophae rhamnoides subsp.chinensis),该种类抗病,因此很难发现干缩病的流行。90年代从俄罗斯大量引入沙棘品种及选种材料,90年代末沙棘干缩病在引种区大流行。黑龙江省黑河市从俄罗斯引进的所有沙棘良种中,部分植株感染干缩病,有的主干干枯,甚至全株死亡,在地势低洼的黏土地发病更严重(张军等,2002)。关于此病的严重性,早在1913年苏联就已有过报道(武福亨等,2006)。
目前对引起该病的病原菌说法不一,不同环境、地域引起沙棘干缩病的病原菌各不相同。有专家将沙棘干缩病分为传染性干缩和非传染性干缩2种,传染性干缩的病原菌是大丽花轮枝孢菌(Verticillium dahliae)和丝核镰刀菌(Fusatium rhizoctonia),前者感染4年以上的植株,后者引起年幼植株的凋萎干缩(武福亨等,2006)。有报道认为该病是由影响沙棘生存状态的综合因素引起的,包括不良的栽培环境,如冬春季节融雪的暖天和寒冷剧烈交替之后,又遇上连续长时间的低温天气、沙棘园行间耕作深度对根部的机械损伤以及镰刀菌的感染等(武福亨等,2006)。张军等(1999)通过致病性测定确定引起沙棘干缩病的病原为沙棘双丝孢座菌(Plowightia hippophaes),无性型为胡颓子小色二孢(Microdiplodia elaeagnipotebnia)。杜汉君(2001)认为该病是由植株和病原菌—沙棘双丝孢座菌的生物学、遗传学和栽培生态学等因素综合作用的结果,干缩病的发生与沙棘成熟期关系密切,早熟品种比晚熟品种易感干缩病,且晚熟品种比较抗日灼,所以也不易发病(杜汉君,2002)。刘晓辉等(2006)报道辽宁省沙棘干缩病的病原菌为Fusarium sporotrichiella。
近年来本课题组在对黑龙江省引自俄罗斯的12年生的大果沙棘干缩病的发生危害和防治开展调查及田间试验的基础上,结合致病性测定、形态学和分子生物学鉴定等方法对沙棘干缩病病原菌进行研究,为病害的进一步防治奠定理论基础。
1 材料与方法 1.1 微生物的分离以研究黑龙江省沙棘干缩病病原、病原在沙棘植株上的分布以及病原菌与沙棘树栖真菌的关系为目的,分别于2006年10月、2007年5月、2007年8月3次在黑龙江省齐齐哈尔市森林与环境科学研究院附属实验林场采集沙棘植株样本。所采集的沙棘植株为12年生的大果沙棘,由黑龙江省齐齐哈尔市森林与环境科学研究院附属实验林场引自俄罗斯。分离所用培养基为改良的PDA培养基(马铃薯200 g,葡萄糖20 g,MgSO4·7H2O 1.5 g,KH2PO4 3 g,琼脂20 g,水1 L)。
在距离沙棘林缘50 m的林内,随机选取沙棘感病植株和健康植株各5株,采集叶、枝、干及根部样本,分别装入采集袋,编号同时记录生境条件。
1) 具有子实体的标本材料,直接切片,采用单孢分离的方法获得纯菌落。若子实体尚未成熟,保湿促成。
2) 不具有明显子实体的标本材料进行组织分离。将标本按所采部位(枝、叶、干、根)切剪成4~5 mm小块,设2组处理:一组为表面消毒组,采用次氯酸钠溶液[次氯酸钠(有效氯≥10%):水=1:4]处理样本块3~5 min,无菌水漂洗后接入平板培养基,每皿接入4~6块; 另一组为表面不消毒,样本块用无菌水漂洗后接入平板培养基,每皿4~6块。设5个重复。
3) 对有明显干缩病症状的植株,取病健交界处组织,用75%乙醇表面消毒30 s后,置于次氯酸钠溶液中消毒3~5 min,无菌水冲洗3~5次后晾干样品表面水分,接种于PDA平板培养基上。
25 ℃条件下黑暗培养,2天后挑取组织块周围的菌落进行纯化,对分离物进行归类、编号、转管保存。
1.2 致病性测定选择分离自具有明显干缩病症状植株的分离物作为致病性测定接种用微生物,接种体采用孢子悬浮液[用PD液体培养基对供试菌株进行摇床(150 r·min-1,25 ℃)培养3~5天,用无菌水将悬浮液调至浓度1×106个孢子·mL-1。]。按照柯赫氏法则,对分离物进行致病性测定。
1.2.1 室内接种接种苗木采用无菌土(土:沙=1:2,121 ℃灭菌3 h)播种苗。苗龄为4个月。采用灌根接种方法,用5 mL注射器吸取接种液接种于植株根际土壤中,以接种无菌水苗木作为对照,每个处理4株,3次重复。接种7~10天后观察病害发生情况。
1.2.2 室外接种该病的侵染点多为芽伤口及分枝处(杜汉君,2002),而修剪造成的剪口也是造成沙棘干缩病发生与流行的重要原因(武福亨等,2006)。因此,室外接种采用刮伤法接种植株的干部。5月中旬在树液开始流动后,采用刮伤法将孢子悬浮液接种于健康植株的干部,每个接种点的接种量为1 mL,以接种无菌水植株作为对照,连续保湿10天。每个处理10次重复。接种后定期调查发病情况。
1.2.3 病原物再分离8月初,在接种后发病率高、症状典型的发病植株病健交界处取样,进行病原物的再分离。方法同1.1。
1.3 病原鉴定 1.3.1 培养性状观察将病原菌菌株接种于改良的PDA平板培养基和改良的PSA平板培养基(马铃薯200 g,蔗糖20 g,MgSO4·7H2O 1.5 g,KH2 PO4 3 g,琼脂20 g,水1 L)上,24~25 ℃、黑暗条件下培养。4天后用十字交叉法测量PSA培养基上菌落生长直径,计算生长速率。观察菌落在2种培养基上的生长状态等特征。
1.3.2 形态特征观察用PDA平板培养基培养病原菌直至产孢。在显微镜下观察分生孢子形态和着生方式,照相记录。
1.3.3 18S rDNA ITS序列将病原菌菌株采用CTAB法(邢晓科等,2004)提取DNA。对DNA产物采用1×TAE的电泳缓冲液,在1.5%~2%的琼脂糖(含EB的终浓度为0.5%μg·mL-1)中电泳,电压为5 V·cm-1,电泳缓冲液高于胶面3~5 mm,电泳结束后,在Genegenius凝胶成像系统(美国Syngene公司)下观察。
利用真菌的通用引物ITS1:5′-TCCGTAGGTG AACCTGCGG-3′(20)和ITS4:5′-TCCTCCGCTTATT GATATGC-3′(20)(由大连宝生物公司合成)进行PCR扩增。PCR反应扩增的条件为:20 μL的反应体系中去离子水11.7 μL,10 ×PCR buffer(含Mg2+)2.0 μL,dNTP(2.5 mmol·L-1)2.0 μL,ITS1(20 μmol·L-1)1.0 μL,ITS4(20 μmol·L-1)1.0μL,Taq酶(5 U·μL-1)0.3 μL,DNA模板(20 μL)2.0 μL。PCR反应参数为:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸2 min,30个循环,最后在72 ℃延伸7 min结束反应,每次反应均设一空白对照,以去离子水代替模板,以排除系统误差,扩增产物用1%琼脂糖凝胶电泳检测。将PCR产物送至上海生物工程有限公司进行测序,测得的ITS序列在GenBank进行BLAST,对获得的同源序列进行序列分析,采用MEGA3.1软件中的UPGMA法构建进化树。通过同源性分析对病原菌的种进行分子水平鉴定。
1.4 病原菌在沙棘植株上的分布及致病性对分离自沙棘感病植株和健康植株各部位(叶、枝、干及根部)的菌株进行分类鉴定(方法同1.3),将鉴定为病原的菌株进行致病性测定(方法同1.2)。
2 结果与分析 2.1 病害症状发病植株的侵染点处薄壁组织出现轻度“肿块”,同时从表皮向韧皮部扩展,韧皮部有细线状的黑色坏死,导管变褐;后期出现凹陷、变硬、干缩。感病部位呈水渍状下陷,再发展为半边扁平干死,多年生枝上的病斑黑褐色、深灰色。导致植株叶片发黄并提前脱落。感病枝干一段时间内不死亡,下一生长季节病皮多从病健交界处开裂,出现翘皮、脱落。
2.2 分离结果自干部发病部位获得6种真菌,其中经表面消毒样品上获得2种(4菌株),表面未消毒样品上获得4种(表 1)。
|
|
致病性测定接种试验选择经表面消毒样品分离获得的4个菌株:LD-002,LD-10,LD-101和LD-11。菌株LD-002的接种发病率最高,室内接种发病率为100%,野外接种发病率为80%;其次为菌株LD-10(室内接种发病率为33.33%,野外接种发病率为50%);菌株LD-101接种发病率较低(室内接种发病率为8.33%,野外接种发病率为40%)。接种菌株LD-11的植株未发病。
接种菌株LD-002, LD-10, LD-101的发病植株其症状表现相同。发病初期薄壁组织出现轻度的“肿块”,而后韧皮部呈现细线状的黑色坏死,导致导管变褐,感病部位出现凹陷、变硬、干缩,植株提前落叶。其症状与沙棘干缩病的症状相同(图 1)。

|
图 1 接种菌株LD-002后的发病症状 Figure 1 Symptom after inoculation with strain LD-002 A:沙棘幼苗Seabuckthorn seedlings;B:接种Inoculation;C:症状Symptom;D:发病植株Diseased plants. |
对接种引起干缩病植株进行再分离,获得菌株shz-5, hz-001, hz-6。这些菌株在形态上、菌丝生长速率、菌落形态、产生色素等方面的特征与菌株LD-002相同。
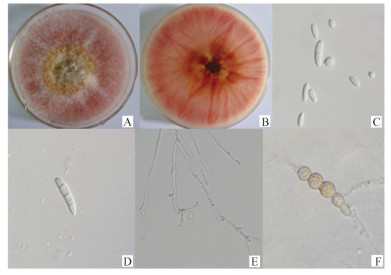
2.4 病原菌的鉴定 2.4.1 菌体培养特性及形态特征PDA及PSA平板培养基上,菌株生长状态相近。菌落生长新区菌丝均匀,贴生、密集。气生菌丝棉絮状后有粉状,初白至玫瑰色,后变为锦葵红,间有浅驼色,菌落背面可见石竹紫色的环带。PSA培养基上生长4天菌落直径为5.5 cm。7~8天后产生分生孢子。产孢细胞多芽生;小型分生孢子数量多,呈椭圆形至倒卵圆形,大型分生孢子数量少,呈镰刀状弯曲,纺锤形,多为3隔,大小为(24~46) μm×(3.5~6) μm;厚垣孢子球形,大多串生,直径9~11 μm(图 2)。
|
图 2 菌株LD-002的形态学特征 Figure 2 Morphology of isolate LD-002 A:菌落正面Colony face;B:菌落背面Colony back;C:小型分生孢子Microconidia;D:大型分生孢子Macroconidia;E:产孢结构Peduncles of the conidiophores;F:厚垣孢子Chlamydospores. |
1) 菌株LD-00218S rDNA ITS序列及分析 用引物ITS1和ITS4从菌株LD-002扩增出的目的片段为508 bp(图 3, 4),其中1~5 bp为16S rRNA部分序列,6~149 bp为ITS1,150~309 bp为5.8S rRNA,310~460 bp为ITS2,461~508 bp为28S rRNA部分序列。GenBank登陆号为EU284169。
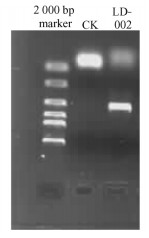
|
图 3 菌株LD-002 rDNA ITS区段的PCR产物 Figure 3 PCR products of rDNA ITS of strain LD-002 |

|
图 4 菌株LD-002 rDNA ITS序列 Figure 4 ITS sequence of strain LD-002 |
从GenBank核酸序列数据库进行比对,获得相似率较高、亲源关系相近的物种,特别是Fusarium属内已知不同种的ITS序列,研究其中的系统发育关系,构建系统进化树(图 5)。聚类分析结果表明,菌株LD-002与Fusarium sporotrichioides (登录号AF414972)的同源性达100%,聚类为同种。

|
图 5 菌株LD-002, shz-5与近缘种构建的系统发育树 Figure 5 UPGMA phylogenetic tree based on the rDNA ITS sequences of LD-002, shz-5 and relating species |
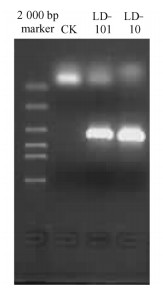
2) 菌株LD-10和菌株LD-101 18S rDNA ITS序列及分析用引物ITS1和ITS4从菌株LD-10和菌株LD-101分别扩增出的目的片段527和526 bp(图 6,7,8),其中1~4 bp为18S rDNA部分序列,5~138 bp为ITS1,139~296 bp为5.8S rRNA,297~447 bp为ITS2,448~496 bp为28S rRNA部分序列。GenBank登陆号分别为EU336987和EU336990。
|
图 6 菌株LD-10和菌株LD-101 rDNA ITS区段的PCR产物 Figure 6 PCR products of rDNA ITS of strain LD-10 and LD-101 |

|
图 7 菌株LD-10 rDNA ITS序列 Figure 7 ITS sequence of strain LD-10 |

|
图 8 菌株LD-101 rDNA ITS序列 Figure 8 ITS sequence of strain LD-101 |
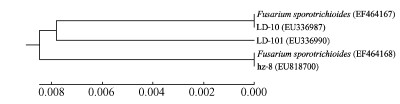
聚类分析结果表明(图 9),菌株LD-10和菌株LD-101与Fusarium sporotrichioides(登录号EF4641-67)的同源性达99%,聚类为同种。
|
图 9 菌株LD-10, LD-101与近缘种构建的系统发育树 Figure 9 UPGMA phylogenetic tree based on the rDNA ITS sequences of LD-10, LD-101 and relating species |
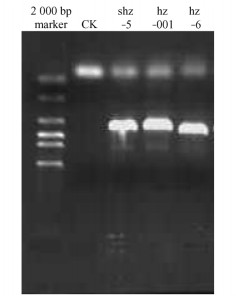
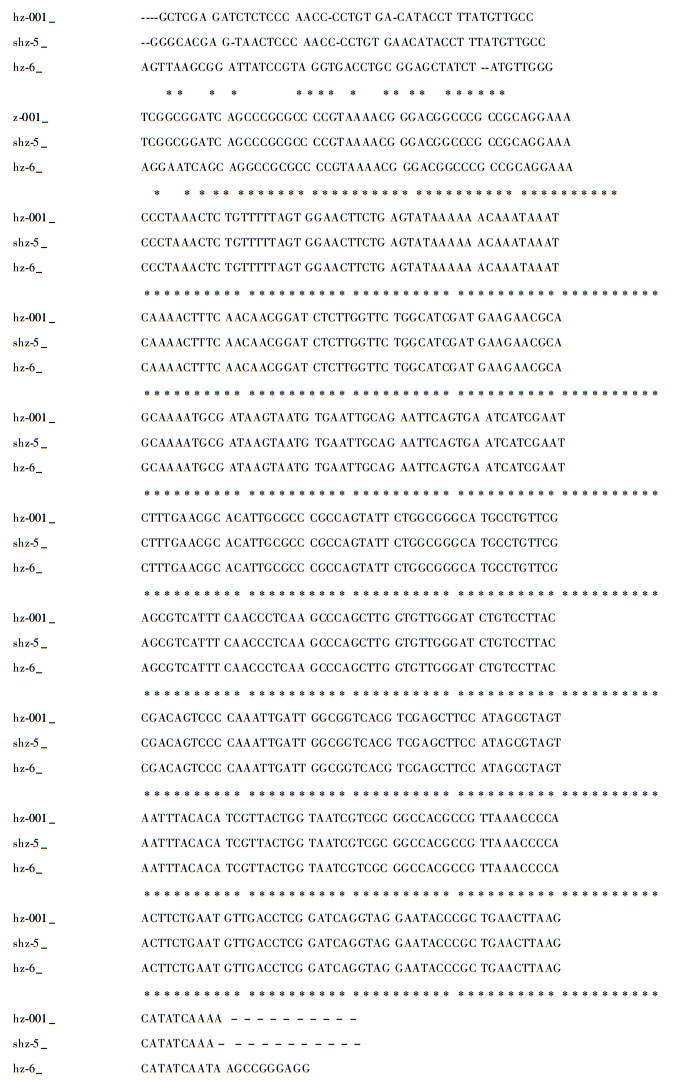
3) 菌株shz-5, hz-001, hz-6 rDNA ITS序列及分析 菌株shz-5, hz-001, hz-6为再次分离获得的菌株。用引物ITS1和ITS4从菌株shz-5, hz-001和hz-6扩增出的目的片段分别为504,505和518 bp(图 10, 11),其中1~3 bp为18S rRNA部分序列,4~148 bp为ITS1,149~306 bp为5.8S rRNA,307~467 bp为ITS2,468~504 bp为28S rRNA部分序列,GenBank登陆号分别为FJ238109,FJ238107,FJ238110。
|
图 10 菌株shz-5,hz-001,hz-6 rDNA ITS区段的PCR产物 Figure 10 PCR products of rDNA ITS of strains shz-5, hz-001 and hz-6 |
|
图 11 菌株shz-5, hz-001和hz-6 rDNA ITS序列 Figure 11 ITS sequence of strains shz-5, hz-001 and hz-6 |
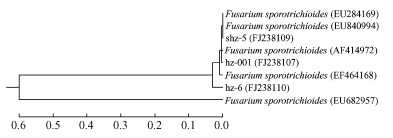
聚类分析结果表明(图 12),菌株shz-5与Fusarium sporotrichioides (登录号EU840994)的同源性达100%,聚类为同种;菌株hz-001与Fusarium sporotrichioides (登录号AF414972)的同源性达100%,聚类为同种;菌株hz-6与Fusarium sporotrichioides (登录号EF464168)的同源性达98%,聚类为同种。
|
图 12 菌株shz-5, hz-001和菌株hz-6与近缘种构建的系统发育树 Figure 12 UPGMA phylogenetic tree based on the rDNA ITS sequences of shz-5, hz-001, hz-6 and relating species |
综合各菌株的培养特性、形态特征以及18S rDNA ITS序列测定结果,将菌株LD-002, LD-10, LD-101和再分离获得的菌株shz-5, hz-001和hz-6确定为拟枝孢镰孢菌(Fusarium sporotrichioides)。
2.5 病原菌在沙棘植株上的分布及致病性自沙棘树栖真菌中鉴定出8个沙棘干缩病病原菌—拟枝孢镰孢菌(Fusarium sporotrichioides)菌株。6个菌株分离自感病植株,其中从叶部、枝部、根部分别获得1个菌株,自干部获得3个菌株;2个菌株来自健康植株,干部、枝部各1株(表 2)。
|
|
分离自沙棘感病植株和健康植株不同部位的病原菌菌株均具有一定的致病性,在致病力上存在一定的差异。生长在干部的菌株致病力较强,其中菌株LD-002的致病力最强,室内接种发病率高达100%,室外接种发病率为80%;其次为生长在根部的菌株hz-8(室内接种发病率为42%,室外接种发病率为30%);分离自叶部的菌株致病力相对较弱(室内接种发病率为8.3 %,室外接种发病率为20%)。
3 结论与讨论通过病害症状的观察、病原菌室内外接种试验、病原菌形态学及分子生物学鉴定,确认引起黑龙江省大果沙棘干缩病的病原为拟枝孢镰孢菌。该病原菌在黑龙江省大果沙棘上的危害在国内外尚属首次报道。
病原物分离结果表明,拟枝孢镰孢菌可生长在沙棘的叶部、枝干部及根部,生长在不同部位的菌株存在致病力上的差异, 生长在沙棘干部的菌株致病力较强。
权威资料(http://www.indexfungorum.org)显示,引起黑龙江省沙棘干缩病的病原菌与刘晓辉等(2006)报道的辽宁省沙棘干缩病的病原菌Fusarium sporotrichiella为同物异名,当前正确的学名应为Fusarium sporotrichioides。该菌在农作物上的报道较多。根据国内外的报道,拟枝孢镰孢菌是经常发现于谷类植物中的一种真菌。该菌被认为是1942—1948年俄罗斯真菌毒素中毒流行病的病原,该病最早可追溯到1913年和1932年。该病大量流行的地区是邻近里海的Orenburg地区。该菌能产生一种称为单端孢霉烯(trichothecene)的毒素,该毒素引起的病害现在称为食物中毒(alimentary toxic aleukia)。该病引起的症状与有辐射引起的辐射病相似(Desjardins, 2006)。该菌能引起小麦(Tricticum aestivum)、玉米(Zea mays)茎腐病(Booth,1977;Nelson et al., 1983),云南灯盏花(Erigeron brevscapus)根腐病(杜宾等,2007),穗花狐尾藻(Myriophyllum spicatum)茎腐病(Andrews et al., 1981),还可以引起马铃薯(Solanum tuberosum)干腐病(叶琪明等,1995)。
在黑龙江省引进的大果沙棘上的拟枝孢镰孢菌作为一种致病菌系首次报道。有关病害的发生、传播途径、防治方法,不同生态条件下病菌的侵染过程和致病机制尚需要进一步研究。
杜汉君. 2002. 沙棘品种抗干缩病性鉴定与筛选[J]. 沙棘, 15(1): 13-14. |
杜汉君. 2001. 沙棘干缩病发病规律及成因的调查与分析[J]. 沙棘, 14(1): 13-15. |
杜宾, 杨生超, 刘翠琼, 等. 2007. 云南灯盏花根腐病病原初步鉴定[J]. 中国农业科学, 40(8): 1830-1834. |
刘晓辉, 冀宝营, 孙翠焕, 等. 2006. 沙棘干缩病拮抗放线菌的分离筛选与鉴定[J]. 沙棘, 19(3): 23-25. |
武福亨, 赵玉珍. 2004. 前苏联沙棘病虫害的研究与防治[J]. 国际沙棘研究与开发, 2(4): 44-48. |
邢晓科, 郭顺星. 2004. 从ITS序列探讨猪苓与其伴生菌的亲缘关系[J]. 微生物学通报, 31(2): 34-36. |
杨芳. 2004. 沙棘的研究进展[J]. 第一军医大学分校学报, 27(1): 79-81. |
叶琪明, 王拱辰. 1995. 浙江马铃薯干腐病病原研究初报[J]. 植物病理学报, 25(2): 148. |
张军, 靳文斌. 2002. 寒地沙棘干缩病流行的构成与避害[J]. 沙棘, 15(2): 16-18. |
张军, 杜汉君, 单金友, 等. 1999. 沙棘干缩病发生规律及防治途径研究初报[J]. 沙棘, 12(2): 27-31. |
周张章, 周才琼, 阚健全. 2005. 沙棘的化学成分及保健作用研究进展[J]. 粮食与食品工业, 12(2): 15-18. |
Desjardins A E. 2006.Fusarium mycotoxins: chemistry, genetic, and biology. AUS: American Phytopathological Society.
|
Andrews J H, Hecht E P. 1981. Evidence for pathogenicity of Fusarium sporotrichioides to Eurasian water milfoil, Myriophyllum spicatum[J]. Can J Bot, 59(6): 1069-1077. DOI:10.1139/b81-146 |
Booth C. 1977. The genus Fusarium. Kew, UK: Commonwealth Mycological Institute.
|
Nelson P E, Tousson T A, Marasas W F O. 1983. Fusarium species. An illustrated manual for identification. Pennsylvania[M]. USA: The Pennsylvania State University Press.
|
 2010, Vol. 46
2010, Vol. 46