文章信息
- 孙玥, 庄海峰, 贾淑霞, 谷加存, 王政权
- Sun Yue, Zhuang Haifeng, Jia Shuxia, Gu Jiacun, Wang Zhengquan
- 多年施用氮肥对水曲柳人工林内生菌根真菌侵染及其根尖形态的影响
- Effects of Nitrogen Fertilization on VA Mycorrhizal Fungal Colonization and Root Morphology of the First Order Roots in Fraxinus mandshurica Plantation in Response to the colonization
- 林业科学, 2010, 46(9): 50-57.
- Scientia Silvae Sinicae, 2010, 46(9): 50-57.
-
文章历史
- 收稿日期:2009-07-21
- 修回日期:2010-01-03
-
作者相关文章
细根形态与功能具有密切联系(Pregitzer,2008),不同形态细根在陆地生态系统碳(C)和养分循环中的作用存在较大差异。例如,Pregitzer等(2002)对北美9个温带阔叶和针叶树种研究表明:生长在根系末端的1级根直径细、N浓度高、呼吸速率快,主要起吸收功能作用,而高级根则相反,主要起运输和储藏作用;Guo等(2008a)对长叶松(Pinus palustris)前3级根研究发现:直径最细的1级根寿命最短,死亡后归还到土壤中的C和N平均占前3级根的50%和64%。细根的这种生理生态功能依赖于菌根真菌(Eissenstat et al., 1997;Pregitzer et al., 2002)。菌根真菌作为根系的重要组分,不但帮助细根吸收养分和水分(Allen, 1992),而且影响细根的生理生态过程,如细根寿命和周转(Eissenstat et al., 2002)。King等(2002)对外生菌根树种火炬松(Pinus taeda)研究表明:未侵染菌根真菌的细根(直径 < 1 mm)寿命181天(年周转率2.02),而侵染的细根寿命388天(年周转率0.94);Hooker等(1995)在内生菌根树种杨树(Populus sp.)同样发现菌根真菌侵染影响细根寿命。因此,菌根真菌侵染对细根生理生态功能的影响是根系生态学关注的重要研究内容(Pregitzer,2008)。
菌根真菌侵染和细根形态均与土壤氮(N)有效性密切相关。已往的研究表明:菌根真菌对根尖(或1级根)细胞的侵染直接影响到细根形态(Berta et al., 1993),同时受土壤N有效性的影响,使侵染和未侵染的根尖吸收功能存在差异。Cruz等(2004)通过研究角豆树(Ceratonia siliqua)发现:养分贫瘠条件下被菌根真菌侵染的根尖对N的吸收速率比未被侵染的根尖高出90%,在养分充足条件下也达到30%~40%。此外,菌根真菌侵染影响根尖形态,Berta等(1990)对青蒜(Allium porrum)的研究发现:内生菌根侵染后根系的分支增加,根长减小;Hetrick等(1988)对美国西部须芒草(Andropogon gerardii)的研究可知:内生菌根真菌侵染后细根直径未发生变化,但比根长显著降低。土壤N有效性、菌根真菌侵染和根尖形态之间存在重要关系(Kabir et al., 1997; Nilsen et al., 1998; Bidartondo et al., 2001)。目前国外的研究结果主要是1年生或多年生草本植物在实验室得到的,对于野外树木根尖在这方面的研究很少。我国对这方面研究也主要是在农作物或草本植物中(刘润进等,2007),主要考虑土壤养分对内生菌根真菌侵染率的影响等。
水曲柳(Fraxinus mandshurica)是内生菌根树种。1级根是典型的吸收根,其形态变化影响生理和生态功能(Guo et al., 2008a)。王向荣等(2006)研究表明:水曲柳1级根形态存在明显的变异,这种变异是受菌根真菌侵染影响的还是受土壤养分影响的不清楚。本研究通过施肥处理、不同季节和不同土层生长的根尖取样:1)研究土壤N有效性与不同季节、不同土层生长的根尖菌根真菌侵染率的关系;2)揭示内生菌根真菌对根尖直径、长度和比根长影响;3)探讨施肥和菌根真菌对根尖形态的综合作用。为了解水曲柳1级根形态与内生菌根真菌侵染、土壤N有效性、生长季节和着生土层之间的关系,为深入研究树木根系结构与功能奠定基础。
1 材料与方法 1.1 研究区自然概况研究地点位于黑龙江省尚志市东北林业大学帽儿山实验林场尖砬沟森林培育实验站(127°30′—127°34′ E,45°21′—45°25′ N)。该地区属温带大陆性季风气候,年均气温2.8 ℃,年均降水量723 mm,年均蒸发量1 094 mm,无霜期120~140天,≥10 ℃积温2 526 ℃。样地设于山坡中上部,坡度13°左右,土壤为暗棕壤,平均土层厚度40~50 cm。林分为19年生水曲柳人工纯林,株行距1.5 m×2.0 m。目前树高和胸径分别为(12.90±1.03) m和(12.50±0.59) cm。
1.2 研究方法 1.2.1 样地设置在山坡中上部(海拔480~500 m,坡向西坡,坡度11~15°左右)的水曲柳人工林内设置6块样地(面积20 m×30 m),其中,3块样地为对照,另外3块样地为施肥处理。立地条件相对一致。2003—2005年间,从5—9月,每月中旬分别在施肥样地内施氮肥(硝酸铵),年施肥量为10 g N·m-2。根据土壤温度的季节变化确定每月施肥量,其中5和9月施肥量均为15.25%,6和8月施肥量均为21%,7月施肥量为27.5%。
1.2.2 根系取样和分级2005年5月15日、7月15日和9月15日分别在6块样地内取样,每块样地随机选择3个样点,每样点用20 cm(长)× 10 cm(宽) × 10 cm(高)的取样器由上至下分2层(0~10 cm,10~20 cm)取土柱样品。Pregitzer等(2002)采用该取样方法研究北美9个树种的1~5级根,因此,该取样方法能够取到根尖部位。从土柱样品中将全部根系取出,装入贴有标签的封口袋中。在实验室内,根据Pregitzer等(2002)方法将1级根取下保存在装有FAA固定液的塑料瓶中,在各塑料瓶上贴上标签进行菌根真菌侵染鉴别。
1.2.3 菌根侵染的观察和细根形态的测定从每一个装有FAA固定液的塑料瓶中随机取出30个根编号(1~30号),分别称量单个根的鲜质量(精度0.000 01),然后将这30个根用EPSON EXPRESSION 10000XL彩色扫描仪逐个进行扫描,用根系分析软件(WinRhizo)分析单个根的直径和长度。采用Trypan blue染色法(Phillips et al., 1970)对这些样品按编号进行染色和制片,并在显微镜下分别统计被丛枝菌根真菌侵染的细胞数量和未侵染的细胞数量,计算菌根侵染率。菌根侵染率=侵染的细胞数/总细胞数×100% (刘润进等,2007)。对照和施肥样地每个取样季节各分析1级根菌根真菌侵染总数540条(根数30×样点数3×样地数3×土层数2),这些根系样品均是取自根尖往上1 cm范围内,包括根冠、分生区、伸长区和成熟区。由于样品经过Trypan blue法染色后,根组织中的物质除菌丝外全部被剔除,这样计算生物量会产生极大偏差,本研究比根长是采用鲜质量计算的结果。
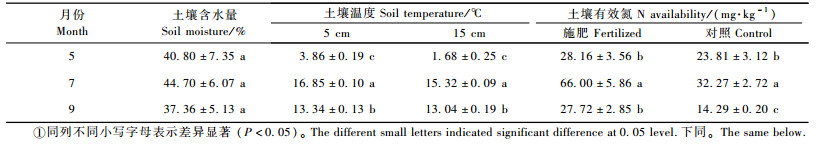
1.2.4 土壤有效氮和土壤温度的测定2005年5,7,9月取样同时,在各个取样点上取出300 g左右新鲜土壤,装入塑料袋密封放入低温箱(2~4 ℃),然后带回实验室分析土壤硝态氮、铵态氮含量和土壤含水量。硝态氮采用酚二磺酸比色法(鲁如坤,2000),铵态氮采用靛酚蓝比色法(鲁如坤,2000)。土壤温度采用便携针式土壤温度计(ST-6310,美国SP公司)在土壤5和15 cm深处每天观测3次(8:00, 14:00, 20:00)。各取样季节的土壤有效N平均含量、5和15 cm平均温度和土壤含水量见表 1。
|
|
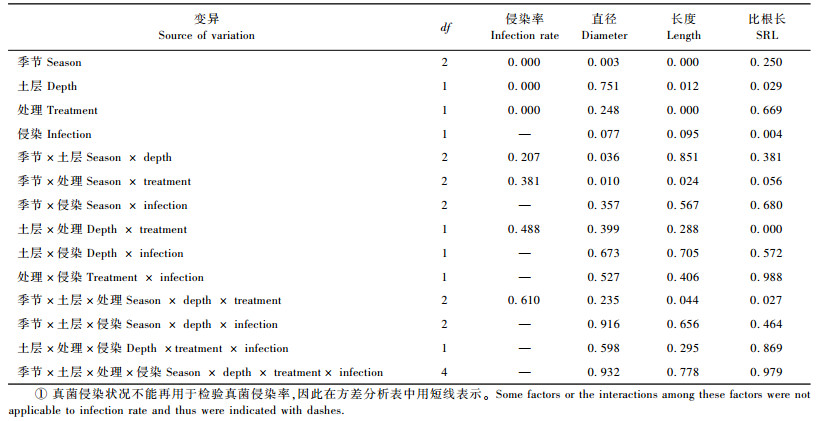
首先对各次采样分析结果数据计算平均值和标准差,然后采用方差分析方法分析1级根侵染率、直径(mm)、长度(cm)和比根长(m·g-1)与施肥处理、季节和土层之间的差异。真菌侵染率采用季节、土层和施肥处理(3×2×2)混合模型(PROC MIXED)进行检验。直径、长度和比根长采用季节、土层、施肥处理和真菌侵染(3×2×2×2)混合模型进行检验。同时分析这些因子之间的交互作用,显著性水平α=0.05, 采用SPSS 11.5软件处理数据,Sigmaplot 9.0软件制图。
2 结果与分析 2.1 施N肥处理、土壤深度和季节对菌根真菌侵染率的影响施N肥处理、土壤深度和季节对水曲柳人工林1级根内生菌根真菌侵染率有显著影响(3个因子显著性水平P < 0.01,表 2,图 1)。施N肥处理导致菌根真菌侵染率显著降低,施肥(39.4%)比对照(50.3%)平均减少10.9%(图 1)。无论施肥或不施肥,表层土壤(0~10 cm)侵染率(施肥为43.0%,对照为55.3%)高于亚表层(10~20 cm,施肥为35.8%,对照为45.3%)。菌根侵染率具有明显的季节变化,春季最高(施肥为48.9%,对照为56.9%),秋季最低(施肥为28.5%,对照为43.2%)(图 1)。

|
图 1 水曲柳1级根菌根侵染率在对照和施肥样地、不同土层和季节的变化(平均值±标准差) Figure 1 The rate of VA mycorrhizal fungal colonization in the first order roots of F. mandshurica with different soil depths and seasons in control and fertilized plots(mean±SD) |
|
|
施肥处理和内生菌根真菌侵染对1级根直径影响不显著(P = 0.248,P = 0.077,表 2),季节对直径影响显著(P = 0.003,表 2)。侵染和未侵染的1级根直径均为(0.27±0.02) mm。季节变化对直径有显著影响(P = 0.003,表 2),夏季最高,春季和秋季较低(图 2)。其中,对照样地夏季直径为(0.27±0.02) mm,春季和秋季分别为(0.26±0.01) mm和(0.26±0.02) mm,施肥样地夏季直径为(0.28±0.02) mm,春季和秋季分别为(0.26±0.01) mm和(0.24±0.02) mm。此外,季节与土层,季节与处理的交互作用对直径也有显著影响(P = 0.036,P = 0.010,表 2)。
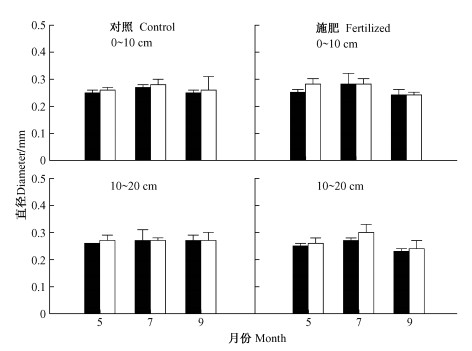
|
图 2 不同土层和季节对施肥和菌根真菌侵染对水曲柳1级根直径的影响 Figure 2 The effects of fertilization and VA mycorrhizal fungal colonization on diameter of the first order roots of F. mandshurica in different soil depths and seasons 
|
施肥处理、季节和土层显著降低了1级根根长(3个因子显著性水平P < 0.05,表 2),内生菌根真菌侵染使1级根长度略有降低,但差异不显著(P= 0.095,图 3,表 2)。对照样地中,菌根侵染平均单根长度(0.92±0.10) cm与未侵染长度(1.01±0.18)cm相比降低8.9%,同样,在施肥样地中,菌根侵染导致单根长度平均降低6.9% [菌根侵染长度为(0.81±0.10)cm,未侵染为(0.87±0.12)cm]。不同季节(P < 0.001)、不同土层(P < 0.05)和不同处理(P < 0.001)以及3者的交互作用(P < 0.05)对根长都有显著影响(表 2)。1级根长度从春季到秋季逐渐降低(图 3),土壤亚表层1级根平均长度(0.94±0.12)cm明显高于土壤表层(0.86±0.13)cm,对照样地和施肥样地1级根平均长度分别为(0.96±0.14)和(0.84±0.11)cm。此外,季节与处理的交互作用对长度也有显著影响(P= 0.05,表 2)。
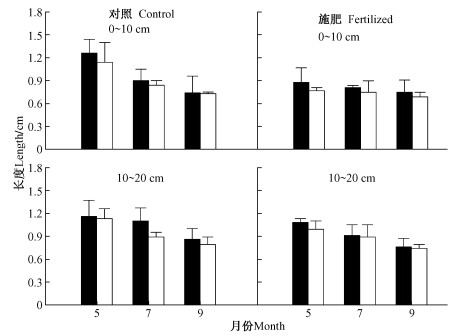
|
图 3 不同土层和季节对施肥和菌根真菌侵染对水曲柳1级根长度的影响 Figure 3 The effects of fertilization and VA mycorrhizal fungal colonization on length of the first order roots of F. mandshurica in different soil depths and seasons |
施肥处理和季节对1级根比根长(SRL)影响不显著(P= 0.669,P= 0.250,表 1),内生菌根真菌侵染影响显著(P= 0.004,表 2),导致比根长显著下降(图 4)。对照样地中,菌根真菌侵染导致SRL降低14.4%[菌根侵染比根长为(124.5±21.1)m·g-1,未侵染为(145.4±31.8)m·g-1],施肥样地中比根长降低13.9%[菌根侵染比根长为(127.6±24.2)m·g-1,未侵染为(148.3±29.1)m·g-1]。土层对1级根SRL也有显著影响(P < 0.05,表 1),亚表层1级根平均SRL(144.2±26.2)m·g-1明显高于表层(128.7 ±26.9)m·g-1。此外,土层与处理,季节、土层与处理的交互作用对SRL有显著影响(P= 0.001,P= 0.027,表 2)。

|
图 4 不同土层和季节对施肥和菌根真菌侵染对水曲柳1级根长度的影响 Figure 4 The effects of fertilization and VA mycorrhizal fungal colonization on SRL of the first order roots of F. mandshurica in different soil depths and seasons |
根系与菌根真菌共生是植物长期进化的产物,陆地生态系统中90%左右的植物根系都着生菌根真菌(Allen, 1992),主要功能是扩大根系吸收面积、帮助根系吸收养分和水分,尤其是在胁迫条件下(刘润进等, 2007)。但是,菌根真菌侵染程度受树种(Chapin et al., 2002)、土壤N有效性(Wallenda et al., 1998)、土壤温度和水分的限制(Hooker et al., 1995; Ruotsalainen et al., 2002)。已往的研究表明:菌根真菌对土壤N有效性反应敏感,随着土壤N有效性增加根系菌根真菌侵染率降低(Brundrett, 2002)。例如,Smith等(1986)对沙葱(Allium cepa)研究表明:增施N肥会降低VA菌根真菌的侵染率;Caporn等(1995)对欧石楠(Calluna vulgaris)研究认为:有效氮的增加可以减少菌根的数量或者降低菌根的活性。本研究结果表明:施N肥处理后水曲柳1级根菌根真菌侵染率显著降低(P < 0.01,图 1,表 2),表层平均降低22%,亚表层平均降低21%。施N肥处理导致侵染率降低可能有3个主要原因:第一,施肥降低林地土壤中菌根真菌数量。Compton等(2004)在北美阔叶林研究发现,施N肥(15 g·m-2a-1)导致真菌生物量减少37%;贾淑霞等(2009)对水曲柳林分研究表明,施N肥(10 g·m-2a-1)导致水曲柳林地真菌数量比对照减少70%,微生物生物量减少73%。真菌生物量和数量降低,可能导致菌根真菌侵染率降低。第二,施肥降低林地土壤pH值。土壤pH是影响菌根真菌发育的重要因素,直接影响孢子萌发和菌丝生长(刘润进等, 2007)。绝大多数菌根真菌在微酸性土壤中发育良好,pH过高或过低都不利于菌根真菌生长和繁殖。在水曲柳林地施肥导致土壤pH从6.16下降到4.36,说明施肥后土壤酸化可能是侵染率降低的原因之一。第三,施N肥降低根系对菌根真菌的依赖程度。根据植物成本-效益理论(cost-benefit)(Eissenstat et al., 1997),菌根真菌的主要作用是帮助根系吸收养分和水分,维持菌丝正常生理活动需要投入光合产物(C)。当土壤养分(如N,P)有效性较高时,根系对菌根真菌的依赖性降低,投入到真菌中的C会减少,植物则主动在新根表面减少菌丝侵染的位点数(Chapin et al., 2002)。因此,施N肥导致水曲柳1级侵染率降低可能与根系对菌根真菌依赖程度降低有关。
菌根真菌侵染率具有明显的季节性,尤其是在温带地区,主要是菌根真菌孢子萌发和菌根形成与土壤温度和湿度有关(刘润进等, 2007)。已往的研究表明:夏季侵染率高于春季和秋季,例如,Brundrett等(1994)对澳大利亚桉树(Eucalyptus marginata)、Swaty等(1998)对美国可食松(Pinus edulis)研究均发现夏季侵染率最高,这种季节性格局同样在草本植物和农作物中得到(Kabir et al. 1997; Ruotsalainen et al., 2002)。但是本研究结果发现:水曲柳的菌根真菌侵染率在春节最高(53%),随后是夏季(46%)和秋季(36%),表层和亚表层以及施肥处理都具有相同的格局(图 1)。不仅在水曲柳中发现菌根真菌春季侵染率高,而且在其他木本植物中也报道过。例如,Allen(1983)对灌木滨藜(Atriplex gardneri)研究发现4月份侵染率78%,到7月份降到3%,此外,对紫穗槐(Amorpha fruticosa)和山葡萄(Vitis amurensis)等研究也发现春季侵染率高于其他季节(刘润进等, 2007)。笔者推测水曲柳菌根真菌侵染率与气候季节性格局不一致的主要原因可能是与根系生理活动和碳水化合物含量相关。作为与根系共生的菌根真菌,尤其是内生菌根真菌在皮层细胞繁殖和生长依赖于根系提供碳水化合物(Simard et al., 2002)。梅莉等(2006)研究表明水曲柳细根在4月下旬开始生长,5月份达到高峰。进一步研究发现:水曲柳1级根可溶性糖浓度春季最高(41.65 mg·g-1),夏季(7.71 mg·g-1)和秋季(6.79 mg·g-1)逐渐降低(梅莉, 2006)。皮层细胞可溶性糖浓度高(分泌物量也多)可能刺激土壤中的菌丝向根系伸展(Olsson et al., 2003),导致侵染率升高。尽管夏季土壤温度和水分都适宜孢子和菌丝生长,但是由于1级根组织中可溶性糖浓度较低,供给菌丝的C较少,因此,限制了菌丝的繁殖和生长。
3.2 内生菌根真菌侵染对1级根形态的影响细根形态与生理功能密切相关(Pregitzer, 2008)。生长在根系末端的1级根最容易被菌丝侵染,也最容易死亡。主要是因为1级根具有皮层薄壁细胞(Guo et al., 2008b; 卫星等, 2008)、直径细、根长短、比根长高(Pregitzer et al., 2002; Guo et al., 2004)以及N浓度高和呼吸强(Burton et al., 2002)的特点。已有研究表明:共生菌根真菌引起根系形态发生改变,而且随着真菌类型、树种及环境条件的变化而变化。例如,Ghosh等(2006)研究马占相思(Acacia mangium)苗木发现,接种内生菌根真菌引起根茎显著增粗;Rousseau等(1994)研究火炬松苗木证实,外生菌根真菌侵染导致根长增加;Berta等(1995)研究红叶李(Prunus cerasifera)也发现,侵染内生菌根真菌的苗木比根长(SRL)降低。本研究表明:菌根真菌侵染引起1级根直径增加和长度降低,但是差异不显著(图 2,3,表 2),对SRL降低(平均降低14.2%)差异显著(图 4,表 2)。施肥处理同时降低根长(图 3,表 2),对直径和比根长没有显著影响,施肥处理与侵染之间也不存在显著的交互作用(表 2)。本研究结果以及其他研究都说明:菌根真菌侵染对细根形态的影响具有复杂性,影响哪些形态指标因树种不同而有显著差别。因此,在分析细根形态指标时,不能忽略菌根真菌潜在的影响。
在形态指标中,直径、长度和SRL之间具有明显的相关性,对于同一树种SRL直接受直径和单个根长的影响(Eissenstat et al., 1997)。内生菌根真菌侵染导致水曲柳SRL显著下降可能有2个主要原因:第一,内生菌根真菌侵染导致根尖生长速度下降引起SRL降低。根伸长生长主要是着生在根系末端的1级根的生长,通过根尖分生组织不断分裂和细胞伸长完成。Berta等(1990)研究青蒜发现,内生菌根真菌侵染后根尖分生组织中有分裂能力的细胞数量减少,不具有分裂能力的细胞数量增加,导致1级根生长速率减慢。Resendes等(2008)在研究苹果(Malus domestica)细根时发现,被真菌侵染的根尖生长速率为每天4.8 mm,而没有侵染的根为每天5.3 mm。在本研究中,没有测定根尖生长过程,但是侵染菌根真菌的1级根平均根长比未侵染的1级根平均降低7.9%,这也说明菌根侵染引起1级根生长速率下降。第二,内生菌根真菌侵染后导致皮层组织细胞内含物增加使单位长度根重量增加(Berta et al., 1995)。如果直径不变(图 2),单根质量增加会引起SRL下降(Eissenstat et al., 1997)。在内生菌根中,菌丝的鲜质量约占根质量的10%左右(郭秀珍等, 1989)。本研究对水曲柳1级根测定结果表明:侵染菌根的单个根鲜质量比未侵染的根平均质量高出7%~9%。由于施肥对SRL影响很小(施肥148.27 m·g-1,对照145.40 m·g-1),因此,侵染后SRL降低可能与单个根质量增加有密切关系。
生长在根系末端的1级根在养分和水分吸收方面发挥重要作用,但是其形态影响生理生态功能(Pregitzer et al., 2002;Guo et al., 2008b)。许多在农作物和草本植物研究表明:内生菌根真菌侵染影响细根形态,不同的土壤肥力条件又会对侵染率和形态产生影响。但是在森林树种中,这些影响是否与农作物或草本植物也存在了解甚少。本研究通过水曲柳1级根证明,施肥导致内生菌根真菌侵染率显著降低(图 1);在施肥和对照样地中,菌根真菌侵染对1级根形态影响因季节和土层变化而不同(图 2,3,4)。但是,处理和菌根侵染对形态不存在交互作用(表 2)。这说明多年生木本植物的1级根形态与菌根真菌和土壤养分有效性之间的关系具有复杂性。SRL是一个综合的功能指标,SRL大小表示投入和产出效率的高低(Eissenstat et al., 1997)。虽然施肥降低菌根真菌的侵染率,但是在施肥样地和对照样地菌根真菌对SRL降低的影响始终存在(图 4)。这说明菌根真菌在影响1级根功能方面可能起重要作用,有菌根和没有菌根侵染的1级根吸收效率、低于外界环境胁迫能力和碳的消耗以及寿命长短方面可能存在较大差异。因此,关注菌根真菌与细根生理生态关系,尤其是对寿命的影响,对认识森林生态系统地下根系动态具有重要意义,也是今后根系生态学一个重要的研究内容(Pregitzer, 2008)。
4 结论1) 菌根真菌侵染根系与土壤N有效性关系密切。本研究表明:施N肥导致水曲柳人工林1级根内生菌根真菌侵染率显著降低;季节和土壤深度对侵染率有显著影响,从春季到秋季侵染率逐渐降低,其中土壤表层侵染率高于亚表层。2)施N肥导致1级根长度显著降低,季节和处理之间的交互作用显著影响1级根的直径和根长,季节、土层和处理3者的交互作用影响根长和比根长。3)内生菌根真菌侵染后1级根直径没有显著变化,根长略有降低,比根长(SRL)则显著降低。这种根系形态变化规律在不同处理、不同季节和不同土壤深度上表现一致。
郭秀珍, 毕国昌. 1989. 林木菌根及应用技术[M]. 北京: 中国林业出版社.
|
贾淑霞, 赵妍丽, 孙玥, 等. 2009. 施肥对落叶松和水曲柳人工林土壤微生物生物量碳和氮季节变化的影响[J]. 应用生态学报, 20(9): 2063-2071. |
刘润进, 陈应龙. 2007. 菌根学[M]. 北京: 科学出版社.
|
鲁如坤. 2000. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社.
|
梅莉, 韩有志, 于水强, 等. 2006. 水曲柳人工林细根季节动态及其影响因素[J]. 林业科学, 42(9): 7-12. |
梅莉. 2006. 水曲柳落叶松人工林细根周转与碳分配. 东北林业大学博士学位论文.
|
王向荣, 谷加存, 梅莉, 等. 2006. 水曲柳和落叶松细根形态及母根与子根比例关系[J]. 生态学报, 26(6): 1686-1692. |
卫星, 刘颖, 陈海波. 2008. 黄波罗不同根序的解剖结构及其功能异质性[J]. 植物生态学报, 32(6): 1238-1247. |
Allen M F. 1983. Formation of vesicular-Arbuscular mycorrhizae in Atriplex gardneri (Chenopodiaceae): Seasonal response in a cold desert[J]. Mycologia, 75(5): 773-776. DOI:10.2307/3792769 |
Allen M F. 1992. Mycorrhizal functioning: an integrative plant-fungal process[M]. New York: Chapman and Hall.
|
Berta G, Fusconi A, Trotta A, et al. 1990. Morphogenetic modifications induced by the mycorrhizal fungus Glomus strain E3 in the root system of Allium porrum L[J]. New Phytologist, 114: 207-215. DOI:10.1111/nph.1990.114.issue-2 |
Berta G, Fusconi A, Trotta A. 1993. VA mycorrhizal infection and the morphology and function of root systems[J]. Environmental and Experimental Botany, 33(1): 159-173. DOI:10.1016/0098-8472(93)90063-L |
Berta G, Trotta A, Fusconi A, et al. 1995. Arbuscular mycorrhizal induced changes to plant growth and root system morphology in Prunus cerasifera[J]. Tree Physiology, 15: 281-293. DOI:10.1093/treephys/15.5.281 |
Bidartondo M I, Baar J, Bruns T D. 2001. Low ectomycorrhizal inoculum potential and diversity from soils in and near ancient forests of bristlecone pine (Pinus longaeva)[J]. Canadian Journal of Botany, 79(3): 293-299. DOI:10.1139/b01-006 |
Brundrett M C. 2002. Coevolution of roots and mycorrhizas of land plants[J]. New Phytologist, 154(2): 275-304. DOI:10.1046/j.1469-8137.2002.00397.x |
Brundrett M C, Abbott L K. 1994. Mycorrhizal fungus propagules in the jarrah forest[J]. I. Seasonal study of inoculum levels. New Phytologist, 127(3): 539-546. |
Burton A J, Pregitzer K S, Ruess R W, et al. 2002. Root respiration in North American forests: effects of nitrogen concentration and temperature across biomes[J]. Oecologia, 131(4): 559-568. DOI:10.1007/s00442-002-0931-7 |
Caporn S J M, Song W, Read D J, et al. 1995. The effect of repeated nitrogen fertilization on mycorrhizal infection in Heather[Calluna vulgaris(L.)Hull][J]. New Phytologist, 129(4): 605-609. DOI:10.1111/nph.1995.129.issue-4 |
Chapin F S, Matson P A, Mooney H A. 2002. Principles of terrestrial ecosystem ecology[M]. New York: Springer-Verlag.
|
Compton J E, Watruda L S, Porteous L, et al. 2004. Response of soil microbial biomass and community composition to chronic nitrogen additions at Harvard forest[J]. Forest Ecology and Management, 196: 143-158. DOI:10.1016/j.foreco.2004.03.017 |
Cruz C, Grenn J J, Watson C A, et al. 2004. Functional aspects of root architecture and mycorrhizal inoculation with respect to nutrient uptake capacity[J]. Mycorrhiza, 14(3): 177-184. DOI:10.1007/s00572-003-0254-5 |
Eissenstat D M, Yanai R D. 1997. The ecology of root lifespan[J]. Advances in Ecological Research, 27(1): 1-60. |
Eissenstat D M, Yanai R D. 2002. Root life span, efficiency, and turnover[M]. New York: Marcel Dekker.
|
Ghosh S, Verma N K. 2006. Growth and mycorrhizal dependency of Acacia mangium Willd[J]. inoculated with three vesicular arbuscular mycorrhizal fungi in lateritic soil. New Forests, 31(1): 75-81. |
Guo D L, Mitchell R J, Hendricks J J. 2004. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest[J]. Oecologia, 140(3): 450-457. DOI:10.1007/s00442-004-1596-1 |
Guo D L, Mitchell R J, Withington J M, et al. 2008a. Endogenous and exogenous controls of root lifespan, mortality and nitrogen flux in a longleaf pine forest: root branch order predominates[J]. Journal of Ecology, 96: 737-745. DOI:10.1111/jec.2008.96.issue-4 |
Guo D L, Xia M X, Wei X, et al. 2008b. Anatomical traits associated with absorption and mycorrhizal colonization are linked to branch order in twenty-three Chinese temperate tree species[J]. New Phytologist, 180: 673-683. DOI:10.1111/nph.2008.180.issue-3 |
Hetrick B A D, Leslie J F, Wilson G T, et al. 1988. Physical and topological assessment of effects of a vesicular-arbuscular mycorrhizal fungus on root architecture of big bluestem[J]. New Phytologist, 110: 85-96. DOI:10.1111/nph.1988.110.issue-1 |
Hooker J E, Black K E, Perry R L, et al. 1995. Arbuscular mycorrhizal fungi induced alteration to root longevity of poplar[J]. Plant and Soil, 172(2): 327-329. DOI:10.1007/BF00011335 |
Kabir Z, O′Halloran I P, Fyles J W, et al. 1997. Seasonal changes of arbuscular mycorrhizal fungi as affected by tillage practices and fertilization: hyphal density and mycorrhizal root colonization[J]. Plant and Soil, 192(2): 285-293. DOI:10.1023/A:1004205828485 |
King J S, Albaugh T J, Allen H L, et al. 2002. Below-ground carbon input to soil is controlled by nutrient availability and fine root dynamics in loblolly pine[J]. New Phytologist, 154(2): 389-398. DOI:10.1046/j.1469-8137.2002.00393.x |
Nilsen P, Borja I, Knutsen H, et al. 1998. Nitrogen and drought effects on ectomycorrhizae of Norway spruce [Picea abies L. (Karst.)][J]. Plant and Soil, 198(2): 179-184. DOI:10.1023/A:1004399303192 |
Olsson P A, Larsson L, Bago B, et al. 2003. Ergosterol and fatty acids for biomass estimation of mycorrhizal fungi[J]. New Phytologist, 159: 7-10. DOI:10.1046/j.1469-8137.2003.00810.x |
Phillips J M, Hayman D S. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 55: 158-160. DOI:10.1016/S0007-1536(70)80110-3 |
Pregitzer K S, DeForest J L, Burton A J, et al. 2002. Fine root architecture of nine North American trees[J]. Ecological Monographs, 72: 293-309. DOI:10.1890/0012-9615(2002)072[0293:FRAONN]2.0.CO;2 |
Pregitzer K S. 2008. Tree root architecture-form and function[J]. New Phytologist, 180: 562-564. DOI:10.1111/nph.2008.180.issue-3 |
Resendes M L, Bryla D R, Eissenstat D M. 2008. Early events in the life of apple roots: variation in root growth rate is linked to mycorrhizal and nonmycorrhizal fungal colonization[J]. Plant and Soil, 313: 175-186. DOI:10.1007/s11104-008-9690-5 |
Rousseau J V D, Sylvia D M, Fox A J. 1994. Contribution of ectomycorrhiza to the potential nutrient-absorbing surface of pine[J]. New Phytologist, 128(4): 639-644. DOI:10.1111/nph.1994.128.issue-4 |
Ruotsalainen A L, Väre H, Vestberg M. 2002. Seasonality of root fungal colonization in low-alpine herbs[J]. Mycorrhiza, 12: 29-36. DOI:10.1007/s00572-001-0145-6 |
Simard S W, Jones M D, Durall D M. 2002. Carbon and nutrient fluxes within and between mycorrhizal plants[J]. Mycorrhizal Ecology, 157: 33-74. |
Smith S E, John B J St, Smith F A, et al. 1986. Effects of mycorrhizal infection on plant growth, nitrogen and phosphorus nutrition in glasshouse-grown Allium cepa L[J]. New Phytologist, 103: 359-373. DOI:10.1111/nph.1986.103.issue-2 |
Swaty R L, Gehring C A, Ert M V, et al. 1998. Temporal variation in temperature and rainfall differentially affects ectomycorrhizal colonization at two contrasting sites[J]. New Phytologist, 139(4): 733-739. DOI:10.1046/j.1469-8137.1998.00234.x |
Wallenda T, Kottke I. 1998. Nitrogen deposition and ectomycorrhizas[J]. New Phytologist, 139(1): 168-187. |
 2010, Vol. 46
2010, Vol. 46