文章信息
- 闫绍鹏, 杨瑞华, 关录凡, 王秋玉
- Yan Shaopeng, Yang Ruihua, Guan Lufan, Wang Qiuyu
- 转基因与非转基因杂种山杨组培苗内源激素的比较
- A Comparative on the Plant Endogenous Hormones of Transgenic and Non-Transgenic Hybrid Aspen Tissue-Cultured Plantlets
- 林业科学, 2010, 46(9): 40-44.
- Scientia Silvae Sinicae, 2010, 46(9): 40-44.
-
文章历史
- 收稿日期:2010-01-05
- 修回日期:2010-03-29
-
作者相关文章
2. 黑龙江省农业科学院园艺分院 哈尔滨 150069
2. Horticultural Branch, Heilongjiang Academy of Agricultural Sciences Harbin 150069
植物激素是植物代谢反应的产物,同时又在各个水平上调节植物的生命活动。在植物不同发育阶段,不同种类的内源激素含量呈规律性的变化,其效应可决定植物个体发育的正常进行。有关植物激素对杨树(Populus)以及其他针阔叶树种的植株生长发育以及生根的影响的报道很多,如细胞分裂素能降低杨树根部对NO3-的摄取(Dluzniewska et al., 2006),以及通过调节远距离氮信号的表达,促进杂种杨(Populus trichocarpa)抽发新枝(Cline et al., 2006);赤霉素在树木形成阶段调节包括细胞伸长在内的木质部早期分化,并且对杂种山杨(Populus tremula×P. tremuloides)(Israelsson et al., 2004)和欧洲山杨(P. tremula)(Israelsson et al., 2005)的生长起关键性的调节作用。陈雪梅等(1994)发现山杨(P. davidiana)扦插生根的难易是潜伏根原基存在与否和皮部内源激素平衡决定。在白杨派(Leuce)杨树的组织培养中增加一定浓度的细胞分裂素和生长素可诱导不定芽的产生, 当细胞分裂素与生长素比值在一定限度内较大时, 有利于不定芽的分化(祁春芳等,2000)。詹亚光等(2004;2006)使用6-BA和2, 4-D诱导杂种山杨再生植株, 并发现6-BA能有效地促进杂种山杨愈伤组织不定芽的发生。Sasamoto等(2002)研究指出ABA和GA含量的差异导致了白桦(Betula platyphylla)和银白杨(P. alba)原生质体再生能力的不同。采用木本植物培养基(woody plant medium,WPM)对大叶山杨(Populus davidiana var. macrophylla)进行生根培养,加入一定浓度的IBA和6-BA或NAA和6-BA可以取得理想的生根效果,生根率可达95%以上(陆斐等,2006)。
近年来,转基因技术在林木的应用越来越广泛,特别是针对模式树种—杨树的研究,主要有抗虫、抗病、木质素调控、激素调控以及抗除草剂、诱导育性、改变谷胱甘肽的代谢、材性改良、抗逆境基因工程等等。转基因技术的应用引起杨树多方面的变化,如幼苗变矮;改变赤霉素含量、根的生长和代谢物形式,而代谢物的变化可作为促进根生长的一种机制(Busov et al., 2003)。
杂种山杨是是欧洲山杨和北美山杨(P.tremuloides)的杂交种,东北林业大学于2001年从芬兰引进几十个无性系,并通过微体繁殖和愈伤组织再生等方法进行扩繁(詹亚光等, 2004; 2005)。2003年,为加强杂种山杨的抗虫性,将蜘蛛杀虫肽和Bt毒蛋白融合基因成功地转入杂种山杨无性系(E10490),得到转基因杂种山杨苗木(李彩华, 2003)。研究中发现与同一基因型的杂种山杨非转基因组培苗相比,转基因苗生根困难,生根率低,而且转基因植株一旦产生愈伤组织将不生根。本研究以转基因杂种山杨无性系为材料,采用ELISA方法测定其内源激素IAA、ABA和GA的含量,从植物细胞代谢角度探究植物遗传转化对杂种山杨组培苗和内源激素变化的影响,以及杂种山杨组培生根的生理机制。
1 材料与方法 1.1 材料原始材料来源于芬兰40年生欧美山杨杂种无性系E10490。2001年春采用微体繁殖法扩大繁殖。2003年利用根癌农杆菌介导法将蜘蛛杀虫肽和Bt毒蛋白融合基因转入该无性系,得到转基因植株。试验材料为转基因杂种山杨无性系生根组培苗和组培不生根培养物,以非转基因无性系直接生根组培苗和愈伤组织生根组培苗为对照(表 1)。
|
|
取组培苗整体植株提取内源激素。植物激素的提取采用冰浴玻璃研磨的方法,目的是最大限度地减少样品的损失。内源激素测定采用间接酶联免疫吸附分析法(enzyme-linked immunosorbent assay, ELISA)(何钟佩,1993)。植物激素ABA, IAA和GA测定试剂盒来自中国农业大学,采用Tecan酶联免疫检测仪测定试样中各种激素含量,每个样品重复4次,取平均值。计算采用回归法,用激素标样各浓度(ng·mL-1)的自然对数与各浓度显色值的Logit值的回归方程代替Logit曲线,建立回归方程,求得样品激素的浓度。
新鲜样品中激素的含量用下式计算:A=(N·V2·V3·B)/(V1·W)。式中,A为激素含量(ng·g-1);V2表示提取样品后,上清液的总体积;V1表示进行真空浓缩干燥的上清液体积(当提取的上清液全部进行真空浓缩干燥时V1与V2的体积是相等的);V3表示真空浓缩后用样品稀释液定容的体积;W表示样品的鲜质量;N表示样品中激素的质量浓度(ng·mL-1);B表示样品的稀释倍数(样品稀释液定容以后的稀释倍数)。
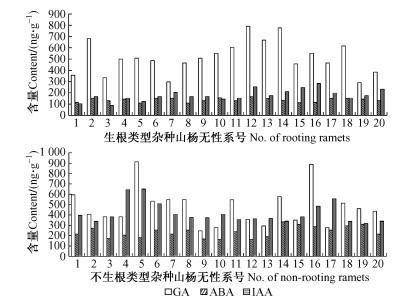
2 结果与分析 2.1 转基因与非转基因杂种山杨不同生根类型间内源激素含量的变化 2.1.1 3种内源激素在转基因杂种山杨不同生根类型无性系分株间的变化在生根的转基因杂种山杨无性系分株间,赤霉素GA含量较高,一般在400 ng·g-1以上;生长素IAA和脱落酸ABA的含量相对较低,普遍不到200 ng·g-1,IAA的含量略高于ABA。在不生根类型分株间,GA和IAA的含量总体上都比较高,基本上都在400 ng·g-1左右,二者相差不多,GA的含量略高于IAA;ABA相对于IAA、GA来说含量少很多,大约在250 ng·g-1以上,但是和生根类型比较,ABA的含量也明显增加(图 1)。
|
图 1 转基因杂种山杨不同生根类型无性系分株间内源激素的比较 Figure 1 Comparison of IAA, ABA and GA content among the rooting and non-rooting ramets of transgenic hybrid aspen |
在转基因杂种山杨无性系不同生根类型间,ABA和IAA的含量变化较大,高含量的ABA和IAA容易使杂种山杨组培苗长出愈伤组织而无法正常生根,而低含量是促进生根的一个条件。
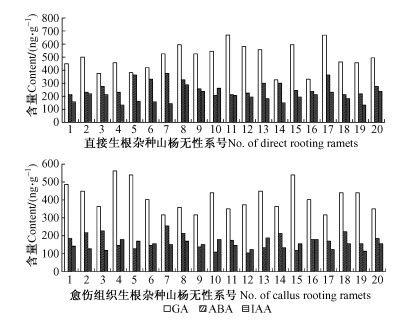
2.1.2 3种内源激素在非转基因杂种山杨不同生根类型无性系分株间的变化在非转基因杂种山杨直接生根类型的无性系分株间,GA的含量保持在较高的水平,与转基因生根类型一致;ABA的含量比转基因生根类型要高,平均达到了250 ng·g-1左右,其含量也超过了IAA;IAA的含量与转基因生根类型相差无几(图 2),这说明IAA在不同处理的杂种山杨无性系分株的生根过程中作用相同。
|
图 2 非转基因杂种山杨不同生根类型无性系分株间内源激素的比较 Figure 2 Comparison of IAA, ABA and GA content among direct rooting and callus rooting ramets of non-transgenic hybrid aspen |
在愈伤组织生根类型的非转基因杂种山杨无性系分株间,GA的含量变化不大,ABA的含量大约在160 ng·g-1左右,与直接生根类型比较株间变化很大,下降很多;IAA的含量虽然也有变化,但降幅没有ABA那么多,在150 ng·g-1左右。
结果说明:GA含量在不同生根类型非转基因杂种山杨无性系分株间没有显著的差异,保持稳定;IAA和ABA在非转基因杂种山杨不同生根类型无性系分株间的含量差异显著,低含量ABA有利于非转基因杂种山杨的直接生根,而ABA含量过低容易导致植株首先长出愈伤组织,然后才生根,延长了生根时间。
2.2 转基因与非转基因杂种山杨不同生根类型间内源激素含量的变异从表 2看出,在转基因杂种山杨生根和不生根类型间,IAA和ABA的含量差异极显著,而GA的含量差异不显著,变异幅度也不大。在非转基因杂种山杨直接生根和愈伤组织生根类型间,ABA的含量差异极显著,IAA的含量差异显著,GA的含量差异依旧不显著。由此可见,不论是转基因还是非转基因杂种山杨无性系不同生根类型间在IAA和ABA含量上差异均达到显著或极显著水平,这也说明ABA和IAA在调控杂种山杨组培苗生根过程中起着重要作用。
|
|
由表 2还看出, 不同生根类型的杂种山杨GA含量处于高值水平,保持在400~500 ng·g-1。说明GA含量在植株生长和生根过程中起着重要作用,但可能不是杂种山杨组培苗生根的决定因素。
在转基因杂种山杨中,直接生根类型的GA含量略高于不生根类型,不生根类型的IAA和ABA含量显著高于直接生根类型, 这也可能是转基因植株只长愈伤组织而不生根的原因。在非转基因不同生根类型中,直接生根类型中3种激素水平均高于愈伤组织生根类型(表 2)。这也可能是植株直接生根或愈伤组织生根的重要影响因素。
比较转基因植株和非转基因植株的3种内源激素含量发现, 2种无性系的直接生根类型的GA含量均略高于不生根(愈伤组织生根)类型, 但不同类型间差异不显著; 转基因和非转基因植株的直接生根类型的IAA含量没有明显差别, 但转基因不生根类型的IAA含量为393.15 ng·g-1,明显高于非转基因植株愈伤组织生根类型(152.67 ng·g-1), 而转基因植株直接生根类型的ABA含量为155.51 ng·g-1,明显低于非转基因植株的直接生根类型(269.35 ng·g-1), 而不生根(愈伤组织生根)类型表现相反的趋势。这一结果也间接表明外源基因的导入有可能会改变植株内源激素的水平,从而不同程度影响了植株的生根情况。
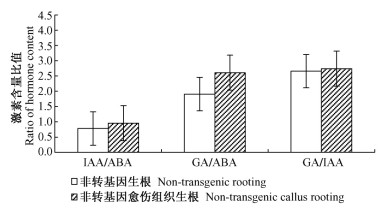
2.3 不同生根类型杂种山杨3种内源激素相互作用总体水平的比较对转基因杂种山杨来说,生根类型IAA/ABA的比值很低,低于不生根类型; 生根类型GA/ABA和GA/IAA的比值都大于2,远远高于不生根类型(图 3)。非转基因不同生根类型中的3个比值具有相似的趋势,即愈伤组织生根类型高于直接生根类型,愈伤组织生根类型和直接生根类型的IAA/ABA较接近,在0.5~1之间,2种生根类型的GA/ABA与GA/IAA的比值均较高,都在2左右(图 4)。由此可见,低的IAA/ABA, 高的GA/ABA和GA/IAA比值是植株生根的重要因素。

|
图 3 转基因杂种山杨激素相互作用总体的比较 Figure 3 The interaction of different hormones in transgenic hybrid aspen |
|
图 4 非转基因山杨激素相互作用总体的比较 Figure 4 The interaction of different hormones in non-transgenic aspen |
脱落酸(ABA)是一种抑制激素,它对生长促进剂起到拮抗作用。有研究表明,一定水平的ABA对不定根、芽的分化可能是必需的。但高含量内源ABA易于愈伤组织分化(郭子彪等,1997)。本试验的结果表明:内源ABA的含量对于杂种山杨生根有很大影响,转基因组培苗ABA含量在150 ng·g-1时,有利于生根;当超过200 ng·g-1,转基因组培苗就会分化出愈伤组织,从而影响生根;但是,ABA含量过低时,对组培苗的生长同样不利,100 ng·g-1左右的ABA会使得转基因组培苗出现玻璃化现象。
生长素(IAA)对植物细胞伸长、分裂等发育过程起着重要作用, 是植物体内促进生长的激素。李胜等(2005)研究表明:在根系启动和根原基诱导时,IAA含量较低。也就是说低含量的IAA有利于根系的启动和根原基的诱导, 有利于生根。本试验的结果也证明,内源IAA水平的高低对于不同转基因处理的杂种山杨组培苗生根的影响不同。但总的来说IAA含量低时,有利于组培苗的生根;2种生根类型的非转基因组培苗的IAA含量都很低,大约在200 ng·g-1左右。这充分说明内源IAA含量与愈伤组织的形成密切相关(郭子彪等,1997)。本研究表明:IAA的含量过高或过低容易诱使杂种山杨组培苗生根不正常。当IAA达到400 ng·g-1的高含量时,转基因组培苗无法生根,或长出愈伤组织,或产生玻璃化现象。IAA含量达到150 ng·g-1左右时,容易使杂种山杨的非转基因组培苗长出愈伤组织。
赤霉素(GA)在植物组织培养过程中的主要功能是促进生长,即促进茎尖分生组织的细胞分裂,增强顶端生长优势,起到拔茎的效果。在不同类型杂种山杨无性系分株间,不论是转基因还是非转基因苗,不论是生根还是不生根苗,GA含量一般都是在较高的水平浮动,平均500 ng·g-1,这说明GA的水平在杂种山杨体内比较稳定。
比较不同生根类型的杂种山杨内源激素总体水平可以看出,非转基因杂种山杨无性系直接生根类型的IAA和ABA的含量均比愈伤组织生根类型的含量高。而转基因杂种山杨正好相反,生根类型的IAA和ABA的含量比不生根类型的低。由此可见,外源基因的遗传转化可以使杂种山杨无性系的内源激素总体水平发生变化。
此外,内源激素间的相互作用对植物生长的调节作用十分重要。例如,IAA促进植物生长,ABA抑制植物生长,目前人们更关注植物体内促进生长的激素与抑制生长的激素的相互作用,认为植物的全部生长过程都受到这2类激素比例的变化控制。郑均宝等(1999)的研究表明杂交杨[Populus alba×(P.davidiana×P.simonii)×P.tomentosa]多继代培养的嫩茎外植体IAA/ABA的比值较高, 为1~2, 其生根率高达90%以上。本研究也计算了不同基因型和生根类型的3种内源激素的比值,转基因杂种山杨内源IAA/ABA的比值都大于1,生根类型接近于1,不生根类型IAA/ABA的比值大于生根类型; 非转基因直接生根和愈伤组织生根类型的IAA/ABA的比值都小于1, 愈伤组织生根类型接近于1。因此,本研究表明, IAA/ABA比值越小生根能力越强,越大生根能力越弱,甚至不生根, 与前人的研究结果不同, 其原因还有待于进一步探讨。
陈雪梅, 高红兵, 王沙生. 1994. 三种杨树扦插生根期间内源激素水平的比较研究[J]. 林业科学, 30(1): 1-7. |
郭子彪, 盖钧镒. 1997. 内源激素IAA、ABA对大豆萌发子叶胚性愈伤组织诱导及其分化的调控[J]. 大豆科学, 16(3): 194-198. |
何钟佩. 1993. 农作物化学控制实验指导[M]. 北京: 北京农业大学出版社: 60-68.
|
李胜, 武季玲, 李唯, 等. 2005. 初代和继代培养葡萄试管苗的内源IAA、ZRs和ABA含量变化及其与生根的关系[J]. 植物生理学通讯, 41(3): 286-288. |
李彩华. 2003. 欧美山杨杂种转抗虫基因的研究. 东北林业大学硕士学位论文.
|
陆斐, 初艳. 2006. 大叶山杨优良无性系组培育苗技术[J]. 林业科技, 31(6): 2-3. |
祁春芳, 郑智礼. 2000. 白杨派杨树组培技术研究[J]. 山西林业科技, (6): 21-23. |
詹亚光, 齐凤慧, 高瑞馨, 等. 2006. 欧美杂种山杨体细胞无性系变异的分析[J]. 植物学通报, 23(1): 44-51. |
詹亚光, 刁桂平, 王秋玉, 等. 2005. 叶腋增殖途径快速繁殖欧美杂种山杨[J]. 东北林业大学学报, 32(2): 7-9. |
詹亚光, 齐凤慧, 杨传平. 2004. 欧美杂种山杨愈伤组织再生系统的建立[J]. 植物生理学通讯, 40(4): 437-440. |
郑均宝, 梁海永, 王进茂, 等. 1999. 杨和苹果离体茎尖培养和愈伤组织分化与内源IAA、ABA的关系[J]. 植物生理学通讯, 25(1): 80-86. |
Busov V B, Meilan R, Pearce D W, et al. 2003. Activation tagging of a dominant gibberellin catabolism gene (GA 2-oxidase) from poplar that regulates tree stature[J]. Plant Physiol, 132(3): 1283-1291. DOI:10.1104/pp.103.020354 |
Cline M G, Thangavelu M, Dong-Il K. 2006. A possible role of cytokinin in mediating long-distance nitrogen signaling in the promotion of sylleptic branching in hybrid poplar[J]. J Plant Physiol, 163(6): 684-688. DOI:10.1016/j.jplph.2005.06.005 |
Dluzniewska P, Gessler A, Kopriva S, et al. 2006. Exogenous supply of glutamine and active cytokinin to the roots reduces NO3- uptake rates in poplar[J]. Plant Cell Environ, 29(7): 1284-1297. DOI:10.1111/pce.2006.29.issue-7 |
Israelsson M, Mellerowicz E, Chono M, et al. 2004. Cloning and overproduction of gibberellin 3-oxidase in hybrid aspen trees[J]. Effects on gibberellin homeostasis and development. Plant Physiol, 135(1): 221-230. |
Israelsson M, Sundberg B, Moritz T. 2005. Tissue-specific localization of gibberellins and expression of gibberellin-biosynthetic and signaling genes in wood-forming tissues in aspen[J]. Plant J, 44(3): 494-504. DOI:10.1111/tpj.2005.44.issue-3 |
Sasamoto H, Ogita S, Wakita Y, et al. 2002. Endogenous levels of abscisic acid and gibberellins in leaf protoplasts competent for plant regeneration in Betula platyphylla and Populus alba[J]. Plant Growth Regulation, 38(184): 195-201. |
 2010, Vol. 46
2010, Vol. 46