文章信息
- 陈芳, 陈少瑜, 吴涛, 王寅冰, 易善军, 宁德鲁
- Chen Fang, Chen Shaoyu, Wu Tao, Wang Yinbing, Yi Shanjun, Ning Delu
- 丽江云杉体细胞胚胎发生
- Somatic Embryogenesis of Picea likiangensis
- 林业科学, 2010, 46(8): 162-167.
- Scientia Silvae Sinicae, 2010, 46(8): 162-167.
-
文章历史
- 收稿日期:2010-04-20
- 修回日期:2010-06-08
-
作者相关文章
2. 国家林业局云南省珍稀濒特森林植物保护和繁育实验室 云南省森林植物培育与利用重点实验室 昆明 650204;
3. 西南林学院 昆明 650224
2. Yunnan Laboratory for Conservation of Rare, Endangered and Endemic Forest Plants of State Forstry Administration Yunnan Key Laboratory for Forest Plant Cultivation and Utilization Kunming 650204;
3. Southwest Forestry College Kunming 650224
体细胞胚胎发生是细胞工程中植株再生的重要途径之一,可作为基因工程的受体系统,同时也是研究细胞全能性、细胞分化及其形态建成的理想试验体系。在应用上,体细胞胚胎发生是一种有效的大规模无性繁殖方法(郭奕明等,2003; 贾彩凤等,2006; Stasolla et al., 2003; Sutton, 2002)。在目前已成功诱导体胚形成的植物中,草本植物占了大多数。已有40多种木本植物获得了体细胞胚,尤其是用常规无性繁殖技术很难生根的针叶树的体胚发生研究取得了令人瞩目的进展,20多种不同的针叶树的外植体成功诱导出体细胞胚(施季森,2000)。自Hakman等(1985)首次报道欧洲云杉(Picea abies)未成熟合子胚培养的体细胞胚胎发生和植株再生以来,白云杉(P. glauca)(Park et al., 1993)、黑云杉(P. mariana)(Tautorus et al., 1990)、塞尔维亚云杉(P. omorika)(Budimir et al., 1992)、北美云杉(P. sitchensis)(Gale et al., 2008)、火炬松(Pinus taeda)(Pullman et al., 2002; Li et al., 1998)、意大利松(P. pinea)(Carneros et al., 2009)等树种的体细胞胚诱导和植株再生已经应用于生产,并把控制木质素合成的基因转化到黑云杉体胚中,部分研究成果已进入中试。美国火炬松、新西兰辐射松(Pinus radiata)已应用于生产,并进行了人工种子生产,仅新西兰一家公司就利用体细胞再生年产200万株辐射松苗(施季森,2000)。
我国木本植物体细胞胚胎发生研究开展虽然较晚,但也取得了很大的进展,马尾松(Pinus massoniana)(黄健秋等, 1995a; 杨艳等,2007)、云南松(Pinus yunnanensis)(黄健秋等,1995b)、华北落叶松(Larix principis-rupprechtii)(齐力旺等, 2004)、日本落叶松(Larix kaempferi)(吕守芳等,2005)、白皮松(Pinus bungeana)(李茜等, 2006)、杉木(Cunninghamia lanceolata)(席梦利等,2006)、长叶松(Pinus palustris)(吴丽君,2008)、红豆杉(Taxus chinensis)和南方红豆杉(Taxus chinensis var. mairei)(邱德有等, 1998)等针叶树种利用成熟或未成熟胚诱导体细胞胚胎发生,实现了植株再生; 云杉属树种青杄(Picea wilsonii)(李映红等,1990)、白杄(Picea meyeri)(杨金玲等,1997)、红皮云杉(Picea koraiensis)(刘宝光等,2009)利用其成熟或未成熟胚诱导体细胞胚胎发生,这些成果为无性系林业的发展提供广阔的前景。
丽江云杉(Picea likiangensis)是我国西南地区重要的寒温性针叶树种,具有生长快、材质优良的特点, 是其分布区的主要造林树种, 也被作为庭园观赏树种普遍栽培。目前人工造林及庭院绿化用苗主要是通过实生繁殖, 但丽江云杉结实较晚, 种子成熟率很低,致使丽江云杉良种苗供不应求, 远远不能满足造林需求(王军辉等,2006)。扦插、组织培养等繁殖方法已成为繁育丽江云杉绿化造林苗木的重要途径。丽江云杉通过体细胞胚途径再生植株在国内外目前尚无报道。本文以丽江云杉成熟合子胚培养直接诱导体细胞胚胎发生和植株再生,为丽江云杉离体快速繁育及基因遗传转化提供必要的技术支撑,为丽江云杉工厂化育苗提供了一条新途径。
1 材料与方法 1.1 材料丽江云杉成熟种子采自云南丽江的丽江云杉天然林,根据植株表型选择生长较好、树干通直的7个单株作为采种林木,每株分别采50~60个球果,阴晾10~15天后剥取种子。
1.2 外植体接种培养在试验室挑选干净、饱满丽江云杉成熟种子,用商用消毒液消毒10 min,无菌水冲洗3次,在超净工作台上剥取完整胚(图 1a),置入诱导培养基进行培养。

|
图 1 丽江云杉体细胞胚胎发生 Figure 1 Somatic embryogenesis of Picea likiangensis a.刚剥的成熟合子胚; b.刚开始形成的胚性愈伤组织; c.水浸状的愈伤组织; d.发育较好的胚性愈伤组织; e.清晰可见的胚头和胚柄; f.体胚成熟; g.体胚开始萌发; h.刚分离的成熟体胚; i.体胚苗伸长; j.再生植株。 a. Zygotic embryo peeled off; b. Initiating embryogenic callus; c. Hydro-callus; d. Embryogenic callus growing well; e. Embryonal head and suspensor system; f. Maturing somatic embryo; g. Germinating somatic embryo; h. Separated somatic embryo; i. Growing up somatic embryo; j. Plantlet regenerated. |
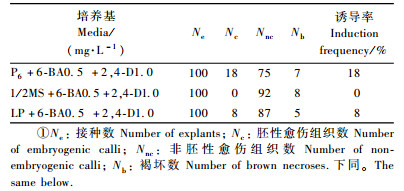
1) 基本培养基的筛选 选用改良P6(Pullman et al., 1991)、1/2MS及LP(Li et al., 1998)为基本培养基,设计诱导培养基3组: ① P6+6-BA0.5 mg·L-1+2, 4-D1.0 mg·L-1; ②1/2MS+6-BA0.5 mg·L-1+2, 4-D1.0 mg·L-1; ③LP+6-BA0.5 mg·L-1+2, 4-D1.0 mg·L-1(表 1)。每组10瓶,每瓶放置剥取的完整胚10粒。
|
|
2) 生长调节剂的筛选 在基本培养基筛选试验完成后,为筛选较适宜的生长调节剂,设计诱导培养基8组,即以P6为基本培养基,分别添加6-BA0.5,0.5,0.5,0.5,0.1,1.0,1.5,2.5 mg·L-1; 2, 4-D1.0,1.5,2.0,2.5,1.5,1.5,1.5,1.5 mg·L-1(表 2)。每组10瓶,每瓶10粒胚。
|
|
以上培养基均加入蔗糖30 g·L-1, 谷氨酰胺450 mg·L-1,水解酪蛋白500 mg·L-1,琼脂5 g·L-1,pH5.8。在22~25 ℃下暗培养。
1.4 胚性愈伤组织保持与增殖培养基设计培养基3组: ① P6+6-BA0.5 mg·L-1+2, 4-D 1.0 mg·L-1; ②P6+6-BA0.5 mg·L-1+2, 4-D 1.5 mg·L-1; ③P6+6-BA0.5 mg·L-1+2,4-D 2.0 mg·L-1。此3组培养基均加入蔗糖30 g·L-1, 谷氨酰胺450 mg·L-1,水解酪蛋白500 mg·L-1,琼脂5 g·L-1。pH5.8,22~25 ℃下暗培养。
1.5 体细胞胚成熟培养基设计培养基3组: ①P6+ABA10 mg·L-1; ②P6+ABA15 mg·L-1; ③ P6+ABA20 mg·L-1。以上培养基均加入蔗糖60 g·L-1, PEG4000 100 mg·L-1,琼脂5 g·L-1。pH5.8,22~25 ℃下暗培养。
1.6 体细胞胚萌发培养基以P6为基本培养基,不加激素,附加活性炭5 g·L-1,蔗糖5 g·L-1,琼脂5 g·L-1,pH5.8,22~25 ℃下暗培养7天后,移入全光培养室。
1.7 观察记录丽江云杉体细胞胚诱导的各个阶段,分别记载胚性、非胚性愈伤组织、体细胞胚发生数量,在Leica显微镜和解剖镜下进行镜检,观察胚性愈伤组织、体细胞胚的形态。
2 结果与分析 2.1 胚性愈伤组织的诱导丽江云杉成熟合子胚在诱导培养基培养30天后,先后从合子胚的胚根端、下胚轴表面和上胚轴与子叶区形成白色半透明的愈伤组织(图 1b),40~50天后继代1次后,愈伤组织增殖较快,此时转入增殖保持培养基中继续培养并增殖,10~14天继代1次,经2~4次继代后将形成3类明显可辨的愈伤组织:第1类为白色或淡黄色,颗粒状疏松或结构紧密的愈伤组织,逐渐变黄而至褐色死亡; 第2类为浅白色水浸状的粘性愈伤组织,这类愈伤组织在继代培养中生长最快,但无形态发生,在光照条件下易变褐死亡(图 1c); 第3类为白色、半透明、晶莹、有粘性的丝状物(图 1d),在显微镜下观察可见其细胞核大、细胞质浓,清晰可见胚头(即胚细胞)和细丝状胚柄细胞团(图 1e),为发育较好的丽江云杉胚性愈伤组织。
2.2 不同基本培养基的胚性愈伤组织诱导结果7个单株的混合种子的胚接种在3组基本培养基附加6-BA0.5 mg·L-1+2, 4-D1.0 mg·L-1上,40天转接1次,60天后进行观察,统计其诱导结果(表 1)。3组培养基的诱导率差异较大: 1/2 MS没有胚性愈伤组织分化; LP为8%; P6比较适宜丽江云杉胚性愈伤组织的诱导,诱导率可达18%,这在针叶树种上是较高的诱导率。
2.3 不同激素配比的诱导结果7个单株的混合种子胚接种在P6基本培养基附加不同浓度6-BA及2, 4-D上,40天转接1次,120天后观察,统计其诱导结果(表 2)。
培养基中外源激素的配比对胚性愈伤组织的诱导及生长有很大的影响,特别是2, 4-D的浓度起着至关重要的作用,虽然在各种2, 4-D浓度的培养基上都能诱导出胚性愈伤组织,但诱导率存在很大差异。从表 2可看出,在P6基本培养基中,6-BA0.5 mg·L-1下,胚性愈伤组织诱导数量在2, 4-D 1.5 mg·L-1时较高,随着附加2, 4-D质量浓度的增加,诱导率逐渐下降; 而在2, 4-D1.5 mg·L-1下,胚性愈伤组织诱导数量随6-BA浓度的增加,诱导率逐渐增加,至6-BA1.0 mg·L-1时达到临界值,其浓度再增加,诱导率随之下降,而低于6-BA0.1 mg·L-1诱导率也很低。综合观察6-BA和2, 4-D的交互作用及后期体胚的成熟质量,选择出丽江云杉胚性愈伤组织较适宜的诱导培养基P6+6-BA0.5 mg·L-1+2, 4-D1.5 mg·L-1。以该培养基作为诱导培养基,能获得较好胚性愈伤组织,后期体胚成熟时畸形胚较少。
2.4 不同单株诱导结果大量文献资料(黄健秋等,1995b; Tang et al., 2001; Jain et al., 1995)表明,针叶树种体胚诱导单株个体差异较大,为此进行了丽江云杉不同单株体胚诱导效果的试验。在以上试验的基础上,选用P6+6-BA0.5 mg·L-1+2, 4-D1.5 mg·L-1,分别对7个单株进行试验(表 3)。由表 3可看出,参试的7个单株中,胚性愈伤组织诱导单株差异较大,6号达18%,而1号为0。可见基因型对其体细胞胚诱导频率的影响很大,这和其他针叶树种体胚诱导情况类似。
|
|
胚性愈伤组织增殖培养1~2次后,愈伤组织不断增殖。在显微镜下可看到由1个长形薄壁细胞组成的胚柄,胚柄上部是一群团状细胞形成的胚性细胞团,在适宜的培养条件下,不断地无序分裂,其细胞系得以正常继代。10~14天继代1次,如果不及时继代,将会导致培养物胚性的丧失,且这种丧失是不可逆转的。选用生长较好的2个细胞系分别放入3组培养基(① P6+6-BA0.5 mg·L-1+2, 4-D1.0 mg·L-1; ②P6+6-BA0.5 mg·L-1+2, 4-D1.5 mg·L-1; ③P6+6-BA0.5 mg·L-1+2, 4-D2.0 mg·L-1)进行增殖试验。
试验结果表明胚性细胞系均能增殖,但在添加2.0 mg·L-12, 4-D的培养基中,其细胞团生长过快,在后期成熟体胚诱导中,不能诱导出成熟体胚,即使诱导出,也是畸形胚。而在其余2组培养基中继代培养,表现较好,1.0 mg·L-12, 4-D在成熟体胚诱导中,较1.5 mg·L-12, 4-D成胚率更高。
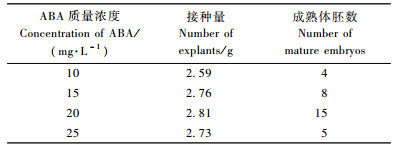
2.6 体细胞胚胎成熟诱导结果待丽江云杉胚性愈伤组织大量增殖后,即可接入体胚成熟培养基中。ABA目前已被广泛用于促进针叶树的子叶胚发育成熟的培养基中,一般认为,ABA的作用是防止产生裂生多胚,因而促进胚胎单个化并进一步发育成熟,但不同物种所需ABA浓度不一。本次试验分别添加ABA10,15,20,25 mg·L-1(表 4)。结果表明以添加ABA20 mg·L-1的处理效果较好,成胚数量较多,且体细胞胚质量较好,偶见畸形胚(图 1f)。
|
|
待体细胞胚成熟后,可清晰见到形成的子叶,而发育到子叶胚期时,将胚轻轻挑出,转至无激素的体细胞胚发育培养基中,放置在光强1 000~1 600 lx下培养。15~20天后,体细胞胚萌发,呈绿色,下胚轴伸长,白色胚根向下延伸,根尖正常分化(图 1g,h,i); 50~60天后,形成完整小植株。待苗长到3~4 cm时,移到自然光下练苗7天,用清水洗净,即可移到营养袋中,放入温室(图 1j)。本试验移栽成活率达到54%。待小苗长出新叶,生长至20~30 cm时即可移到大田。
3 结论与讨论选择合适的外植体是诱导体细胞胚发生的第一步,也是成功的关键。Hakman等(1985)首次以欧洲云杉的幼胚为外植体诱导体细胞胚获得成功,愈伤组织诱导率几乎达到100%,而von Armold(1987)以其成熟胚为材料诱导愈伤组织,诱导率仅为50%;在白云杉中,Lu等(1987)以幼胚为材料诱导率达60%,Tremblay(1990)以成熟胚为材料诱导率仅为10%; Budimir等(1992)以塞尔维亚云杉10~21天的幼苗为材料诱导体胚,通过调节细胞分裂素浓度,最高诱导率达9.6%; 李映红等(1990)对青杄进行体胚诱导,结果只从幼胚中诱导出体细胞胚; 杨金玲等(1997)在总结前人经验的基础上以白杄成熟胚为材料得到了较好的结果,诱导率达96%; 刘宝光等(2009)以红皮云杉未成熟胚为材料进行诱导,研究了基本培养基、光照条件、胚采集时间,最后得到较高诱导率81.5%。
基因型是影响体细胞胚胎发生的内在因素,其个体遗传基础,决定了离体培养的反应能力(即再生能力)。不同种的植物甚至同种植物的不同品种、不同地理来源、不同家系个体之间,其个体基因型都存在差异,这就决定了不同的体细胞胚胎发生能力明显不同(Miguel et al., 2004; Lelu-Walter et al., 2008)。黄健秋等(1995b)以云南松云南、广西2个种源成熟胚为材料, 同时放入2种培养基中,诱导率为0.8%~35.8%; 唐巍等(1998)以火炬松成熟胚8个基因型为材料,放入9种培养基中分别培养,结果发现各基因型差异较大,诱导率为0~81.6%; Tang等(2001)以24个基因型火炬松为材料诱导胚性愈伤组织,诱导率最高达77.7%,最低仅为18.2%;塞尔维亚云杉的5个品种在外植体大小和培养条件完全相同的情况下诱导体胚,体细胞诱导频率最高达18.7%, 最低只有1.3%(Jain et al., 1995)。为了使取材时间不受胚发育时间的限制,本试验以丽江云杉成熟胚为材料,分别从7个单株上采集进行培养,诱导率为0~18%。这一结果表明丽江云杉基因型对体细胞胚胎发生有较大影响,这方面的机制还有待深入研究,为提高体胚诱导率下一步可以尝试以不同发育期的胚作为外植体进行培养。
丽江云杉体细胞胚胎发生过程可分为4个阶段,每个阶段所用培养基中激素类型和浓度配比的组合比较复杂。从本试验看,诱导阶段2, 4-D起主导作用,而在成熟培养阶段,ABA是关键因子,这与目前已成功进行体胚再生的其他针叶树种相似。通过试验筛选出1)胚性愈伤组织诱导培养基P6+6-BA0.5 mg·L-1+2, 4-D1.5 mg·L-1; 2)胚性愈伤组织保持与增殖培养基P6+6-BA0.5 mg·L-1+2, 4-D1.0 mg·L-1; 3)成熟体胚诱导培养基P6+ABA20 mg·L-1; 4)体胚萌发培养基P6+5 g· L-1活性炭+蔗糖5 g·L-1。
胚性愈伤组织增殖培养1~2次后,愈伤组织不断增殖,在显微镜下可看到由1个长形薄壁细胞组成的胚柄,胚柄上部是一群团状细胞形成的胚性细胞团,在适宜的培养条件下,分散的多胚就会不断地无序分裂,细胞系得以正常继代。10~14天继代1次,如果不及时将胚性愈伤组织从非胚性愈伤组织中挑选出来进行培养,将会导致培养物胚性丧失,而且这种丧失是不可逆转的; 继代培养时最好把2, 4-D浓度降低,这有利于保持其胚性。
本试验成功建立了丽江云杉体细胞胚胎发生体系,扩大规模,与生产结合进行规模化种苗生产,利用生物反应器大规模生产丽江云杉体细胞胚还有待进一步完善和研究。由于体细胞胚发生体系较为稳定,可以在分子水平上研究其胚胎发生的机制。利用农杆菌介导等转化方法,在胚性愈伤组织阶段进行侵染,导入目的基因,进行遗传改良,可以缩短丽江云杉育种周期。
郭奕明, 杨映根, 郭毅, 等. 2003. 落叶松体细胞的胚胎发生[J]. 植物生理学通讯, 39(5): 531-535. |
黄健秋, 卫志明, 许智宏. 1995a. 马尾松成熟合子胚的体细胞胚胎发生和植株再生[J]. 科学通报, 40(1): 72-75. |
黄健秋, 卫志明. 1995b. 云南松成熟胚的体细胞胚胎的发生研究[J]. 实验生物学报, 28(4): 371-376. |
贾彩凤, 李悦. 2006. 华山松胚性愈伤组织诱导与幼胚离体培养[J]. 植物学通报, 23(2): 186-191. |
李茜, 张存旭, 郑瑞杰. 2006. 白皮松胚性愈伤组织诱导因素的研究[J]. 西北林学院学报, 21(2): 80-83. |
李映红, 郭仲琛. 1990. 青杄在不同条件下的体细胞胚胎发生及苗的形成[J]. 植物学报, 32(7): 568-570. |
刘宝光, 李成浩, 王伟达, 等. 2009. 红皮云杉胚性愈伤组织诱导技术研究[J]. 植物研究, 29(1): 69-73. |
吕守芳, 张守攻, 齐力旺, 等. 2005. 日本落叶松体细胞胚胎发生的研究[J]. 林业科学, 41(2): 48-52. DOI:10.11707/j.1001-7488.20050208 |
齐力旺, 韩一凡, 韩素英, 等. 2004. 麦芽糖、NAA及ABA对华北落叶松体细胞胚成熟及生根的影响[J]. 林业科学, 40(1): 52-57. DOI:10.11707/j.1001-7488.20040109 |
邱德有, 李如玉, 李玲. 1998. 红豆杉及南方红豆杉体细胞胚胎发生研究[J]. 林业科学, 43(6): 50-54. |
施季森. 2000. 迎接21世纪现代林木生物技术育种的挑战[J]. 南京林业大学学报, 24(6): 1-6. |
唐巍, 欧阳潘. 1998. 火炬松胚性愈伤组织诱导和植株再生的研究[J]. 林业科学, 34(3): 115-119. |
王军辉, 张建国, 张守攻, 等. 2006. 丽江云杉硬枝扦插技术与生根特性研究[J]. 西北农林科技大学学报, 34(7): 97-105. |
吴丽君. 2008. 长叶松优良家系的体胚发生研究[J]. 福建林学院学报, 28(1): 42-47. |
席梦利, 施季森. 2006. 杉木合子胚愈伤组织的诱导及植株再生[J]. 南京林业大学学报, 30(2): 6-9. |
杨艳, 李志辉, 丁贵杰, 等. 2007. 马尾松幼胚培养愈伤组织诱导的初步研究[J]. 湖南环境生物职业技术学院学报, 13(1): 6-9. |
杨金玲, 桂耀林, 杨映根, 等. 1997. 白杄体细胞胚胎发生及其植株再生[J]. 植物学报, 39(4): 315-321. |
Budimir S, Vujicic R. 1992. Benzyladenine induction of buds and somatic embryogenesis in Picea omorika Purk[J]. Plant Cell, Tissue and Organ Culture, 31: 89-94. DOI:10.1007/BF00037691 |
Carneros E, Celestino C, Klimaszewska K, et al. 2009. Plant regeneration in Stone pine (Pinus pinea L.) by somatic embryogenesis[J]. Plant Cell, Tissue and Organ Culture, 98: 165-178. DOI:10.1007/s11240-009-9549-3 |
Gale S, John A, Harding K, et al. 2008. Developing cryopreservation for Picea sitchensis (Sitka spruce) somatic embryos: a comparison of vitrification protocols[J]. Cryolettters, 29: 135-144. |
Hakman I, von Arnold S. 1985. Plantlet regeneration through somatic embryogenesis in Picea abies(Norway spruce)[J]. Journal of Plant Physiology, 121: 149-158. DOI:10.1016/S0176-1617(85)80040-7 |
Jain S M, Gupta P K, Newton R J. 1995. Somatic embryogenesis in woody plants Volume 3: Gymnosperms[J]. Dordrecht Kluwer Academic Publishers. |
Lelu-Walter M A, Bernier-Cardou M, Klimaszewska K. 2008. Clonal plant production from self-and cross-pollinated seed families of Pinus sylvestris(L.) through somatic embryogenesis[J]. Plant Cell, Tissue and Organ Culture, 92: 31-45. |
Li X Y, Huang F H, Gbur Jr E E. 1998. Effect of basal medium, growth regulators and Phytagel concentration on initiation of embryogenic cultures from immature zygotic embryos of loblolly pine[J]. Plant Cell Reports, 17: 298-301. DOI:10.1007/s002990050396 |
Lu C Y, Thorpe T A. 1987. Somatic embryogensis and plantlet regenration in cultured immature embryos of Picea glauca[J]. Plant Physiol, 128: 297-302. DOI:10.1016/S0176-1617(87)80244-4 |
Miguel C, Goncalves S, Tereso S, et al. 2004. Somatic embryogenesis from 20 open-pollinated families of Portuguese plus trees of maritime pine[J]. Plant Cell, Tissue, and Organ Culture, 76: 121-130. DOI:10.1023/B:TICU.0000007253.91771.e3 |
Park Y S, Pond S E, Bonga J M. 1993. Initiation of somatic embryogenesis in white spruce(Picea glauca): genetic control, culture treatment effects, and implications for tree breeding[J]. Theor Appl Genet, 86: 427-436. DOI:10.1007/BF00838557 |
Pullman G S, Gupta P K.1991. Method for reproducing coniferous plants by somatic embryogenesis using adsorbent materials in the development stage. U.S. Patent No.5034326, July 23, 1991.
|
Pullman G S, Johnson S. 2002. Somatic embryogenesis in loblolly pine(Pinus taeda L.): improving culture initiation rates[J]. Ann For Sci, 59: 663-668. DOI:10.1051/forest:2002053 |
Stasolla C, Yeung E C. 2003. Recent advances in conifer somatic embryogenesis: improving somatic embryo quality[J]. Plant Cell, Tissue and Organ Culture, 74: 15-35. DOI:10.1023/A:1023345803336 |
Sutton B. 2002. Commercial delivery of genetic improvement to conifer plantations using somatic embryogenesis[J]. Ann For Sci, 59: 657-661. DOI:10.1051/forest:2002052 |
Tang Wei, Ross Whetten, Ron Sederoff. 2001. Genotypic control of high-frequency adventitious shoot regeneration via somatic organogenesis in loblolly pine[J]. Plant Science, 161: 267-272. DOI:10.1016/S0168-9452(01)00394-6 |
Tautorus T E, Attree S M, Fowke L C, et al. 1990. Somatic embryogenesis from immature and mature zygotic embryos, and embryo regegeration from protoplasts in Black spruce(Picea mariana)[J]. Plant Sci, 67: 115-124. DOI:10.1016/0168-9452(90)90057-U |
Tremblay F M. 1990. Somatic embryogenesis and plantlet regeneration from embryos isolated from stored of Picea glauca[J]. Can J Bot, 68: 236-242. DOI:10.1139/b90-033 |
von Armold S. 1987. Improved efficiency of somatic embryogenesis in mature embryos of Picea abies[J]. Plant Physiol, 128: 233-244. DOI:10.1016/S0176-1617(87)80237-7 |
 2010, Vol. 46
2010, Vol. 46