文章信息
- 林霞, 郑坚, 刘洪见, 钱仁卷, 王金旺
- Lin Xia, Zheng Jian, Liu Hongjian, Qian Renjuan, Wang Jinwang
- 不同基质对无柄小叶榕容器苗生长和叶片生理特性的影响
- Effects of Different Media on Growth and Leaf Physiological Characteristics of Ficus concinna var. subsessilis Container Seedlings
- 林业科学, 2010, 46(8): 62-70.
- Scientia Silvae Sinicae, 2010, 46(8): 62-70.
-
文章历史
- 收稿日期:2010-01-22
- 修回日期:2010-06-06
-
作者相关文章
2. 浙江省亚热带作物研究所 温州 325005
2. Zhejiang Institute of Subtropical Crop Wenzhou 325005
林业发达国家早在20世纪50年代就开始对容器育苗基质进行研究(周红等,1993),经过多年的探索,许多国家都研发取材于本地、适用于本地树种的优良容器育苗基质,而且都在向轻型化基质发展。如波兰用泥炭、枯枝落叶或树皮粉作基质; 芬兰采用泥炭、苔藓或矿质和堆肥的混合物作为培养基质; 美国常用1:1或2:1细泥炭与蛭石的混合物作基质; 加拿大常用在魁北克等地区发现的、具有商业意义的草炭土来做基质。我国早期容器苗生产多采用从国外进口的泥炭藓,由于价格昂贵,限制了容器苗的发展。近些年来,各地开始走国产化的道路,发掘当地的可利用资源,广泛开展育苗基质筛选研究。但总体看来,我国的培养基质多采用天然土壤配制而成,不仅质量大,而且保水性、孔隙度等性状远远不如泥炭、蛭石等材料(秦国峰等,1998)。目前以我国当地资源为基础、用质地疏散、质量较轻的有机物为主配制轻型基质进行林木容器育苗技术研究的报导尚不多见。
无柄小叶榕(Ficus concinna var. subsessilis)是分布于我国亚热带最北缘的榕属常绿大乔木,其树姿雄伟,长寿常绿,是优良的植树造林绿化树种。该树种在我国尤其南方的生态绿化中占据重要的位置,因此每年都需要大量的苗木。然而在实际的造林和城市绿化实践中,无柄小叶榕的大树价格昂贵,苗木奇缺,其关键问题之一就在于缺少良好的育苗技术措施。因此以本地丰富资源为基础筛选轻型基质,进行无柄小叶榕容器育苗技术的研究具有较大的社会和经济意义。本研究以温州当地农林废弃物资源为原料,配置轻型育苗基质,研究了不同轻型基质对无柄小叶榕容器苗生长和叶片生理特性的影响。试图筛选适用于无柄小叶榕的轻型容器育苗基质,探明不同轻型基质对无柄小叶榕生长的影响,旨在为无柄小叶榕的容器育苗和造林技术提供实践经验和理论依据。
1 材料与方法 1.1 试验材料与培养方法以温州本地无柄小叶榕为试验材料,按照林霞等(2003)采用的方法进行种子的收集处理。用清水浸泡种子24 h,再用0.5%的高锰酸钾溶液消毒种子3~4 h,然后用清水冲洗3~4遍,放入沙床中30 ℃沙藏催芽,25 ℃播种于容器盘中。每种基质播种穴盘苗50盘,播种后约7~12天出苗,小苗供试验用。小苗长到约50天后开始各生长指标和生理指标的测定,每隔15天测定1次。试验在浙江亚热带作物研究所的瓯海潘桥花卉基地智能温室内进行,白天最大光照为1 200 μmol·m-2s-1,温度为白天28 ℃±2 ℃,夜间20 ℃±2 ℃,相对湿度为60%±5%。
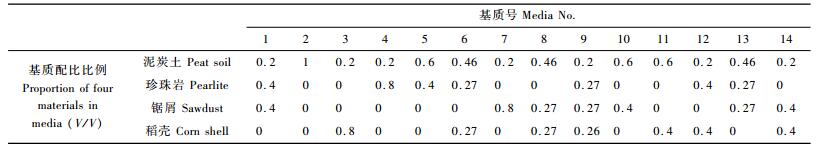
1.2 基质的配比与试验设计选择当地资源丰富、加工容易、价格低廉的珍珠岩、锯屑、稻谷壳和泥炭土4种材料作为育苗基质的基本材料,并对其适当加工以降低可溶物含量。珍珠岩经过膨化处理,粒径约5 mm; 锯屑加入尿素堆放2个月以上以使其加速分解,使用前揭开塑料布晾干; 稻谷壳经过炭化处理,淋洗、晒干; 泥炭土经晒干、粉碎、过筛,粒径约5 mm,然后加高锰酸钾堆沤消毒。基质配方采用单形重心混料试验设计方法(洪伟,1993),共设计了14个轻型基质配方(表 1),并以目前林业生产中常用容器苗基质配方为对照(对照基质编号为15,其配方为:松林表土:黄心土:肥土:火烧土为1:7:1:1)。
|
|
采用常规测定方法(华孟等,1993)测定基质密度、毛管孔隙度、总孔隙度、毛管持水量、最大持水量和最小持水量等物理性质。按照鲍士旦等(2000)的方法测定化学性质。有机质用重铬酸钾容量法,总N用凯氏法,总P用钼铵兰比色法测定; 速效K用1 mol·L-1醋酸铵浸提火焰光度法测定; pH值用酸度计测定。以上各指标重复3次。
1.4 植株生长指标的测定从2006年4月1日开始,每隔15天进行定期生长监测。用游标卡尺和常规米尺测量植株的苗高、地径等,用电子天平等测定植株的全株鲜质量、全株干质量等生长指标,每处理测定30株。相对生长速率(RHR)为n天内植物高度生长量/n,其单位为mm·d-1。
1.5 叶片气体交换参数和荧光参数的测定采用LI-6400便携式光合测定系统(LI-6400,LI-COR,USA)测定气体交换参数。测定时大气CO2浓度约为385 μmol·mol-1,相对湿度为65%,叶室温度为25 ℃。净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)由仪器直接给出,水分利用效率(WUE)按WUE=Pn/Tr计算。每项测定重复4次。
叶绿素荧光参数按照Yang等(2007)的方法用荧光叶室(LI-6400荧光叶室,LI-COR USA)测定。叶片黑暗适应1 h后,打开检测光( < 0.1 μmol·m-2 s-1)测定最小荧光(Fo),随后打开600 nm的饱和光(>7 000 μmol·m-2 s-1)测定最大荧光(Fm),然后打开作用光(1 000 μmol·m-2 s-1)平衡30 min后测定光下稳态荧光(Fs),紧接着再打开饱和光测定光下最大荧光(F′m),然后打开远红光,5 s后测定光下最小荧光(F′o)。PSⅡ(photosystemⅡ,光系统Ⅱ)最大光化学效率(Fv/Fm)按公式Fv/Fm=(Fm-Fo)/Fm计算; 非光化学猝灭系数(qN)由公式qN=(Fm-F′m)/(Fm-F′o)计算而得。每项测定重复4次。
1.6 色素含量、超氧自由基生成速率和膜脂过氧化程度的测定取测定气体交换参数和荧光参数相对应的叶片迅速置于液氮中,然后带回实验室内进行色素含量、超氧自由基(O2·)生成速率和丙二醛(MDA)含量的测定,重复4次。叶绿素含量的测定参照Arnon(1949)的方法,类胡萝卜素含量参照赵世杰等(1998)的方法,O2·生成速率按照Verma等(2005)的方法进行测定。以MDA含量作为膜质过氧化的指标,参照Huang等(2004)的方法稍加改动,用硫代巴比妥酸(TBA)比色法测定氧化物MDA的形成。MDA在4 ℃ 3 mL的0.1%(W/V)三氯乙酸(TCA)中提取,在11 700 r·min-1下离心2 min后,取上清液0.5 mL加入1.5 mL TBA(0.5%,溶于20%TCA),在90 ℃水浴下加热20 min后,快速在冰浴下停止反应,在10 300 r·min-1下离心5 min后取上清液,测定532,600和450 nm波长下的消光度,利用分光光度计法计算MDA的含量。
1.7 数据分析本文采用SPSS 13.0版对数据方差分析和差异显著性分析。
2 结果与分析 2.1 不同基质的化学和物理性质表 2, 3是不同基质的基本物理和化学性质。从中可以看出,7号和11号基质的有机质含量略高于对照(15号常规育苗基质),但差异不显著; 而其他基质的有机质含量则明显低于常规基质,其中12号基质的含量最小,仅为对照的20.5%。2,8,11号基质的总磷(TP)含量显著高于对照,而3,7,12号基质的总磷含量则明显低于常规基质。1,4,7号基质的有效钾(K)含量高于常规基质,其他基质有效钾含量则低于对照,但是所有基质与对照之间的差异不显著。9号和12号基质的总氮(TN)含量与常规基质的TN含量无显著差异,而14号基质的TN含量明显低于对照,其余基质的TN含量则显著高于对照。在物理性质方面,不同基质的物理性质有较大差异。密度最小的是7号基质,只有对照的16.3%,而最大持水量却是对照的6.0倍。与常规基质相比,各轻型基质在各项物理指标上大都优于对照。总体来看,本试验所设计的14种基质中的一部分无论是化学性质还是物理性质都要优于常规基质。这部分基质养分丰富、质地疏松、质量轻、具有良好的透气性能和持水能力,可为苗木的生长提供有利条件。
|
|
|
|
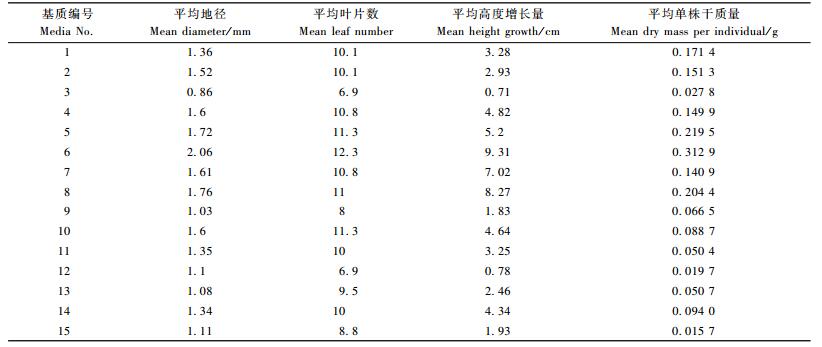
不同基质的容器苗苗高的生长趋势基本相同,在开始测量后的30天内生长缓慢(4月1日—30日苗高的平均相对生长速率值RHR为0.285 mm·d-1),之后开始迅速生长(4月30日—5月30日苗高的平均相对生长速率值RHR为1.351 mm·d-1)。在4月30日前的30天内不同基质容器苗苗高的差异不明显(F=0.278,P=0.996),而30天后,苗高生长曲线的离散度增加,不同基质之间的苗高出现极显著差异(F=95.150,P < 0.001)。4,5,6,7,8,10号基质苗高生长量明显优于对照(表 4),其中6号基质表现最好; 3,9,12号基质明显比对照差,其中3号和12号表现最差。
|
|
与苗高生长不同,不同基质容器苗地径的生长从试验开始后的15天就出现显著差异。4月15日开始不同基质容器苗的地径差异极显著(F=6.651,P < 0.001),且随着生长的继续这种差异逐步明显(30天后F=21.064,P < 0.001,60天后F=43.103,P < 0.001),F值越来越大,说明其差异性越来大。与苗高生长类似,6号和8号基质的容器苗表现最好,3号和12号则始终表现较差。但是与苗高相比,各基质间地径的差异稍小(60天后苗高F值为126.074,P < 0.001,地径F值为43.103,P < 0.001)。
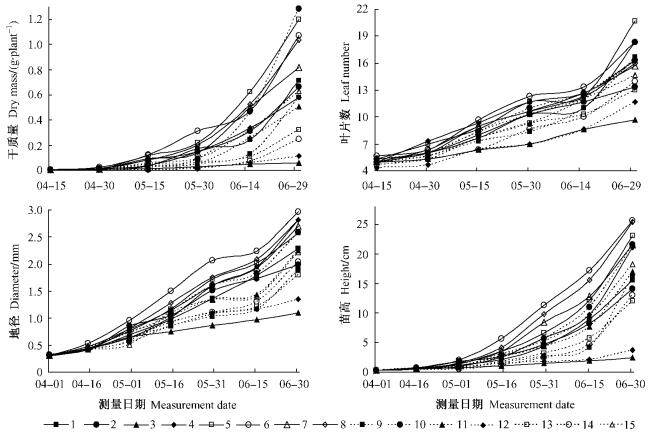
单株叶片数也是反映苗木质量的重要指标之一。同地径的生长进程类似,不同基质无柄小叶榕的单株叶片数在测量期间一直呈现逐步增加的趋势。不同基质配方对单株叶片数的影响有明显差异(处理结束后,各基质处理的幼苗叶片数F值为48.432,P < 0.001)。总体而言,5,6,7,8和11号基质的植株叶片数多于对照,3,12,13和14号基质的苗木叶片数明显少于对照(图 1)。
|
图 1 不同基质容器苗的生长变化 Figure 1 Growth of container seedlings in different media |
生物量是评价植株长势的重要指标。图 1表明,无柄小叶榕容器苗平均单株干质量增长呈现相似的趋势。在测量的前15天内,容器苗生物量增长缓慢,不同基质对干质量的影响不显著,各基质无柄小叶榕生物量的生长曲线成较紧密的束状。在此之后,容器苗生物量的生长加快,不同基质之间也开始出现明显的差异,而且有越来越扩大的趋势。在测量开始后的第75天,不同基质容器苗的平均单株鲜质量排序为: 5>10>6>8>7>2>1>9>15>4>11>13>14>12>3号基质。不同基质对容器苗平均单株干质量的影响与其对鲜质量的影响大体类似,其中平均单株干质量最大的是10号基质,其值达到1.28 g·株-1,平均单株干质量最小的是3号基质,其值仅为0.06 g·株-1。
2.3 不同基质对无柄小叶榕容器苗气体交换特性的影响图 2显示不同基质对无柄小叶榕容器苗净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)和水分利用效率(WUE)的影响。不同基质无柄小叶榕容器苗的Pn有明显的差异,其中Pn较大的是1,5,6,8号基质,其值分别达到了11.7,11.5,10.5和11.2 μmol·m-2s-1,都明显高于常规基质容器苗的Pn(7.3 μmol·m-2s-1)。容器苗Pn较小的几个基质是3,12和14号,其值分别为3.4,3.8和2.1 μmol·m-2s-1,都要明显低于对照。叶片气孔导度最大的是9号基质培育的容器苗,其值(0.819 mol·m-2s-1)为对照(0.381 mol·m-2s-1)的2.15倍; 最小的是14和4号基质,其值仅为对照的4.7%和17.3%。与14和4号容器苗较低的Gs相对应,在15种基质配方中,只有这2种基质的Ci明显低于其他基质的容器苗。尽管12,13和3号基质容器苗的Gs也较低,然而这3种基质容器苗的Ci并没有明显降低,说明它们较低的光合速率并不是气孔因素导致的。9,1,10和6号基质容器苗的蒸腾速率(Tr)要高于常规基质容器苗,而14,4和12号的Tr则明显低于对照。从图 2可以看出,不同基质对无柄小叶榕容器苗水分利用效率(WUE)的影响差异也很大。15种基质配方中,3号基质容器苗的WUE最小,仅为0.84 μmol·mmol-1; 而最大的是4号基质,其值(3.65 μmol·mmol-1)是3号的4.3倍。

|
图 2 不同基质对无柄小叶榕气体交换特性及荧光诱导动力学参数的影响 Figure 2 Effect of different media on gas exchange property and fluorescent induced dynamics parameters |
在荧光诱导动力学参数测定中,Fv/Fm代表PSⅡ最大光化学效率,能够反映PSⅡ利用光能的能力和光系统反应中心受到损伤的情况(史庆华,2004; 郭英等,2006)。图 2显示不同基质配方对无柄小叶榕Fv/Fm值的影响。可以看出,不同基质容器苗的Fv/Fm值的排序为: 1>8>6>5>10>2>7>11>15>9>12>13>4>3>14号基质,其中该值最小的14号基质容器苗的Fv/Fm(0.568)仅为常规基质容器苗Fv/Fm(0.773)的73.5%,而3,4,13和12号基质容器苗的Fv/Fm也要明显低于对照。
从图 2可以看出,15种基质配方中,3,12和14号容器苗的qN明显低于15号常规基质容器苗,5号和10号的qN显著高于对照,而其他容器苗的qN值则与对照相比无明显差异。这说明相对于常规基质容器苗,3,12和14号基质容器苗不能有效地耗散光系统积累的过剩激发能,而其他容器苗则能够维持或促进这种生理功能来保护光合机构。
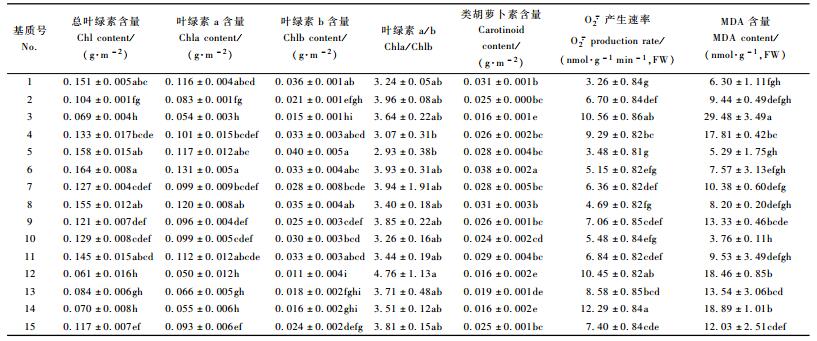
2.5 不同基质对无柄小叶榕容器苗光合色素含量、O2·产生速率和膜脂过氧化的影响叶片光合色素含量是反映植物光合能力的一个重要指标。不同基质无柄小叶榕的叶绿素a、叶绿素b、总叶绿素含量和类胡萝卜素含量有很大的差异(表 5)。总体而言,1,5,6,8和11号基质容器苗的光合色素含量较高,而3,12,13和14号基质容器苗的光合色素含量则要显著低于常规基质容器苗的含量。这与Pn的试验结果大体一致,说明前5种基质可促进无柄小叶榕光合色素的合成,从而提高其叶片的光合速率,而后4种基质则不利于光合色素的合成和光合速率的提高,从而抑制容器苗的生物产量。然而,不同基质小叶榕叶绿素a和b的比值(Chla/Chlb)与对照之间的差异则不显著(表 5)。
|
|
1,5和8号基质小叶榕的O2·产生速率显著低于常规基质容器苗的O2·产生速率,而3,12和14号基质容器苗的O2·产生速率则明显高于对照,其中最高的14号的O2·产生速率(12.3 nmol·g-1 min-1 FW)约为15号(7.4 nmol·g-1 min-1) 1.67倍,其他则与对照的差异较小(表 4)。与此相对应的是3,2和14号基质容器苗的丙二醛(MDA)含量明显高于15号,说明其叶片膜脂过氧化程度加剧,而其他基质容器苗的MDA含量与对照差别不大或者低于对照(表 5)。
3 讨论与结论 3.1 不同基质无柄小叶榕容器苗生长差异的原因不同基质无柄小叶榕容器苗的地径和单株叶片数呈现逐步增加的趋势; 而苗高和单株生物量在生长初期存在大约30天的缓慢增长期,随后进入快速增长期。在缓慢增长期,15种基质对无柄小叶榕容器苗地径的生长影响显著,但对苗高和生物量的影响不明显; 在缓慢生长期后,不同基质容器苗的苗高、地径、叶片数量和生物量生长出现明显的差异,说明基质对容器苗生长的影响主要发生快速生长期,这可能是因为在缓慢增长期容器苗的生长对于养分和水分等的需求较少,不同基质都能够提供足够的营养以供其正常生长; 然而在快速生长期,容器苗生长所需的水分和营养元素显著增加,一些基质提供养分不足,容器苗的生长便出现明显的差异。
与对照基质15相比,3,12,13和14号基质容器苗生长较差,而5,6,8和10号基质容器苗生长较好。在物理性状方面,无论是最大持水量、最小持水量还是毛管持水量,5,6,8和10号基质均明显高于常规基质; 3,12,13和14号基质的毛管孔隙度和总孔隙度以及最大持水量、最小持水量和毛管持水量都没有显著低于常规基质,说明基质的透气性能和水分供应能力不是这4种基质容器苗生长显著低于对照的主要因素; 而5,6,8和10号基质较强水分供应能力可能是容器苗生长较好的原因之一。
3,12,13,14,5,6,8和10号基质的有机质含量都明显低于常规基质,生长较好的5,6,8和10号基质有机质含量仅为265~384 g·kg-1,生长较差的3,13和14号基质有机质含量338~388 g·kg-1,说明这些基质所提供的有机质能满足容器苗的生长所需,有机质含量的差异不是造成5,6,8和10号基质容器苗生长好的原因,也不是导致3,13和14号基质容器苗生长差的原因,而12号基质有机质含量为88 g·kg-1,显著低于其他基质,可能是造成容器苗生长差的原因之一。
5,6,8,10,3,12,13和14号基质速效钾含量与对照15号基质没有明显差异,因此速效钾不是造成容器苗生长差异的原因。容器苗生长较差的3,12,13和14号基质总磷含量0.47~0.76 g·kg-1,与容器苗生长较好的基质5,6和10号(除8外)总磷含量差异不明显,因此基质总磷含量不是造成苗木生长差的原因。5,6,8和10号基质的总磷含量明显高于常规基质15,而3,12和14号基质总磷含量明显低于5,6,8和10号基质,因此基质总含量可能是导致容器苗生长差异的主要营养元素,但基质13例外,导致该基质容器苗的生长较差的原因是试验造成还是其他因素,还需要进一步的研究证实。
3.2 不同基质无柄小叶榕容器苗光合作用差异的原因光合作用是植物生物量形成的基础,为植物提供95%以上的干物质(Sheehy et al., 2000)。不同基质容器苗的Pn差异明显,1,5,6和8号基质容器苗的Pn明显高于对照,而3,12和14号基质容器苗的Pn显著低于常规基质容器苗,这与容器苗的生长参数和生物量的试验结果基本一致,说明无柄小叶榕生物量的增长和光合作用具有密切的关系。
引起Pn下降的原因主要分为两大类,一类是气孔因素,主要受气孔的数量、孔径和开度等的影响(Cornic et al., 1991; Quick et al., 1992); 另一类为非气孔因素,主要受光合色素含量、光合机构活性和光合酶活性等多种因素控制(Lal et al., 1996)。伴随着气孔导度的下降,14号基质容器苗的胞间CO2浓度也显著低于对照和其他基质,说明由于气孔因素的限制,进入细胞内部的CO2浓度减少而抑制了容器苗的光合作用。因此气孔因素是导致14号基质容器苗Pn降低的一个重要原因。与此不同的是,3和12号基质容器苗的气孔导度也显著降低,但是其胞间CO2浓度不仅没有相应地降低,反而有所升高,因为CO2利用的减少会引起胞间CO2的大量积累,导致胞间CO2浓度升高,说明气孔因素不是造成这2种基质容器苗Pn降低的原因。3号和12号基质容器苗的叶绿素含量以及类胡萝卜素含量都明显低于对照,而且这2种基质容器苗的Fv/Fm也显著低于常规基质容器苗。因此导致3号和12号基质容器苗光合性能降低的非气孔因素包括光合色素合成不足和光合机构活性降低。此外,14号基质容器苗的光合色素含量和Fv/Fm也都明显低于对照,这说明除了气孔限制因子之外,非气孔因素也是14号基质容器苗Pn显著下降的另一重要原因。需要说明的是,光合作用的非气孔限制包括多种复杂因子,这里并不能排除光合关键酶(Rubisco和Rubisco活化酶)活性降低等其他原因在3、12和14号基质容器苗的Pn降低中可能起到的作用。
3.3 不同基质无柄小叶榕容器苗叶片过剩激发能的耗散途径叶片色素吸收的光能主要通过光合电子传递、叶绿素荧光发射和热耗散来消耗,这3种途径之间此消彼长,光合作用和热耗散的变化可引起荧光的相应改变。因此测量荧光参数可探究光合作用和热耗散情况。荧光非光化学猝灭系数(qN)反映PSⅡ反应中心所吸收的光能不用于光合电子传递而以非辐射能耗散掉的这部分光能(Demmig-Adams et al., 1992; 1996),而Car保护光系统散耗过剩光能,这已经被证明是高等植物在进化中获得的一种适应环境的有效措施(Gilmore et al., 1997; Demmig-Adams et al., 1990)。1,5,6,8和10号基质容器苗能够维持较高的非光化学淬灭系数(qN),同时这几种基质中无柄小叶榕的Car含量相对较高,说明这几种基质的容器苗能够有效地耗散过剩激发来保护光合机构,从而有利于维持较高的光合能力。PSⅡ原始光能转换效率(Fv/Fm)是反映光系统Ⅱ光化学效率的稳定指标,3,12和14号基质容器苗的Fv/Fm显著降低,表明这几种基质中容器苗处于胁迫环境中,导致光系统Ⅱ受到伤害,而这几种基质氮含量显著低于5,6,8和10号基质,因此氮素胁迫可能是造成光系统Ⅱ受损的原因。因此引起光合速率显著下降,这将导致这些苗木碳同化所需的光能严重下调。因此,尽管在正常的光强和环境下,这些容器苗所吸收的光能也可能超过其所利用的能量,而其非光化学淬灭系数和Car含量均较低,从而导致过剩激发能的大量积累。不能有效耗散的过剩激发能会导致大量的O2·等有害物质的产生,这些毒性自由基的积累能够引起膜脂过氧化加剧,从而加重光合机构的损伤程度,而这反过来又加剧光合能力的进一步下降。
3.4 结论在本试验的15种基质中,从出圃时容器苗高度、地径、叶片数量和生物量来看,3,12,13和14号基质容器苗明显比常规基质差,其光合作用受到明显限制,除14号基质由于气孔限制引起光合速率下降之外,气孔限制不是生长较差的容器苗光合作用降低的主要原因,光合作用下降主要与光合色素合成(叶绿素和类胡萝卜素含量显著降低)及叶绿体功能障碍有关。叶绿素荧光参数表明氮素胁迫可能是导致基质3,12和14号基质容器苗光系统Ⅱ受损的主要原因。与此相反,5,6,8和10号基质容器苗明显优于常规基质,而且基质在质量上均远远小于常规基质,为容器苗育苗的实际操作提供了便利条件。因此, 本试验所优选出来的几种基质配方可以为无柄小叶榕容器育苗的实践操作和理论研究提供基础和参考。
鲍士旦, 江荣风, 杨超光, 等. 2000. 土壤农化分析[M]. 北京: 中国农业出版社.
|
郭英, 孙学振, 宋宪亮, 等. 2006. 钾营养对棉花苗期生长和叶片生理特性的影响[J]. 植物营养与肥料学报, 12(3): 363-368. DOI:10.11674/zwyf.2006.0313 |
洪伟. 1993. 林业试验设计技术与方法[M]. 北京: 科学技术出版社: 317-322.
|
华孟, 王坚. 1993. 土壤物理学实验指导[M]. 北京: 北京农业大学出版社.
|
林霞, 陶正明, 张庆良, 等. 2003. 无柄小叶榕种子育苗技术[J]. 浙江林学院学报, 20(3): 325-327. |
秦国峰, 吴天林, 金国庆, 等. 1998. 应用舒根型容器与半轻型基质培育马尾松苗的研究[J]. 林业科学研究, 11(5): 491-497. |
史庆华, 朱祝军, KhalidaA A, 等. 2004. 等渗Ca(NO3)2和NaCl胁迫对番茄光合作用的影响[J]. 植物营养与肥料学报, 10(2): 188-191. DOI:10.11674/zwyf.2004.0215 |
赵世杰, 刘华山, 董新纯. 1998. 植物生理学实验指导[M]. 北京: 中国农业科技出版社: 68-72.
|
周红. 1993. 国内外容器育苗近况[J]. 贵州林业科技, 21(4): 44-46. |
Arnon D I. 1949. Copper enzymes in isolated chloroplast: polyphenoloxidase in Beta vulgaris[J]. Plant Physiology, 24(1): 1-15. DOI:10.1104/pp.24.1.1 |
Cornic G, Briantaris J M. 1991. Partitioning of photosynthetic electron flow between CO2 and O2 reduction in a C3 leaf (Phaseolus vulgaris L.) at different CO2 concentrations and during drought stress[J]. Planta, 183: 178-184. |
Demmig-Adams B, Adams WW III. 1992. Photoprotection and other responses of plants to high light stress[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 43: 599-626. DOI:10.1146/annurev.pp.43.060192.003123 |
Demming-Adams B, Adams W W, Heber U, et al. 1990. Inhibition of zeaxanthin formation and of rapid changes in radiationless energy dissipation by dithiothreitol in Spinach leaves and chloroplast[J]. Plant Physiology, 92(2): 293-301. DOI:10.1104/pp.92.2.293 |
Gilmore A M. 1997. Mechanistic aspects of xanthophyll cycle-dependant photo protection in higher plant chloroplast and leaves[J]. Physiologia Plantarum, 99: 197-209. DOI:10.1111/ppl.1997.99.issue-1 |
Lal A M, Ku S B, Edwards G E. 1996. Analysis of inhibition of photosynthesis due to water stress in the C3 species Hordeum vulgare and Vicia faba: electron transport, CO2 fixation and carboxylation capacity[J]. Photosynthesis Research, 49: 57-69. DOI:10.1007/BF00029428 |
Quick W P, Chaves M M, Wendler R, et al. 1992. The effect of water stress on photosynthetic carbon metabolism in four species grown under field conditions[J]. Plant, Cell and Environment, 15: 25-35. DOI:10.1111/pce.1992.15.issue-1 |
Sheehy J E, Mitchell P L, Hardy B. 2000. Redesigning rice photosynthesis to increase yield[J]. Dordrecht: Elsevier Science. |
Verma S, Mishra S N. 2005. Putrescine alleviation of growth in salt stressed Brassica juncea by inducing antioxidative defense system[J]. Journal of Plant Physiology, 162: 669-677. DOI:10.1016/j.jplph.2004.08.008 |
Yang Y, Yan C Q, Cao B H, et al. 2007. Some photosynthetic responses to salinity resistance are transferred into the somatic hybrid descendants from the wild soybean Glycine cyrtoloba ACC547[J]. Physiologia Plantarum, 129: 658-669. DOI:10.1111/ppl.2007.129.issue-3 |
 2010, Vol. 46
2010, Vol. 46