文章信息
- 李炎林, 熊兴耀, 于晓英, 何长征, 吕长平, 袁飞荣, 朱杰辉
- Li Yanlin, Xiong Xingyao, Yu Xiaoying, He Changzheng, Lü Changping, Yuan Feirong, Zhu Jiehui
- 红花檵木花叶芽变生物学特性
- Biological Characteristics of Variegated Bud Sports of Loropetalum chinense var. rubrum
- 林业科学, 2010, 46(8): 56-61.
- Scientia Silvae Sinicae, 2010, 46(8): 56-61.
-
文章历史
- 收稿日期:2009-08-10
- 修回日期:2009-11-01
-
作者相关文章
2. 湖南省作物种质创新与资源利用重点实验室 长沙 410128;
3. 湖南省马铃薯工程技术研究中心 长沙 410128
2. Provincial Key Laboratory of Crop Germplasm Innovation and Utilization, Hunan Agricultural University Changsha 410128;
3. Hunan Provincial Engineering Research Center for Potatoes Changsha 410128
红花檵木(Loropetalum chinense var. rubrum)系金缕梅科(Hamamelidaceae)檵木属常绿灌木或小乔木(祁承经等,2002),具有较高的观赏价值、经济价值及较强的适应性、抗逆性(李炎林,2009)。红花檵木以无性繁殖为主,其有性繁殖大约1.58%的后代返祖为檵木(Loropetalum chinense)(沙石,1983)。迄今为止,国外登录的红花檵木品种已有21个,国内登录的有41个,大多数品种来自芽变选种(李炎林,2009)。2006年,笔者从红花檵木‘密枝玫红’中分离芽变枝条得到3份花叶芽变材料。为明确3份花叶芽变的真实性,对其部分生物学特性进行了初步研究。
花叶现象是观赏植物重要的经济性状(周焱等,1999)。植物的花叶现象分为可遗传的和不可遗传的。产生植物花叶现象的原因多种多样,如形态解剖结构(Hirokazu et al., 2004)、基因突变(Mandal et al., 2000; Michael,2001; Wataru et al., 2004)、病毒侵染(Beretta et al., 1997)、环境因素(Lee,1988)等。诊断植物花叶现象是否由病毒引起的常用检测手段有依据生物学特性方法、依据病毒粒体物理特性方法、依据病毒蛋白特征的方法和依据病毒核酸特性的方法,通常以2种或者2种以上手段结合更为可靠(赫尔,2007)。本研究以‘密枝玫红’及其3种花叶芽变材料的第2代扦插苗为试验材料,对其组织提取液进行指示植物接种试验,同时结合透射电镜技术进行病毒鉴定,并通过大量扦插繁殖,进行栽培试验和区域引种试验,再在此基础上比较花叶芽变叶片及其母株叶片横剖面结构、叶片色素含量和光合特性的差异,旨在探讨红花檵木‘密枝玫红’花叶突变体的机制,从解剖和生理生化特性方面将芽变类型与普通类型区分开来。
1 材料与方法 1.1 供试材料2006年9月笔者在湖南农业大学蔬菜基地和湖南省肿瘤医院的道路绿化材料中发现了2株红花檵木‘密枝玫红’的花叶变异枝条,结合扦插繁殖分离得到其3种花叶芽变类型。‘密枝玫红’花叶芽变1号:幼叶浅红色间淡黄褐色,成熟叶片墨绿色,花朵浅粉红色; ‘密枝玫红’花叶芽变2号:幼叶草绿色间红色斑块(点),成熟叶片墨绿色间红色斑块,花朵乳白色嵌粉红色; ‘密枝玫红’花叶芽变3号:幼叶紫红色间草绿色斑块,成熟叶片墨绿色间紫黑色斑点,花朵紫红色(图版Ⅰ)。其中‘密枝玫红’花叶芽变1号和‘密枝玫红’花叶芽变2号来自湖南农业大学蔬菜基地的同一母株,所有材料(表 1)均为第2次扦插的扦插苗后代,栽培条件均一致,对照样品是母株上的普通枝条(CK)。

|
图版Ⅰ 1, 2:'密枝玫红'; 3, 4:'密枝玫红'花叶芽变1号; 5, 6:'密枝玫红'花叶芽变2号; 7.8:'密枝玫红'花叶芽变3号 Plate Ⅰ 1, 2:'Mizhi Meihong'; 3, 4:'Variegated bud sport of 'Mizhi Meihong' No.1;5, 6:'Variegated bud sport of 'Mizhi Meihong' No.2;7.8:'Variegated bud sport of 'Mizhi Meihong' No.3. |
|
|
供试接种材料包括黄豆(Glycine max)、黄瓜(Cucumis sativus)、辣椒(Capsicum annuum)、番茄(Solanum lycopersicum)和红花檵木5种植物,在实验室的光照培养箱中进行培养,以马铃薯(Solanum tuberosum)X病毒株系(potato X virus,PVX)作为阳性对照,各个试验处理的条件均一致。
1.2 试验方法 1.2.1 生物学检测参考李文凤等(2008)的方法,分别取健康红花檵木、红花檵木花叶芽变材料和阳性对照含PVX病毒的马铃薯的叶片各10 g,用自来水冲洗干净; 在超净工作台上用75%的酒精浸泡10 s,再用无菌水冲洗4次,在无菌纸上晾干; 用灭过菌的研钵加10倍的接种用0.01 mol·L-1磷酸缓冲液(pH 7.0)充分研磨后,再用台式冷冻离心机于4 ℃,5 000 g离心2 min,并取上清液保存于冰上备用。将上述组织浸提液接种于敏感期的黄瓜、番茄、辣椒、黄豆、光照培养箱里面水插的红花檵木以及室外种植的红花檵木上面,其中黄瓜、黄豆的接种用一次性的注射器吸取5 mL的上述组织浸提液,注射于茎尖的生长点里面(多余的组织浸提液任其流出); 番茄、辣椒的接种分别用一次性的注射器吸取5 mL的上述组织浸提液注射于第1片真叶的主脉里面(多余的组织浸提液任其流出); 光照培养箱里面水插的红花檵木以及室外种植的红花檵木用上述组织提取液浸染新撕开的韧皮部,并挂牌观察。上述试验处理均以清水为对照,15天后观察试验结果。
1.2.2 透射电镜检测参照张仲凯等(1993)的方法,对照母株的组织浸提液取5 mL并编号为Ⅰ; 花叶芽变1号、2号和3号组织浸提液各取5 mL按照1:1:1混合,并编号为Ⅱ; 阳性对照PVX马铃薯组织浸提液取5 mL,编号为Ⅲ。用镊子夹持铜网边缘,在铜网上方滴上上述组织浸提液,使铜网正面与液滴接触,5 min后,用干净的滤纸从铜网边缘吸去余液,再用蒸馏水轻轻冲洗铜网,用干净的滤纸从铜网边缘吸去蒸馏水,冲洗3次。待铜网干燥后,在封口膜上滴上2%醋酸铀[UA,UO2(CH3COO)2·2H2O]溶液(pH 4.0~5.2),用镊子夹持铜网边缘,把铜网放在醋酸铀液滴上,使铜网正面与液滴接触,5 min后,用干净的滤纸从铜网边缘吸去余液,重复3次。将负染好的铜网正置于底部铺有干净滤纸的培养皿中,30 min后,在透射电镜(MSC KAF10001)下观察,并拍照记录。
1.2.3 栽培与区域引种试验于2007—2009年,红花檵木‘密枝玫红’与其花叶芽变1号、2号、3号1年生(各25株)、2年生(各50株)、3年生(各50株)扦插苗分别以25 cm×25 cm、40 cm×40 cm、50 cm×50 cm的株行距栽培(用土为湖南典型的山地红壤土),进行露地品比试验。2008—2009年先后在湖南省郴州市(资兴市波水乡)、常德市(临澧县)、吉首市(白岩乡)进行区域试验,每地各1/15 hm2,以其母本‘密枝玫红’为对照,以考察其在湖南省的适应性。
1.2.4 叶片解剖结构观察选取红花檵木及其花叶芽变材料成熟叶片3~4片,用湿润的纸巾包好带回实验室。选取干净的玻片,在中央滴1滴干净的无菌水,用2片干净的刀片夹紧切去薄片在Motic显微镜(SMZ-143)下观察,并拍照保存。叶片横剖面参数的观测使用Motic显微镜自带图像测量软件测量,每个参数测量3次。
1.2.5 叶片色素含量测定2008年11月27日,称取定量的叶片测定叶片中叶绿素a、叶绿素b、叶绿素总含量、类胡萝卜素和花色苷含量,参考唐前瑞等(2006)的方法。
1.2.6 光合参数测定1) 光合作用光响应曲线的测定 2008年11月14,15日上午9: 00—11: 30,采用Li-6400-02B红蓝光源,光照强度(PDF)在0~2 000 μmol·m-2s-1范围内设定15个梯度,分别为0,20,50,80,100,200,300,400,700,800,1 000,1 200,1 500,1 800,2 000 μmol·m-2s-1,测定相应的净光合速率(Pn)值。测定时通过系统控制叶片温度为(32±1) ℃,叶室CO2浓度为400 μmol·m-2s-1,空气相对湿度为80%±1%,采用手动记录不同光强所对应的净光合速率。采用Walker(1989)的方法进行光响应曲线拟合。
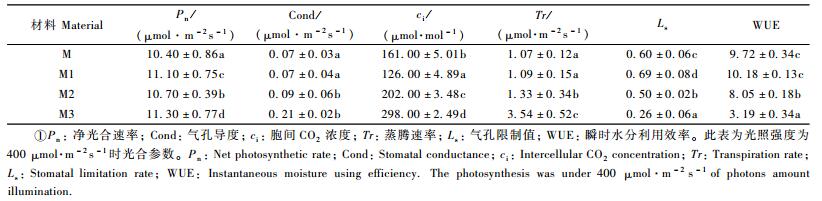
2) 光合特性比较 在天气晴朗的2008年11月16日,采用美国Li-COR公司生产的Li-6400,在自然的条件下采用Li-6400-02B人工红蓝光源,光照强度(PDF)400 μmol·m-2s-1条件下进行净光合速率(Pn)的测定,同时测定气孔导度(Cond)、蒸腾速率(Tr)、胞间CO2浓度(ci)等生理参数。气孔限制值(Ls)=1-ci/ca,瞬时水分利用效率(WUE)=Pn/Tr。式中, ca为外界CO2浓度,大约为(400±10) μmol·mol-1。每个观测指标3次重复。
1.2.7 数据处理所有测定数据用Excel 2003统计,方差分析采用SPSS13.0进行分析。
2 结果与分析 2.1 病理学检测黄豆、黄瓜、辣椒、番茄幼苗经‘密枝玫红’、‘密枝玫红’花叶芽变1号、2号和3号的组织提取液接种后,与对照相比,植株生长发育均正常,无叶片卷曲、黄化和花斑现象等; 植株无徒长或者莲座化现象; 植株生长有光泽,且注射针孔清晰可见。而接种马铃薯PVX病毒的番茄出现了坏死斑。光照培养箱内水插红花檵木和室外地栽红花檵木接种后伤口愈合完好,老叶生长健康,新芽萌动。红花檵木和其花叶芽变材料所有制备样品电镜观察没有看到任何形状的病毒颗粒(图 1-Ⅰ,Ⅱ)。马铃薯含PVX病毒的阳性对照制备样品能够看到明显的长杆状的颗粒,长515 nm,宽13.6 nm(图 1-Ⅲ)。

|
图 1 红花檵木、红花檵木花叶芽变材料和马铃薯样品透射电镜观察结果 Figure 1 The results of TEM view on L. chinense var. rubrum, variegated bud sports of L. chinense var. rubrum and S. tuberosum Ⅰ: ‘密枝玫红’的组织浸提液电镜观察; Ⅱ: ‘密枝玫红’花叶芽变1号、2号、3号的混合组织浸提液电镜观察; Ⅲ:含PVX病毒的马铃薯组织浸提液电镜观察。 Ⅰ: The results of TEM view on the crude sap from tissue of'Mizhi Meihong '; Ⅱ: The results of TEM view on the mixed crude sap from tissue of variegated bud sports of'Mizhi Meihong 'No.1, No.2 and No.3; Ⅲ: The results of TEM view on the crude sap from tissue of potato infected PVX virus. |
2008—2009年先后在湖南省郴州市、常德市、吉首市的区域引种试验表明: ‘密枝玫红’3份花叶芽变是一种可稳定遗传的变异类型,其栽培容易,对环境和栽培技术要求不严,栽培时应选择阳光充足的环境,其须根发达,根系分布浅,萌芽率强,全年均可栽植。在湖南地区露地引种栽培,抗病虫能力强。
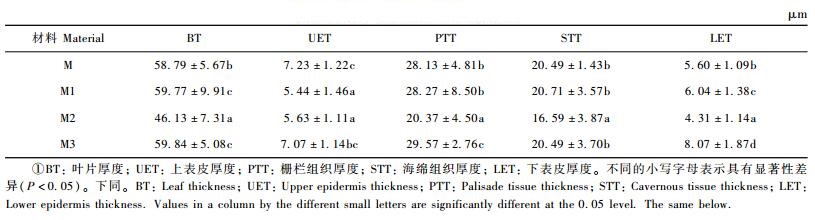
2.3 叶片解剖结构差异从表 2可以看出,‘密枝玫红’及其3份花叶芽变材料叶片横剖面解剖结构差异显著,叶片厚度、上表皮厚度、栅栏组织厚度、海绵组织厚度和下表皮厚度在花叶芽变材料与母株之间以及芽变单株之间均发生了改变。可能是因为这些结构的改变导致了红花檵木花叶芽变叶片的色素分布和光线折射的改变,影响了叶片的成色,形成不同的花叶类型。
|
|
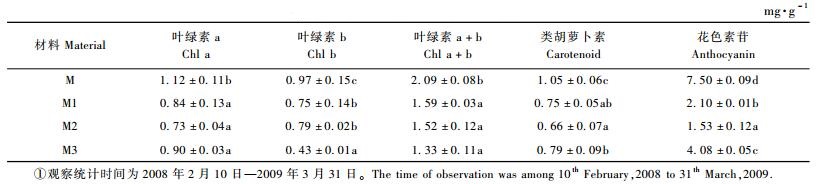
叶片中色素的含量和不同色素的比例是决定红花檵木叶片色彩的关键因素(李炎林,2009)。从表 3可以看出,‘密枝玫红’与其3份花叶芽变材料之间叶绿素a、b、a+b, 类胡萝卜素和花色素苷的含量差异均显著。其中3份花叶芽变材料的不同色素含量均低于对照母株,这可能是由于试验取样误差造成的,也可能是3份花叶芽变材料的物候期与母株不同造成的。3份花叶芽变材料叶片中叶绿素类差异不显著,而胡萝卜素和花色素苷含量差异显著,这可能是造成3种花叶芽变不同类型的原因之一。
|
|
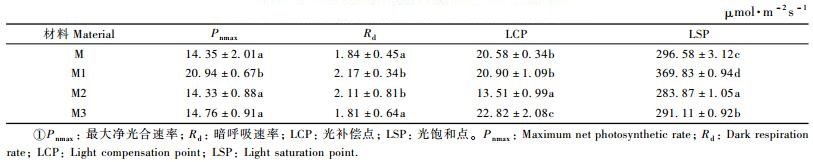
植物光补偿点和光饱和点是推测植物光照适应性的重要依据。从表 4可知,‘密枝玫红’及其3份花叶芽变材料的最大净光合速率、暗呼吸速率、光补偿点和光饱和点差异显著。其中‘密枝玫红’花叶芽变2号光补偿点最低,为13.51 μmol·m-2s-1,‘密枝玫红’花叶芽变1号光饱和点最高,为369.83 μmol·m-2s-1。
|
|
从表 5可以看出,‘密枝玫红’及其3份花叶芽变材料的净光合速率、气孔导度、胞间CO2浓度、蒸腾速率、气孔限制值和瞬时水分利用效率差异显著。3份花叶芽变材料的净光合速率高于母株,其中花叶芽变2号约低于其他2种花叶芽变材料,这可能是因为叶片绿色部分增多增强了其光合能力。‘密枝玫红’花叶芽变1号具有较高的气孔限制值和瞬时水分利用效率,其可能具有较强的抗旱性。
|
|
本研究报道的红花檵木花叶突变体和前人报道的红花檵木叶片上黄绿色的斑块有显著的区别(王燕,2007; 王燕等,2007),在相同栽培条件下的‘密枝玫红’及其3份花叶芽变材料的组织浸提液接种黄豆、黄瓜、辣椒、番茄,被接种材料均生长正常,无黄化、花叶、叶片卷曲、坏死斑等出现,而对照含马铃薯PVX病毒的组织浸提液接种番茄出现明显的坏死斑点; ‘密枝玫红’室内光照培养箱内水插叶片无花叶现象,同时室外地栽‘密枝玫红’韧皮部摩擦接种,试验结果表明其伤口愈合完好,无花叶现象出现,腋芽有萌动的迹象; 电镜观察其组织浸提液无病毒颗粒。这说明‘密枝玫红’的这种花叶现象不是由于病毒或者类病毒引起的,其可能是一种由于遗传物质引起的花叶芽变,或者解剖结构发生改变引起的。同时2008—2009年先后在湖南省郴州市、常德市、吉首市的区域引种试验表明: ‘密枝玫红’的3份花叶芽变材料是一种可稳定遗传的突变体,可通过扦插繁殖保持芽变的特性。对红花檵木‘密枝玫红’及其3份花叶芽变系的第1代和第2代扦插苗后代进行了限制性位点扩增多态性(restrict site amplification polymorphism,RSAP)分子标记验证, 文章另行发表,品种申报工作正在进行中。
植物可遗传的花叶类型可分为2种:一种为扇形嵌合体,另一种为周缘嵌合体。在双子叶植物中,周缘嵌合体的叶片表皮细胞来源于茎尖分生组织的LⅠ层,LⅡ层沿着叶片边缘分化成栅栏组织和海绵组织,而LⅢ层分化形成除叶缘外的栅栏组织和海绵组织的上下部分(Michael,2001)。本研究发现‘密枝玫红’及其3份花叶芽变材料的叶片厚度、上表皮组织和下表皮组织的厚度差异显著,这可能是由于其茎尖分生组织的LⅠ层细胞发生了较大的改变,而LⅡ和LⅢ层细胞改变较小。红花檵木叶片中不同色素种类的比例决定着其叶片的颜色(唐前瑞等,2003; 2006),‘密枝玫红’3份花叶芽变材料的叶片类胡萝卜素含量和花色素苷含量的显著差异是造成红花檵木3种不同花叶现象的直接原因。采自同时期同条件下的母株叶片的叶绿素类色素含量略高于3份花叶芽变单株,可能是因为普通型的‘密枝玫红’突变为花叶类型时控制物候期的基因发生了改变而造成的。
影响植物光合作用的因素较多,如植物生境光照条件、CO2浓度等因素的差异(李长缨等,1997; 王永健等,2001; 黄伟等,2002; 杨盛昌等,2003); 不同种类、品种间的叶绿素含量存在差异(Kappel et al., 1983); 另外不同的光合曲线拟合方程如二项式回归法、直角双曲线法、非直角双曲线法等,得到植物的光饱和点、光补偿点、表观量子效率、最大净光合速率等均存在较大差异(刘宇峰等,2005; 叶子飘,2008; 叶子飘等,2008)。本研究发现‘密枝玫红’与其3份花叶芽变材料的最大净光合速率、暗呼吸速率、光补偿点和光饱和点等均有显著的差异,4份材料的最大净光合速率为11.30~20.94 μmol·m-2s-1,光饱和点为283.87~369.83 μmol·m-2s-1,光补偿点为13.51~22.82 μmol·m-2s-1。此结果与前人的研究结果(甘德欣等,2006; 余旋等,2007)不一致,这可能是由于不同的测定季节、不同品种、不同计算方法造成的。
本研究还发现叶片的解剖结构和色素含量影响其光合作用的能力。在排除因物候期造成的叶片色素含量取样误差外,研究发现‘密枝玫红’花叶芽变2号叶片解剖结构(如叶片厚度、栅栏组织厚度、海绵组织厚度等)和叶片光合色素含量均较对照母株小,而其最大净光合速率和净光合速率却与其母株相近。可能原因是: 1)在相同的光照条件下,3份花叶芽变材料的气孔导度、胞间CO2浓度、蒸腾速率、水分利用效率均较母株高,花叶芽变2号和3号材料的气孔限制值均较母株小,因此4种材料之间直接参与光合作用的CO2和水可能存在差异; 2) 4份材料之间叶片中光合电子传递体和光合作用关键酶等的含量存在差异; 3) 4份材料之间叶片解剖结构除了厚度不同,可能还存在结构上的不同,如栅栏组织的细胞排列方式和密度、细胞间隙、表皮细胞的排列等(李翠等,2009)。从以上研究结果来看,‘密枝玫红’花叶芽变是一种由于遗传物质或者叶片形态结构发生改变而形成,其芽变类型光合作用能力强,是一种有利的突变类型。
红花檵木叶色为红色系,花色因品种类型不同而有深浅变化,如粉红、玫红、深红、紫红等(李炎林,2009)。本研究报道的红花檵木‘密枝玫红’花叶芽变类型叶片出现不同程度的绿色嵌合,尤其是‘密枝玫红’花叶芽变2号花朵出现明显的乳白色和红色的嵌合,极具观赏价值,有可能成为新的红花檵木品种资源。
甘德欣, 王明群, 龙岳林, 等. 2006. 3种彩叶植物的光合特性研究[J]. 湖南农业大学学报:自然科学版, 32(6): 607-610. |
赫尔. 2007. 马修斯植物病毒学. 范在丰, 李怀方, 韩成贵, 等译. 4版. 北京: 科学出版社.
|
黄伟, 任华中, 张福墁. 2002. 低温弱光对番茄苗期生长和光合作用的影响[J]. 中国蔬菜, (4): 15-17. |
李翠, 程明, 唐宇丹, 等. 2009. 青藏高原2种柳属植物叶片解剖结构和光合特征的比较[J]. 西北植物学报, 29(2): 275-282. |
李长缨, 朱其杰. 1997. 光强对黄瓜光合特性及亚适温下生长的影响[J]. 园艺学报, 24(1): 94-97. |
李炎林. 2009. 红花檵木花叶芽变的遗传和生物学特性研究. 湖南农业大学硕士学位论文. http://cdmd.cnki.com.cn/Article/CDMD-10537-2010061609.htm
|
李文凤, 黄应昆, 卢文洁, 等. 2008. 甘蔗花叶病抗病性鉴定接种新技术研究[J]. 植物保护, 34(1): 127-130. |
刘宇锋, 萧浪涛, 童建华, 等. 2005. 非直线双曲线模型在光合光响应曲线数据分析中的应用[J]. 中国农学通报, 21(8): 76-79. |
祁承经, 喻勋林. 2002. 湖南种子植物总览[M]. 长沙: 湖南科学技术出版社.
|
沙石. 1983. 红檵木扦插试验报告[J]. 湖南园林, (1): 6-11. |
唐前瑞, 陈友云, 周朴华. 2003. 红花檵木花色素苷稳定性及叶片细胞液pH值变化的研究[J]. 湖南林业科技, 30(4): 24-25. |
唐前瑞, 陈德富, 陈友云, 等. 2006. 红檵木叶色变化的生理生化研究[J]. 林业科学, 42(2): 111-115. |
王燕. 2007. 红檵木花叶病毒病危害现状及其表现症状[J]. 现代园艺, (6): 20-21. |
王燕, 朱发仁. 2007. 红花檵木花叶病毒病研究[J]. 中国森林病虫, 26(6): 19-21. |
王永健, 张海英, 张峰, 等. 2001. 低温弱光对不同黄瓜品种幼苗光合作用的影响[J]. 园艺学报, 28(3): 230-234. |
杨盛昌, 中须贺常雄, 林鹏. 2003. 光强对秋茄幼苗的生长和光合特性的影响[J]. 厦门大学学报, 42(2): 242-247. |
叶子飘. 2008. 光合作用对光响应新模型及其应用[J]. 生物数学学报, 23(4): 710-716. |
叶子飘, 于强. 2008. 光合作用光响应模型的比较[J]. 植物生态学报, 32(6): 1356-1361. |
余旋, 刘军. 2007. 红檵木和檵木光合特性的比较[J]. 四川农业大学学报, 25(3): 502-507. |
张仲凯, 方琦. 1993. 马铃薯脱毒组培苗的电镜检测研究[J]. 电子显微学报, 12(1): 34-34. |
周焱, 周厚高, 张西丽. 1999. 观赏植物花叶现象研究现状[J]. 广西农业生物科学, 18(4): 304-309. |
Beretta M J G, Barthe G A, Ceccardi T L, et al. 1997. A survey for strains of Xylella fastidiosa in Citrus affected by citrus variegated chlorosis and citrus blight in Brazil[J]. Plant Diseases, 81: 1196-1198. DOI:10.1094/PDIS.1997.81.10.1196 |
Hirokazu Tsukaya, Hiroshi Okada, Maryati Mohamed. 2004. A novel feature of structural variegation in leaves of the tropical plant Schismatoglottis calyptrate[J]. Journal of Plant Research, 117: 477-480. DOI:10.1007/s10265-004-0179-x |
Kappel F, Flore J A. 1983. Effect of shade on photosynthesis, specific leaf weight, leaf chlorophyll content, and morphology of young peach trees[J]. Journal of the American Society for Horticultural Science, 108(4): 541-544. |
Lee M K. 1988. Growth and leaf color change of variegated Lonicera japonica var. aureo-reticulata under varied light intensity and nitrogen fertilization[J]. J of Korean Society for Hort Sci, 29(1): 53-57. |
Mandal A K A, Chakrabarty D, Datta S K. 2000. Application of in vitro techniques in mutation breeding of chrysanthemum[J]. Plant Cell, Tissue and Organ Culture, 60: 33-38. DOI:10.1023/A:1006442316050 |
Michael M. 2001. Genetic mosaics and the analysis of leaf development[J]. Int J Plant Sci, 162(3): 513-525. DOI:10.1086/320138 |
Walker D A. 1989. Automated measurement of leaf photosynthetic O2 evolution as a function of photon flux density[J]. Philosophical Transanctions of the Royal Society London B, 323: 313-326. DOI:10.1098/rstb.1989.0013 |
Wataru S, Eiko M, Yumiko K. 2004. Allelic characterization of the leaf-variegated mutation var2 identifies the conserved amino acid residues of FtsH that are important for ATP hydrolysis and proteolysis[J]. Plant Molecular Biology, 56: 705-716. DOI:10.1007/s11103-004-4561-9 |
 2010, Vol. 46
2010, Vol. 46