文章信息
- 郭学民, 高忠明, 刘振林, 梁丽松, 王贵禧
- Guo Xuemin, Gao Zhongming, Liu Zhenlin, Liang Lisong, Wang Guixi
- 美国红梣雄株和雌株茎导管分子的形态解剖比较
- Comparative Anatomy of Vessel Elements in Staminate and Pistillate Plants of Fraxinus pennsylvanica
- 林业科学, 2010, 46(8): 51-55.
- Scientia Silvae Sinicae, 2010, 46(8): 51-55.
-
文章历史
- 收稿日期:2009-07-07
- 修回日期:2009-11-19
-
作者相关文章
2. 河北科技师范学院数理系 秦皇岛 066600;
3. 河北科技师范学院园艺园林系 秦皇岛 066600;
4. 中国林业科学研究院林业研究所 北京 100091
2. Department of Mathematics and Physics, Hebei Normal University of Science & Technology Qinhuangdao 066600;
3. Department of Horticulture and Landscape Architecture, Hebei Normal University of Science & Technology Qinhuangdao 066600;
4. The Research Institute of Forestry, The Chinese Academy of Forestry Beijing 100091
自然界中存在着大量的雌雄异株植物。自Darwin(1877)认识到雌雄异株植物的生殖差异将会导致性别特化和对资源的不同需求以来,雌雄异株现象一直是研究的热点。对雌雄个体与生态对策之间的不同联系以及有性生殖和性别二态分化方面的生物学过程已做了大量的研究(Sakai et al., 1999)。由于适应自然界而长期演化的结果,这类植物的雌雄植株在生长、生殖、空间分布和资源配置方面表现出明显的差异(Allen et al., 1993; Bullock et al., 1981; Cipollini et al., 1994; Delph,1990; Gross et al., 1981; Lovett Doust et al., 1988; Ramp et al., 1988; Sakai et al., 1988; Thomas et al., 1993; Vitale et al., 1987)。
20世纪50年代初波兰学者Buggala(1951)首先通过叶色鉴定了欧洲山杨(Populus tremula)的性别。但通过外部形态来鉴定植物性别的方法不够准确。近年来又从细胞、生化和分子等不同水平上对雌雄异株植物进行性别鉴定(李瑞丽等,2006)。迄今未见雌雄异株植物导管分子鉴定的报道。
导管分子是由维管形成层纺锤状原始细胞及其衍生细胞发育而来的。导管分子分化是一个典型的细胞程序性死亡过程(programmed cell death,PCD)(Hosokawa et al., 2001)。在导管分子分化中,原生质体发生PCD、细胞内的各种细胞器均解体消失(Pennel et al., 1997),在PCD的末期,端壁自溶,最后形成由一系列死细胞(导管分子)组成的输导水分和无机盐的管道——导管。虽然导管分子的分化必然受到某些因素(内在因素如脱落酸、生长素等植物激素以及钙离子和钙离子结合蛋白,外在因素如阳光、水分、养分及温度等)的制约(樊汝汶等,1999),且不同生长环境的选择压力(与湿度的利用、蒸腾作用以及机械强度的需要有关)会引起现存植物木质部功能上的适应性变化,进而导致木质部结构的差异(Fahn,1990),使得同一种植物表现出导管分子样式的多样性。但是这仅仅是形成层基因组在初级细胞分化活动中的可塑性表达造成的,其物种的基本结构特征仍然稳定。因此,在外界环境基本相同的条件下,导管的形态结构特征基本可以反映植物的某些遗传特性。
美国红梣(Fraxinus pennsylvanica)是木犀科(Oleaceae)梣属(Fraxinus)乔木,原产美国,雌雄异株,花先叶开放,喜光、抗寒、抗盐碱、抗水湿,是我国重要的行道树或庭园绿化树种。但随着城市园林化水平的提高和人们环境意识的增强,美国红梣雌株常年挂果、影响美观的弱点愈发显得突出。利用现代植物学方法判断植株性别并最终实现该树种实生苗的早期性别鉴定,成为摆在植物科学工作者面前亟待解决的问题之一。本文利用导管分子离析法和显微技术,对美国红梣茎导管分子进行了形态解剖比较,探讨导管分子特征作为性别鉴定指标的可能性,以期为该树种生理生化、分子遗传学等的性别鉴定提供结构依据。
1 材料与方法试材来自河北科技师范学院校园。选择长势相似的20年生美国红梣雌、雄各3株,在树冠同一高度、相同方位,分别取其长势良好、直径相似的1年生枝条,将其第4和5节间木质部切成长1㎝左右、火柴棍粗细的小条,充分混匀; 常温下在Jeffrey离析液(10%铬酸与10%硝酸体积比为1:1)中处理10天。材料漂洗后,转入70%乙醇保存。制片时,采取混合取样法,轻轻研磨,用1%番红染液进行染色,在ZEISS Primo Star型显微镜下观察,用Canon A650 IS型数码相机拍照。随机选取100个导管分子,测量其长度、宽度,求平均值及标准误差,并应用DPS v3.01专业版数据处理系统对各项数据进行Duncan新复极差法比较。本文依据Tippo(1941)描述双子叶植物木材的鉴定特征表中的术语对导管进行描述。
2 结果与分析 2.1 导管分子类型在美国红梣茎次生木质部的离析材料中,发现有多种类型的导管分子。从尾的有无来看,有两端具尾导管分子(图 1C,D,E,G,I,L; 图 2C,D,E,F,G,J,L,P)、一端有尾一端无尾的导管分子(图 1A,B,F,H,J,K,M; 图 2A,H,K,M,N)和两端无尾的导管分子(图 1N; 图 2B,I,O)。由表 1可看出,雄株两端具尾和一端具尾的导管分子均比雌株多8%,而无尾导管分子则比雌株少16%。

|
图 1 雄株茎导管分子 Figure 1 Vessel elements in the shoot of staminate plant A,B,F,H,J,K,M:一端具尾的导管分子Only one tail in vessel element; C,D,E,G,I,L:两端具尾的导管分子Tail in either of top wall; N:无尾导管分子No tail. |

|
图 2 雌株茎导管分子 Figure 2 Vessel elements in the shoot of pistillate plant A,H,K,M,N:一端具尾的导管分子Only one tail in vessel element; C,D,E,F,G,J,L,P:两端具尾的导管分子Tail in either of top wall; B,I,O:无尾导管分子No tail. |
|
|
具尾导管分子按其尾的长短,又可观察到具长尾导管分子(图 1C,F,H; 图 2G,J,L)、具短尾导管分子(图 1A,B,E,F,G,J,L; 图 2A,F,J,M,N,P)以及在有尾和无尾间过渡阶段的导管(图 1D,I,M; 图 2D,E,H,K)。从穿孔的样式来看,导管分子均为单穿孔,并且绝大多数单穿孔分别位于两端的端壁上。在各种材料中均未发现含侵填体的导管分子。同时,端壁斜度也有很大的变化,从比较倾斜的端壁(图 1C,J)到中间过渡类型(图 2B,I,O)。
大多数为梯纹-网纹导管(图 1B,C,E,F,H,I,K,N; 图 2B,D,E,G,H,I,J,K,L,N,P),少数为网纹导管(图 1A,D,L; 图 2A,F,M)、孔纹导管(图 1J,M; 图 2O)和梯纹导管(图 1G; 图 2C)。
所以,美国红梣雌雄株在导管分子类型上未见明显的性别差异。
2.2 导管分子长度在光镜下,美国红梣雄株和雌株茎导管分子平均长度分别为178.49 μm和148.52 μm,雄株比雌株大16.79%(P < 0.001)。从雌雄株茎导管分子长度分布(图 3)可看出,雌雄株导管分子长度均主要分布在75~225 μm,但在雌株中长度大于225 μm的导管分子数仅占所观察导管分子数的2%,而雄株中则占20%,可见,相对于雌株,美国红梣雄株具有长导管性。

|
图 3 导管分子长度分布情况 Figure 3 Distribution of the length of vessel elements |
在光镜下,美国红梣雄株和雌株茎导管分子平均宽度分别为30.22 μm和18.92 μm,雄株比雌株大37.39%(P < 0.001)。从雌雄株茎导管分子宽度分布(图 4)可看出,雌株导管分子宽度均分布在13~28 μm,虽然雄株茎导管分子分布比较离散,但是雄株茎中大于28 μm的导管分子数占所观察导管分子数的60%,可见,相对于雌株,美国红梣雄株具有宽导管性。
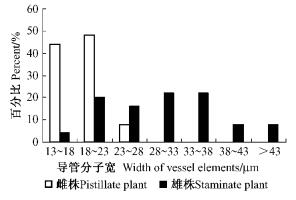
|
图 4 导管分子宽度分布情况 Figure 4 Distribution of the width of vessel elements |
管间纹孔多为互列式纹孔(图 1C,D,H,J,K,M,N; 图 2A,C,F,G,H,O,P),少数为对列式纹孔(图 1F,I; 图 6I,J,L)。
3 讨论 3.1 导管分子离析法鉴定植物性别的意义迄今,雌雄异株植物的性别鉴定主要是根据植株形态的差异(李美善等,2009; 王丙武等,1999)、生理的差异(魏晓东等,2008; 金静等,2008)、化学成分的差异(赵云云等,1996; 赵林森等,1999; 李国梁等,1993)、同工酶的差异(李惠敏等,2007; 王妹清等,1989; 温银元等,2008)、茎叶结构的差异(何丽君等,2000; 何维明等,2002; 铁军等,2008)、分子标记的差异(王玉富等,2006; 高武军等,2008; 柯辉鹏等,2007; Xu et al., 2004; Jiang et al., 2003)和性染色体(Liu et al., 2004)等进行的。除了根据形态差异鉴别植物的方法外,其他方法都比较复杂,有的鉴定成本较高,不易实施。而在一定的条件下导管分子的形态结构特征在一定程度上可以反映植物的某些遗传特性,且离析法简便易行,成本很低,可能发展为一种行之有效的、鉴定植物性别的方法。
3.2 导管分子的性别鉴定特征本研究发现,美国红梣雄株具有长导管性和宽导管性,而雌雄株茎在导管分子类型上未见明显的差异,因此,导管分子大小具有性别鉴定意义。
3.3 导管分子长度和宽度与美国红梣生长和抗旱性的关系管状分子是在陆生植物时期产生的(Fahn,1990),其中导管分子是管状分子中输导水分和无机盐最主要的细胞,因此其形态结构与植物的生长发育密切相关。
导管长度的大小决定了植物水分运输过程中,经过不同类型转运次数的多少以及运输阻力的大小。水分长距离运输的阻力与导管长度倒数呈极显著的线性关系(房凯,2003)。本研究发现美国红梣雄株具有长导管性,在生长季节树干具有较高的输水效率,更能满足植株生长发育对水分和无机盐的需求,生长较快。
孔纹导管属于进化类型,宽度大。导管宽度越大,输水阻力越小,反之,阻力越大(李吉跃等,2000; 刘晓燕等,2003)。美国红梣雄株具有宽导管性,输水效率高,在生长季节可以极大地满足植株地上部分对于水分的需要,这可能是美国红梣雄株生长较快的一个重要原因。
陈耀华等(1984)的调查认为,在相同的环境条件下,美国红梣雄株的生长势显著优于雌株。本研究表明美国红梣雄株具有长导管性和宽导管性,这从解剖学角度解释了陈耀华的结果。
短而窄的导管分子可增强抗负压能力,加之较多的次生加厚和较少纹孔,不仅增加了木质部输导组织的机械支持力,而且也阻滞了水流的横向扩散,防止水分蒸发。这一特征可能是美国红梣雌株抗旱性较强的细胞解剖学依据。
3.4 导管分子长度和宽度与性分配可能的关系风媒植物具有“个体越大越偏向雄性分配”的性分配模式(Fox,1993; Pannell,1997)。对此模式的解释有2种假说:一是“生殖力效应”(即生殖力与植物的大小有关),风媒植物的雄性适合度(fittness,不同个体在同一种环境条件下存活的百分率)是对花粉的资源投入的线性函数,因为风作为花粉的载体不会有饱和效应(Allen et al., 1993; Klinkhamer et al., 1997),即对花粉的资源投入越大,雄性适合度越大; 而雌性适合度是种子投入的减函数,因为较大植物的幼苗受到局域资源竞争(Klinkhamer et al., 1997; Lloyd et al., 1984),即种子成熟利用的是所储存的和光合产生的资源,由于资源的制约,种子投入越多,雌性适合度越小。二是Burd和Allen(1988)提出的“身高效应” (即与植物的身高有关):较大的植物通常较高,所产生的花序离地面更高(较高的地方气流更快),因此有利于花粉的远距离扩散,可以获得更高的繁殖成功率。
美国红梣属于雌雄异株的风媒植物,其传粉的成功首先取决于花粉的数量,小而多的花粉是授粉成功的前提,而对花粉资源的投入则需要更多的物质和能量,这些物质和能量主要来源于光合作用以及对水分和无机盐的吸收。快速的光合作用和大量的水分和无机盐的吸收在宏观上即表现为雄株生长势强、生长速度大; 其次,高大的雄株有利于花粉的散播。因此,美国红梣雄株的长导管性与宽导管性可能是在生长环境的选择压力下性分配的表现。
陈耀华, 俞玖. 1984. 洋白蜡雌雄株生长特性的调查[J]. 园艺学报, 11(1): 69-71. |
Fahn A. 1990. 植物解剖学. 吴树明, 等译. 天津: 南开大学出版社, 102-113;106-107.
|
樊汝汶, 尹增芳, 周坚. 1999. 植物木质部发育生物学研究[J]. 植物学通报, 16(4): 387-397. |
房凯. 2003. 植物导管输送水的实验室检测方法研究[J]. 绵阳师范学院学报, 22(2): 56-60. |
高武军, 洪达, 肖理会, 等. 2008. 雌雄异株植物性别连锁的DNA标记[J]. 植物生理学通讯, 44(1): 155-157. |
何丽君, 慈忠玲, 李健军. 2000. 沙柳茎叶结构的比较解剖学观察[J]. 内蒙古农业大学学报, 21(1): 128-132. |
何维明, 张新时. 2002. 沙地柏雌株与雄株的叶结构和功能比较[J]. 云南植物研究, 24(1): 64-67. |
金静, 江洪, 余树全, 等. 2008. 孑遗植物银杏(Ginkgo biloba L.)伴性光合生理特征与进化生态[J]. 生态学报, 28(3): 1128-1136. |
柯辉鹏, 李小丹, 周玲艳, 等. 2007. 不同猕猴桃品种雌雄植株的AFLP分析[J]. 仲恺农业技术学院学报, 20(3): 7-12. |
李国梁, 林伯年, 沈德绪. 1993. 酚类物质在鉴别园艺雌雄性植物中的应用研究[J]. 园艺学报, 20(4): 397-398. |
李惠敏, 黄夕洋, 高成伟, 等. 2007. 罗汉果雌雄株同工酶性别鉴定研究[J]. 广西植物, 27(5): 792-795. |
李吉跃, 翟洪波. 2000. 木本植物水力结构与抗旱性[J]. 应用生态学报, 11(2): 301-305. |
李美善, 许明子, 李长军, 等. 2009. 高山红景天不同性别植株形态的比较研究[J]. 安徽农业科学, 37(4): 1599-1600. |
李瑞丽, 卢龙斗, 高武军, 等. 2006. 雌雄异株植物性别鉴定的研究进展[J]. 广西植物, 26(4): 387-391. |
刘晓燕, 李吉跃, 翟洪波, 等. 2003. 从树木水力结构特征探讨植物耐旱性[J]. 北京林业大学学报, 25(3): 48-54. |
铁军, 金山, 李旭娇, 等. 2008. 濒危植物南方红豆杉叶片形态结构及气孔参数[J]. 东北林业大学学报, 36(9): 24-27. |
王丙武, 王雅清, 莫华, 等. 1999. 杜仲雌雄株细胞学、顶芽及叶含胶量的比较[J]. 植物学报, 41(1): 11-15. |
王妹清, 赵英琪, 刘建朝, 等. 1989. 猕猴桃雌雄植株过氧化物酶同工酶的研究[J]. 经济林研究, 7(2): 30-33. |
王玉富, 粟建光, 赵立宁. 2006. 大麻的性别分化及其分子生物学研究进展[J]. 中国麻业, 28(3): 117-119. |
魏晓东, 陈国祥, 徐艳丽, 等. 2008. 银杏叶片衰老过程中光合生理特性及叶绿体超微结构的变化[J]. 植物研究, 28(4): 433-437. |
温银元, 扆铁梅, 王玉国, 等. 2008. 银杏雌雄株间多种同工酶和磷酸腺苷含量的差异[J]. 山西农业科学, 36(6): 84-85. |
赵林森, 王强, 何健, 等. 1999. 复叶槭雌雄株叶片中酸性醇溶性酚类物质的比较[J]. 南京林业大学学报, 23(3): 41-44. |
赵云云, 田汝岑, 刘捷平. 1996. 杜仲雌雄株树皮和叶片中氨基酸及其含量的研究[J]. 氨基酸和生物资源, 18(2): 5-9. |
Allen G A, Antos J A. 1993. Sex ratio variation in the dioecious shrub Oemleria cerasiformis[J]. The American Naturalist, 141(4): 537-553. DOI:10.1086/285490 |
Buggala W. 1951. Sex determination of poplars from the color of leaves[J]. Forestry Abstracts, 52: 13. |
Bullock S H, Bawa K S. 1981. Sexual dimorphism and the annual flowering pattern in Jacaratia dolichaula (D. Smith) Woodson (Caricaceae) in a Costa Rican rain forest[J]. Ecology, 62(6): 1494-1504. DOI:10.2307/1941506 |
Burd M, Allen T F H. 1988. Sexual allocation strategy in wind-pollinated plants[J]. Evolution, 42: 403-407. DOI:10.1111/evo.1988.42.issue-2 |
Cipollini M L, Whigham D F. 1994. Sexual dimorphism and cost of reproduction in the dioecious shrub Lindera benzoin (Lauraceae)[J]. American Journal of Botany, 81(1): 65-75. DOI:10.2307/2445564 |
Darwin C. 1877. The Different forms of flowers on plants of the same species[M]. London: John Murray.
|
Delph L F. 1990. Sex-differential resource allocation patterns in the subdioecious shrub Hebe subalpina[J]. Ecology, 71(4): 1342-1351. DOI:10.2307/1938271 |
Fox J F. 1993. Size and sex allocation in monoecious woody plants[J]. Oecologia, 94: 110-113. DOI:10.1007/BF00317310 |
Gross K L, Soule J D. 1981. Differences in biomass allocation to reproductive and vegetative structures of male and female plants of a dioecious, perennial herb, Silene alba (Miller) Krause[J]. American Journal of Botany, 68(6): 801-807. DOI:10.2307/2443186 |
Hosokawa M, Suzuki S, Umezawa T. 2001. Progress of lignification mediated by intercellular transportation of monolignols during tracheary element differentiation of isolated Zinnia mesophyll cell[J]. Plant Cell Physiol, 42(9): 959-968. DOI:10.1093/pcp/pce124 |
Jiang Ling, You Ruilin, Li Maoxue, et al. 2003. Identification of a sex-associated RAPD marker in Ginkgo biloba[J]. Acta Botanica Sinica, 45(6): 742-747. |
Klinkhamer P G L, de Jong T J, Metz H. 1997. Sex and size in cosexual plants[J]. Trends in Ecology and Evolution, 12: 260-265. DOI:10.1016/S0169-5347(97)01078-1 |
Liu Z, Moore P, Ma H, et al. 2004. A primitive Y chromosome in papaya marks incipient sex chromosome evolution[J]. Nature, 427: 348-352. DOI:10.1038/nature02228 |
Lloyd D G, Bawa K S. 1984. Modification of the gender of seed plants in varying conditions[J]. Evolutionary Biology, 17: 255-338. |
Lovett Doust J, Lovett Doust L. 1988. Modules of production and reproduction in a dioecious clonal shrub Rhus typhina[J]. Ecology, 69(30): 741-750. |
Pannell J. 1997. Variation in sex ratios and sex allocation in androdioecious Mercurialis annua[J]. Journal of Ecology, 85: 57-691. DOI:10.2307/2960627 |
Pennel R I, Lamb C. 1997. Programmed cell death in plants[J]. Plant Cell, 9: 1157-1168. DOI:10.1105/tpc.9.7.1157 |
Ramp P F, Stephenson S N. 1988. Gender dimorphism in growth and mass partitioning by box-elder (Acer negundo L.)[J]. American Midland Naturalist, 119(2): 420-430. DOI:10.2307/2425825 |
Sakai A K, Sharik T L. 1988. Clonal growth of male and female bigtooth aspen (Populus grandidentata)[J]. Ecology, 69(6): 2031-2033. DOI:10.2307/1941181 |
Sakai A K, Weller S G. 1999. Gender and sexual dimorphism in flowering plants: A review of terminology, biogeographic patterns, ecological correlates, and phylogenetic approaches//Gerber M A, Dawson T E, Delph L F. Gender and sexual dimorphism in flowering planting. Berlin: Springer, 1-32.
|
Thomas S C, Lafrankie J V. 1993. Sex, size and interyear variation in flowering among dioecious trees of the Malayan rain forest[J]. Ecology, 74(5): 1529-1537. DOI:10.2307/1940080 |
Tippo O. 1941. A list of diagnostic characteristics for description of dicotyledonous woods[J]. Trans Illinois Acad Sci, 34: 105-106. |
Vitale J J, Freeman D C, Merlotti L A, et al. 1987. Patterns of biomass allocation in Spinacia oleracea (Chenopodiaceae) across a salinity gradient: evidence for a niche separation[J]. American Journal of Botany, 74(7): 1049-1054. DOI:10.2307/2443944 |
Xu W J, Wang B W, Cui K M. 2004. RAPD and SCAR markers linked to sex determination in Eucommia ulmoides Oliv[J]. Euphytica, 136(3): 233-238. DOI:10.1023/B:EUPH.0000032741.99885.c4 |
 2010, Vol. 46
2010, Vol. 46


