文章信息
- 高瑞如, 赵瑞华, 杜新民, 黄振英, 杨学军, 魏学智, 黄培祐
- Gao Ruiru, Zhao Ruihua, Du Xinmin, Huang Zhenying, Yang Xuejun, Wei Xuezhi, Huang Peiyou
- 2种盐生植物根系的适盐特性
- Characteristics of Root Systems of Two Halophytes for Adaptability to Salinity
- 林业科学, 2010, 46(7): 176-182.
- Scientia Silvae Sinicae, 2010, 46(7): 176-182.
-
文章历史
- 收稿日期:2009-02-09
- 修回日期:2009-09-25
-
作者相关文章
2. 中国科学院植物研究所植被与环境变化国家重点实验室 北京 100093;
3. 新疆大学生命科学与技术学院 乌鲁木齐 830046
2. State Key Laboratory of Vegetation and Environmental Change, Institute of Botany, The Chinese Academy of Sciences Beijing 100093;
3. College of Life Science and Technology, Xinjiang University Urumqi 830046
植物在吸收水分和营养物质的过程中,根系起关键性作用(Satomura et al., 2006),同时根系在土壤中的分布格局反映出植物的生态适应对策(Hartlea et al., 2006),这种对策在逆境中表现为增加其生存的机会(冯锋等,2000)。盐生植物作为一类具有特殊适应能力的植物,生长于盐渍化土地上,这种适应对策可能表现在种子萌发(高瑞如等,2007;Song et al., 2006;Qu et al., 2008)、幼苗生长(李圆圆等,2003;韩张雄等,2008)、形态结构(陆静梅等,1998;赵可夫,2002)、生理(孙黎等,2006;贾娜尔·阿汗等,2007)及分子调控(Yin et al., 2002)等方面。有关温带荒漠植物根系的研究主要集中于沙生植物(Dubrovsky et al., 1997; Ricardo et al. 2002; Puente et al., 2004; Carolyn et al., 2004; Rodriguez et al., 2004; Hartlea et al., 2006),而对盐生植物根系的研究不多,弋良朋等(2007)通过控制试验研究盐分对盐生植物幼苗根系影响得出,较高浓度的NaCl可以抑制梭梭(Haloxylon ammodendron)、囊果碱蓬(Suaeda physophora)和钠猪毛菜(Salsola nitraria) 3种盐生植物幼苗根系的生长(弋良朋等,2007a; Yi et al., 2007),而200 mmol·L-1 NaCl降低盐生车前(Plantago maritima)的根鲜质量和提高根系的含水量,但并没有抑制根长的生长(Rubinigg et al., 2003), 野外调查发现亚麻叶碱蓬(Suaeda linifolia)根冠部分发育根套,耐盐能力可能因此增强(高瑞如等,2006)。王俊等(2008)对盐生植物群落地下生物量进行调查,得出群落中植物根系生物量密度分布格局与土壤盐分水盐动态密切相关,这种相关可能是由于根冠区土壤盐分特异变化引起的(郗金标等,2004),尽管这些研究结果在说明根系与植物耐盐性的关系上具有一定的作用,但均集中于实验室单盐模拟和群落水平上的研究,对自然生境中的盐生植物个体根系分布格局及适盐特性研究不足。
盐节木(Halocnemum strobilaceum)和盐爪爪(Kalidium foliatum)均为藜科多年生植物,分布较广,是盐生荒漠群落的优势物种(Song et al., 2006;Qu et al., 2008)。有关这2种植物的研究主要集中在种子萌发生态学(高瑞如等,2007;Song et al., 2006)、群落特征(孔令韶等,1995)、分子生物学特征(曾幼玲等,2007), 类黄酮、咖啡酸酯及香豆素等化学成分提取和资源开发等方面(Miftakhova et al., 1999; 2001;Gibbons et al., 1999)。笔者对新疆准噶尔盆地南缘自然生境中的盐节木和盐爪爪长期调查发现:这2种植物具有很强的适盐性,甚至可在土壤表面具有2~6 cm厚的盐壳中生存,其之所以能在高盐地上生存,可能与根系特征有关。2003年5月,采用野外调查和实验室分析相结合,对自然生境中的盐节木和盐爪爪根系分布格局与土壤水、盐和pH等的关系;粗细根分布特征及其水分含量与植物耐盐性关系;离子在根系中的分布及其与土壤中离子含量的关系等进行研究,以期从根系的特征上探明盐生植物适应高盐环境的机制,丰富植物适盐机制的理论,同时对荒漠植物的生态恢复策略的制定和植物资源的开发具有重要参考意义。
1 研究区概况本项研究是在准噶尔盆地古尔班通古特沙漠南缘的新疆建设兵团103团进行(87°25′—87°36′ E,44°18′—44°40′ N,海拔450~510 m)。由于该区紧邻沙漠,气候炎热干燥,降水稀少。最冷月(1月)均温-20.7 ℃,最热月(7月)均温22.2 ℃,年均温度2.7 ℃、大气相对湿度61.90%、降水量153.88 mm,无霜期162天,≥10 ℃以上积温3 490 ℃,日照2 955.2 h(自治区气象局提供,2004)。蔡家湖辖区内盐渍化土地8 785.7 hm2(1988年资料,103团土地局提供)。4月份以后,该地到处可见白色盐花,盐花下面是厚约2~6 cm的盐壳,其主要成分是硫酸盐和盐酸盐,0~30 cm土壤层可溶性盐含量达(8.68±0.85)%。在严酷的生境中,生长着如藜科(Chenopodiaceae)的雾滨藜(Bassia dasyphylla)、密枝猪毛菜(Salsola implicata)、延叶猪毛菜(S. pachyhpyl)、亚麻叶碱蓬(S. linifolia)、盐节木和盐爪爪等,蒺藜科的西伯利亚泡泡刺(Nitraria sibirica),柽柳科的长穗柽柳(Tamarix elongata)、多枝柽柳(T. ramosissima),禾本科的芦苇(Phragmites australis)等植物。
2 研究方法 2.1 植物根系采集在盐渍化生境,选取400 m×800 m的典型样地,分别选取植株大小相等、相对独立生长的盐节木和盐爪爪各2株,以植株为圆心,水平方向上以0~20, 20~60, 60~100和100~140 cm为段,140 cm以外的由于根量较少,停止挖掘;垂直方向上以0~10, 10~20, 20~30, 30~40, 40~50, 50~60, 60~70和70~80 cm为层采用挖掘法做根系分布调查。另外,选择样地相对独立生长的这2种植物各3株,采用剖面调查法对上述结果进行验证。将挖出的土壤装进塑料编织袋,移至旁边较平坦地方堆放,做好标志,然后对根进行人工分捡,肉眼可见的均捡出,捡后土壤用水浸泡,并用0.8 mm×0.8 mm尼龙纱网过滤,得到无法捡出的细根,吸水纸吸干。捡出的根装进塑料袋中,封口并标记,及时带回实验室处理。
2.2 根质量、根长及直径测定为迅速清除根表面土壤而不影响其鲜质量,将根样品分别放在太阳光下曝晒5 min,主要使附着在根表面土壤中水分蒸散,对根含水量的影响不大(测试后证实),而后将根分别放入0.8 mm×0.8 mm尼龙纱网中,用自来水冲洗并轻轻揉搓1 min,根表面土壤冲净,然后迅速用去离子水冲洗,吸水纸吸干,分别用电子天平(0.001 g)称鲜质量。粗根根长用直尺直接测量,细根根长采用体积法测定(马骥等,1996)。根长密度采用单位体积土壤内根长即dni =lni/vni(其中所挖土壤体积vni =π(rni2-rn(i-1)2)×0.1,n为水平分段1,2,3和4,i为垂直分层1,2,……8,r是以植株为圆心的挖掘半径长,rn0=0,lni为土壤体积vni内的总根长);单位体积土壤根质量gni =wni/vni (其中所挖土壤体积vni,计算方法同上,wni为vni体积土壤内的总根质量)。
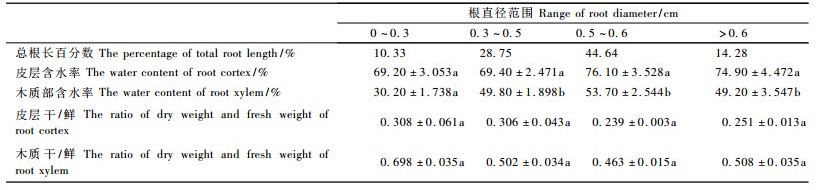
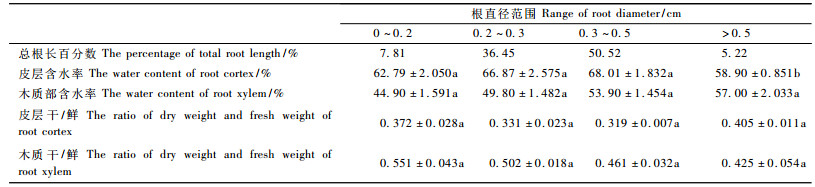
将盐节木和盐爪爪根系分别集中,用0.02 mm游标卡尺测定根直径。根据测得的结果,将盐节木和盐爪爪根分别分为4个径级范围,即0~0.3, 0.3~0.5,0.5~0.6,>0.6 cm和0~0.2,0.2~0.3,0.3~0.5和>0.5 cm,最后对径级范围内的总根长进行统计。
2.3 根系含水量及离子含量测定根据2种植物的4个径级范围,在每一范围内随机挑选10条根,用解剖刀划开后可直接分离皮层(含木栓形成层)和木质部(韧皮部几乎无),标注后分别放入直径为20 cm培养皿中,烘箱中105 ℃至恒重,计算径级范围内的皮层含水量(%)、木质部含水量(%)、皮层干/鲜和木质部干/鲜质量。将上述处理(主根除外)的根木质部和皮层进行Cl-,SO42-,Mg2+和Ca2+含量测定,采用沃尔什等(1982)的方法。
2.4 土样采集及理化性质测定在盐节木和盐爪爪生境中随机选取3点,做垂直土壤剖面,取0~10, 10~20,20~30,30~40,40~50,50~60,60~70 cm和70~80 cm土壤层的土样,铝制土壤盒盛装,每个样3个重复,就地用HT-300电子天平(精确到0.01g)测定土壤湿质量,带回实验室复测。含水量测定采用李培清(1983)的方法;土壤可溶性盐含量用电导率法(PD-501便携式多功能测量仪,上海伟业仪器厂)(佩奇等,1991;刘广明等,2001);土壤pH测定及离子含量均采用北京林业大学(2002)的方法。
2.5 数据分析方法用SPSS13.0数据分析软件对不同直径范围内的根皮层和木质部含水量、皮层和木质部干鲜质量比值的变化及同一离子在根系不同部位及土壤中分布的差异性进行单因素方差分析(LSD),以揭示水和离子在根系中的分布特征;分别对根长密度和鲜质量与土壤水、盐含量、pH值、根系木质部和皮层离子含量与土壤离子含量做相关性分析,以探索外界因素对根系分布的影响。
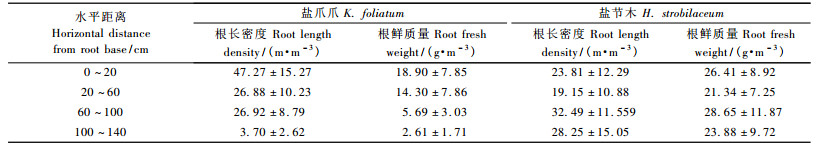
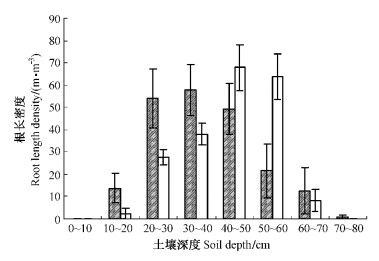
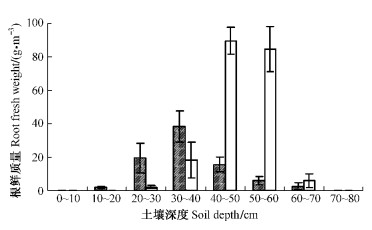
3 结果与分析 3.1 根系分布1) 根系分布特征在垂直方向上,盐节木和盐爪爪根长密度分别集中分布在30~60和20~50 cm土壤层。以植株为圆心,水平半径60 cm范围内,盐节木根系在0~20 cm土壤层没有分布;60 cm范围以外,在10~20 cm土层中出现分布。盐爪爪根系始终在0~10 cm土壤层没有分布。盐节木和盐爪爪根系在土壤层中最深分别可达70和80 cm(图 1);根鲜质量在垂直方向上的分布规律类似于根长密度分布(图 2)。在水平方向上,盐节木根系延伸距离超过1.4 m,并且在20~60 cm段根长密度和根鲜质量减小,60~100 cm段增大,超过100 cm逐渐减小;根鲜质量出现类似变化。盐爪爪根长密度在20~60 cm范围内略有减小,根鲜质量则逐渐减小(表 1)。结果显示:盐生植物并不是借助于根系的垂直方向上的伸长来逃脱盐的胁迫,而是严格将根系集中控制在一定范围的土壤层中,同时在水平方向上根幅较广。
|
图 1 盐爪爪和盐节木根长密度在垂直方向上的分布 Figure 1 The vertical distribution of root length density of H. strobilaceum and K. foliatum 
|
|
图 2 盐爪爪和盐节木根鲜质量在垂直方向上的分布 Figure 2 The vertical distribution of root fresh weight of H. strobilaceum and K. foliatum |
|
|
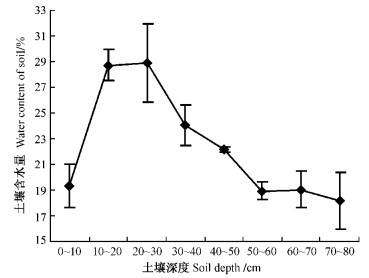
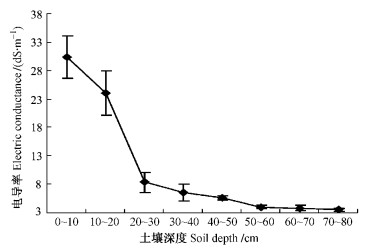
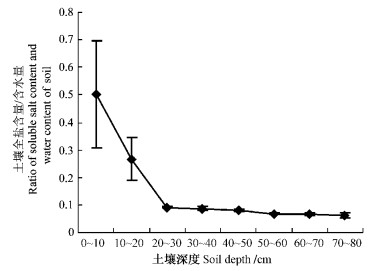
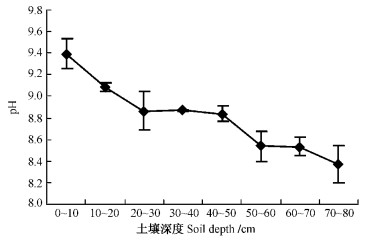
2) 根系分布与土壤水、盐含量和pH值的关系盐节木和盐爪爪生境土壤分析得出,土壤表层含水量较低,15~25 cm土壤层含水量最大,为28.8%,明显高出其他层次(P<0.05);深于25 cm,土壤含水量逐渐下降; 到75 cm时,土壤含水量仅为18.1%(图 3)。土壤可溶性盐含量随土壤层加深而不断减少,5和15 cm土壤层可溶性盐含量分别高达9.72%和7.69%,与其他层次差异显著(P<0.05)(图 4);土壤可溶性盐含量和土壤含水量比值在0~15 cm,分别为0.57和0.26,随后下降至0.092~0.067(图 5);土壤pH随土壤加深由9.39减至8.37(图 6)。相关分析结果显示:土壤含水量、土壤可溶性盐含量及土壤pH值与根长密度和鲜质量没有明显的相关关系(P>0.05)。由此可知: 0~15 cm土壤层,土壤可溶性盐含量和土壤水分含量及其两者的比值较大,即含盐量过大,且pH值较高,植物根系基本无分布;盐节木和盐爪爪根系分别集中在30~60和20~50 cm土壤层,主要因为这一范围土壤可溶性盐含量和土壤水分含量的比值(0.08~0.09)较稳定,且pH值较小;55 cm以下的土壤含盐量急剧减少。
|
图 3 不同土壤深度含水量变化 Figure 3 The changes of water in different soil depth |
|
图 4 不同土壤深度土壤可溶性盐含量变化 Figure 4 The changes of soil soluble salt content in different soil depth |
|
图 5 不同土壤深度土壤可溶性盐含量/含水量的变化 Figure 5 The ratio of soluble salt content and water content in different soil depth |
|
图 6 不同土壤深度pH值变化 Figure 6 The changes of pH in different soil depth |
在根的分捡过程中发现:盐节木直径<0.3 cm和盐爪爪<0.2 cm的根均很少,分别占总根长的10.33%和7.81%,而直径>0.6 cm的盐节木和>0.5 cm的盐爪爪的根也不多,仅占总根长的14.28%和5.22%,大部分根直径均分布在0.3~0.6 cm(盐节木)和0.2~0.5 cm(盐爪爪),分别为总根长的73.39%和86.97%(表 2和表 3),这与一般植物细根总长占绝对优势现象相悖。对根的皮层厚度和含水量进行测定,结果显示:盐节木和盐爪爪根内外径比值分别在0.5~0.6和0.3~0.5 cm径级内达到最大,其含水量分别也达到最大值,为76.10%和68.01%。
|
|
|
|
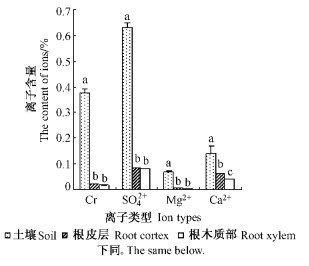
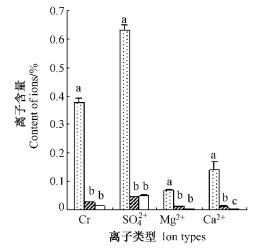
为进一步分析根的适盐特性,笔者对根中离子的分布及含量做了测定。结果显示:2种植物根系木质部和皮层中的Cl-, SO42-,Mg2+和Ca2+的平均含量与土壤中相应离子含量存在显著差异(P<0.01)(图 7, 8);盐爪爪和盐节木根系木质部Cl-含量分别达到0.017 6%和0.015 7%,分别低于皮层的0.022%和0.027%,但差异不显著(P>0.05);2种植物根系木质部SO42-含量均与皮层相似,盐爪爪和盐节木根系木质部Mg2+含量分别为皮层的2和3倍,而Ca2+则在2种植物分别出现木质部和皮层的显著差异(P<0.05)。根系木质部和皮层离子含量分别与土壤中离子含量相关分析发现,盐爪爪根系木质部和皮层离子含量分别与土壤离子含量呈高度相关,Pearson相关系数分别为0.611和0.787,但相关不显著(P>0.05);盐节木根系木质部和皮层离子含量与土壤离子含量呈显著高度相关,Pearson相关系数分别为0.954(P<0.05)和0.992(P<0.01)。
|
图 7 盐爪爪根中离子含量 Figure 7 The content of ions in roots of K. foliatum |
|
图 8 盐节木根中离子含量 Figure 8 The content of ions in roots of H. strobilaceum |
盐节木和盐爪爪生长在温带干旱盐漠上,具有很强的耐盐能力。这种耐盐能力在很大程度上与根系的生态生物学特性有关(孙祥等,1991),土壤中盐碱对植物的危害最直接的受害部位是植物的根系,它在逆境下的形态特征和生理表现,是植物有效吸收和利用土壤养分最直接的适应特征(冯锋等,2000)。从盐节木和盐爪爪的根系在垂直方向上分别集中分布在30~60和20~50 cm土壤层,而并不是先前人们所认为的植物为逃避盐害,根系不断向下生长。根系的在垂直方向上的这种分布可能是由土壤的水、盐及pH值决定的,土壤分析结果显示:0~10 cm土壤盐分含量为9.72%,水分含量为19.34%,pH值高达9.4,因而严酷的条件不适合根系生长;随土壤加深,盐分含量和pH值减小,条件越来越适合根系生长,但由于土壤水分含量不断减少,当深达55 cm以下,土壤含水量仅为18.10%,成为限制因子,所以深层土壤也不利于根系生长;25~55 cm土壤层,土壤盐和水含量比值较小,为0.06~0.09,且pH值也较小,虽然条件不是最佳,但各种条件在这一空间均达到较好水平, 这说明根系在土壤表层可能受盐分和水分双重影响,在土壤底层主要受水分的影响,盐节木和盐爪爪根系的这种分布格局可能是植物适应当地盐生生境的1种策略。影响根系分布可能还有其他条件如养分(弋良朋等,2007b),根系生物量和根长密度在肥沃的表层分布较多,而在相对贫瘠的下层分布较少(Fransen et al., 1998)。盐节木和盐爪爪的根系在水平方向上延伸均超过1.4 m,这可能是由于盐渍化土地比较贫瘠,植物通过扩大根系吸收范围,获取更多资源。盐节木和盐爪爪根系在20~60 cm水平分布上根长密度较小,这可能是由于盐生灌木引起的“盐分岛”效应造成的(王珺等,2008),尤其是在冠幅边缘区更为严重(郗金标等,2004),植物根系分布影响土壤中水分和盐分的梯度分布,同时土壤中水分和盐分的梯度格局也影响根系在土壤中的分布(David et al., 1999),而这2种植物的冠幅区均在1.2 m以内,因而出现根长密度在20~60 cm范围内较小,这种影响一旦消失,盐节木根系分布范围由30~40 cm土壤层上升到20~30 cm土壤层,这充分表现出盐生植物根系在胁迫环境中的敏感性(Lynch,1995)。所以,植物根系的分布格局一方面可以反映出植物的生态对策(Hartlea et al., 2006),另一方面,也说明了环境状况。
根系生物量的大小用来评价根系吸收养分和水分的能力(李凌浩等,1998),即根系生物量越高,吸收的养分和水分就越多。盐节木和盐爪爪根系生物量与密度的分布格局相似,主要由于根系中的细根所占比例很少的原因造成,但2种植物根系生物量均不高,其可能是造成其吸收能力并不很强的原因之一,植物可能会因此而矮小或生长不良,地上生物量减少会导致根系生产量不高,而维持根系生物量及其生理生态活动需要的大量光合产物(Pregitzer,2003)可能不够;而细根根长密度在决定根吸收养分和水分的能力方面更具有意义(Farrar et al., 2000),土壤层中的盐节木和盐爪爪根长密度最大值分别为67.75和57.69 m·m-3,根长密度较低,细根根长密度更低,这不同于非盐生植物如臭柏(Sabina vulgaris)根长密度达1.448 cm·cm-3(张国盛等,2009),梭梭则为94.04 m·m-3(黄勇等,2009),较低的根系密度可能会影响到其根系对养分和水分的吸收,但这2种植物能够在高盐地上生长,可能与其根系的强大贮水存能力有关。
根系的主要功能是从土壤中吸收和传递水分和营养物质(Gibbens et al., 2001),但这种吸收作用主要由细根来完成(Wilcoxa et al., 2004),这是因为细根吸收面积最大(Satomura et al., 2006)。但在对盐节木和盐爪爪根系的研究得出,细根仅占总根长的10.33%和7.81%,这2种植物细根较少的原因可能是高盐胁迫导致植物体根内ABA增多,抑制侧根的发育,进而抑制细根的生长(郭栋梁等,2008)。细根较少可能不利于植物吸收功能的正常发挥,但这2种植物均能在高盐地上生长,推测可能原因:低渗状态下,植物会利用粗根和少数细根共同吸收营养,粗根可能效率不及细根,但由于盐节木和盐爪爪根系的皮层含水量均高达58%~70%,木质部含水量也在30%~60%,强大的贮藏功能允许根系吸收缓慢,同时也可增强了植物对土壤环境变化的抵抗能力,生存机会增加(冯锋等,2000)。研究还发现2种盐生植物根系分布密度最大的径级含水量也达到最大,这可能与植物适盐特征相联系,但这方面的研究还有待进一步深入。
盐节木和盐爪爪根系中的Cl-, SO42-,Mg2+和Ca2+ 4种离子和土壤离子含量呈高度相关,并且含量均相对较高,但并未对植物体造成损害,主要原因可能与2种植物根系的含水量较高有关,即在植物体内产生稀释作用,同时,根系皮层中Ca2+显著高于植物体的其他部分,由于Ca2+可以拮抗其他离子对植物的伤害(蔡蕾等,2004;尹增芳等,2006),因而植物可能借助根系吸收大量的Ca2+来减轻盐分对自身的伤害,结果显示盐节木和盐爪爪根系对盐分具有很强的适应性。
北京林业大学. 2002. 土壤理化分析实验指导书[M]. 北京: 北京林业大学出版社.
|
蔡蕾, 丁同楼, 王宝山. 2004. 外源GA3、ABA和Ca(NO3)2缓解盐对小麦种子萌发的抑制作用[J]. 西北植物学报, 24(4): 583-587. |
冯锋, 张福锁, 杨新泉. 2000. 植物营养研究—进展与展望[M]. 北京: 中国农业大学出版社: 12-21.
|
高瑞如, 赵瑞华, 黄培祐. 2006. 亚麻叶碱蓬幼苗适盐特性研究[J]. 新疆大学学报:自然科学版, 25(3): 329-333. |
高瑞如, 赵瑞华, 张双风, 等. 2007. 盐分和温度对盐节木种子萌发的影响[J]. 西北植物学报, 27(11): 2281-2285. DOI:10.3321/j.issn:1000-4025.2007.11.023 |
郭栋梁, 李玲. 2008. ABA对植物侧根发生的调节[J]. 亚热带植物学报, 37(1): 67-69. |
韩张雄, 李利, 徐新文, 等. 2008. NaCl胁迫对3种荒漠植物幼苗叶绿素荧光参数的影响[J]. 西北植物学报, 28(9): 1843-1849. |
黄勇, 郭玉海. 2009. 人工梭梭林根系的分布特征[J]. 草地学报, 17(1): 84-87. DOI:10.11733/j.issn.1007-0435.2009.01.017 |
贾娜尔·阿汗, 杨春武, 石德成, 等. 2007. 盐生植物碱地肤对盐碱胁迫的生理响应特点[J]. 西北植物学报, 27(1): 79-84. |
孔令韶, 马茂华. 1995. 新疆呼图壁绿洲外缘的盐节木及其群落的生物生态学特征[J]. 生态学报, 15(4): 351-358. |
李凌浩, 林鹏, 邢雪荣. 1998. 武夷山甜槠林细根生物量和生长量研究[J]. 应用生态学报, (4): 337-340. |
李培清. 1983. 新疆土壤分析[M]. 乌鲁木齐: 新疆人民出版社.
|
李圆圆, 郭建荣, 杨明峰, 等. 2003. KCl和NaCl处理对盐生植物碱蓬幼苗生长和水分代谢的影响[J]. 植物生理与分子生物学学报, 29(6): 576-580. |
刘广明, 杨劲松. 2001. 土壤含盐量与电导率及水分含量关系的试验研究[J]. 土壤通报, 32(专辑): 85-86. |
陆静梅, 刘友良, 胡波, 等. 1998. 中国野生大豆盐腺的发现[J]. 科学通报, 43(19): 2074-2078. DOI:10.3321/j.issn:0023-074X.1998.19.013 |
马骥, 王勋陵, 赵松岭. 1996. 西北地区骆驼蓬根系的研究[J]. 干旱区研究, 13(3): 60-64. |
佩奇A L, 米勒R H. 1991. 土壤分析法[M]. 北京: 中国农业科技出版社.
|
孙黎, 刘士辉, 师向东, 等. 2006. 10种藜科盐生植物的抗盐生理生化特征[J]. 干旱区研究, 23(2): 309-313. |
孙祥, 于卓. 1992. 白刺根系的研究[J]. 中国沙漠, 12(4): 50-54. |
王珺, 刘茂松, 盛晟, 等. 2008. 干旱区植物群落土壤水盐及根系生物量的空间分布格局[J]. 生态学报, 28(9): 4120-4127. |
沃尔什L M, 比坦J D. 1982. 土壤测定与植物分析. 周鸣铮, 译. 北京: 农业出版社.
|
郗金标, 张福锁, 陈阳, 等. 2004. 盐生植物根冠区土壤盐分变化的初步研究[J]. 应用生态学报, 15(1): 53-58. |
弋良朋, 马健, 李彦. 2007a. 3种荒漠盐生植物根系及根毛形态特征的比较研究[J]. 植物研究, 27(2): 204-211. |
弋良朋, 马健, 李彦. 2007b. 荒漠盐生植物根际土壤盐分和养分特征[J]. 生态学报, 27(9): 3565-3571. |
尹增芳, 何祯祥, 陈梦阳, 等. 2006. 外源钙对NaCl胁迫下海滨锦葵种子萌发和幼苗生长的缓解效应[J]. 西北植物学报, 26(3): 462-466. |
曾幼玲, 幸婷, 蔡忠贞, 等. 2007. 盐生植物盐爪爪甜菜碱醛脱氢酶基因的克隆及在盐胁迫下的BADH基因的表达[J]. 云南植物研究, 29(1): 79-84. |
张国盛, 吴国玺, 王林和, 等. 2009. 毛乌素沙地臭柏(Sabina vulgaris)和油蒿(Artemisia ordosica)群落的细根分布特征[J]. 生态学报, 29(1): 18-27. |
赵可夫. 2002. 植物对盐渍逆境的适应[J]. 生物学通报, 37(6): 7-10. |
Carolyn S W, Joseph W F, George C J F, et al. 2004. Fine root growth dynamics of four Mojave Desert shrubs as related to soil moisture and microsite[J]. Journal of Arid Environments, 56: 129-148. DOI:10.1016/S0140-1963(02)00324-5 |
David D B, Fairley J B. 1999. Interrelationships between plant functional types and soil moisture heterogeneity for semiarid landscapes within the grassland / forest continuum: a unified conceptual mode[J]. Landscape Ecology, 14: 465-478. DOI:10.1023/A:1008040327508 |
Dubrovsky J G. 1997. Determinate primary-root growth in seedlings of Sonoran Desert Cactaceae; its organization, cellular basis, and ecological significancy[J]. Planta, 203: 85-92. DOI:10.1007/s00050168 |
Farrar J F, Jones D L. 2000. The control of carbon acquisition by roots[J]. New Phytol, 147(1): 43-53. DOI:10.1046/j.1469-8137.2000.00688.x |
Fransen B, Kroon H D, Bereddse F. 1998. Root morphological plasticity and nutrient acquisition of perennial grass species from habit of different nutrient availability[J]. Oecologia, 115(3): 351-358. DOI:10.1007/s004420050527 |
Gibbens R P, Lenz J M. 2001. Root systems of some Chihuahuan Desert plants[J]. Journal of Arid Environments, 49: 221-263. DOI:10.1006/jare.2000.0784 |
Gibbons S, Mathew K T. 1999. Gray A I.A caffeic acid ester from Halocnemum strobilaceum[J]. Phytochemistry, 51: 465-467. DOI:10.1016/S0031-9422(99)00007-2 |
Hartlea R T, Fernandez G C J, Nowaka R S. 2006. Horizontal and vertical zones of influence for root systems of four Mojave Desert shrubs[J]. Journal of Arid Environments, 64: 586-603. DOI:10.1016/j.jaridenv.2005.06.021 |
Lynch J P. 1995. Root architecture and plant productivity[J]. Plant Physiology, 109: 7-13. DOI:10.1104/pp.109.1.7 |
Miftakhova A F, Burasheva G S, Abilov Z A. 1999. Flavonoids of Halocnemum strobilaceum[J]. Chemistry of Natural Compounds, 35(1): 100-110. DOI:10.1007/BF02238224 |
Miftakhova A F, Burasheva G S, Abilov Z A, et al. 2001. Coumarins from the aerial part of Halocnemum strobilaceum[J]. Fitoterapia, 72: 319-321. DOI:10.1016/S0367-326X(00)00301-4 |
Pregitzer K S. 2003. Woody plants carbon allocation and fine roots[J]. New Phytol, 158(3): 419-430. DOI:10.1046/j.1469-8137.2003.00778.x |
Puente M E, Bashan Y, Li C Y. 2004. Microbial populations and activities in the rhizoplane of rock-weathering desert Plants.Ⅰ. Root colonization and weathering of igneous rocks[J]. Plant Biology, 6: 629-642. DOI:10.1055/s-2004-821100 |
Qu X X, Baskin J M, Wang L, et al. 2008. Effects of cold stratification, temperature, light and salinity on seed germination and radical growth of the desert halophyte shrub, Kalidium caspicum (Chenopodiaceae)[J]. Plant Growth Regul, 54: 241-248. DOI:10.1007/s10725-007-9246-3 |
Ricardo M G, Ronald E S, Wan C G. 2002. Shoot and root biomass of desert grasses as affected by biosolids application[J]. Journal of Arid Environments, 50: 477-488. DOI:10.1006/jare.2001.0897 |
Rodriguez Zaragozaa S, Steinberger Y. 2004. Seasonal dynamics of amoebae in the root canopy of Zygophyllum dumosum in the Negev Desert, Israel[J]. Pedobiologia, 48: 277-281. DOI:10.1016/j.pedobi.2004.02.001 |
Rubinigg M, Posthumus F, Ferschke M, et al. 2003. Effects of NaCl salinity on 15N-nitrate fluxes and specific root length in the halophyte Plantago maritima L[J]. Plant and Soil, 250: 201-213. DOI:10.1023/A:1022849928781 |
Satomura T, Fukuzawa K, Horikoshi T. 2007. Considerations in the study of tree fine-root turnover with Minirhizotrons[J]. Plant Root, 1: 34-45. DOI:10.3117/plantroot.1.34 |
Song J, Feng G, Zhang F S. 2006. Salinity and temperature effects on germination for three salt resistant euhalophytes, Halostachys caspica, Kalidium foliatum and Halocnemum Strobilaceu[J]. Plant and Soil, 279: 201-207. DOI:10.1007/s11104-005-1012-6 |
Wilcoxa C S, Fergusona G C, Fernandezb J, et al. 2004. Fine root growth dynamics of four Mojave Desert shrubs as relate J.W.D to soil moisture and microsite[J]. Journal of Arid Environments, 56: 129-148. DOI:10.1016/S0140-1963(02)00324-5 |
Yi L P, Ma J, Li Y. 2007. Impact of salt stress on the features and activities of root system for three desert halophyte species in their seedling stage[J]. Scicence in China Series D-Earth Sciences, 50(Suppl. 1): 97-106. |
Yin X J, Zhao Y X, Luo D, et al. 2002. Expression of the Betaine Aldehyde Dehydrogenase (AcBADH) Gene and Isolation of Its Promoter from the Halophyte Atriplex centralasiatica Iljin[J]. Journal of Plant Physiology and Molecular Biology, 28(6): 479-484. |
 2010, Vol. 46
2010, Vol. 46