文章信息
- 杨晓红, 陈晓阳, 王颖, 周伟, 肖铃, 宋雅丹
- Yang Xiaohong, Chen Xiaoyang, Wang Ying, Zhou Wei, Xiao Ling, Song Yadan
- 干旱胁迫对转SacB基因、转BADH基因的美丽胡枝子的影响
- Effects of Drought Stress on Lespedeza formosa Plants Expressing SacB Gene & BADH Gene
- 林业科学, 2010, 46(7): 64-68.
- Scientia Silvae Sinicae, 2010, 46(7): 64-68.
-
文章历史
- 收稿日期:2009-05-31
- 修回日期:2009-12-03
-
作者相关文章
2. 华南农业大学林学院 广州 510642
2. College of Forest, Southern China Agricultural University Guangzhou 510642
据统计,我国干旱半干旱地区约占国土总面积的1/2。干旱对世界作物产量的影响,在诸自然逆境中占据首位,其危害相当于其他自然灾害之和。耐干旱植物对抵御风沙等自然灾害、稳定干旱区环境,起着不容忽视的作用(杨瑞丽,2003)。因此培育耐旱植物新品种对农业、林业生产具有重要意义。
果聚糖、甜菜碱为植物组织中重要的渗透调节物质。果聚糖主要在植物液泡中积累,这种积累能降低细胞液泡水势,有助于提高植物抵御干旱、低温以及盐胁迫的能力(Tita et al., 2003)。在盐、干旱等逆境下,一些高等植物如大麦(Hordeum vulgare)、玉米(Zea mays)、菠菜(Spinacia oleracea)、甜菜(Beta vulgaris)等能够积累甜菜碱,以维持胁迫下细胞的正常膨压和代谢功能(Sakamoto et al., 2002)。
目前,运用基因工程技术改进植物体内的渗透调节物质水平已经成为培育抗逆性新品种的一种手段。果聚糖蔗糖转移酶(SacB)催化以蔗糖为底物合成果聚糖的反应,转SacB基因的烟草(Nicotiana tabacum)(Konstantinova et al., 2002; Pilon-Smits et al., 1995)、番茄(Lycopersicon esculentum)(王关林等,2004)、银腺杨(Populus alba × P.glandulosa)(李义良等,2007),能够在植株中积累果聚糖,提高转基因植株的抗旱、耐寒等能力。甜菜碱醛脱氢酶(BADH)是甜菜碱合成中的关键酶,转入BADH基因的烟草(司怀军等,2007)、小麦(Triticum aestirum)(霍云谦等,2003)植株的耐旱性明显提高。本文以转入SacB基因、BADH基因的美丽胡枝子(Lespedeza formosa)及非转基因植株为对象,研究干旱胁迫对它们的一些逆境生理指标的影响和转基因植物的田间抗旱性能,以此探讨与渗透调节相关的外源基因的导入对植物产生的一些影响。
1 材料与方法 1.1 材料试验材料为同时炼苗出瓶的转果聚糖蔗糖转移酶(SacB)、转甜菜碱醛脱氢酶(BADH)及未转基因的美丽胡枝子,2种转基因植株均各选3个生长健壮的株系作为研究对象,各个转基因株系均为单拷贝插入,SacB基因、BADH基因的启动子均为CAMV35S。
1.2 方法3种试材同时炼苗,同时上盆,上盆时就将每盆质量调到一致状态。盆栽基质为大田表土,盆栽容器为营养钵。对于炼苗成活的试验材料,一部分盆栽用于抗性生理测定,其余材料种植于苗圃地。经过4个月盆栽后,当苗木高度达70~80 cm时进行干旱胁迫试验。采用称重法,分别于土壤含水量达到最大田间持水量的90%,75%,62%时取样进行生理指标测定,以90%水平作为正常生长状态。每种材料每个处理为10盆,分别测定3种试材在3种土壤含水量下的叶片游离脯氨酸含量、可溶性总糖含量、甜菜碱含量、丙二醛含量、超氧化物歧化酶活性、叶绿素含量,每种指标重复测定3次。用于生理指标测定的材料均为植株中部叶片,每种材料每处理用于生理测定的复叶数量在10枚以上。试验结果用DPS软件进行分析。用于田间观察的材料被随机种植于北京农学院园林系苗圃地,总种植面积约10 m2,第2年春季萌动前平茬,观察当年平茬后发出的植株和次年生长植株。
丙二醛(MDA)含量采用硫代巴比妥酸法,超氧化物歧化酶(SOD)活性采用NBT光化还原法,叶绿素含量采用分光光度法,可溶性糖采用蒽酮法,脯氨酸含量采用酸性茚三酮比色法(陈建勋,2006)测定。甜菜碱含量测定采用雷氏盐法(王淑慧,2006; 杨晓红等,2009)。
2 结果与分析 2.1 不同试材在田间自然干旱条件下的表现从图 1可看出,2008年5月下旬在自然干旱条件下,转入SacB基因、BADH基因的美丽胡枝子的抗旱性明显比未转基因的植株强。当距离地表约40 cm的土壤含水量为最大田间持水量32%时,非转基因植株整体出现叶片枯萎皱缩症状,而2种转基因植株仍然叶色浓绿,生长正常。2009年6月下旬到7月初在北京地区持续高温干旱气候条件下,当非转基因植株叶片已经干黄时,2种转基因材料绝大多数叶片仍然能保持正常生长状态,仅个别下部老叶出现枯黄。2个年度的观察结果均显示出在自然状态下,外源SacB基因、BADH基因的导入确实能提高美丽胡枝子的田间抗旱性。

|
图 1 田间自然干旱条件下的转基因植株与对照 Figure 1 The transgenic plants and non-transgenic plants under natural drought align="center"ondition in field A:转入SacB植株与对照SacB-transgenic plants and CK(2008-05); B:转入BADH植株BADH-transgenic plants(2008-05); C:非转基因植株(对照) Non-transgenic plants(CK)(2008-05); D: 2009年6月底至7月初持续高温干旱下的自然表现The growth under water stress and high temperature from the last ten-day pariod of June to the first ten-day period of July in 2009. |
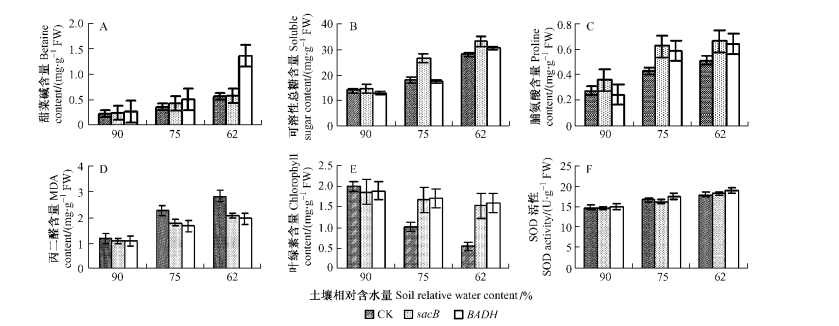
甜菜碱是一种小分子渗透调节物质,其在植物体内的积累可保护蛋白质结构和代谢酶活性。从图 2A可见,3种试材在正常生长情况下,甜菜碱平均含量基本相同,为0.234~0.273 mg·g-1(FW)。在弱度干旱胁迫下(土壤相对含水量75%),3类植株的甜菜碱含量都呈现出增加态势,但3者的甜菜碱含量没有显著差异(F =4.125,α=0.075)。但当土壤相对含水量达到62%时,转入BADH基因的美丽胡枝子在积累甜菜碱方面的能力明显大于非转基因植株及转入SacB基因的植株,其甜菜碱含量平均可达1.36 mg·g-1(FW),而且非转基因植株和转入SacB基因的植株在甜菜碱含量上差异不显著[非转基因植株95%置信区间为0.554~0.586 mg·g-1(FW); 转入SacB基因的植株95%置信区间为0.518~0.644 mg·g-1(FW)]。
|
图 2 3种试材的几个生理指标 Figure 2 Some physiological indexes in 3 material types |
图 2B显示出:在正常生长条件下,3种试材的可溶性总糖含量没有显著差异(F=4.69,α=0.059 3),但随着干旱胁迫强度的增加,3种试材可溶性总糖含量在不断增加。当土壤相对含水量为75%时,转入SacB基因的美丽胡枝子的可溶性总糖含量显著高于非转基因植株和转入BADH基因的植株,而转入BADH基因的植株与非转基因植株之间则不存在显著差异。但当土壤相对含水量为62%时,与第1次水分胁迫(土壤相对含水量为75%)时相比,转入BADH基因的美丽胡枝子的可溶性总糖含量增幅最大,达到了12.93 mg·g-1(FW),而转入SacB基因的植株在可溶性总糖含量上则增幅最小,只有6.44 mg·g-1(FW),此时2种转基因植株与非转基因植株在可溶性总糖含量上存在显著差异[非转基因植株的95%置信区间为26.99~28.87 mg·g-1(FW); 转入SacB基因植株的95%置信区间为30.36~35.58 mg·g-1(FW); 转入BADH基因的植株其95%置信区间为30.8 ~32.1 mg·g-1(FW)]。
2.4 干旱胁迫下3种试材的脯氨酸含量变化从图 2C中可看出,在正常土壤含水量下,不同转基因植株与非转基因植株在脯氨酸含量上并无显著差异(F=4.587,α=0.062),但进行干旱胁迫后,这种差异就表现出来。当土壤相对含水量达到75%时,2种转基因植株与非转基因植株相比,在积累脯氨酸能力方面达到显著性差异(F=74.766,α=0.000 1),转基因植株的脯氨酸含量明显大于非转基因植株。当土壤相对含水量为62%时,非转基因植株已经出现极其明显的叶片萎蔫症状,其叶片内的脯氨酸含量与土壤相对含水量为90%时相比,平均增加了0.238 mg·g-1(FW),而转SacB基因的植株平均增加了0.309 mg·g-1(FW),转BADH基因的植株平均增加了0.405 mg·g-1(FW)。
2.5 干旱胁迫下3种试材丙二醛(MDA)含量变化丙二醛是具有细胞毒性的物质,其含量可以作为衡量膜脂过氧化程度,反映膜的受损程度的一个指标。从图 2D可看出,在没有进行干旱胁迫时,3种美丽胡枝子试材叶片中的丙二醛含量均处于较低水平,但随着干旱胁迫强度的加大,丙二醛含量则不断增加,且非转基因植株积累的丙二醛浓度明显大于转入SacB, BADH基因的植株,当土壤相对含水量为75%时,这种差异就达到了显著水平(F=72.03,α=0.000 1)。虽然,在土壤相对含水量为75%时,2类转基因材料的丙二醛含量与其正常生长状态(土壤相对含水量为90%)相比也达到了显著性差异(F=21.76,α=0.006 7),但其丙二醛增加量还是明显小于非转基因材料。然而2类转基因材料即使在土壤相对含水量为62%时,积累的丙二醛含量并不存在显著差异[转入SacB基因的植株95%置信区间为1.86~2.26 mg·g-1(FW); 转入BADH基因的植株95%置信区间为1.73~2.18 mg·g-1(FW)]。
2.6 干旱胁迫下3种试材的叶绿素含量变化图 2E显示出,在正常水分条件下,转基因美丽胡枝子与非转基因植株之间的叶绿素含量不存在差异(F=1.918,α=0.227)。进行水分胁迫后,非转基因的美丽胡枝子叶绿素含量明显下降,当土壤相对含水量为62%时,其含量只有正常状态的26.8%;而转入SacB基因的植株与转入BADH基因的植株的叶绿素含量与正常状态相比不存在显著差异(转入SacB基因的植株的F=17.97,α=0.133;转入BADH基因的植株的F=4.961,α=0.09)。
2.7 干旱胁迫下3种试材的SOD活性变化图 2F显示出水分胁迫可促进美丽胡枝子SOD活性的增强,但在2种程度的水分胁迫条件下,转入SacB, BADH基因的美丽胡枝子及非转基因植株在SOD活性上并不存在显著差异(土壤相对含水量为75%时F=4.76,α=0.058;土壤相对含水量为62%时F=4.43,α=0.066)。
3 结论与讨论脯氨酸、叶绿素、丙二醛是常用的植物逆境生理指标,植物在干旱等逆境条件下积累脯氨酸、丙二醛,并加快叶绿素分解。MDA含量升高,叶绿素分解加快、合成能力下降标志着植物转向衰老(张亚冰等,2006)。在干旱胁迫下,转BADH的水稻(Oryza sativa)(杨晓玲等,2007)、小麦(霍云谦等,2003)、转Fe-SOD基因的烟草(覃鹏等,2006)的脯氨酸含量明显大于对照(非转基因植株),而MDA含量低于对照。本研究对转入2种不同基因的美丽胡枝子的研究结果也呈现出相同的特征。可见,转入外源耐旱基因能使植株在干旱胁迫下增强脯氨酸的积累,减少MDA的积累。众多研究表明抗旱性强的品种可保持相对较高的叶片叶绿素含量。本次试验中在自然干旱条件下转基因植株能保持正常绿色,而非转基因植株枯黄; 干旱胁迫后非转基因植株叶绿素快速降解,而2种转基因植株叶绿素含量还能维持在较高水平。这些结果表明外源SacB基因、BADH基因的导入确实可提高植物的抗旱性。
研究表明:转入胆碱单氧化酶(CMO)基因、BADH基因可提高植物在逆境下积累甜菜碱的能力(Shirasawa et al., 2006)。在本次试验中,转入BADH基因的美丽胡枝子在干旱胁迫下,明显比非转基因植株及转入SacB基因的植株积累较多的甜菜碱; 此外,转入BADH基因的植株在干旱胁迫下也能积累明显高于非转基因植株的可溶性总糖,但其积累量比转入SacB基因的植株低。孙耀中等(2004)对转BADH基因的水稻研究中也观察到逆境胁迫下转基因水稻的可溶性总糖含量比非转基因植株高。表明外源BADH基因的导入可影响植物的可溶性总糖含量。尽管一些研究表明外施甜菜碱也可影响植物体内的可溶性总糖含量(王一鸣等,2007; 刘俊英等,2009; 李新梅等,2006),但甜菜碱是通过怎样的途径来影响可溶性糖的积累目前并不清楚,还有待进一步研究。
在干旱胁迫环境中,植物为了减缓由胁迫造成的生理代谢不平衡,细胞大量积累一些小分子有机化合物,如脯氨酸、可溶性糖、甜菜碱等,以通过渗透调节来降低水势,维持高的细胞质渗透压,保证细胞的正常生理功能(Bray,1993)。转入SacB基因的美丽胡枝子能在植物体内合成较多的果聚糖,转入BADH基因的美丽胡枝子能在植株体内合成较多的甜菜碱。果聚糖、甜菜碱这些渗透调节物质可有效保护植物免受逆境的伤害,保护植物的叶绿体,因此使得在自然干旱下,当非转基因美丽胡枝子叶片大量枯黄时,转SacB、转BADH基因的美丽胡枝子叶片仍然保持正常绿色。本次研究及一些前人的研究结果表明在干旱状态下,果聚糖或甜菜碱的大量合成和积累可导致脯氨酸的高量合成和积累,表明果聚糖与脯氨酸、甜菜碱与脯氨酸存在某种代谢关系。
SOD是生物防御活性氧伤害的重要保护酶之一。尽管盐胁迫下转BADH基因的水稻(杨晓玲等,2006)、干旱胁迫下转烟酰胺合酶(NAS)基因的匍匐翦股颖(Agrostis stolonifera)(孙鏖等,2008)的SOD活性比非转基因植株高,但本次对转SacB、转BADH基因的美丽胡枝子的研究结果显示,转基因植株的SOD活性只是比非转基因植株略高些,并不存在显著性差异。分析原因,可能是虽然甜菜碱、果聚糖可参与植物的渗透调节,保护膜结构,但还不足以明显影响美丽胡枝子的SOD活性。
陈建勋. 2006. 植物生理学实验指导[M]. 广州: 华南理工大学出版社: 114-186.
|
霍云谦, 张艳敏, 郭北海. 2003. 导入外源甜菜碱醛脱氢酶基因BADH对小麦盐旱抗性的影响[J]. 河北农业科学, 7(1): 1-3. |
李义良, 苏晓华, 张冰玉, 等. 2007. 外源SacB基因在银腺杂种杨基因组中的表达及抗旱性分析[J]. 北京林业大学学报, 29(2): 1-5. |
李新梅, 孙丙耀, 谈建中, 等. 2006. 根施甜菜碱对盐胁迫下桑树幼苗生理生化反应的影响[J]. 蚕业科学, 32(3): 414-417. |
刘俊英, 石国亮, 崔辉梅. 2009. 外源甜菜碱对盐胁迫下加工番茄生理特性的影响[J]. 北方园艺, (8): 243-246. |
司怀军, 张宁, 王蒂. 2007. 转甜菜碱醛脱氢酶基因提高烟草抗旱及耐盐性[J]. 作物学报, 33(4): 1335-1339. |
孙耀中, 东方阳, 陈受宜, 等. 2004. 盐胁迫下转甜菜碱醛脱氢酶基因水稻幼苗耐盐生理的研究[J]. 华北农学报, 19(3): 38-42. |
孙鏖, 易白力, 蒋建雄, 等. 2008. 转NAS基因冷季型草坪草的生长及抗旱性研究[J]. 生物技术通报, (4): 122-129. |
覃鹏, 刘飞虎, 孔治有, 等. 2006. 转SOD基因对烟草抗旱性和相关生理指标的影响[J]. 广西植物, 26(6): 621-625. |
杨瑞丽. 2003. 植物耐旱性及其机理[J]. 内蒙古科技与经济, (4): 107-108. |
杨晓玲, 郭守华, 杨晴, 等. 2007. 转BADH基因水稻幼苗抗旱性研究[J]. 华北农学报, 22(3): 60-64. |
杨晓玲, 东方阳, 孙耀中, 等. 2006. 转BADH基因水稻幼苗抗盐的若干生理生化反应[J]. 河北师范大学学报, 20(4): 1-4. |
杨晓红, 陈晓阳, 李守菊, 等. 2009. 盐胁迫对转SacB、BADH基因的美丽胡枝子部分逆境生理指标的影响[J]. 北京林业大学学报, 31(4): 37-41. |
王淑慧. 2006. Nacl胁迫下甘菊甜菜碱的积累及其合成酶基因片断的克隆与转录表达. 北京林业大学硕士学位论文, 17-24. http://d.wanfangdata.com.cn/Thesis/Y958530
|
王一鸣, 王有年, 师光禄, 等. 2007. 外源甜菜碱对水分胁迫下桃树生理响应的影响[J]. 应用生态学报, 18(3): 542-548. |
王关林, 李铁松, 方宏筠, 等. 2004. 番茄转果聚糖合酶基因获得抗寒植株[J]. 中国农业科学, 37(8): 1193-1197. |
张亚冰, 刘崇怀, 潘兴, 等. 2006. 盐胁迫下不同耐盐性葡萄砧木丙二醛和脯氨酸含量的变化[J]. 河南农业科学, (4): 84-86. |
Bray E A. 1993. Molecular responses to water deficit[J]. Plant Physiology, 103: 1035-1040. DOI:10.1104/pp.103.4.1035 |
Konstantinova T, Parvanova D, Atanassov A, et al. 2002. Freezing tolerant tobacco, transformed to accumulate osmoprotectans[J]. Plant Science, 163: 157-164. DOI:10.1016/S0168-9452(02)00090-0 |
Pilon-Smits E A H, Ebakamp M J M, Jenken M J W, et al. 1995. Improved performance of transgenic fructan-accumulating tobacco under drought stress[J]. Plant Physiology, 107: 125-130. DOI:10.1104/pp.107.1.125 |
Sakamoto A, Murata N. 2002. The role of glycine betaine in the protection of plants from stress: clues from transgenic plants[J]. Plant Cell and Environment, 25: 163-171. DOI:10.1046/j.0016-8025.2001.00790.x |
Shirasawa K, Takabe Tomoko, Takabe Tetsuko, et al. 2006. Accumulation of glycinebetaine in rice plants that overexpress choline monooxygenase from spinach and evaluation of their tolerance to abiotic stress[J]. Annals of Botany, 98: 565-571. DOI:10.1093/aob/mcl126 |
Tita R, Sief C M S. 2003. Engineering fructan metabolism in plants[J]. Journal of Plant Physiology, 160(7): 811-820. DOI:10.1078/0176-1617-01029 |
 2010, Vol. 46
2010, Vol. 46

