文章信息
- 王连荣, 杨敏生
- Wang Lianrong, Yang Minsheng
- 转基因杨树中外源Bt基因mRNA及其蛋白运输
- Transportation of the mRNA and Protein of the Foreign Bt Gene in Transgenic Poplar
- 林业科学, 2010, 46(7): 49-54.
- Scientia Silvae Sinicae, 2010, 46(7): 49-54.
-
文章历史
- 收稿日期:2009-07-10
- 修回日期:2009-12-20
-
作者相关文章
2. 河北北方学院园艺系 张家口 075131
2. Horticulture College, Hebei North University Zhangjiakou 075131
自Vaeck等(1987)首次将Bt(Bacillus thuringiensis,苏云金芽孢杆菌)基因转入烟草(Nicotiana tabacum)获得抗天蛾(Sphingidae)的转基因植株以来,Bt基因相继被转化到棉花(Gossypium)、水稻(Oryza sativa)、玉米(Zea mays)等多种植物中,获得的植株均有不同程度的抗虫性。到目前为止,国内外用不同的Bt基因和转化方法获得了70种转Bt基因作物,其中以双子叶植物居多(陆小毛等,2006)。国内外许多学者都对抗虫植物各器官Bt毒蛋白的含量及表达进行了研究(王保民等,2002; 李葱葱等,2006; 朱路青等,2005; 甄志先等,2007; Li et al., 2008; Martins et al., 2008),但关于外源Bt基因表达产物在植物体内如何运输的研究较少。随着转基因抗虫植物的种植,人们开始关注转基因抗虫植物的生态环境安全性(Saegusa,1999; Poppy,2000; Frankenhuyzen et al., 2004; Yang et al., 2006; 高素红等,2005; 陈兴玲等,2007), 其中外源Bt基因在转基因植物中的稳定性是安全性评价的重要内容之一。
杨树(Populus)等树种主要通过无性方式繁殖,转基因植物与非转基因植物嫁接繁殖在生产上应用具有现实可行性。中国是目前唯一实现转基因造林树种商品化的国家,引起国际上广泛关注。由于这些原因,针对转基因树木开展相关研究是十分必要的。本文通过转Bt基因杨树与非转基因杨树间的相互嫁接,来深入研究Bt基因的表达产物在转基因嫁接树木中的表达和运输规律,了解转基因树木生态安全性,减少害虫危害,扩展抗虫植物的利用途径,为转Bt基因树木合理利用、抗性预测和安全评价管理提供科学依据。
1 材料与方法 1.1 材料 1.1.1 植物材料741杨是1974年开始采用有性杂交获得杂种、经过选育获得的白杨杂种无性系,杂交组合为{银白杨(P. alba)×[山杨(P. davidiana)+小叶杨(P. simonii)]}×毛白杨(P. tomentosa),适应范围广,稳定性强,其木材具有优良的物理力学性质; Pb29为河北农业大学和中国科学院微生物研究所共同培育的转Btcry1Ac基因741杨株系,经多年试验证明其对杨扇舟蛾(Clostera anachoreta)、美国白蛾(Hyphantria cunea)等鳞翅目(Lepidoptera)害虫具抗性(杨敏生等,2005; Yang et al., 2003),于2004年获得商品化生产许可。
1.1.2 饲虫材料杨扇舟蛾卵块:2009年4月初采自河北农业大学苗圃,在室内常温常压下孵化。
1.2 方法 1.2.1 试验材料的准备在河北农业大学苗圃进行嫁接处理,2007年3月底嫁接处理为741/ Pb29:以741杨当年生枝条为接穗,1年生Pb29苗木为砧木进行嫁接; 2008年3月底嫁接处理为Pb29/741:以Pb29当年生枝条为接穗,1年生741杨苗木为砧木进行嫁接。于2008年6月,分别采集各嫁接杨树砧木和接穗的嫩叶及嫩枝,同时采集741杨的嫩叶作为阴性对照,Pb29的嫩叶作为阳性对照,用于RNA的提取。于2008年7月,分别采集各嫁接杨树砧木和接穗的韧皮部、木质部、髓、叶片,同时采集741杨叶片作对照,重复3次,用于Bt毒蛋白的测定。于2009年4月,分别采集各嫁接杨树接穗的叶片,同时采集741杨的叶片和Pb29的叶片,在室内喂饲杨扇舟蛾幼虫。
1.2.2 植物材料总RNA的提取采用上海生工生物工程公司的UNIQ-10柱式Trizol总RNA抽提试剂盒来提取植物总RNA。
1.2.3 RNA检测取3 μL RNA样品,点样于1.0%琼脂糖凝胶上(每100 mL凝胶含有5 μL GoldView),在0.5× TBE电泳缓冲液中,5 V·cm-1的电压下电泳40 min,然后在紫外凝胶成像系统中观察所提取RNA的完整性。
1.2.4 反转录合成cDNA第1链利用Fermentas公司的RevertAidTM First Strand cDNA Synthesis Kit试剂盒来合成cDNA第1链。
1.2.5 RT-PCR扩增反应及电泳检测根据Btcry1Ac基因序列设计引物,由北京三博生物工程公司合成,合成引物序列为:5′-CAA CCC GAA CAT CAA CGA AT-3′; 5′-GCC AAT AAG CCT AGT TAA ATC A-3′。RT-PCR反应在Biormetra T1 Thermocycler热循环仪中进行。PCR扩增程序为:94 ℃预变性4 min; 94 ℃ 50 s, 54 ℃ 60 s, 72 ℃ 80 s,共30个循环; 最后72 ℃延伸10 min。PCR反应总体积为20 μL,水12.8 μL,10×PCR缓冲液(Tris-HCl, pH 8.3, 500 mmol·L-1 KCl, 15 mmol·L-1 MgCl2)2.0 μL,dNTP (2.5 mmol·L-1)2.0 μL,引物(10 mmol·L-1) 1.0 μL,模板cDNA 1.0 μL,Taq酶(5 U·μL-1) 0.2 μL。利用1%琼脂糖凝胶电泳检测RT-PCR产物。
1.2.6 Bt毒蛋白的测定称取样品0.3 g,加入2 mL 1 × PBST和少许石英砂,研磨成匀浆转入7 mL离心管中,再用2 mL 1 × PBST冲洗研钵一并转入离心管中,10 000 r·min-1离心10 min,取上清液用于Bt毒蛋白的测定。具体操作步骤按照美国Agdia公司的BtCry1Ab/1Ac ELISA试剂盒(货号为PSP06200/0288)说明书进行。
1.2.7 饲虫试验室温孵化杨扇舟蛾卵块,从中随机挑选刚孵化的幼虫,轻移至清洁干燥的高12.5 cm、直径8.5 cm的罐头瓶中,每瓶15头,6次重复。放入新鲜叶片后,用透气塑料膜扎紧瓶口,每2天换1次新鲜叶片,同时观察记录幼虫的死亡和蜕皮情况。
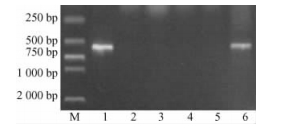
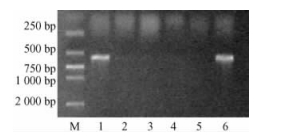
2 结果与分析 2.1 RT-PCR检测分析 2.1.1 741/Pb29嫁接处理中砧木和接穗的嫩枝和嫩叶RT-PCR检测以Pb29为砧木嫁接741杨,成活后砧木和接穗嫩枝和嫩叶的RT-PCR检测结果见图 1、图 2。从图可以看出,砧木嫩枝、嫩叶及阳性对照的RT-PCR产物,在500~750 bp之间均有1条清晰的扩增条带,与用特异引物扩增的预期Bt基因片断大小相吻合,这说明外源Bt基因mRNA能够在砧木嫩枝和嫩叶中稳定转录。但接穗下、中、上部嫩枝, 接穗下、中、上部嫩叶及阴性对照的RT-PCR产物在500~750 bp之间均没有出现扩增条带,即没有检测出外源Bt基因的mRNA。这说明通过嫁接的方式,外源Bt基因的mRNA没有从砧木运输到接穗的嫩枝和嫩叶中。
|
图 1 嫩枝RT-PCR产物电泳检测结果 Figure 1 The electrophoresis test results of RT-PCR product from branches M. DL2000 Marker; 1.砧木嫩枝The branch of stock; 2.接穗下部嫩枝The lower branch of scion; 3.接穗中部嫩枝The middle branch of scion; 4.接穗上部嫩枝The upper branch of scion; 5.阴性对照Negative control; 6.阳性对照Positive control. |
|
图 2 嫩叶RT-PCR产物电泳检测结果 Figure 2 The electrophoresis test results of RT-PCR product from leaves M. DL2000 Marker; 1.砧木嫩叶The leaf of stock; 2.接穗下部嫩叶The lower leaf of scion; 3.接穗中部嫩叶The middle leaf of scion; 4.接穗上部嫩叶The upper leaf of scion; 5.阴性对照Negative control; 6.阳性对照Positive control. |
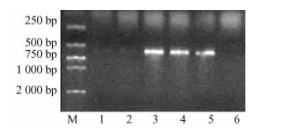
琼脂糖凝胶电泳检测RT-PCR产物的结果见图 3,从图中可以看出,接穗嫩枝、嫩叶以及阳性对照嫩叶的RT-PCR产物,在500~750 bp之间均有1条清晰的特异性扩增条带,与用特异引物扩增的预期Bt基因片断大小相吻合,这说明外源Bt基因mRNA能够在接穗嫩枝和嫩叶中稳定转录。但砧木嫩叶、砧木嫩枝、阴性对照的RT-PCR产物在500~750 bp之间没有出现特异性扩增条带,即没有检测出外源Bt基因的mRNA。这说明通过嫁接的方式,外源Bt基因的mRNA没有从接穗运输到砧木的嫩枝和嫩叶中。
|
图 3 RT-PCR产物电泳检测结果 Figure 3 The electrophoresis test results of RT-PCR product M. DL2000 Marker; 1.砧木嫩枝The branch of stock; 2.砧木嫩叶The leaf of stock; 3.接穗嫩枝The branch of scion; 4.接穗嫩叶The leaf of scion; 5.阳性对照Positive control; 6.阴性对照Negative control. |
从图 4、图 5可以看出,以Pb29为砧木嫁接741杨植株的砧木和接穗各组织中均检测到Bt毒蛋白的存在,且同一部位不同组织中Bt毒蛋白含量明显不同。其中,韧皮部中Bt毒蛋白含量最高,叶片、木质部次之,髓中Bt毒蛋白含量较低。同一组织不同部位中Bt毒蛋白含量也明显不同。砧木韧皮部中Bt毒蛋白含量最高,达到163.34 ng·g-1,接穗下部和中部韧皮部次之,接穗上部最低, 为112.51 ng·g-1。叶片、木质部和髓的不同部位中Bt毒蛋白含量变化趋势与韧皮部基本一致。CK中未检测到Bt毒蛋白的存在。以上分析结果说明,通过嫁接的方式,外源Bt毒蛋白可以从砧木向上运输到接穗各组织,且以韧皮部运输为主。
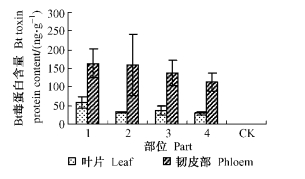
|
图 4 转基因嫁接杨树(741/Pb29)不同部位叶片、韧皮部中Bt毒蛋白含量 Figure 4 Bt toxin protein contents of leaf and phloem of different parts in transgenic grafting poplar (741/Pb29) 1.砧木Stock; 2.接穗下部The lower scion; 3.接穗中部The middle scion; 4.接穗上部The upper scion.下同。The same below. |
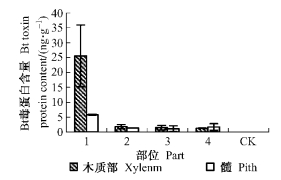
|
图 5 转基因嫁接杨树(741/Pb29)不同部位木质部、髓中Bt毒蛋白含量 Figure 5 Bt toxin protein contents of xylem and pith of different parts in transgenic grafting poplar (741/Pb29) |
由图 6可看出,虽然CK中未检测到Bt毒蛋白的存在,但是以741杨为砧木嫁接Pb29植株的砧木和接穗各组织中均检测到Bt毒蛋白的存在,且各组织中Bt毒蛋白含量均表现为砧木低于接穗。砧木各组织以韧皮部和叶片中Bt毒蛋白含量较高,分别为24.97 ng·g-1和20.71 ng·g-1,木质部和髓中Bt毒蛋白含量较低,分别为1.85 ng·g-1和1.26 ng·g-1。接穗中Bt毒蛋白含量变化趋势与砧木基本一致。以上分析结果说明,通过嫁接的方式,外源Bt毒蛋白可以从接穗向下运输到砧木各组织,且以韧皮部运输为主。
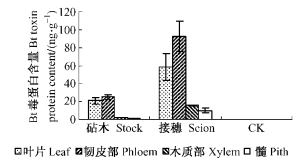
|
图 6 转基因嫁接杨树(Pb29/741)砧木、接穗不同组织中Bt毒蛋白含量 Figure 6 Bt toxin protein contents of different tissues of stock and scion in transgenic grafting poplar (Pb29/741) |
分别用741/Pb29、Pb29/741接穗叶片,CK和Pb29叶片饲养杨扇舟蛾初孵幼虫21天。由图 7可以看出,741/Pb29累积死亡率为21.79%,高于CK的累积死亡率(7.87%),并低于Pb29的累积死亡率(75.28%); Pb29/741累积死亡率与Pb29相比无显著差异。各处理饲养前9天杨扇舟蛾幼虫累计死亡率均呈明显上升趋势,此后趋于平缓。说明低龄幼虫对Bt毒蛋白的抗性较差,而随着幼虫的增长,虫体本身的抗性增强,使得Bt毒蛋白对幼虫的毒害相对降低,因此,杨扇舟蛾幼虫累积死亡率的增长速率减慢。
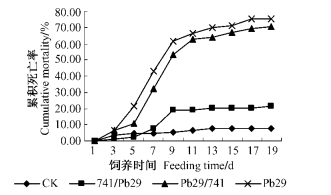
|
图 7 杨扇舟蛾幼虫累积死亡率 Figure 7 The larval cumulative mortality of Clostera anachoreta |
分别用741/Pb29、Pb29/741接穗叶片,CK和Pb29叶片饲养杨扇舟蛾初孵幼虫21天,其发育历期见表 1。由表 1可以看出,与CK相比,741/Pb29, Pb29/741, Pb29对杨扇舟蛾幼虫的发育历期均有明显的抑制作用。饲养杨扇舟蛾幼虫第5天,取食CK的杨扇舟蛾幼虫己有24.66%进入2龄,取食741/Pb29的幼虫只有5.26%进入2龄,其他处理均没有进入2龄的幼虫; 第11天取食CK的幼虫有88.89%进入3龄,取食其他几个处理的叶片的杨扇舟蛾幼虫进入3龄的百分率均低于该水平,741/Pb29为74.60%、Pb29为10.00%,而取食Pb29/741的叶片的幼虫没有进入3龄。第17天取食CK叶片的杨扇舟蛾幼虫有部分进入5龄,而取食其他处理叶片的杨扇舟蛾幼虫均没有进入5龄。第21天取食CK叶片的杨扇舟蛾幼虫有化蛹的现象,而取食其他处理叶片的杨扇舟蛾幼虫均没有此现象。以上数据说明,各个处理都在不同程度上抑制了杨扇舟蛾幼虫的发育进度,使其发育进度明显减慢,从而延长幼虫的发育,导致幼虫的发育不良,严重的导致死亡。
|
|
随着RNA分子在基因表达调控中重要作用的发现,RNA分子如何在植物体内运输移动,如何在目标组织中发挥作用等问题引起越来越多的关注。研究表明RNA可作为—个活跃的信号分子调控基因表达和植物发育(Yoo et al., 2004; Wu et al., 2002; Qi et al., 2006),在植物中,信号分子通过韧皮部进行长距离运输,而在细胞与细胞之间的转运则通过胞间连丝进行,这与病毒在植物体内的运输方式相似。许多证据表明mRNA在植物细胞间的或系统性的运动是一种很普遍的现象(Jorgensen et al., 1998)。比如病毒对植物的侵染,就是mRNA在植物中的一种运动形式,植物病毒为了达到其成功侵染的目的,简单地侵占植物大分子运输的寄主系统,并且用植物病毒自身编码的特定蛋白质去促进病毒mRNA运动(Lazarowitz et al., 1999)。
本试验通过Pb29(转Btcry1Ac基因741杨)与741杨间相互嫁接的方法,来研究外源Bt基因的mRNA在砧木与接穗间运输规律及其可能所起的调控作用。嫁接试验是一种研究根系与地上部物质信息交流的重要手段(Golecki et al., 1998; Crete et al., 2001)。一些韧皮部转录物如马铃薯(Solanum tuberosum)蔗醣转运子mRNA和水稻Thioredoxinh mRNA可以在整株植物中运输(Sasaki et al., 1998)。Ruiz-Medrano等(1999)用南瓜(Cucurbita maxima)/黄瓜(Cucumis sativus)进行异质嫁接,对其中一个mRNA的转录物CmNACP(Cucurbita maxima non-autonomous cell protein)做了详细研究,发现大量转录物从南瓜砧木转移到黄瓜接穗的分生组织中,这是mRNA分子远距离控制基因表达作用的一个实例。也有研究发现遗传转移仅仅发生在叶绿体基因组携带的基因中; 而且基因转移只发生在嫁接部位,不会长距离发生。而位于核基因组的标记基因不发生转移(Stegemann et al., 2009)。本试验RT-PCR检测结果表明,以Pb29为砧木嫁接741杨以后,接穗的嫩枝和嫩叶,以及以741杨为砧木嫁接Pb29以后,砧木的嫩枝和嫩叶中均没有检测到Bt基因mRNA的存在,说明外源Bt基因的mRNA没有在砧木与接穗间进行长距离的运输,在转基因杨树中是稳定表达的,没有通过嫁接的方式进行转移。外源Bt基因的mRNA与植物病毒和植物内源特异RNA的运输方式是不同的,因此,转Bt基因的植物具有一定的生态环境安全性。
转基因植物中表达蛋白在植物体内的转运和代谢已引起了一些科学家的重视。研究报道,在所检测的2个转Bt基因抗虫棉品种的伤流中有外源毒蛋白存在,但是常规棉品种中检测不到它的存在,说明转基因作物的外源蛋白可以通过根系合成并分泌到伤流液中再运输到地上组织中(芮玉奎等,2005)。已有研究发现,转基因植物中的Bt毒蛋白作为一种分泌蛋白可向土壤中扩散(Saxena et al., 1999)。本试验的ELSA检测结果为,各嫁接处理砧木和接穗的叶片、韧皮部、木质部和髓中均检测出Bt毒蛋白的存在,说明外源Bt毒蛋白可以通过嫁接的方式在砧木和接穗间进行运输。且各组织中以韧皮部的含量最高,说明外源Bt毒蛋白主要通过韧皮部进行运输。关于外源Bt毒蛋白如何在植物体内运输,同时需要哪些物质的参与, 需进一步深入的研究。
BtCry1Ac毒蛋白能毒杀鳞翅目昆虫,转基因741杨对不同龄期幼虫的抗性不同,对低龄幼虫的致死作用较强,随着虫龄的升高幼虫本身抗性增强,转基因741杨的致死作用相对降低,幼虫的死亡率降低(杨敏生等,2006)。本试验研究结果表明,以转基因嫁接杨树接穗叶片饲养杨扇舟蛾,同样对低龄幼虫有毒杀作用,而对存活的高龄幼虫则表现为对其生长发育的抑制作用。以741/Pb29接穗叶片饲养的杨扇舟蛾幼虫,其死亡率高于CK,发育进程低于CK,生长受到抑制。进一步证明了Bt毒蛋白通过嫁接的途径从砧木运输到接穗中,因此,Bt毒蛋白在嫁接杨树体内的运输提高了杨树的抗虫性,但其抗虫效果低于Pb29。而以Pb29/741接穗叶片饲养的杨扇舟蛾幼虫死亡率高,发育进程缓慢,与Pb29无显著差异。因此,通过转基因接穗嫁接到未转基因的砧木上来繁殖苗木,将可能提高植物的抗虫性,为生产提供了一条新的抗虫途径。
陈兴玲, 胡建军, 赵楠木. 2007. 转基因植物基因漂移研究[J]. 安徽农业科学, 35(10): 2851-2852. DOI:10.3969/j.issn.0517-6611.2007.10.013 |
高素红, 毛富玲, 王江柱, 等. 2005. 转双抗虫基因741杨节肢动物群落生态安全性评价——转基因741杨对节肢动物群落空间结构的影响[J]. 河北农业大学学报, 28(3): 77-80. |
李葱葱, 刘娜, 康岭生, 等. 2006. 转基因抗虫玉米Bt蛋白表达量的研究[J]. 玉米科学, 14(3): 40-41. |
陆小毛, 朱路青, 曹越平. 2006. 转Bt基因作物及其安全性研究[J]. 上海交通大学学报:农业科学版, 24(2): 214-220. |
芮玉奎, 朱本忠, 罗云波. 2005. 转Bt基因抗虫棉(Gossyposium)伤流中Bt毒蛋白的运输[J]. 植物学通报, 22(3): 320-324. |
王保民, 李召虎, 李斌, 等. 2002. 转Bt抗虫棉各器官毒蛋白的含量及表达[J]. 农业生物技术学报, 10(3): 215-219. |
杨敏生, 高宝嘉, 王进茂, 等. 2005. 转双抗虫基因741杨基本特性分析[J]. 林业科学, 41(1): 91-97. DOI:10.11707/j.1001-7488.20050116 |
杨敏生, 李志兰, 王颖, 等. 2006. 双抗虫基因对三倍体毛白杨的转化和抗虫性表达[J]. 林业科学, 42(9): 61-68. |
甄志先, 李静, 梁海永, 等. 2007. 转Btcry3A基因杨树毒蛋白表达及对桑天牛抗性的研究[J]. 蚕业科学, 33(2): 538-542. |
朱路青, 曹越平. 2005. 转Bt基因大豆植株中Bt毒蛋白的表达[J]. 上海交通大学学报:农业科学版, 23(3): 234-238. |
Crete P, Leuenberger S, Iglesias V A, et al. 2001. Graft transmission of induced and spontaneous post-transcriptional silencing of chitinase genes[J]. The Plant Journal, 28(5): 493-501. DOI:10.1046/j.1365-313X.2001.01171.x |
Golecki B, Schulz A, Carstens-Behrens U, et al. 1998. Evidence for graft transmission of strucrural phloem proteins or their precursors in heterografts of Cucurbitaceae[J]. Planta, 206: 630-640. DOI:10.1007/s004250050441 |
Frankenhuyzen K, Beardmore T. 2004. Current status and environmental impact of transgenic forest trees[J]. Canadina Journal of Forest Research, 34(6): 1163-1180. DOI:10.1139/x04-024 |
Jorgensen R A, Atkinson R G, Forster R L, et al. 1998. An RNA-based information superhighway in plants[J]. Science, 279(5356): 1486-1487. DOI:10.1126/science.279.5356.1486 |
Lazarowitz S G, Beachy R N. 1999. Viral movement proteins as probes for intracellular and intercellular trafficking in plants[J]. Plant Cell, 11(4): 535-548. DOI:10.1105/tpc.11.4.535 |
Li Xiangqian, Tan A, Voegtline M, et al. 2008. Expression of Cry5B protein from Bacillus thuringiensis in plant roots confers resistance to root-knot nematode[J]. Biological Control, 47: 97-102. DOI:10.1016/j.biocontrol.2008.06.007 |
Martins C M, Beyene G, Hofs J L, et al. 2008. Effect of water-deficit stress on cotton plants expressing the Bacillus thuringiensis toxin[J]. Annals of Apllied Biology, 152(2): 255-262. DOI:10.1111/j.1744-7348.2007.00214.x |
Poppy G. 2000. GM crops: environmental risks and non-target effects[J]. Trends in Plant Science, 5(1): 4-6. DOI:10.1016/S1360-1385(99)01514-9 |
Qi Liwang, Li Xinmin, Zhang Shougong. 2006. Genetic regulation by non-coding RNAs[J]. Science in China: Series C Life Science, 49(3): 201-217. DOI:10.1007/s11427-006-0201-8 |
Ruiz-Medrano R, Xoconostle-Cazares B, Lucas W J. 1999. Phloem long-distance transport of CmNACP mRNA: implications for supracellular regulation in plants[J]. Development, 126: 4405-4419. |
Saegusa A. 1999. Japan tightens rules on GM crops to protect the environment[J]. Nature, 399(6738): 719. |
Sasaki T, Chino M, Hayashi H, et al. 1998. Detection of several mRNA species in rice phloem sap[J]. Plant Cell Physiol, 39(8): 895-897. DOI:10.1093/oxfordjournals.pcp.a029451 |
Saxena D, Flores S, Stotzky G. 1999. Insecticidal toxin in root exudates from Bt corn[J]. Nature, 402: 480. |
Stegemann S, Bock R. 2009. Exchange of genetic material between cells in plant tissue grafts. Science 1 May: DOI: 10.1126/science.1170397.
|
Vaeck M, Revnaerts A, Hofte A, et al. 1987. Transgenic plants protected from insect attack[J]. Nature, 328(6125): 33-37. DOI:10.1038/328033a0 |
Wu Xuelin, Weigelel D, Wigge P A. 2002. Signaling in plants by intercellular RNA and protein movement[J]. Genes & Development, 16: 151-158. |
Yang Minsheng, Liang Haiyong, Gao Baojia, et al. 2003. Insecticidal activity and transgene expression stability of transgenic hybrid poplar clone 741 carrying two insect-resistant genes[J]. Silvae Genetica, 52(6): 197-201. |
Yang Minsheng, Mi D, Ewald D, et al. 2006. Survival and escape of Agrobacterium tumefaciens in triploid hybrid lines of Chinese white poplar transformed with two insect-resistant genes[J]. Acta Ecologica Sinica, 26(11): 3555-3561. DOI:10.1016/S1872-2032(06)60055-3 |
Yoo B C, Kragler F, Varkonyi-Gasic E, et al. 2004. A systemic small RNA signaling system in plants[J]. The Plant Cell, 16: 1979-2000. DOI:10.1105/tpc.104.023614 |
 2010, Vol. 46
2010, Vol. 46