文章信息
- 张春雨, 王德胜, 魏彦波, 赵秀海, 贾玉珍, 周海成
- Zhang Chunyu, Wang Desheng, Wei Yanbo, Zhao Xiuhai, Jia Yuzhen, Zhou Haicheng
- 山杨、水曲柳种群密度与种群性比的关系
- Density-Dependent Sex Ratios for Dioecious Tree Species Populus davidiana and Fraxinus mandshurica
- 林业科学, 2010, 46(7): 16-21.
- Scientia Silvae Sinicae, 2010, 46(7): 16-21.
-
文章历史
- 收稿日期:2009-03-16
- 修回日期:2010-05-25
-
作者相关文章
2. 吉林省天然林保护工程管理中心 吉林 133613;
3. 吉林省长白山国家级自然保护区管理局 吉林 133613
2. Management Center of Natural Forest Protection Project in Jilin Province Jilin 133613;
3. Administration of Changbai Mountain National Nature Reserve in Jilin Province Jilin 133613
雌雄异株物种占被子植物的6%,在被子植物的多个科属中,大约40%的科、7%的属中至少包含1种雌雄异株植物(Bawa,1980;Renner et al., 1995)。国外学者在雌雄异株植物与性别相关的进化生态学方面进行了大量研究,取得了丰硕成果。Fisher于1930年首次提出雌雄异株植物的性别比率(性比)问题:当雌、雄植株对后代的投资,即繁殖代价相同时,性比应该保持均衡(即不偏离1:1);当某个性别具有更高的丰富度时,选择作用趋向于产生更多的低丰富度性别个体,促使性比重新回归均衡状态; 当性别由环境条件决定时,虽然选择作用仍趋向保持均衡性比,但环境状况的变异将促使种群性比格局发生相应改变(Fisher,1930)。
显著偏雌性(Opler et al., 1978; Alliende et al., 1989)及不显著偏离1:1(Morellato,2004)的性比格局虽已被报道,但绝大多数研究显示性比通常显著偏雄性(Sakai,1990; Vasiliauskas et al., 1992; Thomas et al., 1993; Matsui,1995; Nicotra,1998; Delph,1990; Pickering,2000; Gauquelin et al., 2002; Pickering et al., 2002)。雌雄异株植物种子性比通常接近1:1(de Jong et al., 2002),但繁殖植株表现出偏雄性的种群结构,可能与雌树需要支付更高的繁殖代价有关(Delph,1990; Lloyd et al., 1977; Willson,1983; Dawson et al., 1993; Cipollini et al., 1994; Bañuelos et al., 2004)。雌树在结实过程中,分配更多的生物量用于繁殖过程(Agren,1988; Delph,1999),这种高生殖投入以无性系构件的枯落和死亡为代价。一些植物的雌树甚至要通过降低随后的生长进行滞后性投资(Nicotra,1999)。随着树木种群密度的变化,树木的繁殖力及死亡率通常表现出密度依赖性。雌雄异株植物不同性别个体对邻体竞争反应敏感性不同(Nanami et al., 2005),这种敏感性差异导致不同性别个体产生不同的繁殖、死亡速率,进而影响种群性比格局。除自身生物学特性外,外界环境状况也通过调控雌雄植株繁殖、生长及死亡过程,影响着雌雄异株植物的种群性比格局。本研究以雌雄异株树种山杨(Populus davidiana)、水曲柳(Fraxinus mandshurica)为例,检验种群性比与种群密度及林分密度之间的关系。由于性别的判断是通过花、种子的观察而获得,因此本研究将树种成熟植株的性比定义为种群性比。为了便于描述和理解,将单位面积上某个树种DBH>4 cm植株数定义为种群密度; 单位面积上某个树种所有繁殖植株数(即,雌树与雄树株数和)定义为该种群繁殖植株密度; 单位面积上所有树种DBH>4 cm植株数定义为林分密度。
1 研究区概况研究区位于吉林省白河林业局光明林场次生林区,属于受季风影响的温带大陆性山地气候,年平均气温3.6 ℃,最热月8月份平均气温20.5 ℃,最冷月1月份平均气温-16.5 ℃,极端最高气温32.3 ℃,极端最低气温-37.6 ℃。年平均降水量770 mm。土壤为山地暗棕色森林土,土层厚度20~100 cm。该区原始植被为阔叶红松林, 经采伐破坏后形成次生林。次生杨桦林样地海拔899 m, 先锋树种山杨、白桦(Betula platyphylla)、水曲柳与紫椴(Tilia amurensis)等顶级树种在主林层占据优势,并伴有红松(Pinus koraiensis)、蒙古栎(Quercus mongolica)、色木槭(Acer mono)和春榆(Ulmus japonica)等树种。次生针阔混交林样地(128°07.988′E,42°20.907′N)海拔748 m,乔木层优势种有红松、臭冷杉(Abies nephrolepis)、紫椴、水曲柳、蒙古栎、色木槭、白桦、山杨和青杨(Populus ussuriensis)等树种。
2 研究方法 2.1 样地设置与调查2005年在次生杨桦林和次生针阔混交林内各建立1块5.2 hm2(200 m×260 m)固定样地。将每个样地划分为2 080个5 m×5 m连续样方,记录每个样方内所有DBH>1 cm的乔木个体种名、胸径、树高、冠幅(东西冠幅长、南北冠幅长)和枝下高。测量植株在整个5.2 hm2固定样地内的位置坐标。
于2006—2008年的4—10月调查样地内雌雄异株树种山杨和水曲柳的性别,利用双筒望远镜观察繁殖器官(花、种子)来判断成熟植株的性别。由于山杨和水曲柳不存在性别变异情况,本研究以观察期间2006—2008年累计性别表达数据为基础。根据繁殖情况将所有DBH>4 cm个体划分为:雌株、雄株以及由于观察期间缺少繁殖器官而暂时无法判断性别的未繁殖植株。
2.2 构建性比-取样面积、性比-株数密度关系采用随机区块抽样技术(张春雨等,2008)建立不同取样面积下的性比统计量:在给定研究区域(200 m×260 m)内产生一系列随机点,以随机点为中心生成边长为t的正方形区块。删除跨越研究区边界的正方形区块,以确保其完全位于研究区域内。根据研究需要,最后在200 m×260 m研究区域内随机产生10 000个边长为t(5,6, …, 200 m)的正方形区块。统计落在每个正方形区块内的雌、雄植株数,计算10 000次随机抽样值的均值,作为当前边长为t的取样面积内雌、雄植株数。将随机区块边长换算为取样区域面积,建立性比与取样面积关系。
2.3 检验性比密度依赖性采用具有二项式分布族的一般线性回归模型(GLM with binomial errors)检验雌雄异株树种种群性比的密度依赖性。将雌株和雄株株数作为响应变量,分别将繁殖植株密度、种群密度及林分密度作为自变量,构建回归模型。本研究采用2个常用的雌雄株性别配比指标:性比为雄株株数比雌株株数; 雄株比例为雄株株数占繁殖植株数(雄株+雌株)的比例(Hardy,2002)。
本研究统计分析及制图均通过R软件实现。
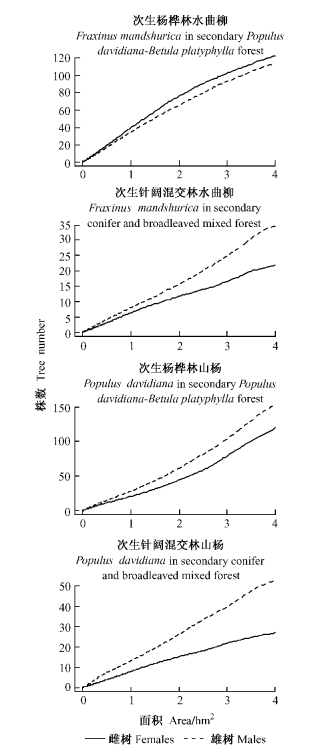
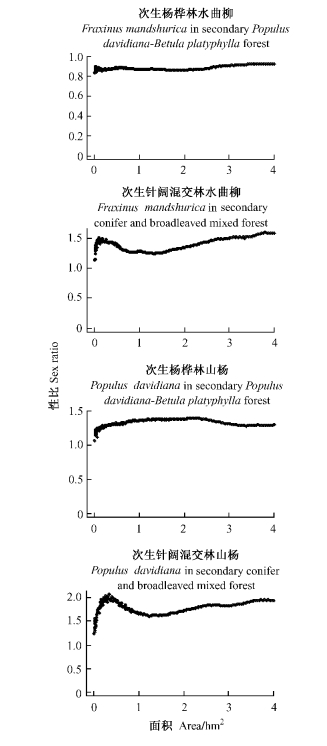
3 结果与分析 3.1 雌雄植株数-取样面积关系山杨、水曲柳的雌雄植株数随着取样面积的增加而增大。次生杨桦林中,水曲柳雌株多于雄株,性比小于1;而山杨雄株多于雌株,性比大于1。次生针阔混交林中,山杨和水曲柳的雄株均多于雌株,性比大于1(图 1)。雌雄异株植物种群性比受取样面积大小影响。次生杨桦林和次生针阔混交林样地中,水曲柳在0~4 hm2取样面积内种群性比均不显著偏离1:1(卡方检验,P>0.05)。当取样面积较大时(次生杨桦林样地>3.53 hm2; 次生针阔混交林样地>2.31 hm2),山杨种群性比显著偏雄(卡方检验,P<0.05)。当取样面积较小时,由于雌、雄个体出现的随机性较大,性比随取样面积波动较大。当取样面积达到1 hm2后,种群性比基本趋于稳定(图 2)。
|
图 1 雌雄异株树种繁殖植株数-取样面积关系 Figure 1 Relationships between numbers of individuals and sample areas for two dioecious tree species |
|
图 2 2个雌雄异株树种种群性比-取样面积关系 Figure 2 Relationships between sex ratios and sample areas for two dioecious species |
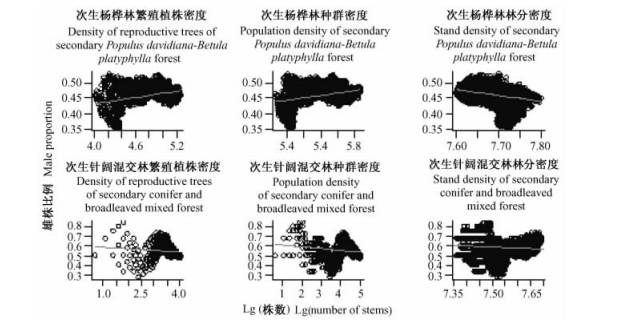
根据种群性比与取样面积关系,随机构建10 000个面积为1 hm2(边长为100 m)的正方形取样区,统计落到取样区内的雌株、雄株株数。并以此为基础,建立种群性比与繁殖植株密度、种群密度及林分密度之间的关系。利用GLM模型检验种群性比与繁殖植株密度、种群密度及林分密度之间的相关性(表 1)。研究结果表明,次生杨桦林及次生针阔混交林样地中,山杨和水曲柳种群性比与繁殖植株密度、种群密度及林分密度均显著相关(P<0.001),即种群性比具有显著的密度依赖性。
|
|
种群性比与种群密度和林分密度相关分析显示(表 1; 图 3):次生杨桦林样地中,水曲柳雄株比例与繁殖植株密度及种群密度呈显著正相关,与林分密度呈显著负相关; 次生针阔混交林样地中,水曲柳雄株比例与繁殖植株密度、种群密度和林分密度呈显著负相关。
|
图 3 水曲柳雄株比例与株数密度间的关系 Figure 3 Relationships between male proportions and stem density for F. mandshurica. |
次生杨桦林样地中,山杨雄株比例与繁殖植株密度、种群密度及林分密度均呈显著负相关; 次生针阔混交林样地中,山杨雄株比例与繁殖植株密度和种群密度呈显著正相关,与林分密度呈显著负相关(图 4)。

|
图 4 山杨雄株比例与林木株数密度间的关系 Figure 4 Relationships between male proportions and stem density for P. davidiana |
由于雌雄异株树种性比格局与取样面积密切相关,进行性比研究时应考虑取样面积的影响。理论上取样面积越大,研究结论越可靠。但受野外试验条件的限制,大的取样面积意味着较高的人力、物力和财力支出。在实践中,应从研究目的及研究对象实际情况出发,科学合理地确定取样面积,保证取样面积满足试验要求即可。对于山杨、水曲柳种群而言,1 hm2取样面积基本能够满足要求。
山杨、水曲柳种群的雄株比例与林分密度显著负相关,因此林分密度对种群性比具有显著的密度制约作用。发育环境的物理性质(Lance et al., 2000)及气候变异(Bulmer et al., 1982)都会导致种群后代性比发生改变。Ortiz等(2002)发现雌雄异株植物的种群性比受海拔影响。Onyekwelu等(1979)和Marques等(2002)认为偏雄性种群性比与较高的局部林分密度有关。高林分密度导致邻体竞争作用增大,产生强大的环境压力。由于雌株的高繁殖代价导致其对相邻个体的存在更加敏感,在较强的邻体竞争作用下,雌株的死亡率将升高。但也有学者对此持不同观点,如Vasiliauskas等(1992)对3 500株雌雄异株裸子植物的研究结果显示性比偏雄性,但认为偏雄性性比与林分密度或局部竞争强度无关。
不同林型中山杨和水曲柳种群性比对繁殖植株密度和种群密度反应不同。次生杨桦林样地中,山杨种群性比与繁殖植株密度和种群密度显著负相关,水曲柳种群性比则与繁殖植株密度和种群密度显著正相关。次生针阔混交林样地中,山杨、水曲柳种群性比对繁殖植株密度和种群密度的响应关系,与次生杨桦林样地中刚好相反。先锋种山杨为次生杨桦林样地内主要树种,在林分内占据优势地位,演替种型属于稳定种; 该林分中水曲柳属于进展种,已进入主林层,并占据一定优势。次生针阔混交林样地中,先锋种山杨为衰退种,林下更新困难,在林分内密度相对较低; 而水曲柳则在主林层占据绝对优势,演替种型为稳定种。因此,种群性比对种群密度的反馈方式与该树种的演替种型相关:稳定种,随种群密度增加,雌株在种群内的比例增大,有利于种群的继续繁衍和维持; 进展种或衰退种,随种群密度增加,雌株在种群内的比例减小,一定程度上促进了进展种群向稳定种群转变,或加速了衰退种群退出群落的进程。因此,在森林经营实践中,可以通过调节种群密度或林分密度来改变种群性比格局,使种群性比达到最佳状态,促进种群的健康发展。
张春雨, 赵秀海. 2008. 随机区块法在空间点格局分析中的应用[J]. 生态学报, 28: 3108-3115. |
Agren J. 1988. Sexual differences in biomass and nutrient allocation in the diocecious Rubus chamaemorus[J]. Ecology, 69: 962-973. DOI:10.2307/1941251 |
Alliende M C, Harper J L. 1989. Demographic studies of a dioecious tree. Ⅰ. Colonization, sex and age structure of a population of Salix cinerea[J]. Journal of Ecology, 77: 1029-1047. DOI:10.2307/2260821 |
Bañuelos M J, Obeso J R. 2004. Resource allocation in the dioecious shrub Rhamnus alpinus: the hidden costs of reproduction[J]. Evolu-tionary Ecology Research, 6: 397-413. |
Bawa K S. 1980. Evolution of dioecy in flowering plants[J]. Annual Review of Ecology and Systematics, 11: 15-39. DOI:10.1146/annurev.es.11.110180.000311 |
Bulmer M G, Bull J J. 1982. Models of polygenic sex determination and sex ratio evolution[J]. Evolution, 36: 326-332. DOI:10.1111/evo.1982.36.issue-2 |
Cipollini M L, Whigham D F. 1994. Sexual dimorphism and cost of reproduction in the dioecious shrub Lindera benzoin (Lauraceae)[J]. American Midland Naturalist, 115: 397-406. |
Dawson T E, Ehleringer J R. 1993. Gender-specific physiology, carbon isotope discrimination, and habitat distribution in bolder, Acer negundo[J]. Ecology, 74: 798-815. DOI:10.2307/1940807 |
de Jong T J, Klinkhamer P G L. 2002. Sex ratios in dioecious plants//Hardy I C W. Sex ratios: concepts and research methods. New York: Cambridge University Press, 349-366. http://dx.doi.org/10.1017/CBO9780511542053.018
|
Delph L F. 1990. Sex-differential resource allocation patterns in the subdioecious shrub, Hebe Subalpina[J]. Ecology, 71: 1342-1351. DOI:10.2307/1938271 |
Delph L F. 1999. Sexual dimorphism in life history//Geber M A, Dawson T E, Delph L F. Gender and sexual dimorphism in flowering plants. Berlin: Springer-Verlag, 149-174. http://link.springer.com/10.1007/978-3-662-03908-3_6
|
Fisher R A. 1930. The genetical theory of natural selection[M]. Oxford: Oxford University Press.
|
Gauquelin T, Bertaudière-Montès V, Badri W, et al. 2002. Sex ratio and sexual dimorphism in mountain dioecious thuriferous juniper (Juniperus thurifera L., Cupressaceae)[J]. Botanical Journal of the Linnean Society, 138: 237-244. DOI:10.1046/j.1095-8339.2002.138002237.x |
Hardy I C W. 2002. Sex ratios: concepts and research methods[M]. New York: Cambridge University Press.
|
Lance V A, Elsey R M, Lang J W. 2000. Sex ratios of American alligators (Crocodylidae): male or female biased[J]. Journal of Zoology, 252: 71-78. DOI:10.1111/jzo.2000.252.issue-1 |
Lloyd D, Webb C J. 1977. Secondary sex characteristics in plants[J]. Botanical Review, 43: 177-216. DOI:10.1007/BF02860717 |
Marques A R, Fernandes G W, Reis I A, et al. 2002. Distribution of adult male and female Baccharis concinna (Asteraceae) in the rupestrian fields of Serra do Cipó, Brazil[J]. Plant Biology, 4: 94-103. DOI:10.1055/s-2002-20441 |
Matsui K. 1995. Sex expression, sex change and fruiting habit in an Acer rufinerve population[J]. Ecological Research, 10: 65-74. DOI:10.1007/BF02347656 |
Morellato L P C. 2004. Phenology, sex ratio, and spatial distribution among dioecious species of Trichilia (Meliaceae)[J]. Plant Biology, 6: 491-497. DOI:10.1055/s-2004-817910 |
Nanami S, Kawaguchi H, Yamakura T. 2005. Sex ratio and gender-dependent neighboring effects in Podocarpus nagi, a dioecious tree[J]. Plant Ecology, 177: 209-222. DOI:10.1007/s11258-005-2210-2 |
Nicotra A B. 1998. Sex ratio variation and spatial distribution of Siparuna grandiflora, a tropical dioecious shrub[J]. Oecologia, 115: 102-113. DOI:10.1007/s004420050496 |
Nicotra A B. 1999. Sexually dimorphic growth in the dioecious tropical shrub, Siparuna grandiflora[J]. Functional Ecology, 13: 322-331. DOI:10.1046/j.1365-2435.1999.00326.x |
Onyekwelu S S, Harper J L. 1979. Sex ratio and niche differentiation in spinach (Spinacia oleracea L.)[J]. Nature, 282: 609-611. DOI:10.1038/282609a0 |
Opler P A, Bawa K S. 1978. Sex ratio in tropical forest trees[J]. Evolution, 32: 812-821. DOI:10.1111/evo.1978.32.issue-4 |
Ortiz P L, Arista M, Talavera S. 2002. Sex ratio and reproductive effort in the dioecious Juniperus communis subsp. Alpine (Suter) Čelak. (Cupressaceae) along an altitudinal gradient[J]. Annals of Botany, 89: 205-211. DOI:10.1093/aob/mcf028 |
Pickering C M, Hill W. 2002. Reproductive ecology and the effect of altitude on sex ratios in the dioecious herb Aciphylla simplicifolia (Apiaceae)[J]. Australian Journal of Botany, 50: 1-12. DOI:10.1071/BT01052 |
Pickering C M. 2000. Sex-specific differences in floral display and resource allocation in Australian alpine dioecious Aciphylla glacialis (Apiaceae)[J]. Australian Journal of Botany, 48: 81-91. DOI:10.1071/BT97121 |
Renner S S, Ricklefs R E. 1995. Dioecy and its correlates in the flowering plants[J]. American Journal of Botany, 82: 596-606. DOI:10.2307/2445418 |
Sakai A K. 1990. Sex ratios of red maple (Acer rubrum) populations in northern lower Michigan[J]. Ecology, 71: 571-580. DOI:10.2307/1940310 |
Thomas S C, LaFrankie J V. 1993. Sex, size, and interyear variation in flowering among dioecious trees of the Malayan rain forest[J]. Ecology, 74: 1529-1537. DOI:10.2307/1940080 |
Vasiliauskas S A, Aarssen L W. 1992. Sex ratio and neighbor effects in monospecific stands of Juniperus virginiana[J]. Ecology, 73: 622-632. DOI:10.2307/1940768 |
Willson M F. 1983. Plant reproductive ecology[M]. New York: Wiley Interscience.
|
 2010, Vol. 46
2010, Vol. 46