文章信息
- 牟长城, 程伟, 孙晓新, 吴云霞
- Mu Changcheng, Cheng Wei, Sun Xiaoxin, Wu Yunxia
- 小兴安岭落叶松沼泽林土壤CO2,N2O和CH4的排放规律
- Seasonal Variation of Emission Fluxes of CO2, N2O and CH4 from Larix gemlinii Swamps Soils in Xiaoxing'An Mountains of China
- 林业科学, 2010, 46(7): 7-15.
- Scientia Silvae Sinicae, 2010, 46(7): 7-15.
-
文章历史
- 收稿日期:2009-03-31
- 修回日期:2009-06-30
-
作者相关文章
目前全球规模的气候变暖问题已引起了广泛关注(王德宣等,2002)。导致全球变暖的主要因素是大气中温室气体含量的迅速增加(李国琛,2005)。CH4和N2O是大气中重要的温室气体,其分子增温潜势分别高出CO2 21和206倍(IPCC,2007)。目前,大气中CH4和N2O的浓度分别为1.72和0.312 μmol·mol-1,并以每年0.6%和0.2%~0.3%的速率增长(Simpson et al., 1999),CO2的浓度从工业革命前的280 μmol·mol-1增加到现在的355 μmol·mol-1,并以每年0.4%的速率增长(Castro et al., 1995)。因此,有关温室气体源汇关系问题备受关注。
湿地排放的N2O是目前全球N2O通量的一个重要部分(Letey et al., 1981)。湿地(包括天然湿地和水稻田)CH4的排放约占全球CH4源的40%~50% (Whiting et al., 1993),是大气CH4的主要生物排放源。Khalil(1999)估计每年自然和人为排放进入大气的甲烷量为515 Tg,其中人为来源占71.88%,自然来源占28.12%,而湿地排放占自然排放的75.96%,处于绝对主导地位,在全球甲烷排放总量中也占到20%以上(Ding et al., 2004)。湿地生态系统CH4和N2O排放已成为科学研究的热点(杨继松等,2006)。
温度和水文条件是影响湿地温室气体排放的重要环境因素。有研究认为温度是影响CO2排放的主要因素(郝庆菊等,2004),同时水位对CO2排放也有影响,因为水位决定了湿地土壤的厌氧度及氧化带的深度(Smith et al., 1998)。在加拿大的研究表明:当水位上升接近泥炭层的时候,CH4排放通量就会增加(Holly et al., 2002),同时在安大略的研究说明CH4排放通量波动是由于水分满足产甲烷菌的需求后,土壤温度改变引起了CH4排放量的改变(Edwards et al., 2001)。研究认为温度是影响N2O排放的主要因素(郝庆菊等,2004),但是土壤的水分状况不仅影响土壤N2O的生成量,也极大地影响了N2O向大气的传输速率(刘景双等,2003)。对南极洲北部苔原湿地研究发现:在土壤中N2O扩散系数随着水位的增加而减少,相应的O2可利用率也减少,这样导致了N2O排放量降低(Renbin et al., 2008)。
目前我国有关天然湿地温室气体排放的研究主要集中在若尔盖和青藏高原的草丛湿地(王德宣等,2003;刘景双等,2003)、辽河三角洲芦苇湿地(黄国宏等,2001)、三江平原的草丛湿地(Song et al., 2003;杨继松等,2004;王毅勇等,2005)和沿海红树林湿地(Lu et al., 1998;叶勇等,2000)。东北地区是我国天然湿地主要分布区之一,天然湿地面积占全国天然湿地总面积的30%,其中,东北林区的大、小兴安岭和长白山是我国森林沼泽集中分布区(郎惠卿,1999),其天然湿地面积为450万hm2,占东北地区天然湿地面积1 017万hm2的44%(刘兴土等,2007),目前对其温室气体排放通量及其源/汇关系尚不清楚,这无疑会影响到我国天然湿地温室气体排放总量估算的客观性与准确性。
本研究选择小兴安岭兴安落叶松(Larix gmelinii)-油桦(Betula ovalifolia)-修氏苔草(Garex schmidtii)沼泽林、兴安落叶松-油桦-笃斯越橘(Vaccinium uliginosum)-藓类沼泽林和兴安落叶松-狭叶杜香(Ledum palustre var. anjustum)-中位泥炭藓(Sphagnum magellanicum)沼泽林,采用静态箱-气相色谱法,于2007年6—10月,通过野外原位同步观测3种天然针叶沼泽林生长季节土壤CO2,CH4和N2O排放通量及其环境因子(大气温度、土壤温度、水位等)的季节变化过程,揭示东北森林沼泽温室气体排放通量的季节变化规律,探讨影响森林沼泽温室气体排放的主控因子,并估算其生长季节排放总量,为客观估算我国温室气体排放总量和制定温室气体减排对策提供科学依据。
1 研究区概况研究在黑龙江省伊春地区的永青林场(128°30′36″—128°45′00″E,48°03′53″—48°17′11″N)进行。该区海拔260~500 m,平均海拔355 m。属于温带大陆湿润季风气候,年平均气温约0.4 ℃,≥10 ℃年积温2 000~2 500 ℃。年平均降水量630 mm,全年有2个降水高峰期,分别为7—8月份降雨期和冬季降雪期,高峰期降水占全年降雨量的70%。地带性土壤是暗棕壤,占所有土壤类型的71%,还有草甸土、沼泽土和泥炭土,草甸土和沼泽土占27%,泥炭土占2%。地带性植被为红松(Pinus koraiensis)阔叶混交林,目前大部分已退化为次生林和人工林,森林覆盖率为74.8%。研究区尚有沼泽湿地4 302 hm2,占林业用地的25.6%,且湿地类型丰富,包括森林沼泽、灌丛沼泽、草丛沼泽、藓类沼泽和泥炭藓沼泽等多种湿地类型,以森林沼泽为主要类型,且以东北林区广泛分布的3种典型针叶沼泽林为主,即:富营养型的兴安落叶松-油桦-修氏苔草沼泽林、中营养型的兴安落叶松-油桦-笃斯越橘-藓类沼泽林和贫营养型的兴安落叶松-狭叶杜香-中位泥炭藓沼泽林。
2 研究方法采用静态暗箱-气相色谱法,野外原位同步测定3种典型针叶沼泽林(兴安落叶松-油桦-修氏苔草沼泽林、兴安落叶松-油桦-笃斯越橘-藓类沼泽林和兴安落叶松-狭叶杜香-中位泥炭藓沼泽林)土壤CO2, CH4和N2O的排放通量。每个针叶沼泽林类型设置3个随机重复取样点,总计设置9个取样暗箱。采样箱由不锈钢制成,体积50 cm×50 cm×50 cm。为了保证采集气体的效果,把暗箱埋入由不锈钢制成的凹槽中,采集气体的时候往凹槽里灌水,防止气体外漏。整个生长季底座放在试验地不动以保证对底座内部植被和土壤的干扰最小。箱内顶部安有直径10 cm的小风扇,取样时风扇保持转动避免箱内出现气体浓度差,风扇用12V蓄电池供电。箱顶部中心开有直径1 cm的小孔,用橡胶塞塞紧,取样时用注射器通过橡胶塞取气体。箱侧面开2个小孔,用于温度计探头和风扇电线通过,分别用橡胶塞和硅胶密封。观测时间为2007年6月4日到2007年10月25日(整个生长季节),观测频次为每月上、中、下旬各观测1次,共计观测15次;具体取样时间为9:00—12:00,并在扣箱后的0,10,20和30 min各取样1次;采集器材为60 mL医用一次性注射器,抽取气体的容积为60 mL,样品用注射器取出后转移进500 mL气体采集袋内,为防止转移过程中漏气,注射器和针头间连有三通阀。样品在采样袋内保存,带回试验室在1周内用HP5890Ⅱ气相色谱仪离子火焰化检测器(FID)和电子捕获检测器(ECD)同步分析CO2,CH4和N2O。CO2和CH4用FID检测,N2O用ECD检测。并计算气体排放通量。气体采集用JM624数字温度计原位人工同步测定气温和0,5,10,15,20,30和40 cm土深处土壤温度,同时挖测水井用卷尺人工记录观测点水位的变化。
气体的通量表示单位时间单位面积观测箱内该气体浓度的变化,一般正值表示气体从土壤排放到大气,负值表示气体从大气流向土壤或土壤吸收消耗大气中的该气体。
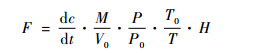
|
式中:F为被测3种温室气体通量(mg·m-2h-1);dc/dt为采样时气体浓度随时间变化的直线斜率(c为t时刻箱内被测气体的体积混合比浓度,t是时间);M为被测气体的摩尔质量;P为采样点的大气压;V0,P0和T0分别为标准状态下的气体摩尔体积、标准大气压和绝对温度;H为采样箱的高度(cm)。
用Microsoft office excel 2003和Spss14.0统计分析软件包对数据进行分析处理。
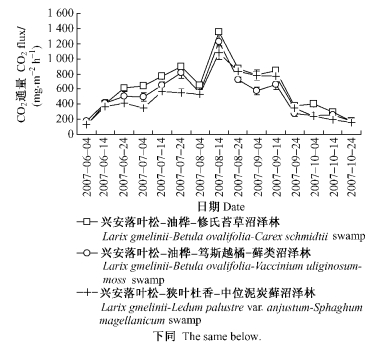
3 结果与分析 3.1 土壤CO2, CH4和N2O排放通量季节变化规律由图 1得到,小兴安岭沿水分环境梯度依次分布的兴安落叶松-油桦-修氏苔草沼泽林、兴安落叶松-油桦-笃斯越橘-藓类沼泽林和兴安落叶松-狭叶杜香-中位泥炭藓沼泽林土壤CO2排放通量季节变化规律基本一致,且排放通量相近。3种沼泽林生长季节土壤CO2排放通量依次为119.25~1 350.02,170.37~1 222.95和126.11~1 080.50 mg·m-2h-1,平均值依次为611.39,514.85和485.95 mg·m-2h-1,呈现出沿水位逐渐升高而递减的空间变化趋势(前者较后2者高15.1%和20.5%),但3者CO2平均排放通量未达显著差异水平(P=0.162)。在春季(6月上旬至7月上旬)、夏季(7月中旬至9月中旬)、秋季(9月下旬至10月下旬)3者土壤CO2平均排放通量依次为:442.48,880.14和309.97 mg·m-2h-1;395.01,742.26和236.73 mg·m-2h-1;312.82,729.23和233.33 mg·m-2h-1。均呈现出夏季最高(较春季和秋季高87.9%~133.1%和183.9%~213.6%,且3者排放峰值1 350.02,1 222.95和1 080.50 mg·m-2h-1均出现在8月中旬、春季相对较高(较秋季高34.1%~66.9%)、秋季最低的季节变化规律性。由此可见,小兴安岭3种典型落叶松沼泽林在生长季节土壤CO2排放通量均呈现出夏季>春季>秋季的季节变化规律性,且其季节变异性明显强于其空间或类型之间的变异性。可能主要由温度的季节变化所致,春季气温逐渐升高,植被处于复苏阶段,植物根系呼吸及微生物分解活动逐渐增强;夏季气温普遍较高,植被生长旺盛,植物根系呼吸及微生物活动强烈;秋季随着气温的逐渐降低,植被生长衰退,植物根系呼吸及土壤微生物活性逐渐减弱。
|
图 1 土壤CO2排放通量季节变化 Figure 1 Seasonal variation of soil CO2 emissions |
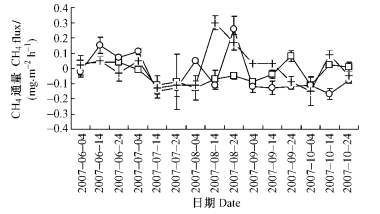
由图 2得到,3种沼泽林土壤CH4排放通量均呈现出排放与吸收交替发生的季节变化规律性,且排放强度相近(P=0.274)。在生长季节,3种沼泽林土壤CH4排放通量依次为-0.13~0.08, -0.17~0.26和-0.15~0.30 mg·m-2h-1,平均值依次为-0.032,-0.033和0.005 mg·m-2h-1,均呈现出CH4吸收与排放交替发生的变化趋势,但前2者总体上以吸收CH4为主且吸收强度比较接近(变化幅度仅为3.1%),后者以排放CH4为主且排放强度相对较低(其平均值仅相当于前2者的15.2%~15.6%)。同时,3者在春、夏、秋季的CH4平均通量分别为:0.025,-0.083和0.000 mg·m-2h-1;0.078 mg·m-2h-1,-0.033和-0.122 mg·m-2h-1;0.023,0.026和-0.05 mg·m-2h-1。依次呈现出以下季节变化规律:春季排放、夏季吸收、秋季零排放;春季排放、夏秋季吸收;春夏季排放、秋季吸收。由此可见,小兴安岭3种落叶松沼泽林生长季节CH4排放的季节变化规律性及其源/汇关系均存在着明显的差异性。分析其原因,可能主要是由于3者所处的生境不同,兴安落叶松-狭叶杜香-中位泥炭藓沼泽林所处地势低、积水量大、积水周期长,能够满足CH4产生菌所需要的厌氧条件,导致其总体上排放CH4,而其他2种沼泽林所处地势相对较高、积水量小、积水周期短,不利于CH4产生菌活动,导致其总体上吸收CH4;此外,由于林区春季土壤解冻迟缓,土壤冻层的存在有利于积水环境的形成,结果导致落叶松沼泽林在春季以排放CH4为主,而在夏季或秋季因土壤冻层消失,水位相对较低,多以吸收CH4为主。
|
图 2 土壤CH4排放通量季节变化 Figure 2 Seasonal variation of soil CH4 emissions |
由图 3得到,3种沼泽林土壤N2O排放通量的季节变化规律不同,且排放强度存在显著差异性(P=0.002)。3种沼泽林生长季节土壤N2O排放通量依次为0.00~0.09,0.00~0.02和0.00~0.08 mg·m-2h-1,平均值依次为0.031,0.005和0.010 mg·m-2h-1,兴安落叶松-油桦-修氏苔草沼泽林最高(为后2者的6.2和3.1倍),兴安落叶松-狭叶杜香-中位泥炭藓沼泽林居中(为落叶松藓类沼泽林的2.0倍),兴安落叶松-油桦-笃斯越橘-藓类沼泽林最低,且3者生长季N2O排放通量存在着显著差异性(P=0.002)。同时,兴安落叶松-油桦-修氏苔草沼泽林土壤N2O排放在整个生长季节均有排放,其春、夏、秋季的平均排放通量依次为0.023, 0.049和0.010 mg·m-2h-1,呈现夏季(较春季和秋季高113.0%和390.0%,且在7月中旬和8月中旬出现2个排放峰值)>春季(较秋季高130.0%)>秋季的季节变化规律性;兴安落叶松-油桦-笃斯越橘-藓类沼泽林土壤N2O排放主要集中在春夏季,其春、夏、秋季的平均排放通量依次为0.008,0.007和0.000 mg·m-2h-1,春季(较夏季高14.3%)>夏季>秋季(零排放);而兴安落叶松-狭叶杜香-中位泥炭藓沼泽林土壤N2O排放呈现间歇性排放(仅在6月上旬、8月中下旬和10月上旬排放N2O),其春、夏、秋季的平均排放通量依次为0.013,0.003和0.020 mg·m-2h-1,呈现出秋季(较春季和夏季高53.9%和566.7%)>春季(较夏季高333.3%)>夏季的季节变化规律性。由此可见,小兴安岭3种典型落叶松沼泽林土壤均为N2O的排放源,但3者在N2O的排放强度及季节变化规律方面却存在着较大的差异性。
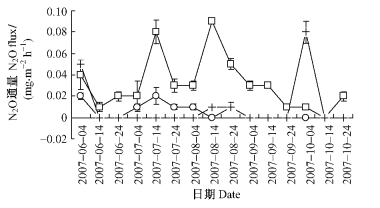
|
图 3 土壤N2O排放通量季节变化 Figure 3 Seasonal variation of soil N2O emissions |
由表 1得到,兴安落叶松-油桦-修氏苔草沼泽林和兴安落叶松-油桦-笃斯越橘-藓类沼泽林土壤CO2排放通量与5,10,15,20,30 cm土深处土壤温度存在极显著的正相关(0.722<R2<0.949,P<0.01),兴安落叶松-狭叶杜香-中位泥炭藓沼泽林土壤CO2排放通量与15, 20和30 cm土深处土壤温度存在极显著的正相关(0.708<R2<0.983,P<0.01);但3种落叶松沼泽林中只有兴安落叶松-油桦-笃斯越橘-藓类沼泽林的土壤CO2排放通量与水位存在显著相关性,其他2种类型没有达到显著相关的水平。因此,表层土壤温度是影响小兴安岭落叶松沼泽林土壤CO2排放的主要因素。分析其原因,主要是由于落叶松沼泽林群落建群种落叶松为浅根系,其根系主要分布在土壤表层(0~30 cm),群落中灌木和草本植物根系也集中在此层,此外也是微生物分解凋落物的主要土层,但因湿地积水或湿度大引起土壤温度相对较低(生长季节5,10,15,20,30和40 cm土深处土壤平均温度依次为6.5~9.7,4.8~7.0,3.5~5.1,2.7~4.1,0.8~2.0和0.2~1.0 ℃),往往成为植物根系呼吸及微生物分解的限制因子,因此相对较高的土壤温度势必有利于土壤呼吸。
|
|
由表 1得到,兴安落叶松-油桦-修氏苔草沼泽林土壤CH4通量与15和20 cm土深处土壤温度存在显著相关性(-0.550<R2<-0.544,P<0.05),与水位无显著相关性,但排放CH4观测日的平均水位相对较高(-27.5 cm),吸收CH4观测日的平均水位相对较低(-36.9 cm),而2者5~40 cm土深处土壤温度均较低且差别不大(0.5~3.9和1.2~9.0 ℃),因此,水位应是其土壤排放或吸收CH4的决定性因子。兴安落叶松-狭叶杜香-中位泥炭藓沼泽林土壤CH4通量与20和30 cm土深处土壤温度呈显著正相关(0.515<R2<0.589,P<0.05),与40 cm土深处土壤温度、水位均呈现极显著正相关(R2=0.647,P<0.01;R2=0.744,P<0.01)。进一步对比分析CH4排放与CH4吸收观测日的水位与土温得到,CH4排放与CH4吸收的平均水位存在较大的差异(-20.5和-39.3 cm),而2者5~40 cm土深处土壤温度均较低且相近(0.2~6.5和0.1~6.3 ℃),因此,水位是决定其CH4排放或吸收的主要因子,而土壤温度主要影响其通量大小。兴安落叶松-油桦-笃斯越橘-藓类沼泽林土壤CH4通量与土壤温度和水位均未达显著相关水平,但其生长季节平均水位相对较低(-36.4 cm),土壤以吸收CH4为主,这也说明了低水位导致了其土壤吸收CH4。因此,水位是影响小兴安岭落叶松沼泽林土壤CH4源/汇转化的主要因素,相对较高的水位导致其土壤排放CH4,相对较低的水位导致其土壤吸收CH4。其主要原因是相对较高的水位能够使绝大部分土壤形成厌氧条件,有利于CH4产生菌的活动,导致土壤排放CH4,而相对较低的水位能够使绝大部分土壤形成有氧条件,有利于CH4氧化菌的活动,导致土壤吸收CH4。而土壤温度主要影响其通量的大小。
由表 1得到,兴安落叶松-油桦-修氏苔草沼泽林土壤N2O排放通量与5,10和15 cm土深处土壤温度存在极显著正相关(0.669<R2<0.748,P<0.01),与20 cm土深处土壤温度存在显著正相关(R2=0.614,P<0.05),而与水位无显著相关,但其生长季水位分布在-16.3~-3.2 cm,平均水位为-33.1 cm,水位相对较低。因此,环境因子对其影响机制应是在水位相对较低的条件下土壤N2O排放才与上层土壤温度呈显著正相关。其他2种沼泽林和兴安落叶松-狭叶杜香-中位泥炭藓沼泽林土壤N2O排放通量与土壤温度和水位均未达到显著相关水平,但兴安落叶松-油桦-笃斯越橘-藓类沼泽林在夏季水位相对较低(平均水位为-40.8 cm),土壤温度较高(5~30 cm土壤温度为11.2~14.4 ℃,平均温度13.2 ℃)时排放N2O,而在秋季水位略高于夏季(平均水位为-31.0 cm),但土壤温度远低于夏季(5~30 cm土壤温度-1.2~5.5 ℃,平均温度1.8 ℃,较夏季低11.4 ℃)时却未发生N2O的排放;兴安落叶松-狭叶杜香-中位泥炭藓沼泽林的土壤N2O排放通量与土壤温度和水位的关系与前者相似。因此,相对较低的水位与相对较高的表层土壤温度有利于小兴安岭落叶松沼泽林土壤N2O排放。其原因可能是由于相对较低的水位(平均水位-33.1~-40.8 cm)同时有利于硝化与反硝化过程,结果导致较多的中间产物N2O生成(刘景双等,2003),而相对较高的土壤温度则能够削弱森林湿地低温对硝化与反硝化细菌活性的限制。
3.3 生长季土壤CO2, CH4和N2O排放量根据生长季观测的落叶松沼泽林3种温室气体排放通量数据,通过分时段计算可以得到各落叶松沼泽林生长季节温室气体的排放总量,进而探讨其土壤温室气体的源汇作用。
兴安落叶松-油桦-修氏苔草沼泽林土壤CO2排放量呈现出夏季(67.2%)>春季(19.3%)>秋季(13.5%)的分布格局,且在整个生长季土壤CO2排放量为22.010 t· hm-2,表现为CO2的排放源;兴安落叶松-油桦-笃斯越橘-藓类沼泽林土壤CO2排放量呈现出夏季(67.3%)>春季(20.5%)>秋季(12.2%)的分布格局,且在整个生长季CO2排放量为18.535 t· hm-2,也是CO2的排放源;兴安落叶松-狭叶杜香-中位泥炭藓沼泽林土壤CO2排放量呈现出夏季(70.0%)>春季(17.2%)>秋季(12.8%)的分布格局,且在整个生长季土壤CO2排放量为17.494 t·hm-2,同样为CO2的排放源。由此可见,3种沼泽林土壤在生长季节均为CO2的排放源,且均呈现出夏季>春季>秋季的类似的季节分布格局,但兴安落叶松-油桦-修氏苔草沼泽林最高(较后2者高18.8%和25.8%),兴安落叶松-油桦-笃斯越橘-藓类沼泽林居中(较后者高6.0%),兴安落叶松-狭叶杜香-中位泥炭藓沼泽林最低。
兴安落叶松-油桦-修氏苔草沼泽林土壤CH4排放量呈现出春季弱排放(仅占夏季吸收量的17.2%)、夏季强吸收、秋季零排放的分布格局,且在整个生长季其土壤净吸收CH4 1.152 kg·hm-2,表现出CH4的吸收汇;兴安落叶松-油桦-笃斯越橘-藓类沼泽林土壤CH4排放量呈现出春季弱排放(仅占夏秋季吸收量的38.3%)、夏季弱吸收(仅占夏秋季吸收量的40.7%)、秋季强吸收(占夏秋季吸收量的59.3%)的分布格局,且在整个生长季其土壤净吸收CH4 1.200 kg·hm-2,表现出CH4的吸收汇;兴安落叶松-狭叶杜香-中位泥炭藓沼泽林土壤CH4排放量呈现出春季弱排放(仅占夏季排放量的50.0%)、夏季强排放、秋季强吸收的分布格局,且在整个生长季其土壤净排放CH4 0.168 kg·hm-2,表现出CH4的排放源。因此,小兴安岭3种落叶松沼泽林在生长季节CH4源/汇功能有所不同,兴安落叶松-油桦-修氏苔草沼泽林和兴安落叶松-油桦-笃斯越橘-藓类沼泽林为CH4的吸收汇,而兴安落叶松-狭叶杜香-中位泥炭藓沼泽林则为CH4的排放源。
兴安落叶松-油桦-修氏苔草沼泽林土壤N2O排放量呈现出夏季(80.9%)>春季(10.6%)>秋季(8.5%)的分布格局,且在整个生长季土壤N2O排放量为1.128 kg·hm-2,为N2O的排放源;兴安落叶松-油桦-笃斯越橘-藓类沼泽林土壤N2O排放量呈现出夏季(75.0%)>春季(25.0%)>秋季(0.0%)的分布格局,且在整个生长季土壤N2O排放量为0.192 kg·hm-2,也为N2O的排放源;兴安落叶松-狭叶杜香-中位泥炭藓沼泽林土壤N2O排放量呈现出秋季(53.4%)>春季(33.3%)>夏季(13.3%)的分布格局,且在整个生长季土壤N2O排放量为0.360 kg·hm-2,同样是N2O的排放源。因此,小兴安岭3种落叶松沼泽林土壤在生长季节均为N2O的排放源,但兴安落叶松-油桦-修氏苔草沼泽林为N2O的强排放源(较后2者提高了487.5%和213.3%),另外2种沼泽林则为N2O的弱排放源。
依据CH4和N2O温室效应贡献率,可得到3种沼泽林生长季节土壤温室气体排放总量及其组成结构。3者生长季节土壤CO2排放量依次为22.010, 18.535和17.494 t·hm-2 a-1;N2O排放量依次为1.128, 0.192和0.360 kg·hm-2 a-1,按其温室效应是CO2的206倍计算(IPCC, 2007)相当于排放了232.4,39.6和74.2 kg·hm-2 a-1的CO2;前2者土壤净吸收CH4 1.152和1.200 kg·hm-2 a-1,后者土壤净排放CH4 0.168 kg·hm-2 a-1,按其温室效应是CO2的21倍计算(IPCC, 2007)相当于吸收或排放了24.2,25.2和3.5 kg·hm-2 a-1的CO2;故3者生长季节土壤温室气体排放总量依次相当于22.218,18.549和17.572 t·hm-2 a-1的CO2,兴安落叶松-油桦-修氏苔草沼泽林最高(较后2者高19.8%~26.4%),兴安落叶松-油桦-笃斯越橘-藓类沼泽林居中(较后者提高5.6%),兴安落叶松-狭叶杜香-中位泥炭藓沼泽林最低。此外,3者生长季节土壤排放的温室气体均以CO2排放占绝对优势地位(99.06%~99.92%),而N2O和CH4排放却占绝对次要地位(0.21%~1.04%和0.02%~0.13%)。因此,小兴安岭落叶松沼泽林生长季土壤温室气体主要来源于CO2的排放。
4 结论与讨论小兴安岭3种沼泽林的土壤在生长季节均为CO2的排放源,其排放量分布在17.5~22.0 t·hm-2 a-1,这与我国三江平原永久水淹的苔草沼泽和季节性水淹的小叶章(Deyeuxia angustifolia)草甸(19.7~25.7 t·hm-2 a-1)(Song et al., 2003)相近;高于北美温带草丛泥炭湿地和冲积平原湿地(4.7~13.2 t·hm-2 a-1)(Roehm, 2003;Wickland et al., 2001)272.2%~368.3%和32.5%~66.7%;高于欧洲高纬度北方泥炭地(3.4~11.9 t·hm-2 a-1)(Alm et al., 1999;Waddington et al., 2000;Heikkinen et al., 2004)414.5%~547.4%和47.0%~85.0%。因此,小兴安岭3种落叶松沼泽林土壤应属于CO2强排放源,这可能与地处温带、水热条件优越、生长期较长、物质生产与分解相对强烈有关。此外,这3种落叶松沼泽林在生长季节土壤CO2排放均呈现出春秋季低而夏季高的季节变化规律性,且主要受0~30 cm土层土壤温度控制,这与现有研究结论(Song et al., 2003; Lafleur et al., 2005)基本一致。小兴安岭兴安落叶松-油桦-修氏苔草沼泽林和兴安落叶松-油桦-笃斯越橘-藓类沼泽林生长季节为CH4的吸收汇(-1.152~ 1.200 kg·hm-2 a-1),兴安落叶松-狭叶杜香-中位泥炭藓沼泽林为CH4的排放源(0.168 kg·hm-2 a-1)。前2者的年通量仅为北方泥炭地CH4通量(-10.58~2 883.0 kg·hm-2 a-1)(Huttunen et al., 2003)最大吸收值的1/10左右,应属于CH4的弱吸收汇,后者的年通量不足北方天然泥炭地CH4最大排放量的1/10 000,仅为三江平原苔草沼泽湿地CH4排放量(460.8 kg·hm-2 a-1)(Song et al., 2003)的4/10 000,故应属于CH4的弱排放源。此外,小兴安岭3种落叶松沼泽林在生长季均呈现出CH4排放与吸收交替发生的现象,且排放主要集中在春季或春夏季,而吸收多发生在夏秋季或秋季,这与三江平原苔草沼泽在整个生长季均排放CH4,且主要集中在夏秋季存在着明显的不同(Song et al., 2003)。其原因可能主要是由于林区春季解冻过程迟缓,水位相对较高,有利于满足CH4产生菌所需厌氧环境,而夏秋季水位相对较低,则不利于CH4产生菌的活动。
3种沼泽林生长季节均为N2O的排放源(0.192~1.128 kg·hm-2 a-1或0.122~0.717 kg N·hm-2 a-1)。其年通量仅相当于利用培养试验方法测定的森林湿地N2O的排放量(4.9~68 kg N·hm-2 a-1)(Hanson et al., 1994; Lowrence et al., 1995; Groffman et al., 1997)的2.5%~14.6%和0.2%~1.1%,仅相当于草丛湿地(220~735 kg N·hm-2 a-1)(Stepanauskas et al., 1996; Davidsson et al., 1997)的0.06%~0.3%和0.02%~0.1%。因此,小兴安岭3种落叶松沼泽林应属于N2O的弱排放源。其原因可能主要由于落叶松沼泽林生长季水位多低于地表 30 cm,土壤以硝化过程为主(Hefting et al., 2004),导致N2O排放相对较少。
小兴安岭3种落叶松沼泽林生长季节土壤温室气体排放总量(相当于17.565~22.218 t·hm-2 a-1的CO2)以兴安落叶松-油桦-修氏苔草沼泽林最高(较后2者提高19.8%~26.4%),兴安落叶松-油桦-笃斯越橘-藓类沼泽林居中(较后者提高5.6%),兴安落叶松-狭叶杜香-中位泥炭藓沼泽林最低。且3者土壤排放的温室气体均以CO2排放占绝对优势地位(99.06%~99.92%),而N2O和CH4排放仅占次要地位(0.21%~1.04%和0.02%~0.13%)。因此,小兴安岭落叶松沼泽林在生长季节土壤温室气体的排放主要来源于CO2的排放,而不是通常认为的CH4排放。故有必要进一步深入开展其碳循环方面的研究。
黄国宏, 李玉祥, 陈冠雄, 等. 2001. 环境因素对芦苇湿地CH4排放的影响[J]. 环境科学, 22(1): 1-5. |
郝庆菊, 王跃思, 宋长春, 等. 2004. 三江平原农田生态系统CO2收支研究[J]. 农业环境科学学报, 23(5): 846-851. |
郎惠卿. 1999. 中国湿地植被[M]. 北京: 科学出版社: 35-74.
|
李国琛. 2005. 全球气候变暖成因分析[J]. 自然灾害学报, 14(5): 38-42. |
刘景双, 王金达, 李仲根, 等. 2003. 三江平原沼泽湿地N2O浓度与排放特征初步研究[J]. 环境科学, 24(1): 33-39. |
刘兴土, 吕宪国, 赵魁义. 2007. 湿地资源及其保育//李文华. 东北地区有关水土资源配制、生态与环境保护和可持续发展的若干战略问题研究-林业卷: 东北地区森林与湿地保育及林业发展战略研究. 北京: 科学出版社, 409-449.
|
王德宣, 丁维新, 王毅勇. 2003. 若尔盖高原与三江平原沼泽湿地CH4排放差异的主要环境影响因素[J]. 湿地科学, 1(1): 63-67. |
王德宣, 吕宪国, 丁维新, 等. 2002. 若尔盖高原沼泽湿地CH4排放研究[J]. 地球科学进展, 17(6): 877-880. |
王毅勇, 赵志春, 宋长春. 2005. 三江平原沼泽湿地CH4排放及贴地层浓度分布特征[J]. 云南大学学报:自然科学版, 27(5A): 239-244. |
肖冬梅, 王淼, 姬兰柱, 等. 2004. 长白山阔叶红松林土壤氧化亚氮和甲烷的通量研究[J]. 应用生态学报, 15(10): 1855-1859. DOI:10.3321/j.issn:1001-9332.2004.10.029 |
杨继松, 刘景双, 王金达, 等. 2006. 三江平原生长季沼泽湿地CH4、N2O排放及其影响因素[J]. 植物生态学报, 30(3): 432-440. DOI:10.17521/cjpe.2006.0058 |
杨继松, 于君宝, 刘景双, 等. 2004. 三江平原湿地岛状林CH4和N2O排放通量的特征[J]. 生态环境, 13(4): 476-479. |
叶勇, 卢昌义, 林鹏. 2000. 海南岛和厦门红树林湿地CH4排放的时空变化[J]. 大气科学, 4(3): 152-156. |
张法伟, 刘安花, 李英年, 等. 2008. 青藏高原高寒湿地生态系统CO2通量[J]. 生态学报, 28(2): 453-462. |
Alm J, Schulman L, Walden J, et al. 1999. Carbon balance of a boreal bog during a year with an exceptionally dry summer[J]. Ecology, 80: 161-174. DOI:10.1890/0012-9658(1999)080[0161:CBOABB]2.0.CO;2 |
Castro M S, Stedudler P A, Mellio J M. 1995. Factor controlling atmospheric methane consumption by temperate forest soils[J]. Global Biogeochemical Cycles, 9: 1-10. DOI:10.1029/94GB02651 |
Davidsson T E, Leonardson L. 1997. Seasonal dynamics of denitrification activity in two water meadows[J]. Hydrobiologia, 364: 189-198. DOI:10.1023/A:1003103222351 |
Ding W X, Cai Z C, Wang D X. 2004. Preliminary budget of methane emissions from natural wetlands in China[J]. Atmospheric Environ-ment, 38: 751-759. DOI:10.1016/j.atmosenv.2003.10.016 |
Edwards G C, Dias G M, Thurtell G W, et al. 2001. Methane fluxes from a wetland using the flux-gradient technique[J]. Wate, Air, & Soil Pollution: Focus, 1: 447-454. |
Groffman P M, Hanson G. 1997. Wetland denitrification: influence of site quality and relationships with wetland delineation protocols[J]. Soil Science Society of America, 61: 323-329. DOI:10.2136/sssaj1997.03615995006100010047x |
Hanson G C, Groffman P M, Gold A J. 1994. Denitrification in riparian wetlands receiving high and low groundwater nitrate inputs[J]. J Environ Qual, 23: 917-922. |
Hefting M, Clement J C, Dowrick D, et al. 2004. Water table elevation controls on soil nitrogen cycling in riparian wetlands along a European climatic gradient[J]. Biogeochemistry, 67: 113-134. DOI:10.1023/B:BIOG.0000015320.69868.33 |
Heikkinen J E P, Virtanen T, Huttunen J T, et al. 2004. Carbon balance in East European tundra[J]. Global Biogeochemical Cycles, 18: 1-14. |
Holly R, Jeff S, Darwin A. 2002. Factors influencing methane flux from a boreal forest wetland in Saskatchewan, Canada[J]. Soil Biology Biochemistry, 34: 435-443. DOI:10.1016/S0038-0717(01)00197-3 |
Huttunen J T, Nykanen H, Turunen J, et al. 2003. Methane emissions from natural peatlands in the northern boreal zone in Finland, Fennoscandia[J]. Atmospheric Environment, 37: 147-151. DOI:10.1016/S1352-2310(02)00771-9 |
IPCC. 2007. Summary for policymakers[M]. Newyork: Cambridge University Press: 1-18.
|
Khalil M A K. 1999. Non-CO2 greenhouse gases in the atmosphere[J]. Annual Review of Energy and the Environment, 24: 645-661. DOI:10.1146/annurev.energy.24.1.645 |
Lafleur P M, Moore T R, Roulet N T, et al. 2005. Ecosystem respiration in a cool temperate bog depends on peat temperature but not water table[J]. Ecosystems, 9: 619-629. |
Letey J, Valoras N, Focht D D, et al. 1981. Nitrous oxide production and reduction during denitrification as affected by redox potential[J]. Soil Science Society of America, 45: 727-730. DOI:10.2136/sssaj1981.03615995004500040010x |
Lowrence R, Vellidis G, Hubbard R K. 1995. Denitrification in a restored riparian forest wetland[J]. Environmental Quality, 24: 808-815. |
Lu C Y, Wong Y, Tam N F Y, et al. 1998. Preliminary studies on methane fluxes in Hainan mangrove communnites[J]. Chinese Journal of Oceanology and Limnology, 16(1): 64-71. DOI:10.1007/BF02848219 |
Renbin Z, Yashu L, Jing M, et al. 2008. Nitrous oxide flux to the atmosphere from two coastal tundra wetlands in eastern Antarctica[J]. Atmospheric Environment, 42: 2437-2447. DOI:10.1016/j.atmosenv.2007.12.016 |
Roehm C L, Roulet N T. 2003. Seasonal contribution of CO2 fluxes in the annual C budget of a northern bog[J]. Global Biogeochem Cycles, 17: 1029-1038. |
Simpson L J, Edwards G C, Thurtell G W. 1999. Variations in methane and nitrous oxide mixing ratios at the southern boundary of a Canadian boreal forest[J]. Atmospheric Environment, 33: 1141-1150. DOI:10.1016/S1352-2310(98)00235-0 |
Smith K A, Thomson P E, Clayton H, et al. 1998. Effects on temperature, water content and nitrogen fertilization on emission of nitrous oxide by soil[J]. Atospheric Environment, 32: 3301-3309. DOI:10.1016/S1352-2310(97)00492-5 |
Stepanauskas R, Davidsson E T, Leonardson L. 1996. Nitrogen trans-formations in wetland soil cores measure by (sup15)N isotope pairing and dilution at four infiltration rates[J]. Applied and Environmental Microbiology, 62: 2345-2351. |
Song C C, Yan B X, Wang Y S, et al. 2003. Fluxes of carbon dioxide and methane from swamp and impact factors in Sanjiang Plain, China[J]. Chinese Science Bulletin, 48(24): 2749-2753. DOI:10.1007/BF02901769 |
Waddington J M, Roulet N T. 2000. Carbon balance of a boreal patterned peatland[J]. Global Change Biology, 6: 87-97. DOI:10.1046/j.1365-2486.2000.00283.x |
Whiting G J, Chanton J P. 1993. Primary production control of methane emission from wetlands[J]. Nature, 364: 794-795. DOI:10.1038/364794a0 |
Wickland K P, Striegl R G, Mast M A, et al. 2001. Carbon gas exchange at a southern Rocky Mountain wetland, 1996-1998[J]. Global Biogeochem Cycles, 15: 321-335. DOI:10.1029/2000GB001325 |
 2010, Vol. 46
2010, Vol. 46