文章信息
- 尹淑艳, 徐常青, 崔孝平, 吴爱莲, 孙绪艮
- Yin Shuyan, Xu Changqing, Cui Xiaoping, Wu Ailian, Sun Xugen
- 针叶小爪螨板栗和杉木种群的形态差异
- Morphological Differences of Oligonychus ununguis Populations from Castanea mollissima and Cunninghamia lanceolata
- 林业科学, 2010, 46(6): 166-170.
- Scientia Silvae Sinicae, 2010, 46(6): 166-170.
-
文章历史
- 收稿日期:2009-04-23
- 修回日期:2009-07-25
-
作者相关文章
2. 中国医学科学院中国协和医科大学药用植物研究所 北京 100193;
3. 青岛市崂山区森林保护站 青岛 266101;
4. 山东省寿光市羊口镇农业综合服务站 寿光 262714
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences, Chinese Peking Union Medical College Beijing 100193;
3. Forest Protection Station of Laoshan District of Qingdao Qingdao 266101;
4. Agricultural General Service Station of Yangkou Town of Shouguang Shouguang 262714
针叶小爪螨(Oligonychus ununguis)俗称板栗红蜘蛛、杉木红蜘蛛,属叶螨科(Tetranychidae),小爪螨属(Oligonychus),广泛分布在亚洲、欧洲、澳洲、美洲的众多国家。在我国北方,该螨主要为害板栗(Castanea mollissima)、麻栎(Quercus acutissima)、栓皮栎(Quercus variabilis),为板栗生产的一大敌害,严重影响板栗的产量及品质(孙绪艮等,1994)。在浙江、安徽、江西等地,杉木(Cunninghamia lanceolata)受害较重,严重影响树木的生长发育(张时敏,1983)。据已有资料记载,该螨的寄主包括松科(Pinaceae)的黑松(Pinus thunbergii)、赤松(Pinus densiflora)、雪松(Cedrus deodara)等, 柏科(Cupressaceae)的侧柏(Platycladus orientalis)、龙柏(Sabina chinensis cv.‘Kaizuka’)等, 杉科(Taxodiaceae)的杉木、云杉(Picea asperata)、日本柳杉(Cryptomeria japonica)等针叶树(Richmond, 1996;Przygoda, 2001; Puchalska, 2002; Czajkowska et al., 2003;2005; Shrewsbury et al., 2003; Kiekiewicz et al., 2005; Puchalska et al., 2006)和壳斗科(Fagaceae)的板栗、日本栗(Castanea crenata)、麻栎、栓皮栎、蒙古栎(Quercus mongolica)、槲树(Quercus dentata)等阔叶树(Shinkaji, 1975a; 1975b; Wanibuchi et al., 1983;王慧芙, 1981; 王源岷等,1989;孙绪艮等,1990;1995; 2000; 2002a; 2002b; 尹淑艳等,2002;刘学辉等,2007;卢向阳等,2008)。但孙绪艮等(2000)在山东泰山、五莲等地的调查中发现,在板栗、麻栎与黑松、赤松混植的林中,甚至在板栗、麻栎与赤松、黑松枝叶相交叉的植株上,板栗、麻栎叶上螨口密度均较高,有的叶片活动螨达每叶200头以上时,赤松、黑松上却没有发生,类似情况在烟台、威海等地也有发现,这与前人记载的该螨的寄主植物范围不一致。为进一步证实上述现象,并探讨其形成原因,孙绪艮等(2000)研究了该螨不同种群间的食性差异及其生殖亲合性状况; 结果表明:南方针叶树(杉木)种群不能在板栗、麻栎等阔叶树上存活,北方阔叶树(板栗、麻栎)种群也不能在杉木、黑松、赤松等针叶树上存活;板栗种群雌螨与杉木种群雄螨杂交无雌性后代产生,而反交雌螨未产卵。反交试验是在板栗叶片上进行的,雌螨未产卵很可能是由于不取食板栗叶片、产卵前期未补充营养、性成熟不充分而造成的,即2个种群间是否存在完全的生殖隔离还无法定论。
针叶小爪螨的针叶树种群和阔叶树种群除了食性不同、存在部分生殖隔离外,在形态上是否有差异?为明确这个问题,研究了2个代表性种群——板栗种群和杉木种群的外部形态特征。
1 材料与方法 1.1 供试叶螨及饲养板栗种群采自山东农业大学果园约10年生板栗树,用叶片水盘法饲养(孙绪艮等,1995)。杉木种群采自浙江省富阳市约10年生杉木林,用盆栽杉木苗饲养。
1.2 外部形态观察雄性外生殖器、雌性生殖盖上的表皮纹及生殖盖前区表皮纹的走向、须肢端感器和背感器的形状及大小、各足节毛序、跗节爪和爪间突的形状等是叶螨分类的重要依据(王慧芙, 1981), 因此,选取这些部位,用光学显微镜和扫描电子显微镜对2个种群的个体进行细致地观察比较。
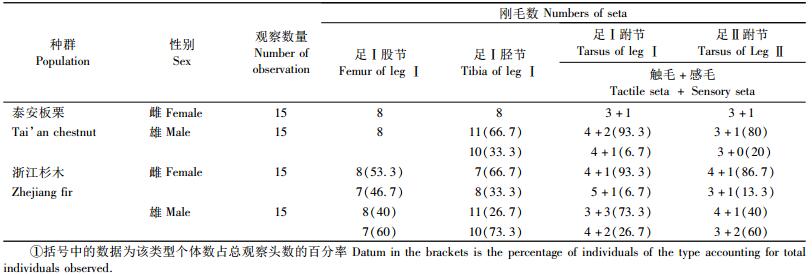
1) 光学显微镜观察 从每个叶螨种群中随机挑取雌雄成螨各15头,以霍氏叶螨封片剂(Hoyer's medium)封片制成玻片,在双目显微镜下观察足Ⅰ~Ⅳ股节、胫节、跗节上的刚毛数。股节、胫节计数刚毛总数,跗节上记录双毛近基侧的触毛和感毛数。
2) 扫描电子显微镜观察 方法参照Brandenburg (1981),每个叶螨种群观察雌雄成螨各15头。观察内容包括:雄螨阳具的形状及大小、雌螨生殖盖及生殖盖前区表皮纹、雌雄螨须肢端感器和背感器的形状及大小、雌雄螨足Ⅰ爪间突的形状等。
2 结果与分析 2.1 不同种群足刚毛数的差异针叶小爪螨的不同种群其足部各环节的刚毛数稳定程度不同。足Ⅱ~Ⅳ股节、胫节刚毛数,足Ⅲ~Ⅳ跗节刚毛数在不同种群间较稳定,刚毛数相同。而足Ⅰ股节、胫节、跗节、足Ⅱ跗节刚毛数及刚毛类型在不同种群间有变异。
泰安板栗种群雌成螨足Ⅰ股节和胫节刚毛数均为8根,足Ⅰ, Ⅱ跗节双毛近基侧有3根触毛和1根感毛。浙江杉木种群雌成螨足Ⅰ股节和胫节刚毛数及足Ⅰ, Ⅱ跗节双毛近基侧触毛和感毛数均有2种类型:足Ⅰ股节和胫节刚毛数有8根和7根2种类型,足Ⅰ跗节双毛近基侧有4根触毛、1根感毛和5根触毛、1根感毛2种类型,足Ⅱ跗节双毛近基侧有4根触毛、1根感毛和3根触毛、1根感毛2种类型。不同类型个体数占总观察头数的比例见表 1。
|
|
泰安板栗种群雄成螨足Ⅰ股节刚毛数为8根,足Ⅰ胫节刚毛数、足Ⅰ, Ⅱ跗节双毛近基侧触毛和感毛数均有2种类型:足Ⅰ胫节刚毛数有10根和11根2种类型,足Ⅰ跗节双毛近基侧有4根触毛、2根感毛和4根触毛、1根感毛2种类型,足Ⅱ跗节双毛近基侧有3根触毛、1根感毛和3根触毛、无感毛2种类型。浙江杉木种群雄成螨足Ⅰ股节和胫节刚毛数及足Ⅰ, Ⅱ跗节双毛近基侧触毛和感毛数均有2种类型:足Ⅰ股节刚毛数有8根和7根2种类型,足Ⅰ胫节刚毛数有10根和11根2种类型,足Ⅰ跗节双毛近基侧有3根触毛、3根感毛和4根触毛、2根感毛2种类型,足Ⅱ跗节双毛近基侧有4根触毛、1根感毛和3根触毛、2根感毛2种类型。不同类型个体数占总观察头数的比例见表 1。
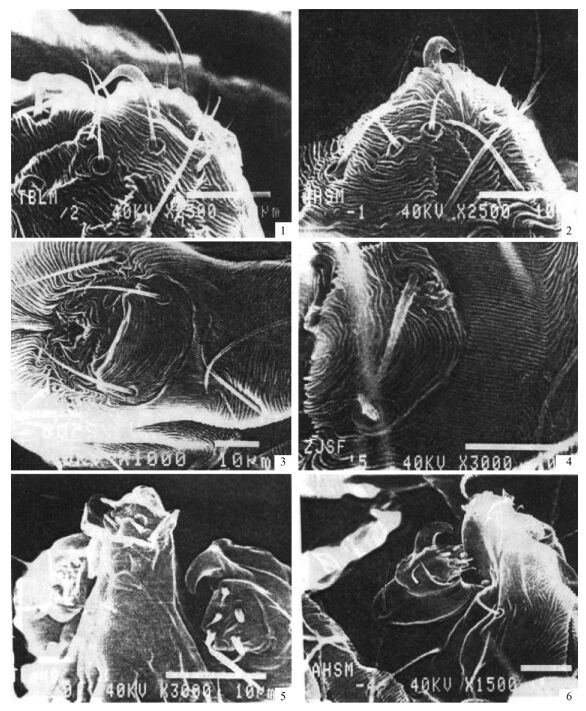
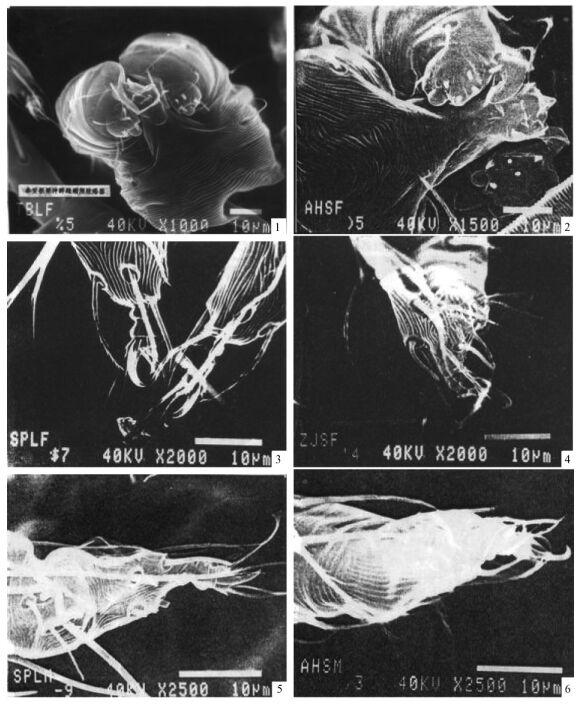
2.2 不同种群雄螨的阳具差异泰安板栗种群雄螨的阳具柄部粗壮,从基部到弯曲部位逐渐变细,呈弧形弯曲;钩部细长,向下弯曲,从弯曲部位到端部逐渐变细,端部微翘(图版Ⅰ-1,表 2)。浙江杉木种群雄螨的阳具较泰安板栗种群的小,弯曲部位与基部粗度近等;钩部向下弯曲,呈指状,短而直,从弯曲部位到端部骤然变细(图版Ⅰ-2,表 2)。
|
|
|
图版Ⅰ Plate Ⅰ 1.泰安板栗种群雄螨阳具; 2.浙江杉木种群雄螨阳具; 3.泰安板栗种群雌螨生殖盖及前区表皮纹; 4.浙江杉木种群雌螨生殖盖及前区表皮纹; 5.泰安板栗种群雄螨须肢跗节感器; 6.浙江杉木种群雄螨须肢跗节感器。 1. Aedeagus of males from Tai’an chestnut; 2. Aedeagus of males from Zhejiang fir; 3. Epidermis of genital flap and its anterior area of females from Tai’an chestnut; 4. Epidermis of genital flap and its anterior area of females from Zhejiang fir; 5. Sensillum of palpal tarsus of males from Tai’an chestnut; 6. Sensillum of palpal tarsus of males from Zhejiang fir. |
泰安板栗种群和浙江杉木种群雌螨的生殖盖表皮纹均为横向,呈弧形弯曲,但泰安板栗种群弧形弯曲不明显,而浙江杉木种群弧形弯曲明显。2个种群的生殖盖前区表皮纹均为纵向(图版Ⅰ-3, 4)。
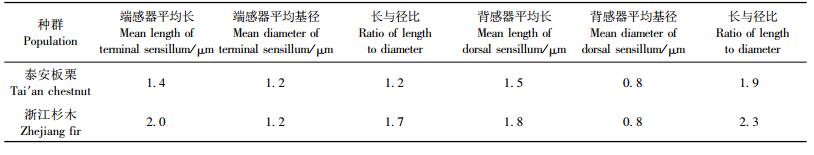
2.4 不同种群雄螨须肢跗节端感器和背感器差异2个种群的须肢跗节端感器形状不同。泰安板栗种群雄螨须肢跗节端感器为圆锥状,浙江杉木种群为圆柱状。2种群的雄螨须肢跗节背感器均为细长的小指状,但泰安板栗种群的较浙江杉木种群的小:泰安板栗种群的背感器长约1.5 μm,浙江杉木种群的长约1.8 μm(图版Ⅰ-5, 6,表 3)。
|
|
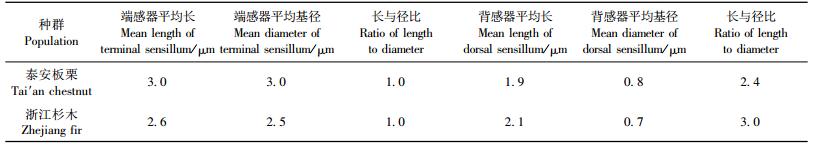
泰安板栗种群和浙江杉木种群的雌螨须肢跗节端感器、背感器形状一样,只是大小略有差别。端感器呈短圆柱形,泰安板栗种群较浙江杉木种群略粗、长;背感器呈细长圆柱形,浙江杉木种群较泰安板栗种群略细、长(图版Ⅱ-1, 2,表 4)。
|
|
|
图版Ⅱ Plate Ⅱ 1.泰安板栗种群雌螨须肢跗节感器; 2.浙江杉木种群雌螨须肢跗节感器; 3.泰安板栗种群雌螨足Ⅰ爪间突; 4.浙江杉木种群雌螨足Ⅰ爪间突; 5.泰安板栗种群雄螨足Ⅰ爪间突; 6.浙江杉木种群雄螨足Ⅰ爪间突。 1. Sensillum of palpal tarsus of females from Tai’an chestnut; 2. Sensillum of palpal tarsus of females from Zhejiang fir; 3. Empodium Ⅰ of females from Tai’an chestnut; 4. Empodium Ⅰ of females from Zhejiang fir; 5. Empodium Ⅰ of males from Tai’an chestnut; 6. Empodium Ⅰ of males from Zhejiang fir. |
不同种群雌雄螨的足Ⅰ爪状爪间突形状不同。泰安板栗种群雌螨的足Ⅰ爪状爪间突粗壮,弧形弯曲不大,端部稍钝,浙江杉木种群雌螨的足Ⅰ爪状爪间突细长,弧形弯曲显著,端部尖利。雄螨的差异同雌螨(图版Ⅱ-3, 4, 5, 6)。
3 讨论1) 王慧芙(1981)对针叶小爪螨的描述为“雌螨生殖盖及生殖盖前区表皮纹均为横向”。Pritchard等(1955)报道,从松树上采集的针叶小爪螨标本,其雌螨生殖盖前区表皮纹都是横向的,从柏树上采集的针叶小爪螨标本,大多数个体雌螨生殖盖前区表皮纹是纵向的。但本文通过扫描电镜观察发现,针叶小爪螨的泰安板栗种群和浙江杉木种群的雌螨生殖盖表皮纹均为横向,生殖盖前区表皮纹均为纵向。
2) 针叶小爪螨是1905年由Jacobi在研究德国云杉上的叶螨时发现,并定名为Tetranychuus ununguis Jacobi,1955年由Prritchad和Baker修订为Oligonychus ununguis (Jacobi)。如前言所述,多数国家学者报道针叶小爪螨的寄主植物为针叶树,只有少数国家(如日本、中国)的有关报道提到该螨还为害板栗、麻栎、栓皮栎、槲树等阔叶树。针叶小爪螨最初在针叶树上被发现并定名,发生在板栗、麻栎等阔叶树上的种群是如何分化形成的,以至于现在针叶树种群和阔叶树种群间存在形态差异、寄主隔离、部分生殖隔离, 这2个种群到底分化到了何种程度, 是形成了不同的生物型还是分化成了不同的种, 要想明确这个问题,还需完善杂交试验。另外,这2个种群的分化是由于寄主隔离还是地理隔离造成的, 还需进一步研究。
刘学辉, 孟庆英, 李中新, 等. 2007. 针叶小爪螨在四种寄主植物上的生物学特性差异[J]. 中国森林病虫, 26(1): 15-17. |
卢向阳, 徐筠, 李青元. 2008. 栗园种植黑麦草和不同刈割方式对针叶小爪螨及其天敌栗钝绥螨种群数量的影响[J]. 中国生物防治, 24(2): 108-111. |
孙绪艮, 苗良. 1990. 针叶小爪螨研究初报[J]. 山东农业大学学报, 21(3): 41-46. |
孙绪艮, 徐常青, 周成刚, 等. 2000. 针叶小爪螨不同种群在针叶树和阔叶树上的生长发育和繁殖及其生殖隔离[J]. 昆虫学报, 43(1): 52-57. DOI:10.7679/j.issn.2095-1353.2001.015 |
孙绪艮, 尹淑艳. 2002a. 针叶小爪螨—寄主植物—芬兰钝绥相互关系的研究Ⅱ[J]. 挥发性物质在寄主植物—针叶小爪螨—芬兰钝绥螨之间的作用.林业科学, 38(2): 73-77. |
孙绪艮, 尹淑艳, 李波. 2002b. 针叶小爪螨—寄主植物—芬兰钝绥螨相互关系的研究Ⅰ[J]. 针叶小爪螨对寄主植物和芬兰钝绥螨对猎物的嗅觉反应.林业科学, 38(1): 76-81. |
孙绪艮, 周成刚, 张小娣, 等. 1994. 针叶小爪螨对板栗的危害及防治指标初步研究[J]. 山东农业大学学报, 25(2): 202-206. |
孙绪艮, 周成刚, 张小娣, 等. 1995. 针叶小爪螨的滞育研究[J]. 昆虫学报, 38(3): 305-311. |
王慧芙. 1981. 中国经济昆虫志.第23册.螨目叶螨总科[M]. 北京: 科学出版社: 104-106.
|
王源岷, 王英男, 徐筠. 1989. 板栗树针叶小爪螨发生规律及其防治研究[J]. 华北农学报, 4(4): 98-140. |
尹淑艳, 孙绪艮. 2002. 针叶小爪螨—寄主植物—芬兰钝绥螨相互关系的研究Ⅲ[J]. 寄主植物的化学组成与针叶小爪螨生长发育的关系.林业科学, 38(4): 105-110. |
张时敏. 1983. 针叶小爪螨初步观察[J]. 林业实用技术, (3): 30-32. |
Brandenburg R L. 1981. Differences in dorsal integumentary lobe densities between Tetranychus urticae and T. cinnabarinus (Boisduval) from northeastern North Carolina[J]. Int J Acarol, 7: 231-234. DOI:10.1080/01647958108683266 |
Czajkowska B, Ewa P. 2005. Spruce spider mite (Oligonychus ununguis Jacobi) and its predators associated with ornamental coniferous plants in Polish nurseries[J]. Bulletin OILB/SROP, 28: 75-78. |
Czajkowska B, Kielkiewicz M, Puchalska E. 2003. Population parameters as an indicator of susceptibility of ornamental coniferous plants to spruce spider mite[J]. Journal of Plant Protection Research, 43(2): 155-162. |
Kiekiewicz M, Puchalska E, Czajkowska B. 2005. Changes in biochemical composition of needles of ornamental dwarf spruce (Picea glauca 'Conica') induced by spruce spider mite (Oligonychus ununguis Jacobi, Acari: Tetranychidae) feeding[J]. Acta Physiologiae Plantarum, 27: 463-471. DOI:10.1007/s11738-005-0051-1 |
Pritchard A E, Baker E W. 1955. A Revision of the Spider Mite, Family Tetranychidae. Pacific Coast Entomological Society, San Francisco.
|
Przygoda E. 2001. The occurrence of spruce spider mite (Oligonychus ununguis Jacobi) on ornamental coniferous plants in botanical gardens in Poland[J]. Annals of Warsaw Agricultural University, 22: 23-29. |
Puchalska E. 2002. Preliminary studies concerning changes of photosynthetic activity of white spruce (Picea glauca 'Conica') infested by spruce spider mite (Oligonychus ununguis Jacobi)[J]. Annals of Warsaw Agricultural University, 23: 7-10. |
Puchalska E, Tykarska T, Czajkowska B. 2006. Morphological and anatomical factors responsible for varied susceptibility of some species of spruce to infestation by spruce spider mite (Oligonychus ununguis Jacobi)[J]. Acta Physiologiae Plantarum, 28: 599-604. DOI:10.1007/s11738-006-0055-5 |
Richmond D S. 1996. Eclosion time and spatial distribution of overwintering spruce spider mite (Acari: Tetranychidae) eggs on Colorado spruce[J]. Journal of Economic Entomology, 89(2): 447-452. DOI:10.1093/jee/89.2.447 |
Shinkaji N. 1975a. Seasonal occurrence of the winter eggs and environmental factors controlling the evocation of diapause in the common conifer spider mite, Oligonychus ununguis (Jacobi), on chestnut[J]. Japanese Journal of Applied Entomology and Zoology, 19: 105-111. DOI:10.1303/jjaez.19.105 |
Shinkaji N. 1975b. Hatching time of the winter eggs and termination of diapause in the common conifer spider mite, Oligonychus ununguis (Jacobi) on chestnut in relation to temperature[J]. Japanese Journal of Applied Entomology and Zoology, 19: 144-148. DOI:10.1303/jjaez.19.144 |
Shrewsbury P M, Hardin M R. 2003. Evaluation of predatory mite (Acari: Phytoseiidae) releases to suppress spruce spider mites, Oligonychus ununguis (Acari: Tetranychidae), on juniper[J]. Journal of Economic Entomology, 96: 1675-1684. DOI:10.1093/jee/96.6.1675 |
Wanibuchi K, Saito Y. 1983. The process of population increase and patterns of resource utilization of two spider mites, Oligonychus ununguis (Jacobi) and Panonychus citri (McGregor), under experimental conditions[J]. Researches on Population Ecology, 25: 116-129. DOI:10.1007/BF02528787 |
 2010, Vol. 46
2010, Vol. 46