文章信息
- 宋建英
- Song Jianying
- 邓恩桉的组织培养和植株再生
- Bud Micropropagation and Plantlet-transplanting Techniques for Breeding Cold-resistant strain of Eucalyptus dunnii
- 林业科学, 2010, 46(6): 138-145.
- Scientia Silvae Sinicae, 2010, 46(6): 138-145.
-
文章历史
- 收稿日期:2009-05-04
- 修回日期:2010-03-21
-
作者相关文章
作为外来种的桉树(Eucalyptus)具有速生、丰产、优质性能,经济效益显著,南方各省均把它作为最重要的人工林树种。但是桉树的北移造林存在一定风险。20世纪50年代,我国在中亚热带种植大量桉树,但70年代中期遇寒潮袭击,大部分桉树受冻死亡(朱宁华,2000)。邓恩桉(E. dunnii)是种优良的耐寒桉树,能耐-5 ℃低温(Potts et al., 2002), 2004年12月2005年3月福建北部的一场20年一遇的灾害性自然低温逆境, 持续时间较长的、邓恩桉普遍受冻,但其中仍存在少部分未受冻的个体。为从暴露在极端逆境环境下的邓恩桉群体中选择出能够存活下来的抗寒性个体进行培育,繁殖出抗性品系,使桉树的造林能够往北方推进,本研究在2004年底邓恩桉受冻害率最高(达76%)的浦城县盘亭乡,选取冻害等级为0级、1.5年生、生长健壮、树型通直的、树高约1.5 m,胸径4 cm的幸存邓恩桉个体,采集其顶芽和腋芽为试验材料进行微繁研究,以期为邓恩桉抗寒品系的开发利用和进一步的抗寒育种提供技术支撑。
邓恩桉是所有桉树种类中组织培养最难生根的树种之一,主要是酚类物质在生根抑制效应中起着重要的作用,其成年树的组织材料提取液的生物效应、化学鉴定、CC-MS分析等3方面都呈现不同程度的生根抑制作用(朱鹏等,2007)。且生根苗的基部易产生愈伤组织阻滞养分和水分的畅通输导,因而不长根或根长出不到0.5 cm后便停止生长,不长侧根或长很少的不定根,并在根尖处变黑(陈江平,2003)。本研究拟通过培养条件的改善和生长调节物质的调配,降低邓恩桉组培苗基部的愈伤组织形成,提高生根率。
轻基质网袋容器可以利用空气修根,通过空气修根的邓恩桉网袋容器苗可促进多级侧根生长,增大根的表面积,使根系与基质紧密交织为一体,形成富有弹性的根团。这种网袋容器苗在造林时不需脱掉容器,根系可完全穿透容器,水平生长。目前的容器育苗技术方法,仍停留在较粗放状态,现有的研究结果多着重于对容器材料、尺寸大小及基质作定性的探讨(陈辉等,1993),对邓恩桉的轻基质容器育苗未见报道。本文利用林区易得的轻型新基质,运用正交试验法分析不同基质配比对苗生长的影响,确定出较佳轻基质组合来对邓恩桉组培苗进行容器育苗,从而改变上山造林人工费用成本高和桉树裸根苗或有土容器苗造林成活率低的现状。
1 材料和方法 1.1 试验材料和处理方法1) 试验材料 在受冻率最高的福建浦城县盘亭乡,选择50株幸存邓恩桉优良单株作为母株,定期修剪,去顶芽,以使大量的侧枝生长。2005年6月采集腋芽尚未萌发的侧梢和顶梢,贮藏在冰壶内,带回试验室备用。
2) 材料处理方法 将侧梢或顶梢除去叶片,剪成1~2 cm的带芽茎段,用洗洁精清洗1~2 min,流水冲洗30 min以上。在超净工作台上用70%的酒精消毒15 s,无菌水冲洗3次,再用0.1%升汞水消毒3~4 min,无菌水冲洗4~6次。滤纸吸干水分,切成0.5~1.0 cm的带芽节段,用于接种。
1.2 组织培养和植株再生试验方法1) 芽茎段诱导培养基和诱导条件的选择和优化 芽茎段诱导采用MS,B5,1/2MS, H和改良H等5种基本培养基。在选出最佳基本培养基种类后,细胞分裂素采用KT0.5,0.8,1.0 mg·L-1;生长素NAA采用0.05,0.08,0.1 mg·L-1;半胱氨酸采用10,20,30 mg·L-1 3个浓度水平,进行3因素、3水平的正交试验L9(34)。以上培养基各配方糖用量为30 g·L-1,pH值为5.6。按每升40瓶的规格分装到沙茶酱瓶内,照常规的高压消毒方法进行灭菌。
每种处理接种40个芽茎段,试验重复3次。将接种后的芽茎段均分成6个组,分别进行光处理和暗处理,暗处理的天数为4,7,10,13,16天,以光处理作为对照。外植体诱导30天后,统计出芽时间、出芽率、芽增殖系数、芽均高、有效芽比率,再进行综合评分。
2) 继代培养基和培养条件的选择和优化 是以改良MS为有效芽的继代基本培养基(欧阳磊, 2006),以不同的KT,NAA,半胱氨酸等作为植物生长调节物质进行调配。其中KT设0.5,0.8,1.0 mg·L-1,NAA设0.05,0.08,0.10 mg·L-1,半胱氨酸设10,20,30 mg·L-1 3个水平,采用L9(34)正交试验设计,共9个试验号,每个试验号接种30个芽茎段,试验重复3次。继代培养的环境条件采用太阳光照、日光灯光照和散射光照。30天后统计各试验的新芽个数、芽均高。
3) 生根培养基和培养条件的选择和优化 以1/2MS作为生根基本培养基,先选择适宜的5号ABT生根粉浓度,再进一步分别添加IBA0.01, 0.1 mg·L-1 (并以不添加5号ABT生根粉,以1/2MS+IBA0.01 mg·L-1和1/2MS +0.1 mg·L-1作为对照)对生根培养基进行优化。各生根培养基中添加蔗糖20 g·L-1,卡拉胶6.5 g·L-1,pH值5.8。每处理接种50个茎芽,试验重复3次。30天后统计生根段数、生根率、平均根条数和平均根长。
采用一步生根法和两步生根法对邓恩桉继代苗进行生根培养试验,即先将组培苗接种在1/2MS+5号ABT 1.0~1.5 mg·L-1+IBA 0.01 mg·L-1生根培养基上,培养10天后转入不含生长调节物质的培养基中,再培养20天后进行调查统计。而一步生根法是在1/2MS+5号ABT 1.0~1.5 mg·L-1+IBA 0.01 mg·L-1生根培养基培养30天后分别统计各试验的生根率、平均每株根条数苗高,以及茎基部愈伤组织生长的情况。
1.3 邓恩桉再生植株的移栽1) 移栽基质 邓恩桉生根苗的下地种植采用轻基质网袋容器育苗。轻基质的主要原料是经风化打碎的杉木(Cunninghamia lanceolata)树皮、木屑、谷壳和泥炭土等,按邓恩桉生长的需要添加复合肥,各种原料按体积比(%)配制,设计3水平、4因子的正交试验L9(34),试验重复3次。移栽对照的培养基质体积比为:黄心土50%+火烧土48%+复合肥2%。各种基质在使用之前均采用0.3%高锰酸钾浇灌,覆盖塑料薄膜7~8天后,掀掉薄膜5天。各种基质容器均为网袋,由中国林业科学研究院工厂化育苗研究中心研制。
2) 移栽方法 移栽前先将高度为(1.5±0.2) cm生根的邓恩桉试管苗移入炼苗室,进行变温驯化3~5天;再将组培瓶打开,进行有菌条件驯化3~5天后,将生根的试管苗用清水轻轻洗掉根部黏附的培养基,根部蘸上多菌灵和黄心土相拌的黄泥浆后,移栽到事先准备好的上述基质内。采用不同基质移栽后的生根苗,均在穴盘上搭拱形架,覆盖薄膜以保温保湿。
2005年12月将邓恩桉生根苗移栽到容器内, 至2006年3月每月28日或29日进行苗木高生长观测10株,共40株。于2006年3月28日(苗龄4个月)观测的苗木平均高,按H±S标准每处理选取5株标准株,于4月1日至5日测定苗木高度、地径、苗木地上部分鲜重。上述各项目测定完毕后,将苗木置于室内自然风干,于5月14日测定苗木地上部分干重。
1.4 统计分析所有的试验都进行3次或3次以上的重复。采用SAS软件对数据进行单因素方差分析及Duncan法进行多重比较。
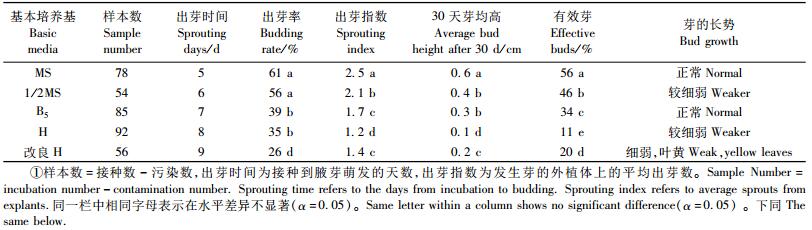
2 结果与分析 2.1 诱导培养基、诱导条件的选择和优化对芽茎段诱导的影响1) 诱导培养基对芽茎段诱导的影响 从表 1可知:5种培养基均能诱导腋芽萌发,但在不同基本培养基上,萌芽后生长势不同。在MS培养基中,出芽率为61%,芽增殖系数为2.5,有效芽数量为56%,继代中芽的长势好;1/2MS培养基中芽的出芽率比MS培养基稍低,但芽的长势较细弱;B5, H和改良H培养基中芽的出芽率比MS培养基低,无效芽数量多,在继代培养中芽生长很慢,不适宜作为丛生芽诱导的基本培养基;改良H培养基芽的出芽率最低,出芽后几乎不能生长,大约4~5天后就死亡。对不同基本培养基对芽茎段诱导效果进行显著性分析表明: MS与1/2MS相比,除对出芽率的诱导差异不显著外(P>0.05),其他生长因子差异均显著(P<0.05);而MS与B5,H和改良H相比,所有生长因子差异均显著。因此,MS可作为诱导邓恩桉芽茎段的首选基本培养基。
|
|
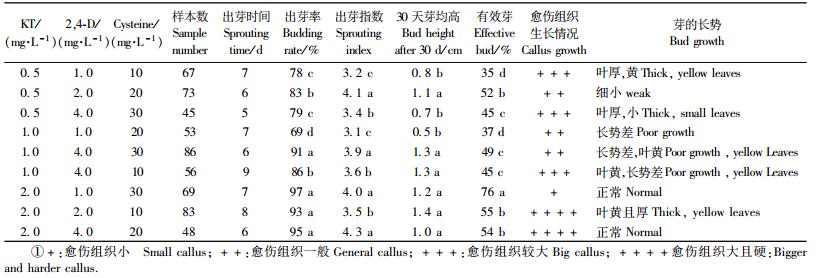
从表 2可知:在MS基本培养基中加入不同浓度的KT,NAA和半胱氨酸,可提高邓恩桉芽的诱导分化能力,降低褐变率。与采用单一的基本培养基(表 1)比较,芽茎段诱导的出芽率和芽均高以及有效芽比率增加,但芽基部均具愈伤组织。9种培养基配方的培养结果可见:当MS培养基中添加KT 1.0 mg·L-1,NAA 0.05 mg·L-1,半胱氨酸30 mg·L-1(7号),芽茎段诱导的芽长势正常,基部的愈伤组织小,褐变率有效芽达76%。对不同培养基配方对芽茎段诱导效果进行显著性分析表明: 7号培养基诱导的有效芽与其他8种培养基诱导的差异显著,因此,MS+KT 1.0 mg·L-1+NAA 0.05 mg·L-1+半胱氨酸30 mg·L-1是本试验中茎段诱导的最佳培养基配方。
|
|
2) 诱导条件的选择对芽茎段诱导的影响 将接种后的芽茎段分别进行光处理和暗处理。从图 1可知:光处理的褐化率高,出芽率低;暗培养10天,出芽率最高,褐化率中等。因此,在采用邓恩桉芽茎段作为外植体时,应在接种后,对外植体进行暗培养10天,才能降低外植体的褐化率,提高出芽率。
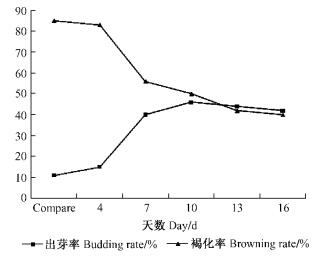
|
图 1 暗培养对芽茎段诱导的影响 Figure 1 Effect of dark culture on bud induction |
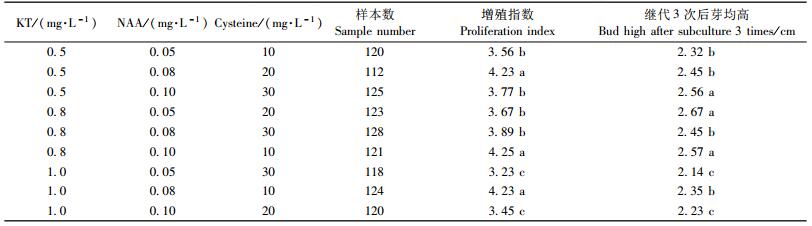
1) 继代培养基的选择和优化对芽继代增殖的影响 从表 3可知:改良MS+KT0.8 mg·L-1+NAA1.0 mg·L-1+半胱氨酸10 mg·L-1 (6号)对邓恩桉芽的继代增殖影响最大,其增殖指数可达4.25,继代3次后芽均高达2.14 cm。通过生长调节物质的选择和调配对增殖指数影响的方差分析可知:KT对邓恩桉芽增殖指数呈显著性影响,而NAA和半胱氨酸对邓恩桉芽增殖指数的影响不显著。对不同生长调节物质对芽继代增殖结果进行显著性分析表明:改良MS+KT0.8 mg·L-1+NAA1.0 mg·L-1+半胱氨酸10 mg·L-1 (6号)对芽继代增殖指数和继代3次后芽均高的2个指标与在其他8种培养基上芽继代增殖的2个指标差异显著。因此,6号培养基可用来作为继代增殖的培养基配方。邓恩桉继代增殖生长情况见图 2和图 3。
|
|

|
图 2 邓恩桉芽苗在6号培养基上生长情况 Figure 2 E. dunnii grow in Medium 6 |

|
图 3 邓恩桉芽苗在1号培养基上生长情况 Figure 3 E. dunnii plantlets grow in Medium 1 |
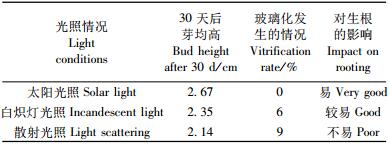
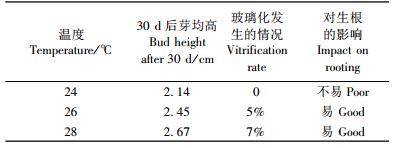
2) 继代培养条件对芽增殖的影响 从表 4和表 5可知:继代培养条件中尽量采用太阳光照或照度大约为3 000 lx的日光灯光照,温度调整在26~28 ℃,可降低继代苗玻璃化程度,对继代苗高生长和生根培养均有利。
|
|
|
|
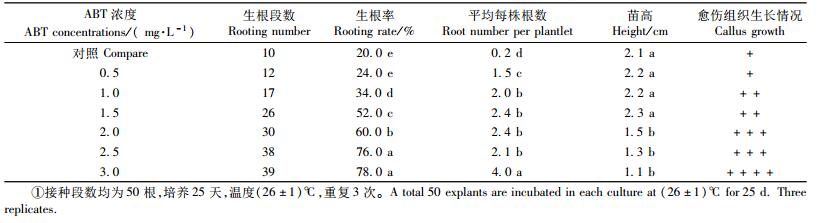
1) 生根培养基的选择和优化对试管苗生根的影响 从表 6可知:茎芽的生根率和平均每株根条数随ABT浓度的增加而增加,在浓度达到3.0 mg·L-1时,上述2项指标达到最大值。通过对不同浓度的ABT生根粉对生根苗影响效果进行显著性分析表明:ABT浓度在0~1.5 mg·L-1范围内,苗高差异不显著,但与浓度为2.0~3.0 mg·L-1范围内生根苗的苗高差异显著;当浓度为2.5~3.0 mg·L-1时,其生根率和浓度为0~2.0 mg·L-1的生根率差异显著;而平均每株根条数在浓度3.0 mg·L-1时,与浓度为0~2.5 mg·L-1的根条数差异显著。但随着ABT浓度的增加,苗茎基部的愈伤组织也相应增大。当浓度超过1.5 mg·L-1时,愈伤组织体积明显增大。这时根不是从茎皮层长出,而是从愈伤组织中形成。同时随着愈伤组织的增大,苗高生长受到抑制。当ABT浓度达到3.0 mg·L-1时,生根率虽然达到78%,平均每株根条数达到4.0,但苗高仅1.1 cm,愈伤组织的体积为最大。因此邓恩桉的生根培养,如果只采用1种5号ABT生根粉作为生长素类物质,在1/2MS基本培养基中,ABT生根粉的浓度不能超过1.5 mg·L-1。
|
|
从表 7可知:当IBA浓度均为0.01 mg·L-1时,随着ABT浓度的提高,生根率和平均每株根条数也随着提高;但当ABT浓度达到或超过1.5 mg·L-1时,试管苗的基部愈伤组织开始增大。当IBA浓度为0.1 mg·L-1时,随着ABT浓度的提高,生根率也随着提高,但苗茎基部的愈伤组织随之增大明显。通过对不同浓度的ABT和IBA组合对生根苗影响效果进行显著性分析表明:当IBA浓度为0.01 mg·L-1,ABT浓度为3.0 mg·L-1时,其生根率与ABT浓度为0~2.0 mg·L-1的差异显著,但愈伤组织大且硬,不利于今后的下地种植;而平均根条数在ABT浓度为2.0~3.0 mg·L-1时,差异不显著;苗高生长在ABT浓度为0~1.0 mg·L-1范围内,差异不显著,但与ABT浓度为1.5~3.0 mg·L-1的苗高生长差异显著。当IBA浓度为0.1 mg·L-1,ABT浓度在1.5~2.0 mg·L-1范围内,其生根率、平均根条数和苗高生长差异不显著,但愈伤组织大且硬,不利于今后的下地种植;而在1/2MS+ABT0.5 mg·L-1 +IBA0.1 mg·L-1培养基中,愈伤组织较小,生根率和根条数比单独使用0.1 mg·L-1 IBA的差异显著。因此,从不同浓度的ABT和IBA组合对邓恩桉生根苗的各项生长因子(特别是愈伤组织生长的情况和提高今后下地种植成活率)综合进行考虑,3号培养基:1/2MS+ABT1.0 mg·L-1 +IBA0.01 mg·L-1或8号培养基:1/2MS+ABT0.5 mg·L-1 +IBA0.1 mg·L-1是邓恩桉生根最佳的ABT和IBA组合。
|
|
对比表 6和表 7数据,ABT与IBA 2者配合使用,芽苗的生根率比单独使用ABT的高。2者配合使用时,生根率是单独使用ABT的2.7~8倍,平均每株根条数是单独使用ABT的1.7~6倍,芽的高生长也明显提高。说明不同浓度的ABT和IBA的组合比单独使用ABT对组培苗的生根有显著的影响。
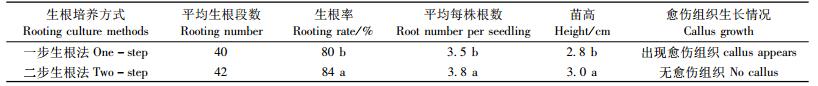
2) 两步生根法对生根的影响 从表 8可知:在一步生根法中,邓恩桉平均生根段数为40,生根率为85%,平均每株根条数为3.5,苗高为2.8 cm,愈伤组织仍会产生(图 4)。在两步生根法中,邓恩桉平均生根段数为42,生根率为84%,平均每株根条数为3.8,苗高为3.0 cm,愈伤组织生长受到抑制(图 5)。通过对2种不同生根法对生根苗生长因子进行显著性分析表明,两步生根法培养的组培苗其生根率、平均每株根条数和苗高生长与一步生根法的差异显著。特别是经两步生根法培养的生根苗基部愈伤组织生长受抑制,这种苗根的维管束系统与茎的维管束系统直接相连,有利于提高生根苗的下地移栽成活率。
|
|

|
图 4 邓恩桉在一步生根法中根的生长情况 Figure 4 E. dunnii root growth in one-step rooting method |

|
图 5 邓恩桉在两步生根法中根的生长情况 Figure 5 E. dunnii root growth in two-step rooting method |
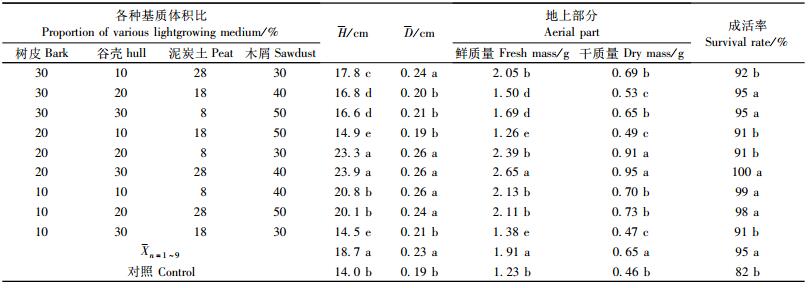
从表 9可知:邓恩桉生根苗在9种轻基质配比的容器苗高生长的平均值为18.7 cm,比对照的14.0 cm高4.7 cm;地径平均值为0.23 cm,比对照的0.19 cm粗0.04 cm;地上部份的平均干重和平均鲜重分别为1.91和0.65 g,比对照的1.23和0.46 g分别重0.67和0.19 g;平均成活率达95%,比对照的82%提高13%。通过对9种轻基质配比栽培苗木生长性状的平均值和有土栽培的进行比较表明:轻基质容器育苗的各种生长性状都显著地高于有土栽培的苗木。
|
|
通过对9种轻基质配比基质中苗木生长性状进行方差分析表明,在6号基质(20%+谷壳30%+木屑40%+泥炭土28%+复合肥2%)生长的苗木各生长性状为最好,苗木的移栽成活率达100%。移栽成活的邓恩桉轻基质容器苗生长情况见图 6。

|
图 6 移栽成活的邓恩桉轻基质容器苗 Figure 6 Plantlets in light growing medium |
用邓恩桉的芽茎段进行诱导,最常见的问题是外植体的褐变。其原因一是由于细胞受胁迫条件或其他不利条件影响所造成的细胞死亡(称为坏死)而形成的;二是因为酚类物质所引起。通常的做法是将抗坏血酸作为抗氧化剂添入培养基,对基部褐变的抑制作用明显,但使用浓度过大,pH值很难调节,培养基不凝固(郭洪英等,2008)。本试验结果表明:当MS培养基中添加半胱氨酸10~30 mg·L-1,其他药物成分不变,培养基的凝固性好,对芽茎段褐变有一定抑制作用,尤以添加半胱氨酸30 mg·L-1浓度处理的效果好。对外植体进行暗处理10天后再光照培养,能显著降低外植体的褐化率,提高出芽率。桉属树种的茎段必须通过外界物理或化学条件的刺激才能产生诱导根原基。根原基既可从皮部直接形成,也可先形成愈伤组织后再产生根原基(朱鹏等,2007),直接形成根原基具有生根时间短、根茎结合度高的优势。而由愈伤组织再分化产生的根,其维管束系统与茎芽皮层的输导系统不联通,下地种植吸收水分差,较难成活(Brooker et al., 2002;Marcucci et al., 2003;王蒂,2004)。因此如何避免茎段愈伤组织的发生、促进皮部直接生根是桉树生根研究的关键。然而邓恩桉对激素特别敏感,即使加入低浓度单一生长素邓恩桉的组培苗基部也会产生愈伤组织(欧阳磊,2006)。林彦等(2007)采用IBA浓度(0.05~0.5)mg·L-1时,邓恩桉芽基部的愈伤组织少,由芽茎直接生根不是从愈伤组织上生根。但无具体数据说明。本研究通过ABT和IBA组合,结果显示:邓恩桉芽苗在1/2MS+ABT0.5 mg·L-1 +IBA0.1 mg·L-1培养基上,比单独使用0.1 mg·L-1 IBA培养效果好,其愈伤组织较小,生根率为62%~66%,根条数可达3.0。为使邓恩桉芽苗基部的愈伤组织降到最小,欧阳磊(2006)采用在培养基S + IBA 3mg·L-1+蔗糖2%暗培养9天后转接到不含激素的培养基上进行光照培养,其中24, 25号无性系的生根率达到80%以上。本研究以一步生根法为对照,采用1/2MS+ABT1.0 mg·L-1 +IBA0.01 mg·L-1培养基和培养10天后转入不含生长调节物质的培养基中,再培养20天后的两步光照培养生根法,邓恩桉生根率为84%,平均每株根条数为3.8,苗高为3.0 cm,愈伤组织生长受到抑制。采用这种两步生根法提高了生根率达4%。试验取得较大的突破,基本解决邓恩桉组培苗难生根的问题。
容器育苗与大田裸根苗相比最大的特点是:适于多种立地类型与不同季节栽植,在不同的空间与时间里造林的成活率都比较高。以往容器苗生产应用实际情况存在不完善之处:一是采用薄膜容器,育苗装土操作不便,苗木根系不发达且易形成扭曲,苗木质量差,在起苗与搬运时容器易破损,又不能回收利用,造成环境污染。二是基质一般以土为主,保水通气性能差,不利于苗木根系生长,且土重搬运劳动强度大(温中林等,2008)。王军等(2005)对桉树的扦插育苗使用松树皮:甘蔗渣:黄心土:珍珠岩按5:2:2:4的配方制成的基质,装入9×9(81)株苗的穴盘中,可以在生根率,平均根数,每株根长度等一系列指标中达到较优的水平,其中生根率达到77%。目前对邓恩桉组培苗的轻基质容器育苗研究未见报道。本研究填装轻基质育邓恩桉组培苗采用的容器为无纺布,这是1种透气、无毒、柔韧、耐用且能自行降解的材料。试验表明:对邓恩桉抗寒品系的生根试管苗采用树皮20%+谷壳30%+木屑40%+泥炭土28%+复合肥2%的轻基质网袋容器育苗,4个月苗龄高生长量达23.9 cm,移栽成活率达100%,比用黄心土作对照的移栽成活率82%提高18%。这说明轻基质对邓恩桉组培苗的影响比较大,这可能是由于树皮、谷壳、木屑等空气孔隙大,组培苗的基部有充足的氧气,而桉树生根的过程需要大量的氧气。采用轻基质网袋育苗有利于邓恩桉根系的发生,利于水分的吸收,这是解决邓恩桉组培苗移栽的技术关键,提高了移栽存活率,苗木生长健壮。轻基质容器苗上山造林时,搬运劳动强度比装土薄膜容器苗的小,从而提高经济效益。
本文仅研究少数几种在南方可能作为轻型育苗基质的材料,还有椰糠、松果等可以作为邓恩桉育苗轻基质值得进一步的研究,以使轻型基质育苗能产生更好的经济效益。为了深入研究轻型基质育苗的效果,还需要对苗木进行造林试验,从而检验苗木的抗性和生长能力与传统的黄土袋苗有无差别。
陈辉, 洪伟, 林光先, 等. 1993. 马尾松轻型基质容器育苗技术的研究[J]. 福建林学院学报, 15(4): 319-326. |
陈江平. 2003. 不同植物生长素对桉树不同无性系组培生根影响的试验[J]. 广西林业科学, 32(1): 50-55. |
郭洪英, 陈炙, 杨晓蓉, 等. 2008. 影响桉树组培苗根系发育关键因子的研究[J]. 四川林业科技, 29(1): 20-26. |
洪伟. 1997. 林业试验设计技术与方法[M]. 北京: 科学技术出版社: 205-211.
|
李浚明. 2002. 植物组织培养教程[M]. 2版. 北京: 中国农业大学出版社: 1-38.
|
李淑仪, 徐胜光. 2003. 桉树微量元素营养功能研究[J]. 北京林业大学学报, 25(2): 94-97. |
林彦, 谢耀坚. 2007. 邓恩桉组织培养技术研究[J]. 桉树科技, 24(1): 16-21. |
马英, 刘友全, 欧阳磊. 2006. 邓恩桉组培中影响继代增殖条件的研究[J]. 林业科技开发, 20(1): 16-18. |
欧阳磊. 2006. 邓恩桉组培生根影响因子的研究[J]. 福建林学院学报, 26(1): 78-82. |
王蒂. 2004. 植物组织培养[M]. 北京: 中国农业出版社: 164-168.
|
温中林, 李荣珍, 罗达珍, 等. 2008. 尾叶桉苗木轻型营养基质配方研究[J]. 安徽农业科学, 36(12): 4973-4976. DOI:10.3969/j.issn.0517-6611.2008.12.074 |
谢耀坚. 2001. 桉树组织培养研究进展[J]. 世界林业研究, 13(6): 14-19. |
朱鹏, 徐建民. 2007. 邓恩桉组织材料生根抑制物研究[J]. 安徽农业科学, 35(32): 10236-10238, 10560. DOI:10.3969/j.issn.0517-6611.2007.32.025 |
朱宁华, 李志辉, 李芳东. 2000. 桉树耐寒性与超氧化物歧化酶关系研究[J]. 中南林学院学报, 20(3): 63-66. |
Brooker M I H, Kleining D A. 2002. Field Guide to Eucalyptus[M]. South-eastern Australia: Inkata Press: 121-135.
|
Marco M A, Lopezh J A. 1995. Performance of Eucalyptus grandis and Eucalyptus dunnii in the Mesopotamia region, Argentina. CRC for Temperate Hardwood Forestry -IUFRO[M]. Hobart: Hobart Press: 40-45.
|
Marcucci P S N, Zelener N, Rodriguez J, et al. 2003. Selection of a seed orchard of Eucalyptus dunnii based on genetic diversity criteria calculated using molecular markers[J]. Tree Physiology, 15: 625-632. |
Potts B M, Barbour R C, Hingston A B, et al. 2002. Genetic pollution of native Eucalyptus gene pools-identifying the risks[J]. Australia Journal of Botany, 12: 11-25. |
 2010, Vol. 46
2010, Vol. 46