文章信息
- 杜克兵, 许林, 涂炳坤, 沈宝仙
- Du Kebing, Xu Lin, Tu Bingkun, Shen Baoxian
- 淹水胁迫对2种杨树1年生苗叶片超微结构和光合特性的影响
- Influences of Soil Flooding on Ultrastructure and Photosynthetic Capacity of Leaves of One-year Old Seedlings of Two Poplar Clones
- 林业科学, 2010, 46(6): 58-64.
- Scientia Silvae Sinicae, 2010, 46(6): 58-64.
-
文章历史
- 收稿日期:2009-03-20
- 修回日期:2010-03-07
-
作者相关文章
2. 湖北省武汉市林业果树科学研究所 武汉 430075
2. Scientific and Research Institute of Forestry and Fruit Sciences of Wuhan City of Hubei Province Wuhan 43007
涝害是世界上许多国家的重大自然灾害之一。世界上水分过多的耕作地土壤约占全部耕作土壤的12%。我国目前有涝渍土地65.94万km2,占国土总面积的6.6%,主要分布在长江和黄河的中下游地区,仅长江中下游沿江就有江、河、湖滩地约60万hm2。这些地区经常会受到降雨等洪涝灾害的影响,在很大程度限制植物的生长,甚至导致植株死亡。随着20世纪80年代“兴林灭螺”项目的实施,杨树(Populus)由于耐水湿的特性,已经成为长江中下游平原水网区及季节性淹水滩地工业原料林、生态防护林建设的首选树种。例如,2002年我国仅在湖北、湖南、安徽的河滩地区就营造杨树林约6.9×102 km2。开展杨树耐涝性研究对我国南方广大地区经济建设和生态环境保护具有重要意义(李义良等,2009)。
淹水胁迫会引起植物形态、解剖、生理和代谢等多方面的变化(Toai et al., 2001)。光合作用是杨树生长发育和生物量积累的基础,目前淹水条件下杨树光合响应机制还不清楚。叶片细胞中含有光合作用的全部机构,是植物最主要的光合部位。魏和平等(2000)的研究表明:淹水胁迫下玉米(Zea mays)植株的死亡与叶片细胞超微结构的损伤密切相关,而杨树叶片细胞超微结构对淹水胁迫的响应尚未见报道。深入研究淹水胁迫对杨树超微结构的影响,将有助于从解剖学角度阐明其抗涝机制。已有研究表明:不同杨树品种间耐涝能力差异极大。有些品种在长期淹水的条件下仍能成活,并获得产量,而有些品种短期淹水后产量即极大降低,甚至死亡(Cao et al., 1999; Du et al., 2008; Gong et al., 2007), 对比研究不同杨树耐涝能力和耐涝机制很有必要。本研究选取2个耐涝性差异明显的杨树无性系进行对比淹水试验,从细胞学角度初步探索杨树叶片超微结构对淹水胁迫的响应,以期为杨树的耐涝机理研究以及湿涝地区杨树品种的选择、栽培和抗涝新品种的培育提供参考。
1 材料与方法 1.1 试验材料Ⅰ-69杨(P. deltoides cv. Lux ex Ⅰ-69/55)与小叶杨(P. simonii), Ⅰ-69杨的抗涝性强,而小叶杨的抗涝性差。
1.2 试验方法 1.2.1 试验材料培养2007年3月上旬,选取Ⅰ-69杨和小叶杨大小基本一致的1年生枝条,剪成带3~4个芽的长约15 cm的插穗。插穗在自来水中浸泡12 h后扦插于35 cm×40 cm的塑料桶中,每桶3株,桶底有3个排水孔。土壤成分为轻壤土:沙:泥炭土=6:1:1,pH=5.7。所有材料于温室内扦插,待插穗成活后拔除部分植株,每桶仅留2株,生长20天后将所有植株搬到自然条件下培养。
1.2.2 试验地概况试验于华中农业大学校园内(30°28′ N, 114°21′ E)进行。该地区气候温和,年平均温度16.3 ℃,无霜期240天,年降雨量1 269 mm,大部分雨量集中在6—8月。
1.2.3 淹水试验全部植株生长65天后,平均高度达到80~90 cm,随后开始淹水试验。所有植株随机分配到3个处理中: 1)对照:正常浇水(CK); 2)淹水10 cm (Flooding); 3)淹没(Submergence),3区组,每区组4株,随机排列。淹水胁迫15天,其中对照植株每天浇水,保持土壤含水量为田间持水量的70%左右; 淹水植株置于70 cm深的人工水池中,使水面高出土壤表面10 cm; 淹没植株置于约150 cm深的人工水池中,使水面高出植株顶端。两种淹水处理过程中不断向水池中灌水,以保持水位深度和水面温度。自来水溶氧量约6.3 mg·L-1,采用水体溶氧测定仪测定(奥立龙805A)。
1.2.4 数据观测1) 苗高、地径:淹水胁迫的第0天, 15天测定全部植株的苗高、地径。
2) 叶片气体交换参数、叶绿素荧光:淹水胁迫的第8和15天分别测定2个无性系各处理的叶片气体交换参数与叶绿素荧光,每处理5株。测定于室外自然条件下进行,每次测定固定植株顶端第5片完全展开的叶片,于上午9: 00—11: 00进行。淹没植株测定时将底部托起,使其中上部叶片离开水面,用吸水纸擦干叶片,自然干燥2~3 min后开始测定。气体交换参数采用便携式光合测定仪测定(PP Systems, Inc., 英国),测定内容包括:净光合速率(Pn)、蒸腾速率、气孔导度、叶面温度、光照强度等。叶绿素荧光采用叶绿素荧光测定仪测定(Hansatech-instruments,Inc., 英国),测定内容包括:最大荧光(Fm)、可变荧光(Fv)、初始荧光等。叶绿素荧光测定前,先在自然条件下暗适应15 min。
3) 叶片的叶绿素、蛋白质含量:淹水胁迫的第8和15天采集植株顶端的第4~5片完全展开的叶片,去掉主脉,用于分析,每品种每处理4次重复。叶绿素含量按照李合生(2000)方法测定,蛋白质含量利用南京建成生物工程研究所试剂盒及考马斯亮兰法测定。
4) 叶片细胞超微结构:淹水胁迫的第8和15天,采集淹水10 cm和对照植株顶端的第5片完全展开的叶片,于靠近叶脉处的同一部位取材,取材大小为1 mm ×1 mm。将材料放入预冷的2.5%戊二醛中前固定4 h(4 ℃),0.1 mol·L-1磷酸缓冲液(pH= 7.2)漂洗3次,每次20 min。然后转移至1%锇酸中后固定4 h(4 ℃),丙酮梯度脱水,之后用SPI-812树脂渗透、包埋,Leica UC6超薄切片机切成60~80 nm超薄切片,醋酸铀-柠檬酸铅双染色,用日立H-7650型透射电镜观察,Gatan 832数字成像系统拍照。
1.2.5 数据分析图表中的数据均为平均值±SE。方差分析(ANOVA)、多重比较(Duncan)采用SAS8.1统计软件分析。采用淹水变化率分析淹水胁迫对植株造成的影响,淹水变化率=(正常浇水-淹水胁迫)/正常浇水×100%。
2 结果与分析 2.1 形态与生长试验期间,所有对照植株(CK)均正常生长,没有出现落叶和死亡现象,而淹水胁迫(淹水10 cm, 淹没)植株的形态产生明显变化,包括叶片的展开与生长速度减缓、叶片变黄、枯萎和脱落、皮孔膨大、根系死亡等。除个别植株于第14天出现极短的不定根外,多数植株在淹水结束前未形成不定根。至试验结束,对照, 淹水10 cm, 淹没处理下,Ⅰ-69杨的成活率均为100%,而小叶杨的成活率则分别为100%, 58.33%和0,充分说明Ⅰ-69杨的抗涝性强,小叶杨的抗涝性差。小叶杨的淹没植株在离开水体30 min后叶片全部枯萎。
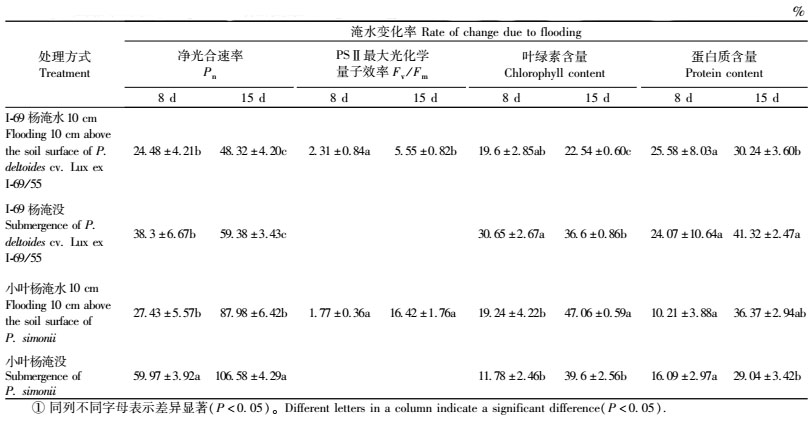
淹水胁迫(淹水10 cm, 淹没)显著抑制杨树的苗高和地径生长,随着胁迫程度的增加抑制作用增强(图 1)。相同处理下,Ⅰ-69杨的苗高和地径生长均显著大于小叶杨(P<00.01)。淹水变化率显示: Ⅰ-69杨(淹水10 cm)和Ⅰ-69杨(淹没)苗高的变化率分别为7.48%和36.35%,而小叶杨(淹水10 cm)和小叶杨(淹没)苗高的变化率分别为28.49%和53.08%。Ⅰ-69杨(淹水10 cm)和Ⅰ-69杨(淹没)地径的变化率分别为-8.41%和16.72%,而小叶杨(淹水10 cm)和小叶杨(淹没)地径的变化率分别为31.76%和52.34%。小叶杨的苗高、地径生长的淹水变化率均显著大于Ⅰ-69杨,说明淹水胁迫对小叶杨造成的伤害比Ⅰ-69杨大,这与2者成活率的结果一致。
|
图 1 淹水胁迫对Ⅰ-69杨、小叶杨的苗高、地径生长的影响 Figure 1 Influence of soil flooding on growth of height and root-collar diameter of P.deltoides cv. Lux ex Ⅰ-69/55 and P. simonii (Mean ± S.E., n=12) 柱形图上不同字母表示差异显著(P<0.05)Bars labeled with different letters are significantly different(P<00.05)。下同。The same below. |
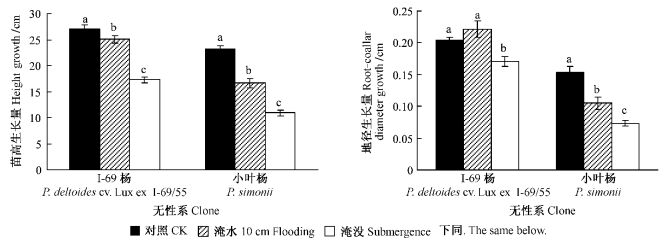
淹水胁迫(淹水10 cm, 淹没)下,Ⅰ-69杨与小叶杨叶片的净光合速率(Pn)和PSⅡ最大光化学量子效率(Fv/Fm)显著下降,且随淹水时间的延长和胁迫程度的加重而降低(图 2)。Pn与Fv/Fm的降低,说明叶片受到淹水胁迫的伤害,PSⅡ损伤,电子传递活性和光化学量子产量降低,出现光抑制现象。Ⅰ-69杨与小叶杨之间差异显著(P<00.01)。相同淹水处理下,Ⅰ-69杨的Pn与Fv/Fm降低的幅度均小于小叶杨。淹水变化率显示:随着淹水时间的延长,Ⅰ-69杨与小叶杨间的差异变得越来越显著(表 1)。相同处理下,小叶杨的淹水变化率显著大于Ⅰ-69杨,说明淹水胁迫对小叶杨叶片光合性能的影响显著大于Ⅰ-69杨,这与2者成活率和生长量的结果一致。
|
图 2 淹水胁迫对Ⅰ-69杨、小叶杨的净光合速率(Pn)、PSⅡ最大光化学量子效率(Fv/Fm)的影响 Figure 2 Influence of soil flooding on netphotosynthetic rate (Pn) and potential efficiency of primary conversion of light energy of PSⅡ (Fv/Fm) of P. deltoides cv. Lux ex Ⅰ-69/55 and P.simonii |
|
|
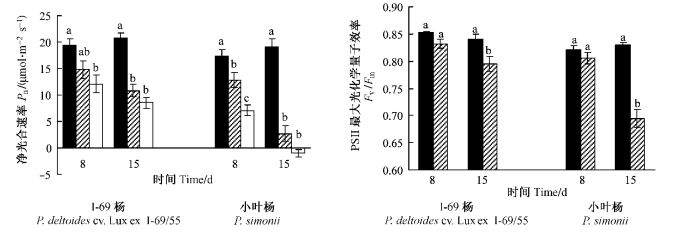
2种淹水胁迫(淹水10 cm, 淹没)显著降低叶片的叶绿素和蛋白质含量(图 3),且随淹水时间的延长和胁迫程度的增加而加重。Ⅰ-69杨与小叶杨对淹水胁迫的响应显著不同(P<00.01)。相同淹水处理下,小叶杨叶绿素含量降低的幅度大于Ⅰ-69杨,而蛋白质含量的变化无明显规律。淹水变化率显示:随着淹水时间的延长,Ⅰ-69杨与小叶杨间的差异变得越来越显著(表 1),这与2者Pn与Fv/Fm的变化规律基本一致。相同处理下,小叶杨叶绿素含量的淹水变化率显著大于Ⅰ-69杨,表明淹水胁迫对小叶杨叶片光合性能的影响更大。
|
图 3 淹水胁迫对Ⅰ-69杨、小叶杨鲜叶的叶绿素、蛋白质含量的影响 Figure 3 Influence of soil flooding on chlorophyll and protein contents of fresh leaves of P. deltoides cv. Lux ex Ⅰ-69/55 and P. simonii |
正常处理下,Ⅰ-69杨与小叶杨的叶片超微结构一致。叶片细胞呈长柱状,细胞壁厚,细胞质浓,液泡膜清晰,细胞核近圆球形,核膜清晰、完整,内部的染色质均匀分布。细胞内叶绿体数量丰富,长椭圆形,沿细胞壁单行排列。叶绿体被膜清晰,靠近细胞壁的一面较平直且紧贴细胞壁,面向中央液泡的一面凸起(图版Ⅰ-A),这样的分布有利于叶绿体同外界进行气体交换。叶绿体内部基粒类囊体和基质类囊体丰富,排列整齐,与叶绿体长轴基本平行。基粒片层结构发达、排列紧密,片层空间小。基质中嗜锇体少,体积小。淀粉粒丰富,体积大,占到叶绿体体积的大部分(图版Ⅰ-A, H)。紧靠叶绿体旁分布着数量丰富的线粒体。线粒体结构完整,圆型或椭圆型,膜清晰,内嵴丰富,基质浓(图版Ⅰ-B, Ⅰ)。所有超微结构的特点都说明对照叶肉细胞发育良好,结构完整,具有正常的光合作用功能。
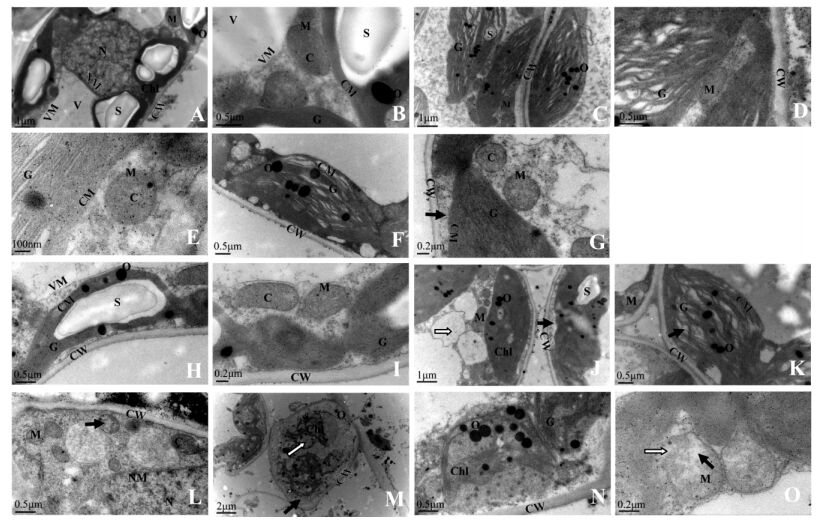
|
图版Ⅰ Plate Ⅰ Ⅰ-69杨: A.正常处理; B.正常处理; C.淹水8天:基粒片层空间变大; D.淹水8天:基粒片层轻度扭曲; E.淹水8天:叶绿体被膜、线粒体基本正常; F.淹水15天:基粒片层扭曲,片层空间变大; G.淹水15天:出现质壁分离(→所示),叶绿体被膜、线粒体正常。 小叶杨: H.正常处理; I.正常处理; J.淹水8天:出现质壁分离(→所示)和多泡现象( 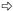 所示); K.淹水8天:基粒片层扭曲,空间变大(→所示); L.淹水8天:少量线粒体内嵴解体,出现空泡现象(→所示),细胞核变形; M.淹水15天:细胞变圆,叶绿体被膜消失,完全质壁分离(→所示),基粒片层大量解体,空间严重变大( 所示); K.淹水8天:基粒片层扭曲,空间变大(→所示); L.淹水8天:少量线粒体内嵴解体,出现空泡现象(→所示),细胞核变形; M.淹水15天:细胞变圆,叶绿体被膜消失,完全质壁分离(→所示),基粒片层大量解体,空间严重变大(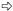 所示),嗜锇体增加; N.淹水15天:基粒片层大量减少; O.淹水15天:线粒体内嵴解体,出现空泡现象(→所示),部分膜破裂,内含物渗出( 所示),嗜锇体增加; N.淹水15天:基粒片层大量减少; O.淹水15天:线粒体内嵴解体,出现空泡现象(→所示),部分膜破裂,内含物渗出(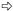 所示)。 所示)。P. deltoides cv. Lux ex Ⅰ-69 /55: A,B. Control; C. Flooded for eight days: Space between grana layers enlarged; D. Flooded for eight days: Grana layers distorted lightly; E. Flooded for eight days: Normal chloroplast envelope and mitochondria; F. Flooded for 15 days: Space between grana layers enlarged and grana layers distorted; G. Flooded for 15 days: Plasmolysis (see →) and normal chloroplast envelope and mitochondria. P. simonii: H,I. Control; J. Flooded for eight days: Plasmolysis (see →) and multivesicular structure (see 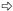 ); K. Flooded for eight days: Space between grana layers enlarged and grana layers distorted (see →); L. Flooded for eight days: Cristae in mitochondria decomposed lightly,multivesicular structure occurred (see →) and nucleus distorted; M. Flooded for 15 days: Cell swelled,chloroplast envelope disappeared,completely plasmolyzed (see →),number of osmophore increased,grana layers decomposed and space between grana layers enlarged seriously (see ); K. Flooded for eight days: Space between grana layers enlarged and grana layers distorted (see →); L. Flooded for eight days: Cristae in mitochondria decomposed lightly,multivesicular structure occurred (see →) and nucleus distorted; M. Flooded for 15 days: Cell swelled,chloroplast envelope disappeared,completely plasmolyzed (see →),number of osmophore increased,grana layers decomposed and space between grana layers enlarged seriously (see 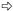 ); N. Flooded for 15 days: Most grana layers decomposed; O. Flooded for 15 days: Cristae in mitochondria decomposed seriously,multivesicular structure aggravated (see →),mitochondria membrane cracked and inclusion exuded partially (see ); N. Flooded for 15 days: Most grana layers decomposed; O. Flooded for 15 days: Cristae in mitochondria decomposed seriously,multivesicular structure aggravated (see →),mitochondria membrane cracked and inclusion exuded partially (see 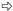 ). ).Chl:叶绿体Chloroplast; CM:叶绿体膜Chloroplast envelope; CW:细胞壁Cell wall; G:基粒片层Grana layer; M:线粒体Mitochondria; N:细胞核Nucleus; NM:核膜Nuclear membrane; O:嗜锇体Osmophore; S:淀粉粒Starch grain; V:液泡Vacuole; VM:液泡膜Vacuole membrane. |
淹水8天后,Ⅰ-69杨细胞的超微结构与对照相比变化不大,叶绿体中淀粉粒大量减少、变小。类囊体略有膨胀,片层空间变大,出现较小的透明腔,少部分片层出现轻微扭曲的现象。基质中嗜锇体数量略有增加,体积变化不大(图版Ⅰ-C, D),其余结构与对照细胞差异不明显(图版Ⅰ-E)。与Ⅰ-69杨相比,小叶杨细胞的超微结构变化略大,细胞内出现多泡结构,叶绿体膨胀成半球形。开始出现质壁分离现象,虽然绝大多数叶绿体仍紧靠细胞壁,但与细胞壁的相邻面积减少(图版Ⅰ-J)。类囊体膨胀,片层空间变大,出现较大的透明腔,片层扭曲的现象较严重(图版Ⅰ-K)。基质中嗜锇体大量增加,体积膨大; 淀粉粒大量减少,体积变小。线粒体仍然丰富,但部分内嵴减少,基质变稀(图版Ⅰ-L)。细胞核的结构仍保持完整,但其被膜开始模糊,且形状逐渐发生变化,由圆球形变成不规则形状,染色质略有降解(图版Ⅰ-L),其余结构与对照细胞差异不明显。
淹水至15天时,Ⅰ-69杨的细胞仍然为长柱状,细胞壁完整,液泡清晰。少部分叶绿体膨胀成半球或圆球形,被膜仍然完整。基质中淀粉粒完全消失,嗜锇体大量增加,体积变大。类囊体膨胀,片层弯曲现象加重,空间进一步变大,但基粒类囊体与基质类囊体仍然丰富,排列方向与叶绿体长轴平行(图版Ⅰ-F),基粒片层仍然垛堆密集(图版Ⅰ-G)。紧挨叶绿体的部位仍然分布有大量线粒体,线粒体内嵴丰富,基质浓,与对照细胞差异不大。开始出现质壁分离现象,细胞质较浅,细胞核解体(图版Ⅰ-G)。与Ⅰ-69杨相比,小叶杨细胞的超微结构出现明显差异。细胞变圆,细胞壁仍然完整,但细胞器结构破坏严重,细胞质浅,其中充满细胞器的分解碎片。液泡膜模糊不清,细胞核结构完全破坏,核膜消失,染色质被消化,呈凝块状。叶绿体膨胀变圆,被膜模糊不清或降解破裂,与细胞壁完全分离,向细胞中心漂移(图版Ⅰ-M)。基质中嗜锇体数量丰富,大小不一,淀粉粒完全消失。基粒类囊体与基质类囊体大量分解,数量减少,排列紊乱,不再与叶绿体的长轴平行。基粒类囊体膨胀,片层扭曲严重,空间变大,出现空泡化,片层的垛叠结构趋于解体(图版Ⅰ-N)。线粒体数量仍然丰富,但肿胀、变形,内嵴大量减少,基质变稀,内外膜模糊或破裂,内含物流出,形成小空泡(图版Ⅰ-O)。
从以上特征可以看出:淹水胁迫下,小叶杨叶片的超微结构受害程度明显比Ⅰ-69杨严重,而且损伤症状出现早。随着时间的延长,二者叶片的超微结构对淹水胁迫响应的差异变得越来越明显。Ⅰ-69杨能够在长期胁迫下保持较为完整的超微结构,而小叶杨却缺乏这种能力,这与二者Pn, Fv/Fm, 叶绿素含量的变化规律完全一致。
3 讨论大量研究表明:淹水胁迫会显著减少植物的生长,甚至导致植株死亡(魏和平等,2000; Marcelo et al., 2005)。本试验中,淹水胁迫对Ⅰ-69杨与小叶杨的苗高与地径生长产生显著的抑制作用,且随胁迫程度的增大抑制作用增强。随着淹水时间的延长,细胞器间的动态平衡被打破,导致细胞内各种细胞器结构的破坏和解体可能是最终导致小叶杨植株死亡的重要原因。综合分析淹水胁迫下Ⅰ-69杨与小叶杨的生长量和成活率,可以肯定Ⅰ-69杨的耐涝性显著强于小叶杨。
叶片是植物最主要的光合器官,对外界环境的改变最为敏感(许涛等,2008)。本试验中,Pn, Fv/Fm、叶绿素含量的降低说明淹水胁迫抑制叶片的光合性能。叶片超微结构受损,尤其光合机构的损伤是光合性能下降的重要原因。叶绿体是植物光合作用的主要机构,光能吸收、电子传递、还原能力的强弱以及初级光合产物的形成都与其结构密切相关(肖祥希等,2003)。叶绿体中基粒片层和基质片层结构的完整有序是光能转换正常有效进行的保证。本试验中,淹水胁迫下嗜锇体增多、增大说明类囊体受到破坏,片层解体(Johnson et al., 2003)。由于基粒片层和基质片层的扭曲、降解抑制光反应及有关光合作用电子传递的正常进行(Zoran et al., 1992),是淹水胁迫下Pn下降的重要原因。淀粉粒数量减少,最后消失则可能是淹水降低叶绿体内的电子传递速率,使淀粉合成量减少,而降解继续进行(Bussis et al., 1998)。由于基粒中含有定向排列的叶绿素分子。本试验中,基粒的受损程度与叶绿素含量下降趋势的一致性说明基粒的损伤是淹水胁迫下叶绿素含量降低的重要原因之一。淹水胁迫下植物体内产生的多种活性氧使光合色素发生降解可能是叶绿素含量降低的另一因素(蒋明义等,1996)。叶绿素作为主要光合色素,参与光合作用中光能的吸收、传递和转化,与光合速率的高低密切相关。淹水胁迫下叶绿体结构的损伤对杨树光合作用的影响是多方面的。Fv/Fm为PSⅡ最大光化学量子产量,室温下叶片的绝大多数叶绿素荧光都来自PSⅡ,而PSⅡ主要存在于基粒片层的堆叠区(姚允聪等,2007)。本试验中,基粒片层的损伤程度与Fv/Fm的变化规律完全一致,说明淹水胁迫下基粒片层垛堆的破坏是导致Fv/Fm下降的重要原因,造成PSⅡ潜在活性中心受损,光合作用原初反应过程受到抑制,进而引起光合CO2同化效率的降低。与小叶杨相比,Ⅰ-69杨耐涝性强,淹水胁迫下其叶绿体结构的损伤程度以及Pn, Fv/Fm, 叶绿素含量降低的幅度均较小叶杨低。
前人研究表明:叶片细胞中叶绿体对干旱、高温、弱光等逆境胁迫最敏感,线粒体相对稳定,可作为植物抗逆程度的细胞学指标(左志锐等,2006)。本研究结果显示:杨树在淹水胁迫下同样具有这一规律,叶绿体对淹水胁迫敏感,而线粒体结构相对稳定。叶绿体对淹水胁迫敏感,可能是由于叶绿体是植物细胞中最需O2的分区。在淹水胁迫下,由于基粒片层垛叠结构的损失,结合在基粒膜上的活性氧清除酶的活力下降。同时,由于碳同化过程受阻,过剩电子传递给O2,造成活性氧等有害物质的积累。积累的活性氧可直接启动膜脂过氧化,造成叶绿体伤害(Allen et al., 2001)。类囊体膜由于富含不饱和脂肪酸,对活性氧诱发的膜脂过氧化特别敏感(Navari et al., 1999)。线粒体是三羧酸循环和氧化磷酸化的中心,在呼吸代谢过程中产生的ATP是光合产物运转所需能量的来源,其结构受损可以导致植物的代谢紊乱,甚至死亡。淹水胁迫下线粒体结构的稳定对杨树的生长和存活具有重要作用。本试验中,小叶杨线粒体结构的受损程度比Ⅰ-69杨严重,所以其植株存活率较Ⅰ-69杨低。
总之,淹水胁迫对杨树叶片的超微结构产生了明显伤害,且随胁迫程度的加重和淹水时间的延长而严重。叶片超微结构,尤其光合机构的损伤程度与Pn, Fv/Fm, 叶绿素含量的变化趋势一致,是造成淹水胁迫下光合性能下降的重要原因。不同杨树叶片的超微结构对淹水胁迫的抗性明显不同。淹水胁迫下,耐涝杨树叶片的超微结构明显比不耐涝杨树稳定,损伤症状轻,出现时间晚。叶片超微结构的稳定性与杨树的抗涝性呈正相关关系,可作为杨树抗涝性鉴定的细胞学参考。通过育种手段提高淹水胁迫下叶片超微结构的稳定性,将有望提高杨树的抗涝性。
蒋明义, 郭绍川. 1996. 渗透胁迫及光照下水稻幼苗叶片光合色素降解过程中1O2的参与[J]. 植物学报, 38(10): 797-802. |
李合生. 2000. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社: 134-137.
|
李义良, 苏晓华, 张冰玉, 等. 2009. 转vgb基因银腺杂种杨的耐涝性[J]. 林业科学, 45(7): 26-31. DOI:10.11707/j.1001-7488.20090705 |
魏和平, 利容千, 王建波. 2000. 淹水对玉米叶片细胞超微结构的影响[J]. 植物学报, 42(8): 811-817. |
肖祥希, 杨宗武, 郑蓉, 等. 2003. 铝胁迫对龙眼叶和根细胞超微结构的影响[J]. 林业科学, 39(1): 58-64. |
许涛, 李天来, 齐明芳, 等. 2008. 番茄花柄脱落过程中超微结构及亚细胞钙分布的变化[J]. 园艺学报, 35(2): 233-238. |
姚允聪, 王绍辉, 孔云. 2007. 弱光条件下桃叶片结构及光合特性与叶绿体超微结构变化[J]. 中国农业科学, 40(4): 855-863. |
左志锐, 高俊平, 穆鼎, 等. 2006. 盐胁迫下百合两个品种的叶绿体和线粒体超微结构比较[J]. 园艺学报, 33(2): 429-432. |
Allen D J, Ort D R. 2001. Impacts of chilling temperatures on photosynthesis in warm-climate plants[J]. Trends in Plant Science, 6: 36-42. |
Bussis D, Heineke D. 1998. Techmation of potato plants to polyethylene glycol-induced water deficitⅡ contents and subcelualr distribution of organic solutes[J]. Journal of Experimental Botany, 49: 1361-1370. DOI:10.1093/jxb/49.325.1361 |
Cao F L, Conner W H. 1999. Selection of flood-tolerant Populus deltoids clones for reforestation projects in China[J]. Forest Ecology and Management, 117: 211-220. DOI:10.1016/S0378-1127(98)00465-4 |
Du K B, Shen B X, Xu L, et al. 2008. Estimation of genetic variances in flood tolerance of poplar and selection of resistant F1 generations[J]. Agroforest Syst, 74: 243-257. DOI:10.1007/s10457-008-9112-y |
Gong J R, Zhang X S, Huang Y M, et al. 2007. The effects of flooding on several hybrid poplar clones in Northern China[J]. Agroforest Syst, 69: 77-88. |
Johnson Z, Barber R T. 2003. The low-light reduction in the quantum yield of photosynthesis: potential errors and biases when calculating the maximum quantum yield[J]. Photosynthesis Research, 75(1): 85-95. DOI:10.1023/A:1022440305765 |
Marcelo M, Alex-Alan F A, Fabio P G, et al. 2005. Effects of soil flooding on leaf gas exchange and growth of two neotropical pioneer tree species[J]. New Forest, 29: 161-168. DOI:10.1007/s11056-005-0247-7 |
Navari I F, Rascid N. 1999. Plant responses to water-deficit conditions//Pessarakli M. Hand Book of Plant and Crop Stress. (2nd ed). New York: Marcel D, 231-270.
|
Toai T T, Martin S K S, Chase K. 2001. Identification of a QTL associated with tolerance of soybean to soil water logging[J]. Crop Sci, 41: 1247-1252. DOI:10.2135/cropsci2001.4141247x |
Zoran R, Davies D C. 1992. Chloroplast structure after water and high temperature stress in two lines of maize that differ in endogenous levels of abscisic acid[J]. Int J Plant Sci, 153: 186-192. DOI:10.1086/297021 |
 2010, Vol. 46
2010, Vol. 46