文章信息
- 李琳玲, 程华, 许锋, 王燕, 姜德志, 程水源
- Li Linling, Cheng Hua, Xu Feng, Wang Yan, Jiang Dezhi, Cheng Shuiyuan
- 银杏叶绿体铜锌超氧化物歧化酶基因GbCuZnSOD的克隆与表达
- Isolation and Expression of the Chloroplast Copper/Zinc Superoxide Dismutase Gene (GbCuZnSOD) from Ginkgo biloba
- 林业科学, 2010, 46(6): 35-42.
- Scientia Silvae Sinicae, 2010, 46(6): 35-42.
-
文章历史
- 收稿日期:2009-04-13
- 修回日期:2009-10-20
-
作者相关文章
2. 黄冈师范学院生命科学与工程学院 黄冈 438000;
3. 长江大学园艺园林学院 荆州 434025
2. College of Life Science and Engineering, Huanggang Normal University Huanggang 438000;
3. College of Horticulture and Gardening, Yangtze University Jingzhou 434025
超氧化物歧化酶(superoxide dismutase,SOD)是体内氧自由基清除反应的第1个酶类,催化超氧负离子转变成为O2和H2O2(Rabinowitch et al., 1983)。植物细胞主要含有3种类型的SOD:CuZnSOD,MnSOD和FeSOD。MnSOD和FeSOD存在于线粒体、过氧化物酶体和叶绿体中,CuZnSOD主要存在于叶绿体、胞质和过氧化物酶体中(郑荣梁, 1992)。因此在植物细胞的不同部位都有相应的抗氧化能力。CuZnSOD是3种歧化酶中含量最丰富的一种,是活性氧清除酶系统中最重要的酶,与植物的抗旱、抗盐碱、耐低温以及耐高温等多种抗逆性有密切关系,在植物体内CuZnSOD的表达受到多种逆境因子以及激素等的诱导表达(Wu et al., 1999; Rafael et al., 1991; Tsang et al., 1991)。
大量研究发现,提高植物体内抗氧化酶活性和增强抗氧化代谢的水平是提高植物抗逆性的有效途径(Tanaka et al., 1999; Foyer et al., 1994; McKersie et al., 1993; Mittler et al., 1994; 1991)。在抗性不同的物种或品种中, 氧化伤害的降低程度与抗氧化物系统相关酶的表达量的增加呈正相关(Pinhero et al., 1997)。通过转基因技术手段将抗氧化相关基因导入植物体内表达,能显著提高转基因植株的部分抗氧化能力和抗逆性。在抗氧化转基因研究中,CuZnSOD活性的提高能显著增强植物对各种环境胁迫的适应能力,转基因植株中CuZnSOD基因的大量表达不同程度地提高了植株对环境胁迫的抵抗能力(李筠等, 2006; Gupta et al., 1993a; 1993b)。
银杏(Ginkgo biloba)历经百万年各种复杂的气候环境,不仅表现了强大的生存适应能力,而且在形态上至今很少改变。这与其对环境的适应,对各种逆境胁迫的耐受能力紧密相关(Deng et al., 2006)。对银杏CuZnSOD (GbCuZnSOD)基因的克隆和表达分析有助于揭示银杏对环境的适应机制,以及抗氧化抗逆性的生理机制,并为利用基因工程技术培育优良林木提供理论依据和基因资源。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒大肠杆菌TOP10为本实验室保存,pMD18-T购自TAKARA。
1.1.2 植物材料基因克隆及不同组织表达分析的银杏材料采集于长江大学银杏果用园,品种为家佛手,12年生嫁接苗。嫁接苗生长势一致,土肥水管理良好。采集时间为:茎采集于2008年5月中旬根蘖苗嫩茎,根和叶采集于5月中旬,果采集于7月上旬。
所有诱导处理的银杏材料均采用长江大学园艺园林学院温室1年生盆栽苗(2008年7月),品种为家佛手。盆栽苗生长在25 ℃、120 μmol photons·m-2s-1光照16 h、18 ℃暗环境8 h的温室中,保持70%相对湿度,培养基质为体积比1:1:1的草炭、腐叶土和珍珠岩。
1.1.3 酶与分子生物学试剂限制性内切酶、Taq酶、PCR耗材、SMARTTM RACE cDNA Amplification Kit均为TAKARA公司产品; DIG-High Prime DNA Labeling and Detection Starter Kit和DIG Northern Starter Kit购自Roch; SuperscriptⅡ反转录酶为Invitrogen公司产品; 杂交膜使用Millipore公司的PVDF膜; 胶回收试剂盒为TIANGEN公司离心柱型琼脂糖凝胶DNA回收试剂盒; ABA和IAA为Sigma公司产品; 氨苄青霉素钠盐购自上海生工生物工程技术服务有限公司; 引物合成和测序由上海生工完成,引物序列见表 1; 其他试剂均为国产分析纯。
|
|
参考魏春红等(2006)CTAB法提取银杏幼叶DNA,提取液成分与魏春红等(2006)配方完全相同。Southern杂交中,基因组分别使用EcoRⅠ、BamHⅠ和HindⅢ酶切,探针浓度、杂交操作参考DIG-High Prime DNA Labeling and Detection Starter Kit。
1.2.2 总RNA提取及反转录银杏不同组织采集后放入液氮速冻并转-70 ℃超低温冰箱保存。不同组织总RNA提取采用蔡荣等(2007)的CTAB法。提取的总RNA用1%琼脂糖凝胶电泳检测。反转录第1链cDNA合成采用Invitrogen的SuperscriptⅡ反转录酶操作; 5′RACE和3′RACE反转录cDNA模板合成参考SMARTTM RACE cDNA Amplification Kit说明书。
Northern杂交检测不同组织和不同处理的银杏叶片CuZnSOD转录情况。为了比较3类SOD基因在银杏不同组织、不同诱导表达变化,根据已提交GenBank的银杏MnSOD(GbMnSOD,EF633506)和银杏FeSOD(GbCuZnSOD,FJ555019)基因序列设计一段cDNA序列作为不同组织杂交和诱导表达分析探针,GbCuZnSOD探针引物(表 1)直接由测序结果设计,银杏18S RNA引物(表 1)扩增产物作为内参探针。杂交操作参照DIG Northern Starter Kit说明书。
1.2.3 不同诱导处理激素处理诱导选择ABA和IAA喷洒处理盆栽苗,浓度均为10 μmol·L-1,处理后分别于12, 24 h采集盆栽苗叶片液氮速冻,转-80 ℃保存。渗透压处理选用10%蔗糖(Suc)、10%甘露醇(Man)和100 mmol·L-1的NaCl,分别喷洒处理盆栽苗,24 h后采集叶片液氮冷冻,-80 ℃保存。以上清水处理作为对照组。
低温选取4 ℃作为处理温度,分别于12, 24和36 h采集叶片液氮处理,-80 ℃保存。高温选取36, 40和44 ℃作处理温度,分别于4, 8 h后采集叶片液氮处理,-80 ℃保存。常温培养(25 ℃)盆栽苗作为对照组。
1.2.4 其他操作简并PCR采用梯度PCR确认最佳退火温度,总共设置12个梯度。RACE PCR使用巢式PCR扩增,首次扩增用Touchdown PCR,巢式扩增为三步法PCR扩增。探针模版扩增采用三步法PCR扩增。PCR操作程序见表 2。PCR扩增产物用1%琼脂糖凝胶电泳检测,胶回收,TA克隆后送出测序。
|
|
软件Vector NTI Suite10.0进行不同物种间同源基因的核苷酸序列比对,测序片段拼接。MEGA4.1绘制系统进化树。利用Quantity One4.5对杂交结果进行定量分析。用Primer Premier5.0和Oligo6软件设计引物。BlastP(http://www.ncbi.nlm.nih.gov/BLAST/)做同源搜索。Swiss-model服务器(http://swissmodel.expasy.org/)进行蛋白质三维结构预测。ProtParam(http://au.expasy.org/tools/protparam.html)计算蛋白质分子质量及等电点。Signal P3.0 Server(http://www.cbs.dtu.dk/services/SignalP)预测信号肽及剪切位点。
2 结果与分析 2.1 GbCuZnSOD cDNA的克隆及其序列特征分析简并引物GbCuSP和GbCuAP对cDNA模板做简并PCR扩增,得到1条306 bp的扩增片段,经NCBI比对分析为叶绿体CuZnSOD基因片段。根据测序结果分别设计5′和3′RACE引物:CuSOD5R1, CuSOD5R2, CuSOD3R1和CuSOD3R2。结果测序拼接得到783 bp GbCuZnSOD全长序列(GeneBank登录号:FJ555020),包含1个642 bp最大读码框(ORF)。分析表明,GbCuZnSOD含有保守的植物基因翻译起始序列AGCAATGG,与Lutcke等(1987)统计的植物基因翻译起始序列(AACAATGG)基本符合。GbCuZnSOD编码1条213个氨基酸残基的多肽,预测分子质量为21.95 ku,等电点(pI)为6.82。
GbCuZnSOD氨基酸序列与海岸松(Pinus pinaster, AF434186)的同源性最高,为82.6%。与拟南芥(Arabidopsis thaliana, AAD10208)、银白杨(Populus alba,BAF80585)、亚洲棉(Gossypium arboreum, ABL63518)、陆地棉(Gossypium hirsutum, ACC93637)、木榄(Bruguiera gymnorhiza, CAM98444)、红三叶(Trifolium pretense, AAR10812)、向日葵(Helianthus annuus, CAH06449)、豌豆(Pisum sativum, CAA39819)、西瓜(Citrullus lanatus, AAS72937)、欧洲山杨(Populus tremula, CAC33844)和扭口藓(Barbula unguiculata, BAC66947)相似性为64.3%~71.8%(图 1)。

|
图 1 CuZnSOD氨基酸序列同源性比较 Figure 1 Mitochondrial CuZnSOD amino acid sequences alignment 下划线为简并引物设计位点; 方框中为预测的信号肽序列;●:表示与Cu结合的氨基酸残基;■:表示Zn结合位点;◆:表示叶绿体引导肽剪切的保守位点;序列比对最后为其他植物与GbCuZnSOD同源性百分比;最后部分比对序列省略。 Sequences used for designing PCR primers are underlined; Shaded boxes are putative chloroplast targeting sequences; (●) indicates an Cu binding site; (■) indicates an Zn binding site; (◆) the shear sign position of transit peptides for chloroplast-targeted CuZnSOD proteins; The sequence of CuZnSOD alignment is homology percentage; Omit some sequence at the last. |
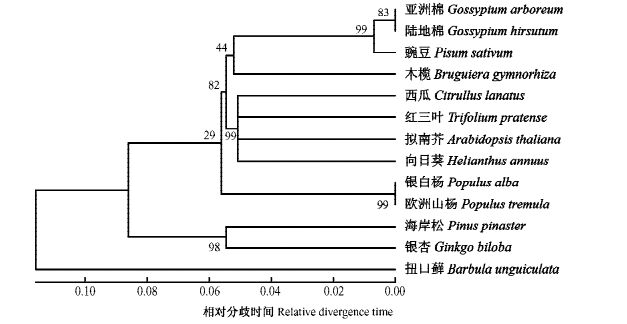
用近邻相接法(Mega4.1)对不同植物CuZnSOD氨基酸序列作进化树分析,进化树中数字代表bootstrap值,重复检测1 000次。进化树下方为相对进化距离。分析结果显示CuZnSOD被分为3大类(图 2),其中被子植物银白杨、欧洲山杨、木榄等为一组,其分化时间最迟,集中在0.05~0.06之间; 银杏和海岸松作为裸子植物为一组,与被子植物的进化分歧时间较早,在0.08~0.09之间; 扭口藓作为较原始的苔藓类植物单独为一组,其相对进化分歧时间大于0.1。
|
图 2 植物胞质CuZnSOD系统进化树 Figure 2 Phylogenetic tree of plant cytoplast CuZnSODs 基于Neighbor-Joining方法构建,MEGA4.1。各节点处数字表示自引值,重复1 000次。 The tree was constructed by the Neighbor-Joining method, MEGA4.1. The numbers at each node represented the bootstrap value, with 1 000 replicates. |
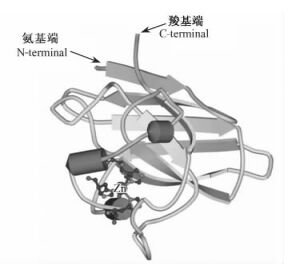
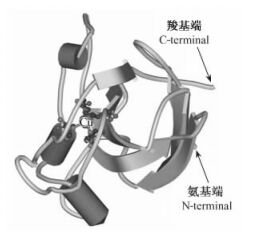
在CuZnSOD蛋白质一级结构分析中,酶的活性中心与金属离子结合部位非常保守,其中His105,His107,His122和His179以Cu原子为中心形成1个活性单位结构,而His122,His130,His139和Asp142与Zn原子结合构成另外一个亚基的活性中心,活性中心主要处于CuZnSOD的靠近C端的区域。靠近N端的氨基酸序列保守性较低。依据同源建模的预测方法,应用Swiss-model构建的GbCuZnSOD蛋白高级结构模型(图 3, 4),预测结果表明GbCuZnSOD蛋白质包含3个小的α螺旋,8个β折叠片,13个卷曲和7个转角结构。该蛋白结构的N端区主要是8个反向平行的β折叠片构成的1个桶状结构,C端区主要为1个拧成3股α螺旋的松散环结构。酶活性中心处于靠近β折叠片的结构域边缘。在GbCuZnSOD的氨基酸序列信号肽预测中发现有一段叶绿体转运肽,剪切点位于59位的丙氨酸。
|
图 3 Swiss-model构建的GbCuZnSOD亚基与Zn2+结合的3D结构模型 Figure 3 The 3D structure prediction of GbCuZnSOD and Zn2+ binding subunit constructed by Swiss-model |
|
图 4 Swiss-model构建的GbCuZnSOD亚基与Cu2+结合的3D结构模型 Figure 4 The 3D structure prediction of GbCuZnSOD and Cu2+ binding subunit constructed by Swiss-model |
为了确定GbCuZnSOD基因在基因组中的拷贝数,设计了1对引物用以扩增cDNA的一段插入序列作为杂交探针。选择1段不含EcoRⅠ、BamHⅠ和HindⅢ酶切位点的GbCuZnSOD基因组外显子序列作为杂交探针,Southern分析结果显示每个基因组酶切产物在0.5~9.0 kb之间有2~3个以上杂交条带(图 5),杂交条带较明显。这说明在银杏中,CuZnSOD基因有多个拷贝,属于1个小的多基因家族。

|
图 5 GbCuZnSOD Southern杂交分析 Figure 5 Genomic blot analysis of GbCuZnSOD 银杏基因组DNA用EcoRⅠ、BamHⅠ和HindⅢ进行酶切,0.7%的琼脂糖凝胶电泳分离,杂交探针为基因组的cDNA间隔序列,左侧为分子量标准。 Genomic DNA was digested with EcoRⅠ, BamHⅠand Hind Ⅲ, and separated on a 0.7% agrose gel. The DNA blot was hybridized with the insert in the GbCuZnSOD cDNA clone. Positions of molecular weight markers are shown on the left. |
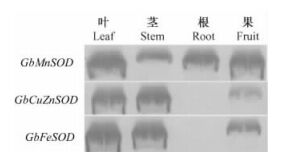
Northern杂交分析显示(图 6),银杏CuZnSOD,MnSOD,FeSOD基因在银杏的茎、叶和果中都有表达。其中CuZnSOD和FeSOD在根中不表达,只有MnSOD在根部有大量表达。在银杏的叶中三者都有大量表达,表达量依次为FeSOD>MnSOD>CuZnSOD。在银杏的茎中CuZnSOD和FeSOD表达量较高,而MnSOD表达量较低。在果实成熟前期,表达量最高的是MnSOD,其次是FeSOD,而CuZnSOD只有痕量表达。
|
图 6 银杏不同组织几种SOD Northern杂交分析 Figure 6 Northern analysis of the expression of three SOD genes in different organs |
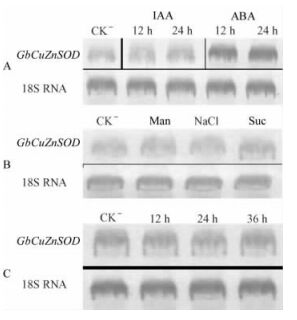
植物激素的诱导试验结果显示,银杏CuZnSOD能够迅速被ABA诱导表达,表达量随时间增加而积累,而IAA对GbCuZnSOD则没有明显诱导作用(图 7A)。ABA喷洒处理12 h后GbCuZnSOD表达量明显提高,处理24 h后表达量基本处于平稳状态。IAA处理样与对照组比较GbCuZnSOD表达量无明显提高。渗透压处理结果显示,蔗糖和甘露醇处理24 h后GbCuZnSOD表达量只有微量增加,而100 mmol·L-1 NaCl处理后表达量未见明显提升(图 7B)。表明渗透胁迫处理不能明显诱导银杏叶CuZnSOD的表达。
|
图 7 银杏盆栽苗几种环境条件诱导GbCuZnSOD转录表达的Northern分析结果 Figure 7 Northern analysis of GbCuZnSOD gene expression in response to several condition A:ABA,IAA处理;B:渗透压处理;C:低温处理。Man:甘露醇; Suc:蔗糖。 A: Treatmeant with ABA and IAA; B: Treatment with osmoticums; C: Treatment with low temperature. Man: Mannitol; Suc: Sucrose. |
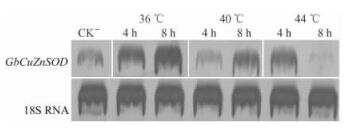
温度胁迫处理显示,4 ℃处理对GbCuZnSOD表达的影响不明显,在低温处理36 h仍未发现表达量有明显升高(图 7C)。而不同高温处理能影响GbCuZnSOD的表达,36 ℃高温能明显诱导CuZnSOD表达量升高,4 h表达量有微弱增加,处理8 h表达量有显著提升。40 ℃高温下,银杏CuZnSOD的表达在4 h取样点有微弱下降,处理8 h后表达量又开始小幅上升。在44 ℃高温处理下,GbCuZnSOD呈现先小幅升高后又降低的现象,4 h取样CuZnSOD转录小幅增加,8 h表达量大幅下降到对照水平下(图 8)。
|
图 8 银杏盆栽苗高温处理诱导GbCuZnSOD 转录表达的Northern分析结果 Figure 8 Northern analysis of GbCuZnSOD gene expression in response to high temperature |
利用简并PCR和RACE技术从银杏中克隆了GbCuZnSOD基因。GbCuZnSOD虽由基因组编码,但最终表达蛋白会定位到叶绿体中发挥作用。进化树(Mega4.1)分析结果显示,GbCuZnSOD在进化上分化较早。在选取的物种中仅次于苔藓类植物扭口藓,而与裸子植物海岸松具有相近的分化时间。这与物种由简单到复杂进化理论是一致的,也与银杏ASR, F3H, MVDs等基因的进化树分析结果相符合(Lu et al., 2008; Shen et al., 2006a; 2006b; 2005)。GbCuZnSOD属于多基因家族。在豌豆(Pisum sativum)中也存在多个CuZnSOD拷贝,而且编码的CuZnSOD同工酶在胞质和叶绿体中都有分布(Scioli et al., 1988)。在菠菜(Spinacia oleracea)中,含有2种CuZnSOD同工酶,CuZnSOD1在菠菜幼苗、黄化苗的细胞质中表达,而CuZnSOD2在菠菜成熟苗的叶绿体中大量表达(Kanematsu et al., 1990)。银杏中多个CuZnSOD拷贝出现可能与GbCuZnSOD同工酶在不同组织或细胞内不同部位表达变化有关。
GbCuZnSOD除了有不同的亚细胞定位外,还具有组织表达差异性。在陆地棉中,CuZnSOD只在叶、茎中表达,而在根、花、下胚轴中不表达(Hu et al., 2007)。Kwon等(2003)在研究萝卜(Raphanus sativus)时发现其CuZnSOD只在叶和绿色下胚轴表达而在红色下胚轴和根中则不表达,其原因可能是CuZnSOD主要在光合代谢中起作用,而呼吸代谢以及其他次生代谢产生的超氧化物主要靠FeSOD和MnSOD来清除。CuZnSOD主要定位于叶绿体中,所以在含有叶绿体等器官组织中有表达,而在不含叶绿体的根部组织中则表达量较低或者不表达。
近年来越来越多的证据表明ABA参与调节植物对逆境胁迫的反应,IAA在植物的细胞分裂、生长、分化等生理过程中起着重要作用(潘瑞炽, 2004)。在木薯(Manihot esculenta)、玉米(Zea mays)和萝卜的研究中都发现,CuZnSOD能够被外源的ABA诱导表达(Lee et al., 1999; Yoshinura et al., 1999; Guan et al., 1998),说明ABA诱导植物抗氧化酶的表达量提升是一个普遍现象。ABA诱导SOD基因表达的分子机制及信号转导途径还不清楚,目前研究认为ROS可能作为信号分子参与了这一过程(Jiang et al., 2001)。烟草(Nicotiana tabacum)中,CuZnSOD对ABA和IAA处理都不敏感(Kurepa et al., 1997)。在银杏中,IAA处理只诱导了FeSOD, MnSOD的大量表达,对GbCuZnSOD的表达没有明显的提高,可能是因为银杏在IAA诱导的细胞生长过程中超氧离子的清除靠FeSOD和MnSOD来完成。渗透压影响SOD转录量的提高也在多种植物抗逆性研究中有报道(Lee et al., 1999; Bueno et al., 1998; Guan et al., 1998)。Lee等(1999)的研究发现,组织悬浮培养的木薯中,CuZnSOD有非常高表达量,但是这种表达量的升高究竟是由于培养基中蔗糖造成的碳源充足生长活性提高,还是由于蔗糖造成渗透压改变,则不清楚。但是在用NaCl对木薯的叶片处理中能够明显诱导CuZnSOD的大量表达。3种渗透压处理银杏,都未能明显引起盆栽苗CuZnSOD表达量的增加,但却能引起银杏MnSOD和FeSOD的大量表达。因此银杏在高渗胁迫下的超氧化物清除可能与MnSOD和FeSOD的大量表达有关。
低温和高温也是普遍存在的2种环境胁迫因子。Lee等(1999)的研究发现,37 ℃高温处理能诱导木薯中CuZnSOD表达量的升高,而4 ℃低温处理反而降低了CuZnSOD表达水平。但这并不代表CuZnSOD与植物抗低温胁迫无关。Wu等(1999)在小麦(Triticum aestivum)耐寒驯化中发现,冬小麦和春小麦MnSOD和CuZnSOD均能被低温诱导表达。郁万文等(2008)研究发现梯度低温处理能够诱导银杏总的SOD活性升高,而在4 ℃低温处理中,银杏MnSOD和FeSOD表达量都有大幅提高,说明银杏中MnSOD和FeSOD参与了银杏对低温胁迫的适应,而CuZnSOD则在银杏的正常生长环境下起作用。高温胁迫下,特别是在44~48 ℃高温处理银杏盆栽苗,能够诱导银杏总的SOD活性提高(欧祖兰等, 2008)。而银杏CuZnSOD在44 ℃时表达量呈先升后降趋势,同处于叶绿体中的FeSOD表达则在40, 44 ℃保持较高的表达量,暗示在正常的银杏生长条件下,CuZnSOD负责叶绿体光合作用中活性氧的清除,而FeSOD则可能在温度补偿点以上叶绿体的呼吸作用中起到抗逆调节作用。
蔡荣, 许锋, 陈柳吉, 等. 2007. 银杏不同组织的总RNA提取方法的改进[J]. 生物技术, 17(4): 38-40. |
李筠, 邓西平, 郭尚洙. 2006. 转铜/锌超氧化物歧化酶和抗坏血酸过氧化物酶基因甘薯的耐旱性[J]. 植物生理与分子生物学学报, 32(4): 451-457. |
欧祖兰, 曹福亮, 郑军. 2008. 高温胁迫下银杏形态及生理生化指标的变化[J]. 南京林业大学学报, 32(3): 31-35. |
潘瑞炽. 2004. 植物生理学[M]. 北京: 高等教育出版社: 286-292.
|
魏春红, 李毅. 2006. 现代分子生物学实验[M]. 北京: 高等教育出版社: 135-137.
|
郁万文, 曹福亮, 汪贵斌, 等. 2008. 银杏抗氧化酶系统对短期梯度变温的响应[J]. 江西农业大学学报, 30(2): 252-255. |
郑荣梁. 1992. 生物学自由基[M]. 北京: 高等教育出版社: 1-2.
|
Bueno P, Piqueras A, Kurepa J, et al. 1998. Expression of antioxidant enzymes in response to abscisic acid and high osmoticum in tobacco BY-2 cell cultures[J]. Plant Science, 138(1): 27-34. DOI:10.1016/S0168-9452(98)00154-X |
Deng Z, Wang Y, Jiang K, et al. 2006. Molecular cloning and characterization of a novel dehydrin gene from Ginkgo biloba[J]. Bioscience Reports, 26(3): 203-215. DOI:10.1007/s10540-006-9016-x |
Foyer C H, Descourvieres P, Kunert K J. 1994. Protection against oxygen radicals: an important defence mechanism studied in transgenic plants[J]. Plant, Cell & Environment, 17(5): 507-523. |
Guan L, Scandalios J G. 1998. Two structurally similar maize cytosolic superoxide dismutase genes, Sod4 and Sod4A, respond differentially to abscisic acid and high osmoticum[J]. Plant Physiology, 117(1): 217-224. DOI:10.1104/pp.117.1.217 |
Gupta A S, Heinen J L, Holaday A S, et al. 1993a. Increased resistance to oxidative stress in transgenic plants that overexpress chloroplastic Cu/Zn superoxide dismutase[J]. PNAS, 90(4): 1629-1633. DOI:10.1073/pnas.90.4.1629 |
Gupta A S, Webb R P, Holaday A S, et al. 1993b. Overexpression of superoxide dismutase protects plants from oxidative stress (induction of ascorbate peroxidase in superoxide dismutase-overexpressing plants)[J]. Plant Physiology, 103(4): 1067-1073. DOI:10.1104/pp.103.4.1067 |
Hu Genhai, Yu Shuxun, Fan Shuli, et al. 2007. Cloning and expression of the chloroplast copper/zinc-superoxide dismutase gene in upland cotton(Gossypium hirsutum L.)[J]. Journal of Plant Physiology and Molecular Biology, 33(3): 197-204. |
Jiang M, Zhang J. 2001. Effect of abscisic acid on active oxygen species, antioxidative defence system and oxidative damage in leaves of maize seedlings[J]. Plant and Cell Physiology, 42(11): 1265-1273. DOI:10.1093/pcp/pce162 |
Kanematsu S, Asada K. 1990. Characteristic amino acid sequences of chloroplast and cytosol isozymes of CuZn-superoxide dismutase in spinach, rice and horsetail[J]. Plant Cell Physiology, 31(1): 99-112. |
Kurepa J, Herouart D, Van Montagu M, et al. 1997. Differential expression of CuZn-and Fe-superoxide dismutase genes of tobacco during development, oxidative stress, and hormonal treatments[J]. Plant & Cell Physiology, 38(4): 463-470. |
Kwon S I, An C S. 2003. Cloning and expression of mitochondrial MnSOD from the small radish (Raphanus sativusL.).[J]. Molecules and Cells, 16(2): 194-200. |
Lee H S, Kim K Y, You S H, et al. 1999. Molecular characterization and expression of a cDNA encoding copper/zinc superoxide dismutase from cultured cells of cassava (Manihot esculenta Crantz)[J]. Molecular and General Genetics, 262(4/5): 807-814. |
Lu J, Wu W, Cao S, et al. 2008. Molecular cloning and characterization of 1-hydroxy-2-methyl-2-(E)-butenyl-4-diphosphate reductase gene from Ginkgo biloba[J]. Molecular Biology Reports, 35(3): 413-420. DOI:10.1007/s11033-007-9101-7 |
Lutcke H A, Chow K C, Mickel F S, et al. 1987. Selection of AUG initiation codons differs in plants and animals[J]. The EMBO Journal, 6(1): 43-48. |
McKersie B D, Chen Y, de Beus M, et al. 1993. Superoxide dismutase enhances tolerance of freezing stress in transgenic alfalfa (Medicago sativa L).[J]. Plant Physiology, 103(4): 1155-1163. DOI:10.1104/pp.103.4.1155 |
Mittler R, Zilinskas B A. 1991. Purification and characterization of pea cytosolic ascorbate peroxidase[J]. Plant Physiology, 97(3): 962-968. DOI:10.1104/pp.97.3.962 |
Mittler R, Zilinskas B A. 1994. Regulation of pea cytosolic ascorbate peroxidase and other antioxidant enzymes during the progression of drought stress and following recovery from drought[J]. The Plant Journal, 5(3): 397-405. DOI:10.1111/tpj.1994.5.issue-3 |
Pinhero R G, Rao M V, Paliyath G, et al. 1997. Changes in activities of antioxidant enzymes and their relationship to genetic and paclobutrazol-induced chilling tolerance of maize seedlings[J]. Plant Physiology, 114(2): 695-704. DOI:10.1104/pp.114.2.695 |
Rabinowitch H D, Fridovich I. 1983. Superoxide radicals, superoxide dismutases and oxygen toxicity in plants[J]. Photochemistry and Photobiology, 37(6): 679-690. DOI:10.1111/php.1983.37.issue-6 |
Rafael P T, Estra G. 1991. The tomato Cu, Zn superoxide dismutase genes are developmentally regulated and respond to light and stress[J]. Plant Molecular Biology, 17(4): 745-760. DOI:10.1007/BF00037058 |
Scioli J R, Zilinskas B A. 1988. Cloning and characterization of cDNA encoding the chloroplastic copper/zinc-superoxide dismutase from pea[J]. PNAS, 85(20): 7661-7665. DOI:10.1073/pnas.85.20.7661 |
Shen Guoan, Pang Yongzhen, Wu Weisheng, et al. 2005. Molecular cloning, characterization and expression of a noval Asr gene from Ginkgo biloba[J]. Plant Physiology and Biochemistry, 43(9): 836-843. DOI:10.1016/j.plaphy.2005.06.010 |
Shen Guoan, Pang Yongzhen, Wu Weisheng, et al. 2006a. Cloning and characterization of a flavanone 3-hydroxylase gene from Ginkgo biloba[J]. Bioscience Reports, 26(1): 19-29. DOI:10.1007/s10540-006-9007-y |
Shen Guoan, Pang Yongzhen, Wu Weisheng, et al. 2006b. Cloning and characterization of a root-specific expressing gene encoding 3-hydroxy-3-methylglutaryl coenzyme a reductase from Ginkgo biloba[J]. Molecular Biology Reports, 33(2): 117-127. DOI:10.1007/s11033-006-0014-7 |
Tanaka Y, Hibino T, Hayashi Y, et al. 1999. Salt tolerance of transgenic rice overexpressing yeast mitochondrial Mn-SOD in chloroplasts[J]. Plant Science, 148(2): 131-138. DOI:10.1016/S0168-9452(99)00133-8 |
Tsang E W T, Bowler C, Herouart D, et al. 1991. Differential regulation of superoxide dismutases in plants exposed to environmental stress[J]. Plant Cell, 3(8): 783-792. DOI:10.1105/tpc.3.8.783 |
Wu G, Wilen R W, Robertson A J, et al. 1999. Isolation, chromosomal localization, and differential expression of mitochondrial manganese superoxide dismutase and chloroplastic copper/zinc superoxide dismutase genes in wheat[J]. Plant Physiology, 120(2): 513-520. DOI:10.1104/pp.120.2.513 |
Yoshinura K, Yabuta Y, Tamoi M, et al. 1999. Alternatively spliced mRNA variants of chloroplast ascorbate peroxidase isoenzymes in spinach leaves[J]. Biochemical Journal, 338(1): 41-48. DOI:10.1042/bj3380041 |
 2010, Vol. 46
2010, Vol. 46