文章信息
- 冯健, 齐力旺, 孙晓梅, 张守攻
- Feng Jian, Qi Liwang, Sun Xiaomei, Zhang Shougong
- 落叶松扦插生根过程SSH文库构建及部分基因的表达分析
- Construction of Suppression Subtractive Hybridization Library and Expression Pattern of a Few Genes Involved in Rooting of Larix Cuttings
- 林业科学, 2010, 46(6): 27-34.
- Scientia Silvae Sinicae, 2010, 46(6): 27-34.
-
文章历史
- 收稿日期:2009-06-29
- 修回日期:2009-09-29
-
作者相关文章
2. 辽宁省林业科学研究院 沈阳 110032
2. Liaoning Academy of Forestry Shenyang 110032
落叶松(Larix)是我国北方地区主要造林树种。扦插繁殖是落叶松今后实现无性系化的主要方式。但是,落叶松是难生根树种,其生根能力差成为其无性系化的瓶颈(杨书文等,1994)。为解决此问题,很多学者从解剖学和生理学角度分析落叶松扦插生根的过程,并提出解决办法(敖红等,2002; 杜继煜等,2004; 黄卓烈等,2002; 刘桂丰等,1992)。这些办法在一定程度上提高了落叶松扦插生根率,但是并未探明落叶松扦插生根的机制,使得生产上带有一定的盲目性。为了解落叶松扦插生根过程中基因表达谱,探明落叶松扦插生根机制,解决落叶松扦插生根率低的问题,本文利用抑制消减杂交(suppression subtractive hybridization,SSH)技术,分别以扦插生根率存在显著差异的2个落叶松全同胞无性系为试验材料,构建落叶松消减文库,并对部分重要的差异表达基因进行表达分析。获得这些基因及其表达模式可为落叶松提高扦插生根率及遗传改良提供理论支持和基因资源。
1 材料与方法 1.1 材料试验材料为杂种落叶松(Larix leptolepis×L. olgensis)(日永85×长4C)31-6和15-4两个全同胞无性系,其中无性系31-6的生根率>90%,无性系15-4的生根率 < 20%。均取自辽宁大孤家国营林场,取样时间为2006—2007年。插穗经IBA处理后进行扦插试验。取材分3个时期,分别为插穗茎段、插穗形成愈伤组织且有根原基形成、不定根生长初期,其中插穗茎段分IBA处理前和处理后,处理的方法为2×10-4 mol·L-1 IBA处理30 min,6 h后取材。上述材料为建库和半定量PCR部分材料。另外取1个14-12全同胞无性系(日永85×长4C)(其生根率为45%~55%)根、茎、叶作为半定量PCR材料使用。取材后迅速液氮冷冻,带回实验室后-70 ℃保存。
1.2 方法 1.2.1 落叶松mRNA分离总RNA提取参照Scott Jr等(1998)的方法; mRNA分离纯化采用Qiagen mRNA分离试剂盒提供的方法。
1.2.2 cDNA消减文库构建获得足量mRNA后,按照Clontech PCR-SelectTM cDNA Subtraction Kit操作手册获得cDNA片断。获得的cDNA片断与T-easy载体连接; 然后转化大肠杆菌菌株DH5α,构建落叶松cDNA消减文库。正库构建以无性系31-6插穗茎段经IBA处理前和处理后、插穗形成愈伤组织且有根原基形成、不定根生长初期4个时期的总RNA等量混合后反转录成cDNA为Tester; 以无性系15-4插穗茎段经IBA处理前和处理后、插穗形成愈伤组织且有根原基形成、不定根生长初期4个时期的总RNA等量混合后反转录成cDNA为Driver; 反库构建所用Tester和Driver为正库构建所用的Tester和Driver互换。
细菌培养参考《分子克隆实验指南》(萨姆布鲁克,2002)的方法进行。随机挑取1 000个克隆,委托上海生工生物工程技术服务有限公司进行3′端单向序列测定。
1.2.3 生物信息学分析采用NCBI的BLAST软件对所测序列与GenBank中的非冗余数据库(non-redundant database,NR)、dbEST库比对。
1.2.4 半定量PCR分析选择9个差异表达基因,设计特异性引物,落叶松β-actin作为内参照物(表 1)。以落叶松根、茎、叶、插穗茎段经IBA处理前和处理后、插穗形成愈伤组织且有根原基形成的插穗基部、不定根生长初期为试验材料,取等量的总RNA为模板合成第1链cDNA,进行RT-PCR分析。反应体系为:模板1 μL,dNTP 0.4 μL,10×PCR反应缓冲液2 μL,上游基因特异引物0.4 μL,下游基因特异引物0.4 μL,酶0.2 μL,PCR级无菌水15.6 μL,合计20 μL。反应循环参数为94 ℃预变性3 min; 94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,18~35个循环(不同的基因,循环数不同,但每个基因在所有参试样品中的循环数是固定的); 72 ℃延伸10 min; 4 ℃保存。所有的PCR产物在1.2%的琼脂糖凝胶上进行电泳,每个基因至少重复3次。
|
|
经过总RNA和mRNA质量、接头连接效率、消减效率、阳性率检测表明,各项指标均符合试验要求。获得的EST大小在500 bp左右,消减效率明显,阳性率达到85%以上。上述结果表明,以落叶松扦插生根率存在显著差异的2个全同胞优良无性系为材料成功构建了cDNA消减文库。
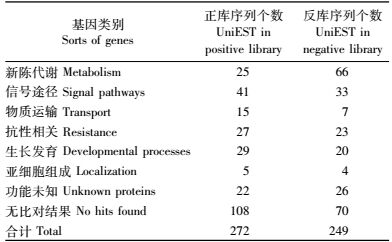
2.2 落叶松cDNA消减文库EST功能分类在构建的正、反2个cDNA消减文库中,随机挑取各500个克隆进行单项序列测定。对测序结果进行整理后,正库得到272个UniEST,反库得到249个UniEST。将以上获得的521条序列和NCBI的NR库、dbEST库进行序列比对,正库中有161条序列,反库中有182条序列与数据库中的序列具有同源性(分值≥80,相似性≥78%,同源序列长100 bp以上)。所获得的521条序列分别属于不同的类别,具体统计情况如表 2所示。
|
|
分类结果(表 2)显示,在正库所获得的272个UniEST中,有同源性的序列中,以信号途径占的比例最大,达到15.07%,其次是生长发育和抗性相关,分别达到10.66%和9.93%;无同源序列的UniEST占39.70%,加上功能尚未确定的序列,占到所获得UniEST的47.70%。在反库所获得的249个UniEST中,有同源性的序列中,新陈代谢类序列占的比例最大,达到26.51%,其次是信号途径、抗性相关、生长发育类序列; 无同源序列的UniEST占28.11%,加上功能尚未确定的序列,占到所获得UniEST的38.15%。
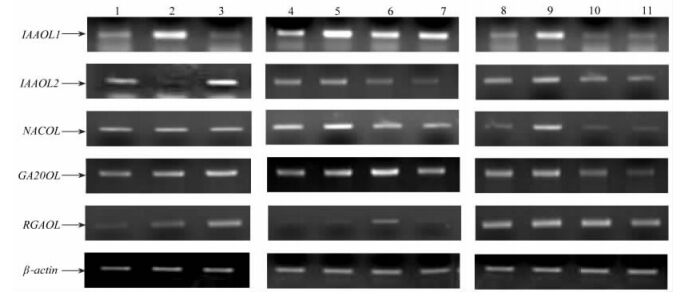
2.3 激素类基因表达分析 2.3.1 IAALO1基因表达分析如图 1所示,IAALO1基因在根、茎、叶中均表达,叶中表达量最高,茎中表达量最低。无论是生根率高的落叶松无性系(31-6,L1)还是生根率低的落叶松无性系(15-4,L2),IBA处理后,IAALO1基因表达量均增加。表明IAALO1基因受生长素的调控。在L1中,各个时期均有IAALO1基因表达,且在不定根生长初期表达量较高。在L2中,各个时期均有IAALO1基因表达,但是在插穗不定根根原基形成和不定根生长初期2个时期表达量很低。上述结果表明,IAALO1基因是生长素早期响应基因,其在落叶松扦插生根过程中可能具有促进不定根和侧根形成和生长发育的作用。
|
图 1 IAAOL1, IAAOL2, NACOL, GA20OL和RGAOL基因表达模式 Figure 1 The expression of IAAOL1, IAAOL2, NACOL, GA20OL and RGAOL 1.根; 2.叶; 3.茎; 4-7.IAAOL1, IAAOL2, NACOL, GA20OL和RGAOL基因在生根率高的落叶松无性系(31-6)中不同生根时期的表达; 8-11. IAAOL1, IAAOL2, NACOL, GA20OL和RGAOL基因在生根率低的落叶松无性系(15-4)中不同生根时期的表达。4, 8.插穗; 5, 9. 2×10-4 mol·L-1 IBA处理的插穗; 6, 10.插穗不定根根原基形成; 7, 11.不定根生长初期。 1.Root; 2.Leaf; 3.Stem; 4-7.The expression of IAAOL1, IAAOL2, NACOL, GA20OL and RGAOL during rooting of Larix cutting which has high rate of rooting; 8-11: The expression of IAAOL1, IAAOL2, NACOL, GA20OL and RGAOL during rooting of Larix cutting which has low rate of rooting. 4, 8.Cuttings; 5, 9.Cuttings treated with 2×10-4 mol·L-1 IBA; 6, 10. Callus with adventitious root primordium; 7, 11. Original development of adventitious root. |
如图 1所示,IAALO2基因在根、叶和茎中均表达,茎中表达量高,叶中表达量最低。IBA处理后,IAALO2基因在L2中表达量明显升高,而在L1中表达量升高不明显。表明IAALO2基因受生长素的调控,但不同落叶松无性系间,其表达量变化不同。在L2中,各个时期均有IAALO2基因表达,且在IBA处理后表达量最高。在L1中,IAALO2基因表达均很低。以上结果表明,IAALO2基因是生长素早期响应基因,其在落叶松扦插生根过程中的作用有待进一步研究。
2.3.3 NACLO基因表达分析如图 1所示,NACOL基因在根、茎、叶中均表达,且表达量无明显差别。IBA处理后,NACOL基因表达量在L1和L2中均增加。表明NACOL基因受生长素的调控,且为生长素早期响应基因。在落叶松扦插生根各个时期,NACOL基因在L1中表达量均高于其在L2中表达量。这一结果表明,NACOL基因可能具有促进落叶松插穗形成不定根或侧根的作用。
2.3.4 GA20OL基因表达分析如图 1所示,GA20OL基因在根、茎、叶中均表达,且茎中表达量高于根和叶中表达量。IBA处理后,GA20OL基因在L2中表达量变化不明显; 而其在L1中表达量明显增加。在落叶松扦插生根各个时期,GA20OL基因在L2中表达量均低于其在L1中的表达量,并且,在L1中,GA20OL基因在IBA处理后和不定根根原基形成2个时期表达量高于其他2个时期。
2.3.5 RGAOL基因表达分析如图 1所示,RGAOL基因在根、茎、叶中均表达,且茎中表达量高于根和叶中表达量。IBA处理后,RGAOL基因表达量在L1中无明显变化,在L2中有增加的趋势。在落叶松扦插生根各个时期,RGAOL基因在L2中表达量均高于该基因在L1中表达量。
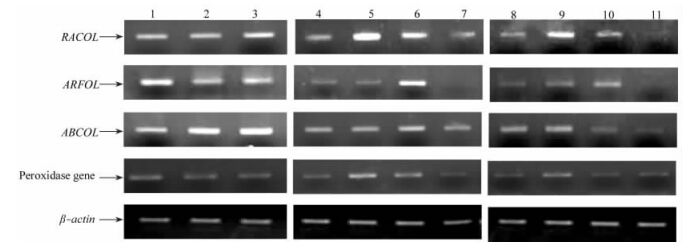
2.4 信号转导类基因——小G蛋白基因的表达分析 2.4.1 RACOL基因表达分析如图 2所示,RACOL基因在根、茎、叶中均表达,其中茎中的表达量略高于根和叶中的表达量。IBA处理后,ARFOL基因表达量在L1和L2中均明显增加。在扦插生根过程中,该基因在L2中的表达量均低于其在L1中的表达量。在L2中,该基因在根生长初期表达量极低。在L1中,该基因在激素处理后和不定根根原基形成2个时期的表达量明显高于其他时期。上述结果表明,RACOL基因的表达量可能受生长素的调控。该基因在落叶松扦插形成不定根的关键时期表达量较高,表明其可能参与生长素作用的信号途径。
|
图 2 RACOL, ARFOL, ABCOL和Peroxidase基因表达模式 Figure 2 The expression of RACOL, ARFOL, ABCOL and Peroxidase 1.根; 2.叶; 3.茎; 4-7.RACOL, ARFOL, ABCOL和Peroxidase基因在生根率高的落叶松无性系(31-6)中不同生根时期的表达; 8-11.RACOL, ARFOL, ABCOL和Peroxidase基因在生根率低的落叶松无性系(15-4)中不同生根时期的表达。4, 8.插穗; 5, 9.2×10-4 mol·L-1 IBA处理的插穗; 6, 10.插穗不定根根原基形成; 7, 11.不定根生长初期。 1.Root; 2.Leaf; 3.Stem; 4-7.The expression of RACOL, ARFOL, ABCOL and Peroxidase during rooting of Larix cutting which has high rate of rooting; 8-11. The expression of RACOL, ARFOL, ABCOL and Peroxidase during rooting of Larix cutting which has low rate of rooting. 4, 8.Cuttings; 5, 9.Cuttings treated with 2×10-4 mol·L-1 IBA; 6, 10.Callus with adventitious root primordium; 7, 11.Original development of adventitious root. |
如图 2所示,ARFOL基因在根、茎、叶中均表达,且根中的表达量略高于茎和叶中的表达量。IBA处理后,ARFOL基因表达量在L1和L2中均增加,但增加不明显。在扦插生根的各个时期,ARFOL基因在L1的不定根生长初期表达量最低,在不定根根原基形成过程中表达量最高。ARFOL基因在L2中茎段和不定根生长初期表达量低,在不定根根原基形成过程中为高表达。在形成愈伤组织且有根原基形成时期,ARFOL基因在L1中表达量明显高于该基因在L2中表达量。上述结果表明,ARFOL基因表达量是否受生长素的调控不能确定。该基因可能具有促进落叶松扦插形成不定根的作用。
2.5 转运蛋白基因表达分析如图 2所示,ABCOL基因在根、茎、叶中均表达。IBA处理后,ARFOL基因在L1和L2中表达量均无明显变化。在L1和L2中,该基因在扦插生根的各个时期均表达。不定根根原基形成和根生长初期,该基因在L2中的表达量明显低于该基因在L1中的表达量。另外,在不定根根原基形成时期,该基因表达量明显高于其他时期,表明该基因可能在不定根形成中发挥作用。
2.6 因伤诱导物质相关基因——过氧化物酶基因表达分析如图 2所示,落叶松过氧化物酶基因在根、茎、叶中均表达,且表达量无明显差别。IBA处理后,落叶松过氧化物酶基因表达量在L2和L1中均增加,但L1增加量高于L2增加量。在落叶松扦插生根的各个时期,落叶松过氧化物酶基因在L2中的表达量均低于该基因在L1中的表达量。在L1中,落叶松过氧化物酶基因在IBA处理后和不定根根原基形成2个时期表达量明显高于该基因在其他时期的表达量。上述结果表明,在落叶松扦插生根的过程中伴随着大量酶类基因的表达,这些基因的表达产生大量创伤相关物质,这些物质同外援IBA共同作用,在落叶松扦插生根过程中促进不定根或侧根的形成和生长发育。
3 讨论构建一个好的差异表达cDNA文库对起始mRNA的完整性和纯度要求非常高。本试验的结果表明,试验获得的总RNA含量高,完整性好,28S与18S带型亮度比达到2:1。mRNA的完整性和纯度也完全达到文库构建要求。在本文抑制消减杂交试验中,从反转录合成cDNA的监控、加接头后的接头连接效率分析到差减cDNA片段的差减效率分析试验,都随时监控着各个试验环节,保证最终获得高质量的差异表达cDNA文库。单菌落PCR扩增电泳图谱呈现很好的多态性,点杂交试验结果为阳性率在85%以上。这些结果直接说明获得了高质量的正、反2个差异表达cDNA文库。
通过生物信息学分析,正库获得的272个UniEST中,以信号途径占的比例最大,达到15.07%,其次是生长发育和抗性相关,分别达到10.66%和9.93%;无同源序列的UniEST占40.81%,加上功能尚未确定的序列,占到所获得UniEST的47.70%。这些结果表明,在落叶松扦插生根过程中,与生长发育和新陈代谢相关的基因大量表达,这些基因的表达产生相应的蛋白和信号,最终促使插穗形成不定根根原基并最终发育成不定根。反库获得的249个UniEST中,新陈代谢类序列占的比例最大,达到26.51%,其次是信号途径、抗性相关、生长发育类序列; 无同源序列的UniEST占28.11%,加上功能尚未确定的序列,占到所获得UniEST的38.15%;这些结果表明,在生根能力弱的落叶松无性系插穗中大量表达新陈代谢类基因。这些基因的表达会在插穗中产生大量次生代谢物,这些物质的产生是否影响插穗生根,有待进一步研究。
3.1 激素相关基因对落叶松扦插生根能力的影响Aux/IAA基因家族是生长素早期响应基因之一,该基因的功能获得性突变体在根的生长发育中表现出生长素敏感性降低,并表现出十分明显的与生长素相关的发育缺陷,如axr2/iaa7突变体(Nagpal et al., 2000; Wilson et al., 1990),axr3/iaa17突变体(Rouse et al., 1998)和axr5/iaa1突变体(Yang et al., 2004)向地性和顶端优势改变,iaa28突变体(Rogg et al.,2001)和slr/iaa14突变体(Fukaki et al., 2002)严重的侧根缺陷,shy2/iaa3(Qing et al., 1999; Soh et al., 1999)光形态建成缺陷,msg2/iaa19突变体(Tatematsu et al., 2004)下胚轴向性缺陷。这些结果说明,Aux/IAA基因在不定根和侧根生长发育中发挥重要作用。本研究通过RT-PCR结果表明,在使用IBA处理后,所获得的2个落叶松Aux/IAA基因表达量均增加,说明IAALO1和IAALO2基因均受生长素的调控,为生长素响应基因。在L1中,在扦插生根的各个时期均有IAALO1基因表达,且均高于其在L2中的表达量。上述结果说明,IAALO1基因伴随着落叶松扦插生根的各个过程,其在落叶松扦插生根过程中具有促进不定根形成和生长发育的作用。然而,IBA处理后,IAALO2基因在L2中的表达量明显高于其在L1中表达量。在落叶松扦插生根的各个过程中,IAALO2基因在L1中表达量均低于其在L2中表达量,因此,IAALO2基因对不定根和侧根的发生具有促进还是抑制作用有待进一步探讨。
NACs是一个植物中特有的基因家族,在植物发育过程中起作用。在根中首次发现该基因家族成员是NAC1。NAC1在根尖、子叶和叶子中都有表达,但以根中的表达最为活跃。通过对NAC1检测,其同样具有转录因子的作用。NAC1参与生长素信号转导途径,过量表达将促进侧根的发生。同时,NAC1控制着DBP和AIR3两个生长素相关基因的表达。这表明NAC1参与了生长素调控的侧根发生过程(Qi et al., 2000)。半定量分析表明,本研究中NACOL基因受生长素的调控。在扦插生根各个时期,NACOL基因均在L1中表达量高于其在L2中表达量。这表明NACOL基因可能在落叶松扦插生根过程中具有促进不定根和侧根生长发育的作用。
上述生长素响应基因的表达分析结果表明,在落叶松扦插生根过程中伴随着一系列生长素相关基因的表达。这些基因的表达最终促进不定根和侧根的形成与生长发育。这些生长素响应基因的发现,从分子水平上证明,生长素在落叶松扦插生根过程中发挥重要作用。这一结果同以往从生理角度研究落叶松扦插生根的结果相一致(敖红等,2002)。
赤霉素对根生长发育影响的报道不多,在落叶松扦插试验中,GA4促进插穗愈伤组织形成和不定根产生。另外,研究表明赤霉素通过减少DELLA蛋白在细胞核内浓度从而降低DELLA蛋白的生长抑制效应。在赤霉素的合成过程中赤霉素20-氧化酶发挥重要作用,参与催化多步氧化的过程,使C20-GAs氧化掉1个碳原子转化成C19-GAs。本研究结果表明,GA20OL基因表达量在L1和L2中存在明显差异,且该基因受生长素的影响。IBA处理后和形成愈伤组织且有根原基形成2个时期,GA20OL基因在L1中表达量明显高于其在L2中表达量。这些结果表明,生根能力强的落叶松无性系在扦插生根过程中合成的赤霉素多,相反,生根能力弱的落叶松无性系在扦插生根过程中合成的赤霉素少。另外,本研究还获得1个RGA基因,该基因编码一种DELLA蛋白,DELLA蛋白具有抑制植物生长发育的作用,但是在生长素促进下赤霉素可以减少DELLA蛋白的浓度,从而降低其对生长发育的抑制作用。半定量分析表明,在落叶松扦插生根各个时期,RGAOL基因在L2中表达量均高于该基因在L1中表达量。在生根能力弱的无性系中,RGAOL基因大量表达产生DELLA蛋白,从而抑制落叶松扦插过程中不定根的生长发育。而在生根能力强的落叶松无性系中,一方面RGAOL基因表达量低,产生的DELLA蛋白少,另一方面,大量合成赤霉素降解DELLA蛋白。这两方面的综合作用,使得DELLA蛋白的抑制生长作用大大降低,从而使插穗具有较强的生根能力。
3.2 其他基因对落叶松扦插生根能力的影响 3.2.1 小G蛋白对落叶松扦插生根的影响小G蛋白家族成员是单体蛋白,分子质量较小,大约20~30 ku,为了与异三聚体G蛋白区别,通常称之为小G蛋白。小G蛋白家族成员结构保守,一般包括4个鸟核苷酸结合区和1个效应器分子结合区(Yang,2002)。小G蛋白虽然结构保守,但其功能却具有多样性。许多植物特有的信号途径和功能均需要小G蛋白参与完成。Ras家族在酵母和哺乳动物中调节细胞分化过程; Rho家族成员调控肌动蛋白重组过程和参与MAP激酶的细胞信号转导过程; Rab家族在膜转运过程中起着重要作用; 而Ran家族在核孔位置调节着蛋白和RNA分子的运输过程。Arf和Arf GEF(guanine nucleotide exchange factor)对PIN1的极性定位有很重要的作用。在调控质膜和胞质之间的蛋白运输中,PIN1可能充当了植物激素的运出载体(Geldner et al., 2001; Yang,2002)。ROP是植物小G蛋白中参与信号转导的唯一家族。ROP在调控根毛的发育中起到重要的作用。通过对ROP4抗体和GFP-ROP2的定位研究表明,ROP位于拟南芥(Arabidopsis thaliana)伸长的根毛尖端。ROP2调控了根毛的发生和尖端的生长,拟南芥ROP2超表达植株增加了根毛的数量和密度,CA-rop2,CA-rop4或CA-rop6能引起根毛尖端各向同性生长或延长根毛的长度,而DN-rop2则抑制根毛尖端的生长(Baluska et al., 2000; Wu et al., 2001; Jones et al., 2002; Molenduk et al., 2001; 吕品等,2005)。另外,ROP介导了ABA应答途径的负调控。拟南芥DN-rop2和CA-rop2分别促进和抑制ABA抑制的种子萌发过程。对某些功能缺失突变体研究表明:ROP9和ROP10是ABA反应的负调控子。ROP9或ROP10突变体中,ABA对种子萌发、变绿以及根生长的抑制作用都微弱增强了,而R0lP10/R0lP9双突变体显著增强了ABA在这些方面的反应(Pei et al., 1998; Zheng et al., 2002)。ROP除了介导ABA应答途径的负调控外,还可能调控其他激素的功能和发育的过程,如转35S:CA-rop2植株表型上类似于生长素或油菜素内酯过量表达的植株。与此相反,转35S:DN-rop2植株表型上类似于缺乏生长素或油菜素内酯的植株。推测不同的ROP基因参与不同的生长素或油菜素内酯反应或积累调控,从而调控植物的形态建成(Li,2001)。本研究获得的RACOL基因在扦插生根率高的落叶松无性系扦插生根的各个时期均有表达,且在生长素处理后和形成愈伤组织且有根原基形成时期表达量高于其他时期。同时,与L2相比,该基因表达量在L1的扦插生根各个时期表达量均较高。这些结果表明,该基因可能在落叶松扦插生根过程中具有促进不定根发生发育的作用。因该基因在生长素处理后表达量明显增加,其作用机制可能参与生长素的信号转导途径。本研究获得的ARFOL基因在落叶松扦插最关键的不定根根原基形成时期表达量最高,且该基因在L1中表达量明显高于其在L2中的表达量。表明该基因在落叶松扦插形成不定根过程中具有促进不定根形成的作用。其作用机制有待进一步探讨。可以肯定的是在落叶松扦插形成不定根、侧根和根毛过程中,小G蛋白具有一定的促进作用。
3.2.2 转运蛋白对落叶松扦插生根能力的影响自然界生物体中普遍存在着2大家族的初级和次级转运体:ATP结合盒式蛋白(ATP-binding cassette transporter,ABC)转运体超家族和主要易化转运体(major facilitator superfamily, MFS)超家族。ABC家族主要是初级主动转运体,通过ATP水解释放能量而运输大小分子化合物,包括离子、氨基酸、核苷酸、多糖、多肽甚至蛋白质等。ABC蛋白除了运输环境胁迫过程中积累的细胞毒素物质到细胞质中以外,还参与调控植物体内的离子运输和植物的生长过程。在拟南芥中,由AtMRP5编码的ABC转运蛋白是有机阳离子的运载体,主要在植物的维管束核表皮表达,此基因的缺失,引起根生长减慢,侧根增加,生长素含量升高,由此认为AtMRP5可能为生长素结合运输载体(Nicola et al., 2001)。在落叶松扦插生根的各个时期,L1中ABCOL基因的表达量均明显高于L2中该基因的表达量。在L1中,ABCOL基因在不定根根原基形成时期表达量特别高。这表明,ABCOL基因的表达量同落叶松扦插形成不定根或侧根的能力成一定的正相关。其在落叶松扦插形成不定根和侧根的过程中可能具有促进作用。
3.2.3 创伤相关物质对落叶松扦插生根能力的影响植物在受到创伤时,会产生一些与伤害有关的物质及代谢酶类,如葡聚糖酶、过氧化物酶、磷脂酶和脂氧化酶等。国内外很多研究表明,一些种类的酶与不定根的发生有关。Szabolcs等(2002)测定了马缨丹(Lantana camara)、南美天芥菜(Heliotropium arborescens)、斯托卡蜡菊(Helichrysum stoechas)扦插生根过程中的过氧化物酶(peroxidase)的动态变化,生根快的马缨丹和南美天芥菜比生根慢的斯托卡蜡菊插穗上所有器官内的过氧化物酶活性都要高10倍。所有插穗上叶片内过氧化物酶活性在生根前均缓慢下降,过氧化物酶活性自顶部向基部逐渐升高,在插穗基部愈伤组织形成的过程中达到最高水平。而最显著的变化是在扦插7天后,马缨丹和南美天芥菜基部的过氧化物酶活性都升高5倍,而斯托卡蜡菊则升高20倍,不定根发生后,过氧化物酶活性降低,最终恢复至样本的初始水平。因此,Szabolcs等(2002)认为不定根发生过程中的过氧化物酶活性与植物生根能力密切相关。通过测定黑杨(Populus nigra)、银白杨(Populus alba)、欧洲山杨(Populus tremula)在扦插生根过程中过氧化物酶和IAA氧化酶活性的动态变化, 发现尽管3个树种的插穗生根能力不同,但在根发生或根原基形成过程中,过氧化物酶活性均上升,没有发现过氧化物酶活性和生根能力有显著的相关性,因此认为过氧化物酶活性不影响插穗生根能力和生根率,但对细胞分裂起作用(Szabolcs et al., 2002; Tohit,2000; Liu et al., 2003; 张肪等,2006)。本研究结果表明,IBA处理后,落叶松过氧化物酶基因在L1和L2中的表达量均升高。但是该基因的表达量是否跟生长素处理有关,仍无法确定。本研究生长素处理后材料是IBA处理至少6 h后取材的,在这段时间里,由于插穗已造成切口,因此与产生因伤诱导物质相关的基因已开始表达。在落叶松扦插生根各个时期,过氧化物酶基因在L1中表达量均高于其在L2中表达量。在L1中,过氧化物酶基因在生长素处理后和不定根根原基形成2个时期的表达量明显高于其他时期该基因的表达量。这些结果说明,该基因的表达量与落叶松生根能力存在正相关,且在落叶松扦插生根的关键时期表达量增高。据此表明,落叶松过氧化物酶基因可能有促进落叶松扦插形成不定根和侧根的作用。
敖红, 王昆, 冯玉龙. 2002. 长白落叶松插穗的内源激素水平及其与扦插生根的关系[J]. 植物研究, 22(2): 190-195. |
杜继煜, 白岩, 白宝璋. 2004. 植物的插条繁殖生理[J]. 农业与技术, 24(5): 96-97. |
黄卓烈, 李明, 谭绍满, 等. 2002. 萘乙酸处理桉树插条后过氧化物酶活性及其同工酶变化与插条生根的关系研究[J]. 植物研究, 22(3): 296-300. |
刘桂丰, 杨书文, 杨春华, 等. 1992. 长白落叶松嫩枝扦插生根的解剖研究[J]. 东北林业大学学报, 20(1): 9-13. |
吕品, 李建华, 张岩, 等. 2005. 植物小G蛋白研究进展[J]. 河北师范大学学报:自然科学版, 29(2): 193-198. |
萨姆布鲁克J, 拉塞尔D W. 2002. 分子克隆实验指南. 黄培堂, 王嘉玺, 朱厚础, 等译. 3版. 北京: 科学出版社.
|
杨书文, 王秋玉, 夏德安. 1994. 落叶松的遗传改良[M]. 哈尔滨: 东北林业大学出版社: 279-282.
|
张肪, 郭素娟. 2006. 不定根发生机理的研究进展[J]. 广东林业科技, 22(3): 91-95. |
Baluska F, Salaj J, Mathur J, et al. 2000. Root hair formation: F-actin-dependent tip growth is initiated by local assembly of profilin-supported F-actin meshworks accumulated within expansin-enriched bulges[J]. Dev Biol, 227: 618-632. DOI:10.1006/dbio.2000.9908 |
Fukaki H, Tameda S, Masuda H, et al. 2002. Lateral root formation is blocked by a gain-of-function mutation in the SOLITARY-ROOT/IAA14 gene of Arabidopsis[J]. Plant J, 29: 153-168. DOI:10.1046/j.0960-7412.2001.01201.x |
Geldner N, Friml J, Sitierhof Y D, et al. 2001. Auxin transport inhibitors block PIN1 cycling and vesicle trafficking[J]. Nature, 413: 425-428. DOI:10.1038/35096571 |
Jones M A, Shen J J, Fu Ying, et al. 2002. The Arabidopsis Rop2 GTPase is a positive regulator of both root hair initiation and tip growth[J]. Plant Cell, 14: 763-774. DOI:10.1105/tpc.010359 |
Li Hai, Shen Junjiang, Zheng Zhiliang, et al. 2001. The Rop GTPase switch controls multiple developmental processes in Arabidopsis[J]. Plant Physiology, 126: 670-684. DOI:10.1104/pp.126.2.670 |
Liu Wei, Xu Zhihong, Luo Da, et al. 2003. Roles of OsCK/1, a rice casein kinase Ⅰ, in root development and plant hormone sensitivity[J]. The Plant Journal, 36: 189-202. DOI:10.1046/j.1365-313X.2003.01866.x |
Molenduk J, Bischoff F, Rajendrakumar C S V, et al. 2001. Arabidopsis thaliana R0P GTPases are localized to tips of root hairs and control polar growth[J]. EMBO J, 20: 2779-2788. DOI:10.1093/emboj/20.11.2779 |
Nagpal P, Walker L M, Young J C, et al. 2000. AXR2 encodes a member of the Aux/IAA protein family[J]. Plant Physiol, 123: 563-573. DOI:10.1104/pp.123.2.563 |
Nicola G, Markus K, Uener K, et al. 2001. The Arabidopsis thaliana ABC transporter AtMRP5 controls root development and stomata movement[J]. The EMBO Journal, 20: 1875-1887. DOI:10.1093/emboj/20.8.1875 |
Pei Z M, Ghassemian M, Kwak C M, et al. 1998. Role of farnesyltransferase in ABA regulation of guard cell anion channels and plant water loss[J]. Science, 282: 287-290. DOI:10.1126/science.282.5387.287 |
Qi X, Giovanna F, Diana C, et al. 2000. Arabidopsis NAC1 transduces auxin signal downstream of TIR1 to promote lateral root development[J]. Genes & Development, 14: 3024-3036. |
Qing T, Jason W R. 1999. Control of auxin-regulated root development by the Arabidopsis thaliana SHY2/IAA3 gene[J]. Development, 126: 711-721. |
Rogg L E, Lasswell J, Bartel B. 2001. A gain-of-function mutation in IAA28 suppresses lateral root development[J]. Plant Cell, 13: 465-480. DOI:10.1105/tpc.13.3.465 |
Rouse D, Mackay P, Stirnberg P, et al. 1998. Changes in auxin response from mutation in an AUX/IAA gene[J]. Science, 279: 1371-1373. DOI:10.1126/science.279.5355.1371 |
Scott Jr D L, Clark C W, Deahl K L, et al. 1998. Isolation of functional RNA from periderm tissue of potato tubers and sweet potato storage roots[J]. Plant Molecular Biology Reporter, 16: 3-8. DOI:10.1023/A:1007438106849 |
Soh M S, Hong S H, Kim B C, et al. 1999. Regulation of both light-and auxin-mediated development by the Arabidopsis IAA3/SHY2 gene[J]. Journal of Plant Biology, 42: 239-246. DOI:10.1007/BF03030485 |
Szabolcs F, Andrea M, Eva S B. 2002. Change of peroxidase enzyme activities in annual cuttings during rooting[J]. Acta Biologica Szegediensis, 46(3/4): 29-31. |
Tatematsu K, Kumagai S, Muto H, et al. 2004. MASSUGU2 encodes Aux/IAA19, an auxin-regulated protein that functions together with the transcriptional activator NPH4/ARF7 to regulate diferential growth responses of hypocotyls and formation of lateral roots in Arabidopsis thaliana[J]. Plant Cell, 16: 379-393. DOI:10.1105/tpc.018630 |
Tohit G. 2000. Peroxidase and IAA-Oxidase activities during rooting in cuttings of three poplar species[J]. Turk J Bot, 24: 97-101. |
Wilson A K, Picket F B, Turner J C, et al. 1990. A dominant mutation in Arabidopsis confers resistance to auxin, ethylene, and abscisic acid[J]. Molecular and General Genetics, 222: 377-383. DOI:10.1007/BF00633843 |
Wu Guang, Gu Ying, Li Shundai, et al. 2001. A genome-wide analysis of Arabidopsis Rop-interactive CRIB motif-containing proteins that act as Rop GTPase targets[J]. Plant Cell, 13: 2841-2856. DOI:10.1105/tpc.13.12.2841 |
Yang X, Lee S, So J H, et al. 2004. The IAA1 protein is encoded by AXR5 and is a substrate of SCFTIRI[J]. Plant J, 40: 772-782. DOI:10.1111/tpj.2004.40.issue-5 |
Yang Zhenbiao. 2002. Small GTPase: versatile signaling switches in plants[J]. The Plant Cell, 14: 375-388. DOI:10.1105/tpc.001065 |
Zheng Z L, Nafisi M, Tam A, et al. 2002. Plasma membrane-associated ROP10 small GTPase is a specific negative regulator of abscisic acid responses in Arabidopsis[J]. Plant Cell, 14: 2787-2797. DOI:10.1105/tpc.005611 |
 2010, Vol. 46
2010, Vol. 46