文章信息
- 郝宇, 梁海永, 杨敏生
- Hao Yu, Liang Haiyong, Yang Minsheng
- 多拷贝rol基因对转基因杨树生长及内源激素的影响
- Effect of the Multi-Copied Gene on the Growth and the Endogenous Hormones of the Transgenic Poplar
- 林业科学, 2010, 46(5): 58-63.
- Scientia Silvae Sinicae, 2010, 46(5): 58-63.
-
文章历史
- 收稿日期:2009-03-30
-
作者相关文章
2. 河北农业大学林学院 保定 071000;
3. 天津国土资源和房屋职业学院艺术设计系 天津 300270
2. College of Forestry, Agricultural University of Hebei Baoding 071000;
3. The Art Department of Design, Tianjin Land Resources and House Vocational College Tianjin 300270
20世纪80年代以来,国内外学者对发根农杆菌Ri质粒及其rol基因进行了广泛深入的研究。至今已成功地利用Ri质粒对多个科属的许多草本植物及一些林木与果树如毛白杨(Populus tomentosa)、杂交杨、刺槐(Robinia pseudoacacia)、欧洲落叶松(Larix decidua)、苹果(Malus pumila)、墨西哥酸橙(Citrus aurantium)等进行了转化(周达锋等,1993; Christey, 2001)。然而,在rol基因表达的性状中, 既有改良目的所需要的, 也存在对育种目标不利的性状,如对多数植物导入rolA、rolB和rolC基因后, 虽然能显著改善植株的生根能力,但常伴随着顶端优势减弱, 节间缩短, 叶片卷皱等不良性状(陶爱群等,2006),限制了其应用。因此,研究多拷贝rol基因在转基因植物中的表达及对形态、生长及内源激素等的影响,对于rol基因的利用具有重要意义。
三倍体毛白杨是我国培育的优良新品种,生长快速, 材质优良,应用前景广泛(朱之悌等,1995)。但由于三倍体树种不能用种子繁殖,扦插不易成活(刘德良等,2007),其快速、大面积繁殖和推广应用受到了严重制约。通过转化rol等生根相关基因,培育易生根三倍体毛白杨新品种,对于降低育苗成本、加快优良品种的繁育和推广具有推动作用。刘兴菊(2005)将发根农杆菌Ri质粒30148菌株转入三倍体毛白杨植株中,也使三倍体毛白杨植株生根能力得到了显著的提高。本研究将Ri质粒上T-DNA区中决定植物毛根形成并影响植株形态的rolB和rolC 2个重要基因进行克隆并分别导入转Ri质粒的三倍体毛白杨植株中,使rolB和rolC基因在转Ri质粒三倍体毛白杨基因组中形成多拷贝,与已转入的rolB和rolC基因的表达情况进行对比分析。
1 材料与方法 1.1 材料2个转Ri质粒T-DNA的三倍体毛白杨株系63, 01和11及在此基础上再转rolB基因获得的14个转基因株系和转rolC基因获得的13个转基因株系组培苗,对照三倍体毛白杨组培苗。
rolB基因的载体为由rolB启动子(Capone et al., 1994)驱动rolB基因和由rolB启动子驱动GUS基因的植物表达载体pCMB-B:GUS, 质粒携带有NptⅡ选择标记基因; rolC基因的载体为由35S启动子驱动rolC基因的植物表达载体pPCV002-CaMVC,质粒携带有NptⅡ基因和AmpR基因(以上载体由河北农业大学林业生物技术实验室提供)。
1.2 方法 1.2.1 转基因组培苗的检测对转基因三倍体毛白杨各株系试管苗的目的基因和标记基因进行PCR检测和组织化学染色检测。
1.2.2 转基因组培苗的生长形态测定将转基因三倍体毛白杨各株系试管苗的茎段和对照试管苗的茎段(长1~2 cm)在无菌条件下接种于不含植物生长调节剂的MS0培养基上,每瓶接种3株,每个处理10瓶,温度(25±3)℃,光照强度1 500~2 000 lx,每天光照时间为14 h,于接种后第7, 10, 13天调查各株系的生根情况,第25天调查高生长情况。
1.2.3 转基因组培苗内源激素测定将转基因株系试管苗进行真空冷冻干燥处理,材料处理后研磨成干粉并过筛,每个株系准确称取50 mg,备用。
内源激素提取方法:50 mg样品→加入2 mL 80%甲醇水含1%冰乙酸的提取液→4 ℃条件下浸提10~12 h →4 ℃ 10 000 r·min-1离心10 min→取1 000 μL浸提液与7 mL含1%冰乙酸的双蒸水混匀,此时甲醇含量为10% →过经预处理的C18柱→用含1%冰乙酸的10%甲醇清洗杂质→加入1 000 μL含1%冰乙酸的80%甲醇洗脱液→收集洗脱液在1.5 mL离心管中。
流动相:甲醇/双蒸水(含0.5%冰乙酸)体积分数为45:55;流速:0.7 mL·min-1; 柱温:30 ℃; 色谱柱:岛津生产的Shim-pack VP-ODS柱(250×4.6,粒径4.6μm); 检测波长:254 nm。数据采集和处理由Class-vp色谱工作站自动完成。
2 结果与分析 2.1 转基因株系外源基因的检测采用农杆菌介导法分2次转入Ri质粒T-DNA和rolB, rolC基因,对各转入基因和标记基因进行PCR检测(图 1)和组织化学染色检测,证明rolB和rolC基因已转入三倍体毛白杨中(表 1)。
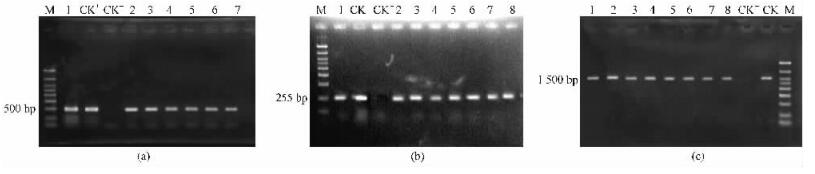
|
图 1 部分转基因植株PCR检测结果 Figure 1 PCR detection of transgenic plants 基因Gene: (a)NptⅡ; (b)rolB; (c)rolC.M:Marker DL3000; CK-:转Ri质粒植株Negative control plants; CK+:质粒阳性对照Positive control plasmid; 1-8:转基因植株Transgenic plants. |
|
|
对rol基因多拷贝株系进行了根、茎、叶的形态比较,发现转Ri质粒三倍体毛白杨再分别转入rolB和rolC基因后,根系形态基本没有变化,大多数株系的分枝能力增强,茎节间有不同程度的缩短,节间距在2~8 mm之间,而未转入rolB、rolC基因的转Ri质粒三倍体毛白杨株系节间距在5~10 mm之间。大多数转rolB基因株系较未转入rolB和rolC基因的转Ri质粒三倍体毛白杨株系植株矮化,但叶面皱缩程度减轻,叶面积增加; 72%的转rolC基因株系叶面由皱缩变为平展(图 2)。由此可看出,rolB基因多拷贝在植株茎段中的表达得到加强,但在植株叶片组织中,其表达则受到一定程度的干扰。

|
图 2 转基因株系的叶形及植株形态变化 Figure 2 Leaf shape and plant morphology changes of the transgenic lines |
调查结果显示,培养25天后,各转rolB和rolC基因株系高生长量差异显著(图 3)。rolB和rolC基因多拷贝株系高生长量均高于对照三倍体毛白杨,其中50%的转rolB基因株系高生长量超过5 cm,但转rolC基因株系高生长量均未超过5 cm,rolB基因多拷贝株系中高生长量超过转Ri质粒对照的比例是64%,此比例在rolC基因多拷贝株系中是53%。说明在茎的伸长生长中,rolB基因多拷贝下其表达所受干扰较rolC基因强些。
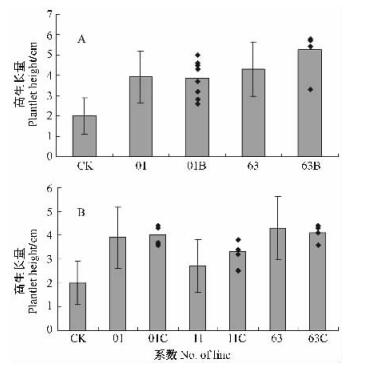
|
图 3 rolB(A), rolC(B)基因多拷贝株系试管苗高生长量 Figure 3 Plantlet height of rolB(A), rolC(B) transgenicplants on tissue culture 01B: n=8; 63B: n=6; 01C: n=4;11C: n=5; 63C: n=4.下同。The same below. |
将转rolB和rolC基因株系试管苗与对照的幼嫩茎段均培养于MS0培养基。图 4为各转基因株系组生根率随培养时间的变化趋势。由图 4可以看出,转rolB和rolC基因植株在7, 10, 13天时的生根率呈上升趋势,但不同转基因株系间生根率存在着一定差异。rolB和rolC基因多拷贝株系生根率均显著高于对照三倍体毛白杨,rolB基因多拷贝株系生根率平均值均高于对照转Ri质粒的三倍体毛白杨,rolC基因多拷贝株系生根率优势于第13天不再明显,部分株系的生根率低于其对照转Ri质粒的三倍体毛白杨。在转rolB基因株系中,63B组株系生根率平均值高于01B组株系; 在转rolC基因株系中,生根率较高的为11C组株系。总体比较,rolB基因多拷贝株系生根率高于rolC基因多拷贝株系。

|
图 4 rolB(A), rolC(B)基因多拷贝株系试管苗生根率的变化 Figure 4 The change of rooting rate of rolB(A), rolC(B) transgenic plants on tissue culture |
从图 5可见,rolB基因多拷贝三倍体毛白杨株系所含的内源IAA平均含量有不同程度提高,其中701B内源IAA含量最高,达514.56 ng·g-1,转Ri质粒的株系01和63内源IAA含量普遍低于转rolB基因多拷贝株系。由图 5可见,rolC基因多拷贝三倍体毛白杨株系所含的内源IAA平均含量01C组与11C组高于对照植株,其中111C含量最高,达354.28 ng·g-1,而63C组则低于对照株系。
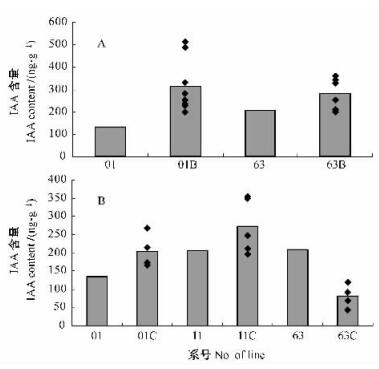
|
图 5 rolB(A), rolC(B)基因多拷贝株系内源IAA含量 Figure 5 Content of endogenous IAA in rolB(A), rolC(B) transgenic plants |
转rolB基因的转Ri质粒三倍体毛白杨株系内源IAA含量超过200 ng·g-1的比率是85.7%,而在转rolC基因的株系中是50%,最高值亦出现在转rolB基因的株系中,说明转rolB基因植株的内源IAA含量普遍高于转rolC基因的株系,这与转rolB和rolC基因植株高生长量的变化一致。
2.4.2 转基因植株内源ABA的变化从图 6可见,将rolB和rolC基因分别对转Ri质粒T-DNA的株系01,11和63转化后,得到rol基因多拷贝株系组01B,01C和11C,其内源激素ABA含量的平均值均低于rol基因单拷贝对照植株,而rol基因多拷贝株系组63B与63C的ABA含量的平均值高于对照植株。2组rolB基因多拷贝株系,01B组的ABA含量普遍高于63B组植株。在rolC基因多拷贝的3组株系中,63C组株系的ABA平均含量明显低于另2组株系。
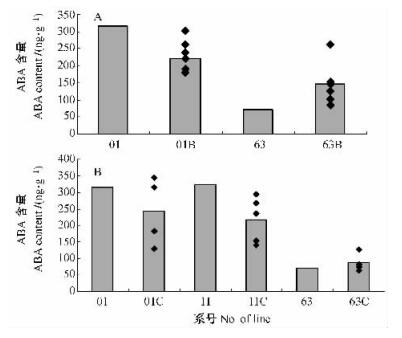
|
图 6 rolB(A), rolC(B)基因多拷贝株系内源ABA含量 Figure 6 Content of endogenous ABA in rolB(A), rolC(B) transgenic plants |
由图 7可知,rol基因多拷贝株系组01B, 01C和11C,其内源激素IAA与ABA比值的平均值均高于对照植株转Ri质粒T-DNA三倍体毛白杨,rol基因多拷贝株系组63B与63C的IAA/ABA平均值均低于对照。其中,rolB基因多拷贝的株系中的最高值为701B,其比值为对照的6.8倍; rolC基因多拷贝株系中的最高值为211C,其比值为对照11的2.4倍。
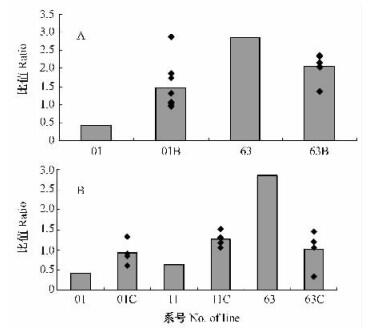
|
图 7 rolB(A), rolC(B)基因多拷贝株系IAA/ABA值的变化 Figure 7 Ratio of endogenous IAA to ABA in rolB(A), rolC(B) transgenic plants |
与未转基因的三倍体毛白杨相比,转Ri质粒T-DNA的三倍体毛白杨发生了形态变异,即生根率均高于对照三倍体毛白杨,且侧根极为发达,但是植株节间缩短,叶片也表现出了不同程度的皱缩现象,与卜学贤等(1991)报道相一致,但组培苗生长表现出相反趋势。一般来说,转入rol基因使植株节间缩短,生长受抑制(Schmülling et al., 1988)。但本试验中转rol基因组培苗生长表现出进一步提高的趋势,这可能是对照组培苗在不含植物生长调节剂的MS0培养基中生长极为缓慢,而转基因株系能够表达生长素,有利于促进组培苗生长,使生长相对较快,但在田间的生长表现还有待于进一步观察。
在转Ri质粒T-DNA的株系中进一步转入rolB和rolC基因后,形成rolB或rolC的多拷贝株系,与单转Ri质粒T-DNA相比,在MS0培养基上组培苗生长未受明显影响,但大部分株系侧枝明显增多,组培苗生根能力进一步提高。但多拷贝rolB和rolC基因株系存在一定差异,多拷贝rolB基因株系生根率提高明显,且株系间差异较小; 多拷贝rolC基因株系生根率提高不明显,且株系间差异明显,部分株系生根率低于单转Ri质粒T-DNA株系。进一步检测植株内源激素表明:在rolB基因多拷贝株系中,IAA含量平均值较对照单拷贝株系表现出略有升高的趋势,而ABA含量和IAA/ABA比值在不同株系中表现不一致, 含量平均值也表现出不一致的变化趋势; 在rolC基因多拷贝株系中的IAA,ABA含量和IAA/ABA比值同样表现出不一致的变化趋势。这可能是由于T-DNA和rolB和rolC基因在不同株系中插入位置不同造成的(李科等,2008),同时也说明多拷贝株系中内源激素的表达量并不是决定生根率提高与否的主要因素。
一般认为,在转基因植株中外源基因拷贝数与表达量不一定有直接关系,即拷贝数多的基因表达量不一定高,而且多拷贝还可能造成基因的共抑制,反而降低了基因的表达量(Vaucheret et al., 2001),但也有相反结果的报道。Bell等(1999)将rolC基因转入梨(Pyrus communis)品种‘Beurre Bosc’获得的转基因植株,经鉴定包括3个拷贝数不同的株系:F24(3个拷贝数)、F23(1个拷贝数)和F22(2个拷贝数),但3个株系在植株高度、节间距上均无显著差异; 转rolC基因苹果砧木Marubakaidou(Malus prumifollia var. ringo)植株的表现型与拷贝数无关(Igarashi et al., 2002); Fladung(1996)在转rolC基因马铃薯(Solanum tuberosum)中发现,随着拷贝数的增加,该基因表达效果越强,但这种现象只在试管中表现明显。在本试验中,多拷贝株系对生长影响不明显,但进一步促进了生根能力,分析其原因可能是rolB和rolC基因拷贝数增加,提高了其表达能力,从而促进了生根; 也可能是多拷贝基因抑制了rolB(或rolC)基因的表达,但促进了其他rol基因的表达,从而出现了生根能力提高的现象。另外,转多拷贝基因的不同株系在生长、形态、生根能力及内源激素水平上表现并不一致,特别是转多拷贝rolC基因的株系,差异更显著,说明外源基因插入位置不同对外源基因的表达也有很大影响。
rol基因转化的三倍体毛白杨表现出了丰富的遗传多样性,且多拷贝外源基因能够进一步影响外源基因的表达,通过这种途径可为三倍体毛白杨生根育种提供大量原始材料, 也为研究基因的功能奠定基础。但是本试验仅以定性PCR检测结果为基础,从转化植株的生长变化、激素差异角度探讨了不同拷贝数群体间的表达差异。对于外源基因的具体拷贝数及表达量等量化指标并未涉及,尚待进一步研究。
卜学贤, 林忠平, 陈维伦. 1991. 农杆菌对毛白杨的转化及完整转化植株的获得[J]. 植物学报, 33(3): 206-213. |
李科, 王世全, 吴发强, 等. 2008. 农杆菌介导的转高赖氨酸蛋白基因(sb401)水稻T4代分析[J]. 中国水稻科学, 22(2): 131-136. |
刘德良, 易诚, 隆朝晖. 2007. 三倍体毛白杨硬枝扦插育苗技术研究[J]. 南华大学学报:自然科学版, 21(4): 24-29. |
刘兴菊. 2005. Ri质粒转化三倍体毛白杨及外源基因表达的研究.保定:河北农业大学硕士学位论文.
|
陶爱群, 谢深喜, 胡春华. 2006. 发根农杆菌Ri质粒rol基因矮化性状表达研究进展[J]. 湖南环境生物职业技术学院学报, 12(4): 360-363. |
周达锋, 卜学贤, 陈维伦. 1993. 发根农杆菌Ri质粒的分子生物学及其应用前景[J]. 植物学通报, 10(2): 24-34. |
朱之悌, 林惠斌, 康向阳. 1995. 毛白杨异源三倍体B301等无性系选育的研究[J]. 林业科学, 31(6): 499-505. |
Bell R L, Scorza R, Srinivasan C. 1999. Transformation of 'Beurre Bosc' pear with the rolC gene[J]. Journal of American Society for Horticultural Science, 124(6): 570-574. |
Capone I, Frugis G, Costantino P, et al. 1994. Expression in different populations of cells of the root meristem is controlled by different domains of the rolB promoter[J]. Plant Molecular Biology, 25: 681-691. DOI:10.1007/BF00029606 |
Christey M C. 2001. Use of Ri-mediated transformation for production of transgenic plants[J]. In Vitro Cell Dev Biol Plant, 37: 687-700. DOI:10.1007/s11627-001-0120-0 |
Fladung M. 1996. Transgenic potato plants can be used to evaluate stability of foreign genes:reversions and chimeras in multiple copies of rolC harboring clones[J]. Agronomie, 16: 113-121. DOI:10.1051/agro:19960205 |
Igarashi M, Ogasawara H, Hatsuyama Y, et al. 2002. Introduction of rolC into Marnbakaidou [Malus prumifollia Borkh. var. ringo Asami Mo 84-A] apple rootstock via Agrobacterium tumefaciens.Plant Science, 163(3): 463-473.
|
Schmülling T, Schell J, Spena A. 1988. Single genes from Agrobacterium rhizogenes influence plant development[J]. The EMBO Journal, 7: 2621-2629. |
Vaucheret H, Fagard M. 2001. Transcriptional gene silencing in plants:targets, inducers and regulators[J]. Trends in Genetics, 17(1): 29-35. DOI:10.1016/S0168-9525(00)02166-1 |
 2010, Vol. 46
2010, Vol. 46


