文章信息
- 杜娟, 南宫自艳, 周国娜, 高宝嘉
- Du Juan, Nangong Ziyan, Zhou Guona, Gao Baojia
- 美国白蛾SSR反应体系的优化与初步应用
- Optimization and Preliminary Application of SSR Analysis System in Hyphantria cunea
- 林业科学, 2010, 46(3): 173-177.
- Scientia Silvae Sinicae, 2010, 46(3): 173-177.
-
文章历史
- 收稿日期:2008-09-09
-
作者相关文章
2. 河北农业大学植物保护学院 保定 071000
2. College of Plant Protection, Agricultural University of Hebei Baoding 071000
我国于1979年首次在辽宁省丹东市发现美国白蛾(Hyphantria cunea)后,害虫扩散蔓延到山东、陕西、河北、天津和上海。美国白蛾繁殖量大,寄主植物种类繁多,扩散速度快,暴发时常食尽叶片。近年来美国白蛾传入了北京,对首都园林绿化及生态环境安全造成了严重影响(杨忠岐等,2007)。Ozaki等(2001)通过比较日本不同地区与原产地佛罗里达州美国白蛾种群的DNA序列后发现,美国白蛾在日本化性的变异是由于适应日本不同地区气候的进化反应,而非来自美国不同气候地区的种群。美国白蛾入侵中国近30年来,我国学者对它的适应性、性信息素、对寄主的选择、天敌、预测预报和防治方法等进行了广泛研究(季荣等,2003; 魏建荣,2003),但对它的入侵机制及不同入侵地区的种群遗传变异等相关的研究还未见报道。随着分子生物学技术的兴起及日臻成熟,各种分子遗传标记技术不但能揭示相似姊妹种之间的差异,还有助于揭示物种的起源和进化规律(Patricia et al., 1998; Roderick,1996; Zhang,2004)。
作为遗传标记方法之一的SSR技术,其原理是每个物种的重复单位的碱基组成及拷贝数存在很大差异,具有检测敏感、共显性、多态性好等优点(Kruglyak et al., 1998; Valdes et al., 1993)。近年来,SSR技术在鳞翅目昆虫中的应用研究已有不少报道(吉亚杰等,2004; 张云武等,2001),而美国白蛾的相关研究报道较少。由于SSR技术也是基于PCR的一种标记,其反应条件易受各种因素的干扰,如模板DNA、TaqDNA聚合酶、dNTP以及Mg2+的浓度等因子的条件不适合,则导致图谱弥散状背景的产生、扩增产物的消失等,这些现象都影响SSR的扩增结果,从而影响整个试验结果。为此本文以美国白蛾沧州种群为试材,对各因子的最佳反应条件进行研究,以期建立一套适合美国白蛾的SSR反应体系。
1 材料与方法 1.1 材料2008年5月自沧州地区随机采集美国白蛾虫蛹,室内羽化后在-20 ℃下保存。
1.2 方法1) DNA的提取 根据经典的SDS-DNA提取法,对部分操作过程进行了优化(姜静,2003)。主要改进之处:剪去枪头的尖端,蛋白酶K终质量浓度400 μg·mL-1,RNase终质量浓度100 μg·mL-1,0.8%的琼脂糖凝胶检测。
2) SSR-PCR反应体系 在25 μL SSR-PCR反应体系中,加入0.40 mmol·L-1 dNTP,2.5 mmol·L-1 MgCI2,2.0 U Taq聚合酶,0.52 μmol·L-1引物,30~60 ng模板DNA,用重蒸水调整体系终体积为25 μL。用dNTP、Mg2+、TaqDNA聚合酶、引物、模板DNA当中任1种成分进行浓度梯度试验时,其他成分浓度不变。引物序列参照文献(Ji et al., 2005),由上海生物技术工程有限公司合成。dNTP和TaqDNA聚合酶均购自海泰克生物技术有限公司(表 1)。
|
|
3) SSR-PCR扩增程序 8对SSR引物(表 1)的退火温度梯度设置分别为50,50.5,51,51.5,52 ℃; 反应程序为94 ℃预变性4 min,94 ℃变性20 s,退火30 s,72 ℃延伸15 s 35个循环,最后在72 ℃延伸2 min。PCR仪为ABI-2720型。
4) PCR产物的检测 配制8%非变性聚丙烯酰胺凝胶,取扩增产物4 μL加1 μL 6倍上样缓冲液混匀、上样,恒压230 V,2 h。标准分子量标记为100 bp DNA Ladder。
电泳结束后将胶剥下,双蒸水冲洗2次、每次10 s; 加0.2%硝酸银染色液,摇床轻摇20 min; 双蒸水冲洗2次、每次10 s; 加150 mL显色液,轻摇5~7 min,即可见清楚条带显现,照相保存。电泳分析使用君意DYC-30型电泳仪及君意DYY-Ⅲ型垂直板电泳槽。
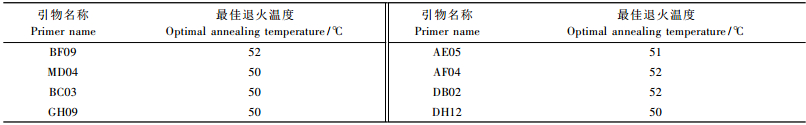
2 结果与分析 2.1 dNTP浓度对SSR反应的影响图 1泳道1~4显示了4个浓度(0.1,0.2,0.4,0.6 mmol·L-1)的PCR扩增产物情况。虽均有扩增产物,但浓度为0.10 mmol·L-1时PCR产物的产量极低,几乎无扩增谱带; 浓度为0.20,0.40和0.60 mmol·L-1时均有扩增谱带,但过量的dNTPs会与聚合酶竞争结合Mg2+,抑制PCR反应。通过比较,0.40 mmol·L-1时扩增带最清晰稳定,而且条带整齐,故dNTP的浓度以0.40 mmol·L-1为宜。
|
图 1 dNTP浓度对SSR反应的影响 Figure 1 Effects of dNTP concentrations on SSR reaction 1~4:dNTP浓度分别为0.1, 0.2, 0.4, 0.6 mmol·L-1 dNTP concentration 0.1, 0.2, 0.4, 0.6 mmol·L-1; M: 100 bp标准分子质量100 bp DNA ladder.下同 The same below. |
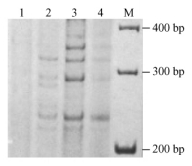
Mg2+浓度在SSR反应中也非常重要,它是PCR中DNA聚合酶的活性所必需的辅助因子,因此其浓度在每一引物与模板配对中均应达最适量。图 2中泳道1~4显示了Mg2+的4个浓度1.5,2.5,3.5,4.0 mmol·L-1的扩增结果,由于当Mg2+浓度为1.5 mmol·L-1时扩增产物条带模糊,浓度为3.5和4.0 mmol·L-1时背景加深,只有2.5 mmol·L-1时扩增谱带清晰且稳定。
|
图 2 Mg2+的浓度对SSR反应的影响 Figure 2 Effects of Mg2+ concentrations on SSR reaction 1~4:Mg2+浓度分别为1.5, 2.5, 3.5, 4.0 mmol·L-1 Mg2+ concentration 1.5, 2.5, 3.5, 4.0 mmol·L-1. |
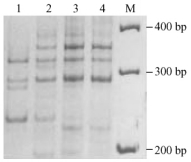
TaqDNA聚合酶浓度过低则合成产物量减少,浓度过高可引起非特异性产物的扩增。图 3显示了不同TaqDNA聚合酶的浓度的PCR扩增产物情况。因TaqDNA聚合酶浓度为0.5 U时条带模糊不清,为2.0, 3.0 U时易出现非特异性条带,只有为1.0 U时谱带清晰、且无非特异性产物的扩增,扩增效果最好。
|
图 3 Taq聚合酶浓度对SSR反应的影响 Figure 3 Effects of Taq polymerase concentrations on SSR reaction 1~4:Taq酶分别为0.5, 1.0, 2.0, 3.0 U Taq polymerase 0.5, 1.0, 2.0, 3.0 U |
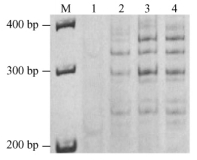
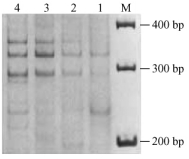
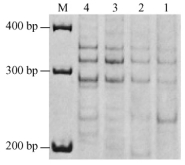
同理,当引物浓度为0.52和0.72 μmol·L-1时,背景加深、条带不清,因此只有0.32 μmol·L-1为引物优化浓度(图 4); 模板DNA在30,60 ng时谱带基本稳定且带型清晰,浓度低时条带模糊不清, 过高则背景加深、较难分辨(图 5)。
|
图 4 引物浓度对SSR反应的影响 Figure 4 Effects of primer concentrations on SSR reaction 1~4:引物浓度分别为0.12, 0.32, 0.52, 0.72 μmol·L-1 Primer concentration 0.12, 0.32, 0.52, 0.72 μmol·L-1. |
|
图 5 模板DNA对SSR反应的影响 Figure 5 Effects of template DNA amount on SSR reaction 1~4:模板DNA分别为15, 30, 60, 90 ng Template DNA 15, 30, 60, 90 ng. |
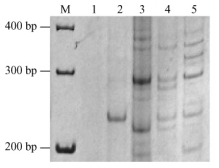
退火温度是决定引物与模板结合的另一重要因素,研究表明(图 6)退火温度较低时无扩增条带或多为非特异性条带,只有52.0 ℃为AF04的最佳退火温度。其他引物的最佳退火温度见表 2。
|
图 6 不同退火温度对SSR反应的影响 Figure 6 Effects of different annealing temperature on SSR reaction 1~5:第6对引物50,50.5,51,51.5,52 ℃ Primer 6 50,50.5,51,51.5,52 ℃; 所用引物为AF04 The primer used in the SSR-PCR is AF04. |
|
|
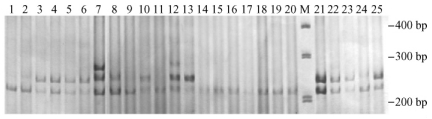
选引物DH12,按照dNTP的Mg2+、TaqDNA聚合酶、引物、模板DNA浓度分别为0.40 mmol·L-1, 2.5 mmol·L-1, 1.0 U, 0.32 μmol·L-1, 30~60 ng,退火温度为50.0 ℃进行5个不同入侵地的美国白蛾种群的SSR扩增,图 7表明该SSR-PCR反应体系的优化条件能扩增出清晰、多态性高的谱带,能够阐明美国白蛾不同侵入地间种群的遗传变异和多态性。
|
图 7 引物AF04的扩增结果 Figure 7 Result of SSR amplification of primer DH12 1~5:丹东 Dandong; 6~10:烟台 Yantai; 11~15:秦皇岛 Qinhuangdao; 16~20:正定 Zhengding; 21~25:沧州. |
同样用引物DH12对沧州美国白蛾种群中的17个个体进行PCR扩增,由图 8可知该引物也能扩增出清晰、多态性高的谱带。表明上述SSR-PCR反应体系稳定可靠。

|
图 8 引物DH12对17个沧州美国白蛾基因组DNA的扩增结果 Figure 8 Profile of amplication products from genetie DNA of 17 H.cunea of Cangzhou accessions using primer DH12 |
SSR具有稳定性、共显性和多态性等优点,是一种较为理想的分子标记技术。但在实际应用中,必须对每个微卫星位点的两翼序列有针对性地设计引物。一个全新引物的设计,对试验技能要求高,成功率较低(Zhang,2004; 姜静,2003); 获得引物较为便捷的方法是检索GenBank、EMTBL或DDBJ DNA序列数据库,参考相关资料进行改进设计。
微卫星标记在鳞翅目昆虫种群遗传学研究中有不少报道,Zhang D X(2004)研究发现鳞翅目粉蝶和蛾类昆虫基因组的微卫星侧翼序列高度保守,认为这可能是鳞翅目昆虫微卫星丰富度较低的原因。Meglecz等(2007)通过对32种昆虫的微卫星序列的研究也证实不同物种之间微卫星位点的侧翼序列差异很大。本研究采用与美国白蛾同一鳞翅目的家蚕(Bombyx mori)、棉铃虫(Helicoverpa armigera)、马尾松松毛虫(Dendrolimus punctatus)、舞毒蛾(Lymantria dispar)等昆虫(Ji et al., 2005; Li et al., 2005; Grasela et al., 2005; 李竞等,2005; 沈利,2004; 王少丽等,2003; Reddy et al., 1999)已有报道的多态性表现好的引物,建立了适合研究美国白蛾的SSR反应体系,但并不是在鳞翅目昆虫上多态性表现好的引物对研究美国白蛾都适用,例如家蚕的7对微卫星引物就不能成功应用美国白蛾的遗传研究,用马尾松毛虫筛选出的8对引物在美国白蛾遗传研究中可以得到较好的扩增其主要原因可能是微卫星高度保守的侧翼序列所致(李竞等,2005; 沈利,2004; 王少丽等,2003)。
虽然SSR技术在其他昆虫上己经有了很多应用,但是不同的昆虫具有不同的最适宜体系,因而筛选SSR引物及建立稳定的反应体系是SSR多态性标记成功应用的基础。在SSR优化的体系中,过量的dNTPs会与聚合酶竞争结合Mg2+、抑制PCR反应。其他成分的浓度过高则会引起引物与模板的错配,产生非特异性扩增; 过低会影响PCR产物的产量,条带明显不清楚。Mg2+浓度也非常重要,它是PCR中DNA聚合酶的活性所必需的辅助因子,因此其浓度在每一引物与模板配对中均应做到最适。TaqDNA聚合酶浓度过高,可引起非特异性产物的扩增; 浓度过低则合成产物量减少。引物浓度偏高会引起错配和非特异性产物扩增,且可增加引物之间形成二聚体的机率,非特异性扩增能竞争所使用的酶、dNTP和引物,导致DNA合成产率下降。模板的质量并不需要很纯,但一定得量化,其浓度太小会影响PCR的产量,浓度太大则会产生非特异性产物或造成扩增泳道背景加深(Grasela et al., 2005)。退火温度是决定引物与模板结合的另一重要因素,实验过程中发现不同引物的最佳退火温度不同,但在本试验中引物的退火温度范围比较小,因而不需太大的变动,选用其他的引物时可以根据Tm值稍作调整, 将Tm控制在5~8 ℃。
季荣, 谢宝瑜, 李欣海. 2003. 外来入侵种—美国白蛾的研究进展[J]. 昆虫知识, 40(1): 3-18. |
吉亚杰, 张德兴. 2004. 鳞翅目昆虫基因组中微卫星DNA的特征以及对其分离的影响[J]. 动物学报, 50(4): 608-614. |
姜静. 2003. 分子生物学实验原理与技术[M]. 哈尔滨: 东北林业大学出版社.
|
李竞, 刘文明, 房守民. 2005. SSR标记在中国野桑蚕和家蚕的遗传多态性分析中的应用[J]. 蚕业科学, 31(3): 251-256. |
沈利. 2004. 家蚕SSR标记和CAPS标记的筛选及其应用. 中国科学院硕士学位论文. http://industry.wanfangdata.com.cn/dl/Detail/Thesis?id=Thesis_Y617655
|
魏建荣. 2003. 利用生命表评价白蛾周氏啮小蜂对美国白蛾的控制作用[J]. 昆虫学报, 46(3): 318-324. |
王少丽, 徐广, 杨效文, 等. 2003. 棉铃虫不同寄主植物种群间的微卫星引物扩增多态性研究[J]. 棉花学报, 15(2): 79-82. |
杨忠岐, 张永安. 2007. 重大外来入侵害虫—美国白蛾生物防治技术研究[J]. 昆虫知识, 44(4): 465-471. DOI:10.7679/j.issn.2095-1353.2007.107 |
张云武, 张亚平. 2001. 微卫星及其应用[J]. 动物学研究, 22(4): 315-320. |
Grasela J J, Mcintosh A H.2005.Cross-species investigation of Helicoverpa armigera microsatellites as potential markers for other related sppecies in the Helicoverpa-Heliothis complex. Journal of Insects Science. http://www.insectscience.org/5.47/.2008-09.
|
Ji Yajie, Hua Yueping. 2005. Ten polymorphic microsatellite markers developed in the masson pine moth Dendrolimus punctatus Walker[J]. Molecular Ecology Notes, 5: 911-913. DOI:10.1111/men.2005.5.issue-4 |
Kruglyak S, Durrett R T, Schug M D. 1998. Equilibrium distributions of microsatellite repeat length resulting from a balance between slippage events and point mutations[J]. Proc Natl Acad Sci USA, 95: 1074-1077. |
Li Muwang, Shen Li, Xu Anying, et al. 2005. Genetic diversity among silkworm (Bombyx mori L, Lep, Bombycidae) germplasms revealed by microsatellites[J]. Genome, 48(5): 802-810. DOI:10.1139/g05-053 |
Meglecz E, Anderson S J, Bourguet D. 2007. Microsatellite flanking region similarities among different loci within insect species[J]. Insect Molecular Biology, 16: 175-185. DOI:10.1111/imb.2007.16.issue-2 |
Ozaki K, Ohbayashi T. 2001. DNA comparision of Japanese population of Hyphantria cunea with divergent life cycles[J]. Entomol Sci, 4(1): 47-52. |
Patricia G P, Allison A S, Malcolm D G. 1998. What molecules can tell us about populations: choosing and using a molecular marker[J]. Ecology, 79(2): 361-382. |
Reddy K D, Abraham E G, Nagaraju J. 1999. Microsatellites in the silkworm, Bombyx mori: Abundance, polymorphism and strain characterization[J]. Genome, 42: 1057-1065. DOI:10.1139/g99-027 |
Roderick G K. 1996. Geographic structure of insect populations: Gene flow, phylogeography, and their uses[J]. Annual Review Entomology, 41: 325-352. DOI:10.1146/annurev.en.41.010196.001545 |
Valdes A M, Slatkin M, Freimer N B. 1993. Allele frequencies at microsatellite ioci: the stepvise mutation model revisited[J]. Genetics, 133: 737-749. |
Zhang D X. 2004. Lepidopteran microsatellite DNA: redundant but promising[J]. Trends in Ecology and Evolution, 19: 507-509. DOI:10.1016/j.tree.2004.07.020 |
 2010, Vol. 46
2010, Vol. 46