文章信息
- 李伟波, 马明, 孙翠, 侯立群, 杨克强
- Li Weibo, Ma Ming, Sun Cui, Hou Liqun, Yang Keqiang
- 核桃早实基因的SCAR标记
- Development of a SCAR Marker Linked to Precocious Trait in Walnut (Juglans regia)
- 林业科学, 2010, 46(3): 56-61.
- Scientia Silvae Sinicae, 2010, 46(3): 56-61.
-
文章历史
- 收稿日期:2008-12-18
-
作者相关文章
2. 山东农业大学农业生态与环境重点实验室 泰安 271018;
3. 山东省济宁技术学院 济宁 272013;
4. 山东省林业科学研究院 济南 250014
2. Key Laboratory of Agricultural Ecology and Environment, Shandong Agricultural University Tai'an 271018;
3. Jining Technology College, Shandong Province Jining 272013;
4. Shandong Academy of Forestry Jinan 250014
多数林木和果树树种,从播种到第1次开花的童期(juvenile)较长,这是影响其栽培和育种的一个主要因素。而在核桃(Juglans regia )中存在着一类播种当年或第2年就能开花结实的早实类型(杨文衡等,1983;Germain et al., 1997)。奚声珂(1987)通过杂交试验认为,核桃早实性状是2对以上等位基因决定的显性性状。Breton等(2004)报道了一些早实核桃,在组织培养的试管内就能开花,并用同源序列法从这些组培苗木中,克隆获得了核桃早实相关基因AGAMOUS和APETALA3。王国安等(2004)以自然存在的早实核桃和晚实核桃类群为试材,参照混合分离群体法(bulked segregant analysis, BSA),初步确定OPG15710是与核桃早实基因相关的RAPD标记。杨克强等(2002)曾获得了与核桃早实性状相连锁的RAPD标记OPB-08900。随后,杨克强等(2007)以核桃早实优系‘绿园’和晚实速生优系‘绿丰’及‘绿园’ב绿丰’杂交组合的F1杂种后代为试材, 定位了RAPD标记OPB-08900与核桃早实基因的遗传距离为1.99 cM,测序结果显示,该标记序列全长958 bp,该标记应记为OPB-08958,GenBank登录号为DQ673614。
本研究根据与核桃早实基因连锁的RAPD标记OPB-08958序列,设计了SEA, SEB 2对SCAR引物,将与核桃早实基因连锁的RAPD标记OPB-08958转化为SCAR(sequence characterized amplified region)标记,并在亲本、杂种后代和栽培品种中验证该SCAR标记与核桃早实基因的分离情况,计算该标记与核桃早实基因间的遗传距离,并对该标记进行克隆测序及序列分析,为核桃分子辅助育种和图位克隆早实基因奠定基础。
1 材料与方法 1.1 植物材料供试植物材料为普通核桃(Juglans regia)的品种、优系及其杂交后代。
栽培品种9个:‘元丰’、‘鲁光’、‘辽1’、‘中林3’、‘中林5’、‘扎343’、‘西扶2’、‘西林2’、‘西林3’,均为早实核桃品种。优系3个:其中早实核桃优系1个,为‘绿园’;晚实核桃优系2个,为‘绿丰’和‘T-12’。
杂交组合2个:‘绿园’(早实)ב绿丰’(晚实)杂交组合F1后代154株;‘T-12’(晚实)ב元丰’(早实)杂交组合F1后代123株。
供试的杂交材料于2002年春进行套袋杂交,秋季收获杂交种子。2005年3年生时,‘绿园’ב绿丰’F1杂交后代中有70株开花,为早实类群,有84株未开花,为晚实类群;‘T-12’ב元丰’F1杂交后代中有38株开花,为早实类群,有85株未开花,为晚实类群。供试栽培品种(系)均为嫁接苗。材料单株按1 m×3 m的株行距定植保存于山东农业大学林学试验站和山东泰安绿园经济林研究所。
1.2 仪器和试剂PCR仪为美国MJ公司生产PTC-100型,电泳仪为北京六一仪器厂生产DYY-Ⅲ型,凝胶成像仪为英国UVP公司生产GDS7600型,高速低温离心机为德国Eppendorf centrifuge 5415D型。
DL2000 DNA Marker, Taq DNA聚合酶Kit, dNTPs, Agarose Gel DNA Purification Kit, Mini BEST Plasmid Purification Kit, 胰蛋白胨, 酵母提取物, X-Gal, IPTG, 氨苄(Amp),以及载体质粒pMD18-T Vector, 大肠杆菌(Escherichia coli) JM109菌株, EcoRⅠ和HindⅢ, M13 Primer M4, M13 Primer RV等,均购自大连TaKaRa公司。CTAB, EDTA, PVP, Tris, β-巯基乙醇, RNA酶购自上海Sangon公司。
1.3 SCAR引物设计在特异引物OPB-08958及其互补序列基础上,向内延长了9~13 bp,设计了SEA, SEB 2对SCAR引物,序列如下:SEA-F: 5′-GTCCACACGGAATAGT CCCAT-3′; SEA-R: 5′-CGTGTGACACCGTGTGGAC-3′; SEB-F: 5′-GTCCACACGGAATAGTCCCATTA-3′; SEB-R: 5′-TGACGTGTGACACCGTGTGGAC-3′。SCAR引物由上海Sangon公司合成。
1.4 核桃基因组DNA的提取核桃基因组DNA的提取参照杨克强等(2007)的方法。
1.5 PCR扩增体系反应体系总体积为25 μL,其中10×PCR Buffer[100 mmol·L-1Tris-HCl(pH 8.3),500 mmol·L-1KCl] 2.5 μL,MgCl2 2.0 mmol·L-1,dNTP各0.25 mmol·L-1,SCAR特异引物0.35 μmol·L-1,Taq DNA聚合酶1 U,DNA模板150 ng。
PCR扩增反应程序:94 ℃预变性5 min;每个循环94 ℃变性1 min,36 ℃退火1 min,72 ℃延伸2 min,共45个循环;完成最后1个循环后,再72 ℃延伸10 min,反应终止于4 ℃。
扩增产物用含0.5 g·L-1EB的1.5%琼脂糖凝胶,在5 V·cm-1电压下电泳,电泳缓冲液为0.5×TBE(45 mmol·L-1 Tris-H3BO4,1 mmol·L-1 EDTA)。在凝胶成像仪下观察、照相。
1.6 SCAR标记片段DNA的克隆与测序SCAR标记片段DNA的回收、克隆、阳性克隆的筛选参照杨克强等(2005)的方法。DNA测序由上海博亚公司完成。
1.7 遗传距离的计算对标记片断在杂交F1后代中的分离状况进行χ2检测,利用Haldane函数M=-ln(1-2r)/2估算遗传距离,式中,M为遗传距离,r为重组率(莫惠栋,1996)。
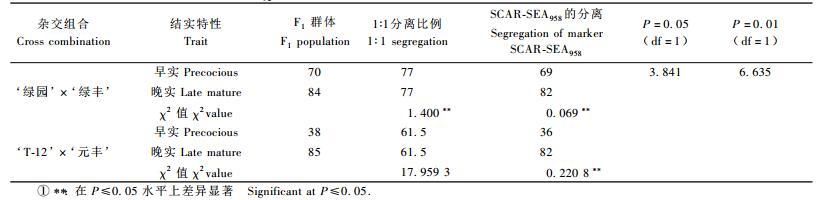
2 结果与分析 2.1 RAPD标记转化为SCAR标记以早实亲本‘绿园’和晚实亲本‘绿丰’的基因组DNA检测2对SCAR引物(图 1)。
|
图 1 SCAR引物SEA和SEB扩增结果 Figure 1 Schematic showing DNA fragments amplified with SCAR-SEA and SCAR-SEB primers M:DL2000 DNA marker;1-3:SCAR-SEA在退火温度分别为54, 56, 58 ℃时在早实亲本‘绿园’上的扩增结果;4-6:SCAR-SEA在退火温度分别为54,56,58 ℃时在晚实亲本‘绿丰’上的扩增结果;7-9:SCAR-SEB在退火温度分别为55,57,59 ℃时在早实亲本上的扩增结果;10-12:SEB在退火温度分别为55,57,59 ℃时在晚实亲本上的扩增结果。 M:DL2000 DNA marker; 1-3: DNA fragments amplified with SCAR-SEA primer on precocious parent 'Lüyuan' at annealing temperature 54, 56, 58 ℃; 4-6: DNA fragments amplified by SCAR Marker SEA on late mature parent 'Lüfeng' at annealing temperature 54, 56, 58 ℃; 7-9: DNA fragments amplified by SCAR-SEB primer on precocious parent 'Lüyuan' at annealing temperature 55, 57, 59 ℃; 10-12: DNA fragments amplified by SCAR-SEB primer on late mature parent 'Lüfeng' at annealing temperature 55, 57, 59 ℃. |
对于第1对引物SEA,分别设定在退火温度为54, 56,58 ℃条件下进行PCR扩增。结果发现,在54,56,58 ℃退火条件下,引物对SEA在早实亲本‘绿园’上均能扩增出958 bp左右和RAPD特异标记片段大小相近的片段特异条带,在晚实亲本‘绿丰’上没有扩增出条带(图 1泳道1-6所示)。将这一特异标记条带记为:SCAR-SEA958。而引物对SEB仅在退火温度55,57 ℃时在早实亲本上同时扩增出了约958 bp的条带,在退火温度59 ℃时在早实亲本上扩增不出特异条带;55,57,59 ℃退火温度时在晚实亲本上扩增不出条带(图 1泳道7-12)。SCAR-SEA引物对的稳定性好于SCAR-SEB引物对。
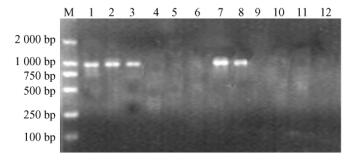
2.2 SCAR-SEA958标记在F1后代和栽培品种中的检验 2.2.1 SCAR-SEA958标记在‘绿园’ב绿丰’F1杂交后代中的分离用SCAR-SEA引物对对‘绿园’ב绿丰’F1杂交后代154株个体的基因组DNA进行PCR扩增,部分扩增结果如图 2。结果表明,在70株早实后代中,有69株扩增出958 bp的DNA条带,1株(5号)未出现该条带;84株晚实后代中,82株未出现该条带,2株(18号、108号)出现,共有3株表现为重组类型,其重组率为1.95%。χ2检测显示,供试的‘绿园’ב绿丰’F1杂交群体早实和晚实性状的分离比例符合1:1的分离比例,标记SCAR-SEA958与早实性状共分离(表 1)。SCAR-SEA958在该群体中与核桃早实基因间的遗传距离为1.99 cM。SCAR-SEA958在后代中的分离情况和RAPD标记OPB-08958的分离情况相一致。
|
图 2 SCAR-SEA引物对在‘绿园’、‘绿丰’及‘绿园’ב绿丰’杂交F1后代1-20号植株上的扩增结果 Figure 2 Schematic showing DNA fragments amplified with SCAR-SEA primer in 'Lüyuan', 'Lüfeng' and 'Lüyuan'×'Lüfeng' F1 hybrids of No.1 to 20 M:DL 2000 DNA marker;E:早实亲本‘绿园’;L:晚实亲本‘绿丰’;+:早实后代;-:晚实后代;P:特异标记出现;A:特异标记未出现。 M:DL 2000 DNA marker; E: Precocious parent 'Lüyuan'; L: Late mature parent 'Lüfeng'; +:Precocious hybrids of cross; -:Late mature hybrids of cross; P:Marker present; A:Marker absent. |
|
|
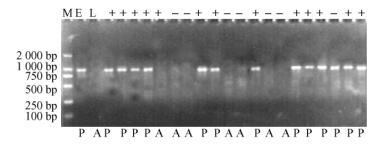
以‘T-12’、‘元丰’及‘T-12’ב元丰’杂交F1后代123株个体的基因组DNA为模板,用SCAR-SEA引物对进行PCR扩增,检测SCAR-SEA958标记在‘T-12’ב元丰’杂交F1后代群体中的分离情况,部分扩增结果如图 3。
|
图 3 SCAR-SEA引物对在‘T-12’、‘元丰’及‘T-12’ב元丰’杂交F1后代1-19号植株上的扩增结果 Figure 3 Schematic showing DNA fragments amplified by SCAR-SEA primer in 'Yuanfeng', 'T-12' and 'T-12'×'Yuanfeng' F1 hybrids of No.1 to 19 M:DL 2000 DNA marker; E:早实亲本‘元丰’; L:晚实亲本‘T-12’; +:早实后代; -:晚实后代; P:特异标记出现; A:特异标记未出现。 M:DL 2000 DNA Marker; E: Precocious parent 'Yuanfeng'; L: Late mature parent 'T-12'; +:Precocious hybrids of cross; -:Late mature hybrids of cross; P:Marker present; A:Marker absent. |
结果表明,在该杂交群体的38株早实后代中,有36株扩增出958 bp的DNA条带,2株(9号、104号)未出现该条带;在85株晚实后代中,82株未出现该条带,3株(23号、54号、78号)出现该条带。共有5株表现为重组类型,检测的准确率为95.93%。在‘T-12’ב元丰’杂交F1杂交群体中,早实和晚实性状与标记SCAR-SEA958共分离(表 1)。SCAR-SEA958标记在‘T-12’ב元丰’杂交F1群体中与核桃早实基因间的遗传距离为4.24 cM。
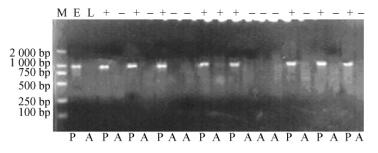
2.3 SCAR-SEA958标记在品种(系)中的检验为进一步检测SCAR-SEA958标记的稳定性和可信度,利用SCAR-SEA引物对对核桃早实品种‘辽1’、‘鲁光’、‘中林3’、‘中林5’、‘扎343’、‘西扶2’、‘西林2’、‘西林3’和晚实优系‘T-12’的基因组DNA进行了PCR扩增。结果发现,在这8个早实品种中, 有7个扩增出了958 bp的特异条带(图 4泳道1,3-8),而早实核桃‘鲁光’未能扩增出特异条带(图 3泳道2);晚实优系‘T-12’上没有出现该条带(图 4泳道9)。说明SCAR-SEA958标记在核桃早实栽培品种上也有较高的检出率。

|
图 4 SCAR-SEA引物对在栽培品种(系)上的扩增结果 Figure 4 Schematic showing DNA fragments amplified by SCAR-SEA primer in walnut varieties(clones) M:DL 2000 DNA marker; 1-9:‘辽1’, ‘鲁光’, ‘中林3’,‘中林5’, ‘扎343’, ‘西扶2’, ‘西林2’, ‘西林3’, ‘T-12’。P:特异标记出现; A:特异标记未出现。 M:DL 2000 DNA marker; 1-9: 'Liao 1', 'Luguang', 'Zhonglin 3', 'Zhonglin 5', 'Zha 343', 'Xifu 2', 'Xilin 2', 'Xilin 3', 'T-12'.P:Marker present; A:Marker absent. |
从早实亲本‘绿园’的SCAR-PCR扩增产物中,利用DNA凝胶回收试剂盒, 回收该特异目的片断,电泳检测纯度和浓度后,将回收产物与质粒PMD18-T连接,转化大肠杆菌JM109菌株感受态细胞,菌液涂布到含Amp 100 μg·L-1的LB平板上。平板表面预先涂布20 μL X-Gal(50 mg·mL-1)和10 μL IPTG(240 mg·mL-1)。平板27 ℃培养10 h后,挑取白色菌落于LB液体培养基(含Amp 100 μg·L-1),37 ℃过夜培养。利用质粒DNA小量纯化试剂盒从菌液中回收质粒。电泳检测回收的特异片断,可以看出与早实品种扩增出的特异片断相一致(图 5泳道4,5)。利用提取的完整质粒,EcoRⅠ和HindⅢ双酶切可以切下插入的特异标记片断(图 5泳道1,2),用M13系列引物M13 Primer M4(5′-GTTTT CCCAG TCACG AC-3′)和M13 Primer RV(5′-CAGGA AACAG CTATG AC-3′)做PCR检测,扩增出异常亮的条带,都与特异片断相一致(图 5泳道3)。这证明特异片段的回收和克隆准确。

|
图 5 SCAR标记片段的回收与重组质粒酶切和PCR鉴定结果 Figure 5 Identification of recombinant plasmid by restriction enzyme EcoRⅠ/HindⅢ and PCR M: DL 2000 DNA marker; 1.重组质粒; 2.重组质粒的酶切鉴定结果; 3.PCR鉴定结果; 4.回收片断; 5. SCAR-SEA引物对在早实亲本‘绿园’上的扩增结果。 M: DL 2000 DNA marker; 1. Recombinant plasmid; 2. Recombinant plasmid digested by EcoRⅠ/HindⅢ; 3. Recombinant plasmid identificated by M13 Primer M4 and M13 Primer RV; 4. SCAR-SEA958 marker retrieval; 5. Fragments amplified by SCAR-SEA primer in 'Lüyuan'. |
DNA序列测定由上海博亚公司完成。测序结果显示,标记SCAR-SEA958片断长度为958 bp,与RAPD标记OPB-08958相一致,具体序列见DQ673614(http://www.ncbi.nlm.nih.gov/nuccore/108784075)。进一步表明本研究将与核桃早实基因相连锁的RAPD标记OPB-08958成功转化为SCAR标记。
3 讨论Michelmore等(1991)曾指出, 对于整个基因组作图, 需要筛选大量的标记, 并且这些标记与具体目标性状的连锁程度较难确定, 而选用与目标性状紧密连锁的标记, 对控制目标性状基因所在的区域进行基因定位与作图, 是比较省时省力和利用价值比较高的策略。SCAR标记一般是由RFLP, RAPD, AFLP等标记转换而来,其基本原理是根据已获得的标记片段的序列信息,设计1对长度为20 bp左右的特异引物,然后通过普通的PCR手段来揭示多态性。在果树和林木上已有许多DNA分子标记成功转换为了SCAR标记。SCAR标记在SNP位点寻找、QTL定位、基因克隆和分子辅助育种上有其独特的优势(Khan et al., 2007;Galeano et al., 2009)。姜立杰等(2005)以桃(Amygdalus persica)品种“京玉”和“美味”的正反交69株F1群体为试材,利用引物对BFP94/BFP95将与桃有毛/无毛性状相连锁的RAPD标记成功转化SCAR标记。任朝兴等(2007)利用RAPD标记技术鉴定了番木瓜(Caric papaya)雄性性状,并将RAPD标记成功转化为SCAR标记,并命名为SD-1000。贾彦利等(2007)获得了梨(Pyrus)矮化基因pcDw的1个SCAR标记。吴松权等(2007)建立了松茸(Tricholoma)SCAR标记。
本研究根据与核桃基因相连锁的RAPD标记OPB-08958测序,在原有的OPB08随机引物及其互补序列基础上,向内延长了9~13 bp,设计了SEA, SEB 2对SCAR引物,以早实亲本‘绿园’和晚实亲本‘绿丰’的基因组DNA检测2对SCAR引物。结果表明,SCAR-SEA引物对具有较好的稳定性(图 1),将该标记命名为SCAR-SEA958。
为进一步检测该标记的稳定性和可信度,本研究检测了SCAR-SEA958标记在‘绿园’、‘绿丰’及‘绿园’ב绿丰’杂交组合154株F1后代群体中的分离状况。结果表明,SCAR-SEA958与RAPD标记OPB-08958在F1群体中的分离状况相一致(图 2,表 1)。还利用‘T-12’、‘元丰’及‘T-12’ב元丰’杂交F1后代123株个体的基因组DNA为模板,检测SCAR-SEA958标记在‘T-12’ב元丰’杂交F1后代群体中的分离情况。虽然‘T-12’ב元丰’杂交F1后代群体中早实类型和晚实类型的分离比例不符合1:1的分离比例,但SCAR-SEA958与核桃早实性状共分离(图 3,表 1)。在部分核桃栽培品种(系)中,SCAR-SEA958在8个供试品种的7个上出现,在1个早实品种‘鲁光’和1个晚实优系‘T-12’上没有扩增出条带。
对SCAR-SEA958标记片断回收、克隆、测序,结果发现,该标记序列为958 bp,序列与RAPD标记OPB-08958的DNA系列相一致。
从1个杂交组合得到的标记能否在其他材料或杂交组合中出现,这对于标记的适用性至关重要。赵晓彦等(2007)开发了普通菜豆(Phaseolus vulgaris)抗炭疽病基因SCAR标记后,利用12个菜豆品种(鉴别寄主)评价了SCAR标记的可靠性和实用性, 认为抗病品种含有的抗病基因标记与品种来源存在相关性。Khan等(2007)在‘Fiesta’苹果第7连锁群中发现了对苹果火疫病(Erwinia amylovora)抗性贡献值高达34.3%~46.6%的一些主效QTL位点,将其中的2个RAPD标记转换成SCAR标记;家系分析表明,这些主效位点来自于‘橘苹’苹果(‘Cox’s Orange Pippin’);为了验证这些位点在不同遗传背景材料中的稳定性,用感病材料‘Milwa’与抗性材料‘1217’的杂交组合和一些栽培品种对标记和抗病性的分离情况进行了验证,结果表明,具有该SCAR标记的位点的材料均具有较高的抗性,而没有该标记的材料感病比较严重,证明了该标记在不同遗传背景下的稳定性。本文研究的结果表明,在‘绿园’ב绿丰’杂交F1群体中,SCAR-SEA958标记与核桃早实性状的遗传距离为1.99 cM;在‘T-12’ב元丰’杂交F1群体中,与核桃早实性状的遗传距离为4.24 cM。在不同杂交群体中,由于交换的存在,使得标记与早实性状的遗传距离有所差异,但在不同的杂交群体中,SCAR-SEA958和核桃早实性状共分离(表 1)。在部分早实栽培品种中的SCAR-SEA958标记也有较高的检出率。这说明SCAR-SEA958与核桃的某一主效早实基因相连锁,而且在不同遗传背景下有较高的稳定性。研究结果为核桃早实性状的分子辅助育种和核桃早实基因的克隆奠定了基础。
贾彦利, 王彩虹, 田义轲, 等. 2007. 梨矮化基因pcDw的一个SCAR标记[J]. 园艺学报, 34(6): 1531-1534. |
姜立杰, 杨英军, 张晓明, 等. 2005. 桃果实有毛/无毛性状的SCAR标记[J]. 园艺学报, 32(6): 1003-1007. |
莫惠栋. 1996. 数量遗传学的新发展--数量性状基因图谱的构建和应用[J]. 中国农业科学, 29(2): 8-16. |
任朝兴, 黄建昌, 肖艳, 等. 2007. 番木瓜雄性性别的RAPD和SCAR标记[J]. 果树学报, 24(1): 72-75. |
王国安, 张虎平, 虎海防, 等. 2004. 核桃早实性状相关联的RAPD标记[J]. 果树学报, 21(5): 485-487. |
吴松权, 管清杰, 全雪丽, 等. 2007. 松茸SCAR标记的建立[J]. 林业科学, 43(10): 150-153. DOI:10.3321/j.issn:1001-7488.2007.10.028 |
奚声珂. 1987. 我国胡桃属(Juglans L.)种质资源与核桃(Juglans regia L.)育种[J]. 林业科学, 23(3): 342-349. |
杨克强, 马明, 孙彩玲, 等. 2007. 核桃(Juglans regia L.)早实基因的RAPD标记及其序列分析研究[J]. 中国农业科学, 40(9): 2021-2027. |
杨克强, 王跃进, 张今今, 等. 2005. 用限制性酶切和Southern杂交对葡萄无核基因分子标记的分析[J]. 农业生物技术学报, 13(3): 294-298. |
杨克强, 王跃进, 张银东, 等. 2002. 核桃早实性状的RAPD标记[J]. 园艺学报, 29(6): 573-574. |
杨文衡, 张建光. 1983. 廿年来核桃科研的进展[J]. 河北农业大学学报, 6(1): 1-13. |
赵晓彦, 王晓鸣, 王述民. 2007. 普通菜豆抗炭疽病基因SCAR标记鉴定[J]. 作物学报, 33(11): 1815-1821. DOI:10.3321/j.issn:0496-3490.2007.11.012 |
Breton C, Cornu D, Chriqui D, et al. 2004. Somatic embryogenesis, micropropagation and plant regeneration of "Early Mature" walnut trees (Juglans regia) that flower in vitro[J]. Tree Physiology, 24: 425-435. DOI:10.1093/treephys/24.4.425 |
Galeano C H, Gomez M, Rodriguez L M, et al. 2009. CEL I nuclease digestion for SNP discovery and marker development in common bean (Phaseolus vulgaris L.)[J]. Crop Science, 49: 381-394. DOI:10.2135/cropsci2008.07.0413 |
Germain E, Delort F, Kanivets V. 1997. Precocious maturing walnut populations originating from central Asia: their behaviour in France[J]. Acta Horticulturae, 442: 83-89. |
Khan M A, Durel C E, Duffy B, et al. 2007. Development of molecular markers linked to the 'Fiesta' linkage group 7 major QTL for fire blight resistance and their application for marker-assisted selection[J]. Genome, 50(6): 568-577. DOI:10.1139/G07-033 |
Michelmore R W, Paran I, Kesseli R V. 1991. Identification of markers linked to disease-resistance genes by bulked segregant analysis: a rapid method to detect markers in specific genomic regions by using segregating populations[J]. Proc Natl Acad Sci USA, 88: 9828-9832. DOI:10.1073/pnas.88.21.9828 |
 2010, Vol. 46
2010, Vol. 46